无创产前检测的临床应用及随访研究*
2016-06-15赖允丽雷亚琴郑海洋邬玲仟韦红卫
赖允丽,陈 筠,易 升,周 林,易 赏,雷亚琴,郑海洋,林 飞,邬玲仟,韦红卫
(1.广西壮族自治区妇幼保健院遗传代谢中心实验室,南宁 530000;2.山东省聊城市东昌府区妇幼保健院 252200;3.中南大学医学遗传学国家重点实验室,长沙 410078;4.广西壮族自治区妇幼保健院妇产科,南宁 530000)
无创产前检测的临床应用及随访研究*
赖允丽1,陈筠1,易升1,周林2,易赏1,雷亚琴1,郑海洋1,林飞1,邬玲仟3▲,韦红卫4△
(1.广西壮族自治区妇幼保健院遗传代谢中心实验室,南宁 530000;2.山东省聊城市东昌府区妇幼保健院252200;3.中南大学医学遗传学国家重点实验室,长沙 410078;4.广西壮族自治区妇幼保健院妇产科,南宁 530000)
[摘要]目的采用大规模平行测序检测胎儿染色体疾病,通过全面随访,为无创产前检测(NIPT)的临床应用提供有效的数据支持及遗传咨询方案。方法唐氏筛查高风险的孕妇接受NIPT,结果提示高危者进行核型确诊,低危者进行生育前后随访。结果(1)NIPT提示胎儿异常25例,异常率为1.49%,核型确诊异常12例,均已引产,NIPT对T21、T18、XO、XXY、XYY的准确性依次为99.93%、100.00%、99.66%、100.00%、100.00%;在高龄妊娠和双胎妊娠中对T21/T18的准确性达100.00%;产前阳性干预率达100.00%。(2)NIPT提示低风险1 651例,完成随访1 468例,成功率为88.91%,发现1例9号染色体倒位(母源性)。(3)B超检测染色体异常准确率达98.17%,检出率仅7.69%;唐氏筛查高风险人群的准确率仅为0.88%,假阳性率高达99.12%;NIPT避免了98.71%的孕妇进行介入性产前诊断。结论NIPT作为现有产前检测技术的重要补充,为寻找最合适的产前筛查模式提供参考。在医疗机构建立健全NIPT随访和服务系统对降低出生缺陷疾病尤为重要。
[关键词]无创产前检测;染色体疾病;超声检测;唐氏筛查高风险;随访研究
当前国际上最前沿的新一代DNA测序技术已在临床中发挥巨大作用,其中NIPT能准确、安全、快速地检测胎儿染色体非整倍体疾病,在国内外广泛推广和应用。国际上NIPT在高风险孕妇人群中检测21三体综合征(T21),18三体综合征(T18)、13三体综合征(T13)的高度准确性和特异性得以高度的认可[1]。但多数文献报道数据未能完成随访,缺乏后期异常病例发现的统计结果,极有可能造成信息的遗漏,全面的追踪随访对提供有效的数据尤为重要,才能更深刻、更全面的对NIPT临床应用进行评估,为建立NIPT适宜产前检测模式具有十分重要价值和临床指导意义,妇幼医疗机构将会在此扮演举足轻重的作用。本文就此报道如下。
1资料与方法
1.1一般资料2013年1月至2014年2月,广西壮族自治区妇幼保健院进行NIPT孕妇1 676例,研究入选条件为:单双胎,孕14周以上,均进行B超检测,唐氏筛查高风险的孕妇人群,孕妇均签署检测知情同意书,孕周大于或等于24周的孕妇均被告知存在错过最佳介入产前诊断时间而无法进行确诊的风险,并签署检测知情同意书。
1.2方法
1.2.1中孕期唐氏血清学筛查采用PE公司的甲胎蛋白/游离hCGβ亚基双标测定试剂盒(时间分辨荧光法)和游离雌三醇测定试剂盒(时间分辨荧光法),针对AFP、游离hCGβ、游离uE3进行三联筛查,按说明书进行实验操作。T21高风险截断值为1/270,T18高风险截断值为1/350。
1.2.2二代测序采用EDTA抗凝管收集孕妇外周血5 mL,8 h内以4 ℃ 1 600 r、16 000 r速度依次进行血浆分离,每管600 μL分装后-20 ℃保存。次日干冰运输至深圳华大基因,采用Hiseq2000测序平台进行单端36+8(index)bp测序。采用生物信息对数据进行分析,Z值评估患病风险率。
1.2.3染色体制备接种:脐血接种后培养68~72 h,羊水接种后培养8~10 d,放置37 ℃恒温箱中。收获:脐血培养液转移至离心管后,采用自动化收获仪收获。羊水则滴加秋水酰胺,混匀后置于37 ℃培养箱中3 h。滴加2 mL 0.25%EDTA-胰酶,37 ℃消化10 min,1 500 r/min离心8 min,去上清。低渗:采用0.075 mol/L KCl在37 ℃水浴箱低渗4.5 min。预固定、固定:加入固定剂后1 800 r/min离心8 min,弃去上清(重复固定2次)。滴片:细胞悬液滴片。染色后扫片,进行核型分析。
2结果
2.1入选NIPT的孕妇基本信息1 676例中晚孕期(≥14周)孕妇进行B超检测和唐氏筛查,唐氏筛查为高风险则选择NIPT,包括双胎妊娠25例,单胎妊娠1 651例;年龄17~47岁,平均29岁,高龄妊娠(≥35岁)264例(15.8%),低龄妊娠1 412例(84.2%);孕周14~34周,平均19.5周,见图1、2。
B超提示:正常1 660例,异常16例,异常率为0.95%,主要表现为左心室强光斑、胎盘增厚、肾盂分离、肠管回声增强、脉络囊肿、股骨偏短、羊水偏多。唐氏筛查提示:21-三体高风险1 481例(88.37%),18-三体高风险138例(8.23%),21/18-三体高风险57例(3.4%);此外,助孕生殖4例,Rh阴性血型1例,梅毒感染1例。见表1。
图1 孕妇年龄分布特征
2.2NIPT技术评估
2.2.1NIPT与染色体非整倍体疾病NIPT结果提示:低风险1 651例,高风险25例(均为单胎),异常率为1.49%。高风险包括7例T21,3例T18,5例XO,2例XXY,1例XYY,1例3号染色体偏多,1例9号染色体偏多,5例16号染色体偏多。25例高风险者均进行核型确诊:阴性13例,阳性12例(6例T21,3例T18,0例XO,2例XXY,1例XYY)。确诊阳性者均已引产,异常产前干预率达100%,确诊阴性者则继续妊娠。
1 651例NIPT低风险孕妇均进行生育前后随访,1 468例随访成功,183例随访失败,随访成功率为88.91%;随访1 468例中,终止妊娠15例(9例流产,6例B超检测异常引产),均未做核型分析。其余1 453例孕妇分娩于37+1~42+2周,平均39+2周;1 453例出生胎儿中,健康状态良好者1 382例,体检异常者71例,异常率为4.89%。新生儿异常疾病以先天性耳聋、先天性心脏病、G6PD缺乏症、地中海贫血为主,占3.23%,偶见甲状腺功能亢进/低下及白化病患儿;亦可见畸形患儿如漏斗胸、畸形儿、缺指/并指等;4例头脑发育迟缓和2例面容异常者经核型确诊均未见异常;发现1例核型异常者,为9号染色体倒位,父母双方验证为母源性,表型正常;未发现T21/T18/T13异常患儿出生。
NIPT对T21、T18、XXY、XYY检测具有较高准确性和高检出率,准确性依次为99.93%、100.00%、100.00%、100.00%,检出率均达100.00%;而NIPT对45,XO准确率达99.66%,检出率低,并有0.34%假阳性率。NIPT对3号、9号、16号染色体偏多的检测准确性不高。NIPT不能检测染色体结构异常。见表2、3。
图2 孕妇孕周分布特征
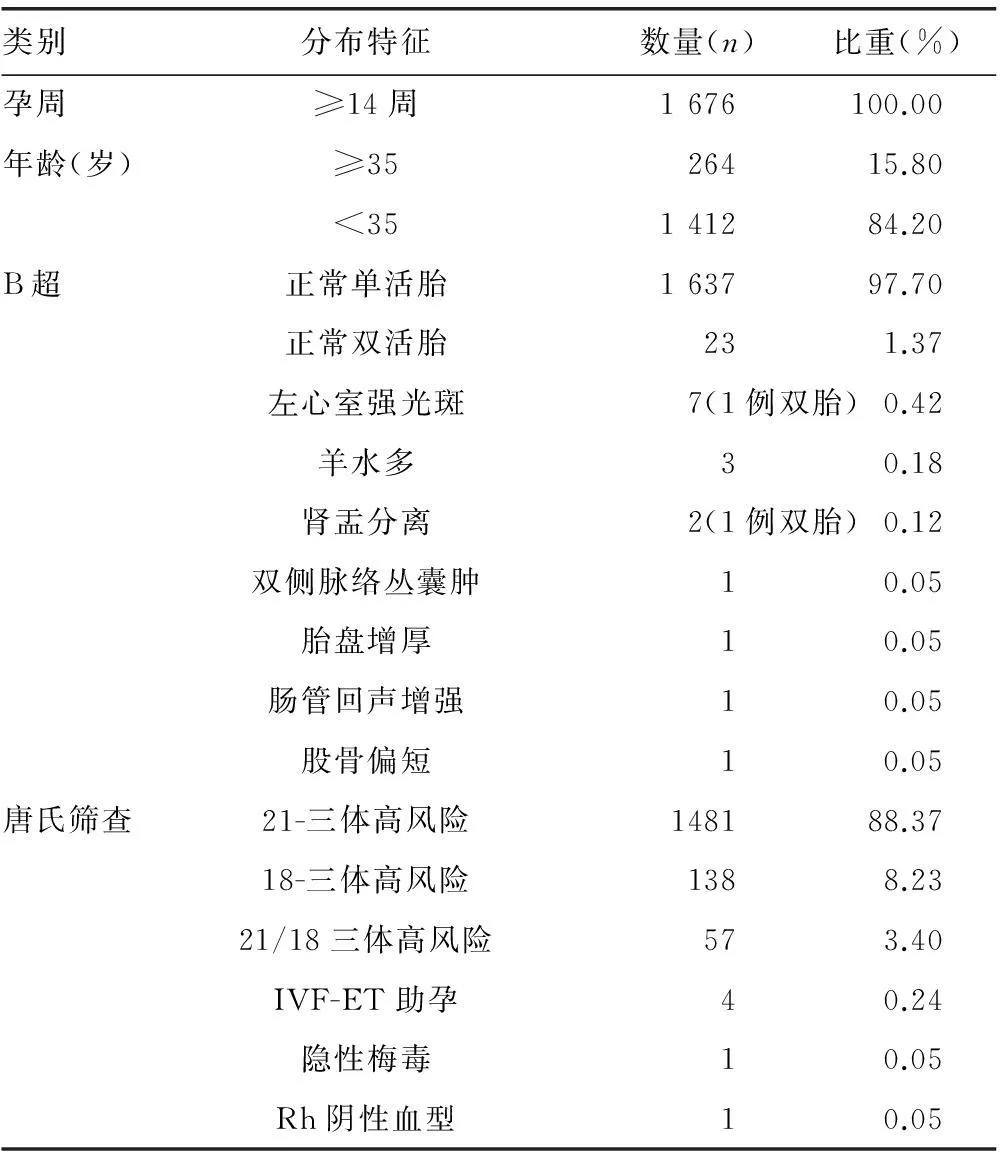
表1 入选NIPT的孕妇信息

表2 NIPT染色体异常与核型分析结果比较
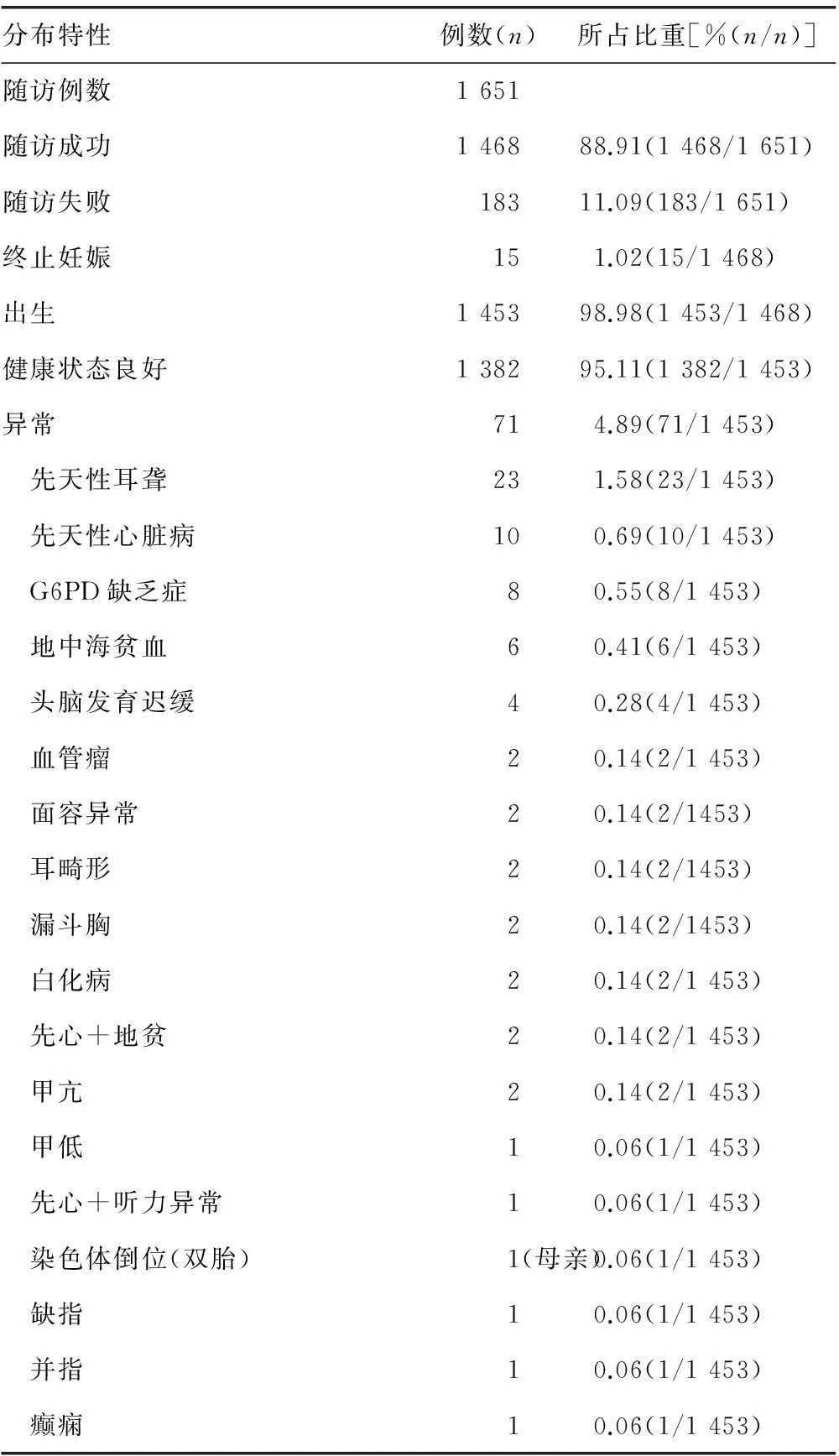
表3 NIPT低风险的追踪随访信息
2.2.2NIPT 与年龄、双胎关系1 478例有效数据中,高龄妊娠(≥35岁)253例,低龄妊娠1 214例,NIPT检测准确性分别为100.00%与99.51%。NIPT检测双胎与单胎的准确性依次为100.00%和99.59%,见表4。
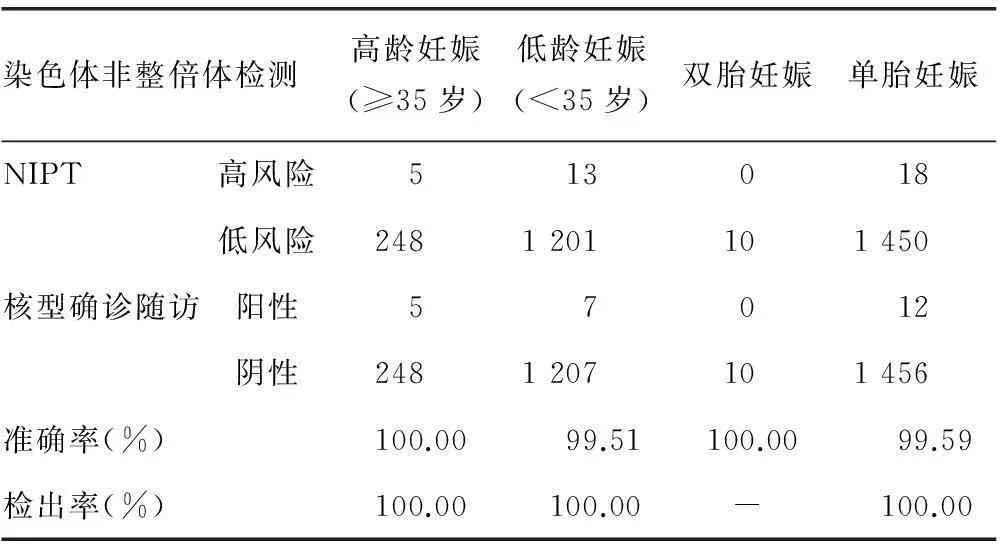
表4 NIPT在高低龄和单双胎人群中检测染色体非整倍体的分析
-:无法计算。
2.3产前检测技术比较1 478例(25例核型确诊+1 453例有效随访)孕妇均进行B超检测,提示正常1 462例,异常16例,核型确诊/随访发现1例异常(染色体倒位)及12例阳性,B超准确性为98.17%,检出率仅为7.69%;1 478例唐氏筛查高风险孕妇,核型确诊/随访仅发现阳性13例,其余均为阴性,唐氏筛查高风险人群的准确率仅为0.88%,假阳性高达99.12%;NIPT对染色体异常疾病检测准确性高达99.00%,检出率达92.00%,具有较高特异性与灵敏性,有效避免了98.71%(1 459/1 478)的孕妇进行介入性产前诊断。见表5、6,图3。
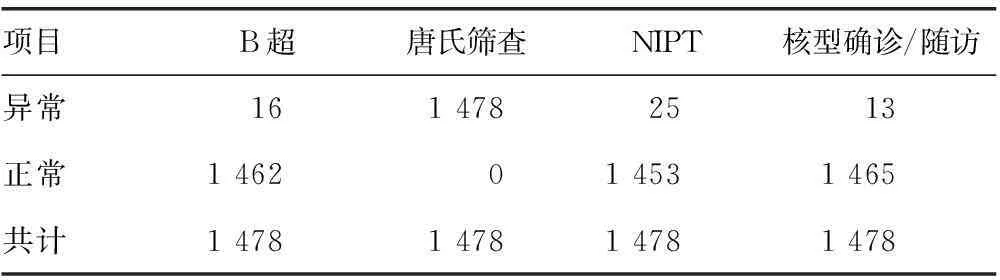
表5 不同检测方法的结果

表6 染色体异常疾病的检测方法比较
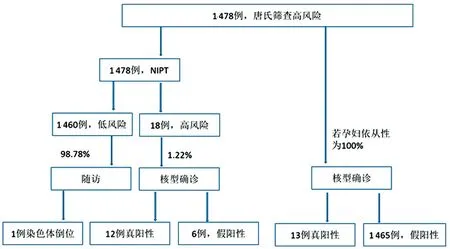
图3 唐氏筛查与NIPT进行介入性产前诊断的比较分析
3讨论
产前筛查、产前诊断是防止出生缺陷率的重要手段。近年来,NIPT在产前领域中取得了迅速的发展和应用。NIPT在唐氏高风险孕妇人群中检测T21/T18/T13的准确性已在国际获得高度认可,并应用于临床检测[2]。但多数文献报道并未完成随访,缺乏后期异常病例的追踪而造成信息的遗漏。因此,通过有效的随访数据,才能对NIPT进行更全面的评估,为寻找NIPT适宜检测模式及给予正确的临床指导尤为重要[3-4]。
本研究NIPT结果显示:低风险1 651例,高风险25例,异常率为1.49%,与Sago等[5]在唐氏高风险人群的研究结果类似。其中染色体非整倍体异常18例,核型确诊阳性12例并引产,干预率达100%,13例低风险经随访均未见异常。NIPT对T21、T18检测准确率分别为99.93%、100%,检出率达100%,与国际报道一致。发现1例T21假阳性,不排除孕妇异体输血、移植手术、干细胞治疗的可能。NIPT对性染色体XXY、XYY 检测准确性和检出率为100%,45,XO检测准确性为99.66%,NIPT对性染色体检出率低于常染色体,多认为和GC含量偏向性有关[6],研究者[7]通过改进染色体内标参照方法,对数据进行GC修正,减小变异系数,一定程度上克服GC含量问题[8]。研究者利用胎儿特异性甲基化DNA比例差异分析,成功解决了这方面的局限性[9]。Yao等[10]对NIPT的性染色体检测进行综合评估,获得Z<-2.5作为判断XO的切值并给临床遗传咨询带来了帮助。
NIPT低风险的随访率为88.91%。1 468例中自然流产9例,因B超发现异常而终止妊娠6例,正常分娩1 453例。1 453例新生儿进行体检,健康状态良好者1 382例(包括孕妇为IVF、梅毒感染及阴性血型者),异常者71例,异常率为4.89%。其中发现染色体异常1例,为9号染色体倒位,经父母验证为母源性遗传,表型正常。其余异常疾病以先天性耳聋、先天性心脏病、G6PD缺乏症、地中海贫血疾病为主,分别占1.58%、0.69%、0.55%和0.41%,为广西地区高发性疾病。可见,NIPT适用于IVF助孕生殖、患感染疾病等孕妇人群;不能检测染色体结构异常,与相关研究结果类似[11-13];NIPT检测3号、9号、6号染色体偏多者,提示T3/T9/T16或者复杂嵌合可能性大,仅作参考。
NIPT低风险人群,并不能完全排除异常妊娠[14-15],而仍需利用B超及时发现先天性心脏病、畸形儿等异常。同时需结合广西地区缺失缺陷疾病发病率,加强对耳聋基因、地中海贫血及单基因疾病的产前筛查/诊断工作,降低异常患儿的出生。此外,NIPT在产前领域中的应用已上升到道德伦理问题,异常的咨询尤为关键[16]。日本Sago等[5]对全国整年的NIPT数据进行统计研究,提出全面有效的检测/随访数据才能更好地服务于遗传咨询,妇幼保健系统需建立完善的随访体系,为NIPT的推广应用非常重要。
NIPT对高龄妊娠检测的准确性达100%,高于低龄妊娠99.51%,美国ACOG推荐NIPT的临床适用高龄妊娠[13]。同时,NIPT对单/双胎妊娠检测准确性大于99.5%,大众对NIPT在双胎妊娠人群中的检测具有极大兴趣,仍未有大数据的研究报道[17],准确性和灵敏度需要进一步的临床验证[18-20]。且本研究高龄、双胎基数过少,仅供参考。
1 478例核型确诊/随访成功者中,B超提示异常仅1例脉络囊肿确诊为T18,其余核型确诊/随访未发现染色体非整倍体异常。B超检查准确性98.17%,检出率仅为7.69%。唐氏筛查高风险孕妇人群的准确率仅有0.88%,假阳性率高达99.12%。B超能了解胎儿生长、发育情况,对异常的流产、死胎、宫外孕、葡萄胎、畸形胎等畸变类型能做出诊断,胎盘嵌合(NIPT假阴性)、Turner综合征等可通过B超发现异常[21],但检测易受仪器的分辨率和医生检测技术和经验的影响,对指标不明确或者有争议的发育异常无法判断。传统的血清学联合筛查法假阳性率较高。本研究理论上避免了98.71%的孕妇进行介入性产前诊断。因此,NIPT以其近乎诊断的技术为产前诊断带来了新的希望[22]。
有研究数据表明,26.7%的唐氏高风险孕妇选择NIPT将减少25.6%的核型穿刺量。美国测序公司Ariosa统计近10万例数据表明:NIPT以795美元收费标准,较早孕唐氏筛查和中孕唐氏筛查成本更经济实惠[23]。比利时Neyt等[24]探索NIPT产前检测模式,认为NIPT针对唐筛高风险人群的二线检测和针对所有孕妇人群的一线检测方法,均可降低因核型穿刺取样所致的流产风险,前者是现今适宜方法,而后者则需较高成本而成为限制。因此,NIPT以更早、更精确的优势作为现有检测技术的重要补充,希望通过降低成本,铺开应用。
通过本研究,广西地区NIPT与产前检测技术结合的检测模式:唐氏筛查高风险、单双胎、高龄妊娠、产前诊断禁忌的孕妇可建议在中孕期(≥14W)进行NIPT检查,若检测为染色体非整倍体高风险则必须进入产前诊断,低风险进行全面随访;NIPT可作为孕龄过大孕妇的补救措施,NIPT高风险者建议行介入性产前诊断,最大限度降低出生缺陷率;建立妇幼系统NIPT随访体系,做好全面随访和遗传咨询工作,随访中需考虑广西重大出生缺陷疾病,发现异常者立即召回进行相关疾病的产前筛查/诊断。
随着测序技术不断进步,NIPT在染色体微缺失/重复[25]、双胎妊娠、唐氏早期筛查[26-27]及单基因疾病[28-29]的检测已成为可能。我们相信,通过技术的不断优化,NIPT必将继续给产前检测领域带来不可估量的价值。
参考文献
[1]Faycal G,Bianchi DW.Noninvasive prenatal testing creates an opportunity for antenatal treatment of Down syndrome[J].Prenat Dia,2013,33(6):614-618.
[2]Grati FR,Ferreira JC,Bajaj K.Noninvasive prenatal screening for fetal trisomies 21,18,13 and the common sex chromosome aneuploidies from maternal blood using massively parallel genomic sequencing of DNA[J].Am J Obst Gynecol,2014,211(96):711-712.
[3]de Jong A,de Wert GM.Prenatal screening:an ethical agenda for the near future[J].Bioethics,2015,29(1):46-55.
[4]Dar P,Curnow KJ,Benn P,et al.Clinical experience and follow-up with large scale single-nucleotide polymorphism-basednoninvasive prenatal aneuploidy testing[J].Am J Obstet Gynecol,2014,211(5):527.
[5]Sago H,Sekizawa Z.Japan NIPT consortium.Nationwide demonstration project of next-generation sequencing of cell-free DNA in maternal plasma in Japan:one-year experience[J].Prenat Dia,2015,35(4):331-336.
[7]Canick JA.DNA sequencing of maternal plasma to identify Down syndrome and other trisomies in multiple gestations[J].Prenatal Dia,2012,32(8):730-734.
[8]Jiang F,Ren J,Chen F,et al.Noninvasive Fetal Trisomy (NIFTY) test:an advanced noninvasive prenatal diagnosis methodology for fetal autosomal and sex chromosomal aneuploidies[J].BMC Med Geno,2012,5(1):1.
[9]Papageorgiou EA,Karagrigoriou A,Tsaliki E,et al.Fetal-specific DNA methylation ratio permits noninvasiveprenatal diagnosis of trisomy 21[J].Nat Med,2011,17(4):510-513.
[10]Yao H,Jiang F,Hu H,et al.Detection of fetal sex chromosome aneuploidy by massively parallel sequencing of maternal plasma DNA:initial experience in a Chinese hospital[J].Ultrasound Obstet Gynecol,2014,44(1):17-24.
[11]Sehnert AJ.Optimal detection of fetal chromosomal abnormalities by massively parallel DNA sequencing of cell-free fetal DNA from maternal blood[J].Clin Chem,2011,57(7):1042-1049.
[12]Sparks AB.Noninvasive prenatal detection and selective analysis of cell-free DNA obtained from maternal blood:evaluation for trisomy 21 and trisomy 18[J].Am J Obst Gynecol,2012,206(4):319.
[13]Gregg AR,Gross SJ,Best RG,et al.ACMG statement on noninvasive prenatal screening for fetal aneuploidy[J].Gene Med,2013,15(5):395-398.
[14]Norton ME.Non-Invasive Chromosomal Evaluation (NICE) Study:results of a multicenter prospective cohort study for detection of fetal trisomy 21 and trisomy 18[J].Am J Obst Gynecol,2012,207(2):137.
[15]Palomaki GE,Deciu C,Kloza EM,et al.DNA sequencing of maternal plasma reliably identifies trisomy 18 and trisomy 13 as well as Down syndrome:an international collaborative study[J].Gene Med,2012,14(3):296-305.
[16]Munthe C.A new ethical landscape of prenatal testing:individualizing choice to serve autonomy and promote public health:a radical proposal[J].Bioethics,2015,29(1):36-45.
[17]Van Lith JM,Faas BH,Bianchi DW.Current Controversies in Prenatal Diagnosis I:NIPT for chromosome abnormalities should be offered to women with low a priori risk[J].Prenat Diagn,2015,35(1):8-14.
[18]Gekas J,Langlois S,Ravitsky V,et al.Identification of trisomy 18,trisomy 13,and Down syndrome from maternal plasma[J].Appl Clin Genet,2014,7:127-131.
[19]Lau TK.Noninvasive prenatal diagnosis of common fetal chromosomal aneuploidies by maternal plasma DNA sequencing[J].J Maternal-Fetal Neonatal Med,2012,25(8):1370-1374.
[20]Ashoor G,Syngelaki A,Wagner M,et al.Chromosome-selective sequencing of maternal plasma cell-free DNA for first-trimester detection of trisomy 21 and trisomy 18[J].Am J Obst Gynecol,2012,206(4):322.
[21]Pan Q,Sun B,Huang X,et al.A prenatal case with discrepant findings between non-invasive prenatal testing and fetal genetic testings[J].Mol Cytogenet,2014,16(7):48.
[22]Poon CF,Tse WC,Kou KO,et al.Fetal Diagn Ther.Uptake of Noninvasive Prenatal Testing in Chinese Women Following Positive Down Syndrome Screening[J].Fetal Diagn Ther,2015,37(2):141-147.
[23]Song K,Musci TJ,Caughey AB.Clinical utility and cost of non-invasive prenatal testing with cfDNA analysis in high-risk women based on a US population[J].J Matern Fetal Neonatal Med,2013,26(12):1180-1185.
[24]Neyt M,Hulstaert F,Gyselaers W.Introducing the non-invasive prenatal test for trisomy 21 in Belgium:a cost-consequences analysis[J].BMJ Open,2014,4(11):e005922.
[25]Jia Y,Zhao H,Shi D,et al.Genetic effects of a 13q31.1 microdeletion detected by noninvasive prenatal testing (NIPT)[J].Int J Clin Exp Pathol,2014,7(10):7003-7011.
[26]Wald NJ,Watt HC,Hackshaw AK.Integrated screening for Down′s syndrome based on tests performed during the first and second trimesters[J].N Engl J Med,1999,341(7):461-467.
[27]Agarwal A.Commercial landscape of noninvasive prenatal testing in the United States[J].Prenatal Dia,2013,33(6):521-531.
[28]Rossa WK.Noninvasive prenatal testing by maternal plasma DNA analysis:Current practice and future applications[J].Scand J Clin Lab Invest Suppl,2014,74(244):48-53.
[29]Lv W,Wei X,Wu L,et al.Noninvasive Prenatal Testing for Wilson Disease by Use of Circulating Single-Molecule Amplification and Resequencing Technology (cSMART)[J].Clin Chem,2015,61(1):172-181.
The clinical application and follow-up study of f non-invasive prenatal testing*
Lai Yunli1,Chen Yun1,Yi Sheng1,Zhou Lin2,Yi Shang1,Lei Yaqin1, Zheng Haiyang1,Lin Fei1,Wu Lingqian3▲,Wei Hongwei4△
(1.Genetic and Metabolic Center,Guangxi Maternal and Child Health Hospital,Nanning,Guangxi 530021,China;2.Maternal and Child Health Hospital of Dongchangfu District of Liaocheng City,Liaocheng,Shandong 252200,China;3.State Key Laboratory of Medical Genetics,Central South University,Changsha,Hunan 410078,China;4.Department of Obstetrics and Gynecology,Guangxi Maternal and Child Health Hospital,Nanning,Guangxi 530021,China)
[Abstract]ObjectiveTo provide valid data and useful genetic counseling in the clinical application of non-invasive prenatal test (NIPT),fetal chromosomal disorder were screened by massive parallel sequencing and made a follow-up study.MethodsPregnant women with Down screening in high-risk were screened by NIPT;NIPT verified high-risk individuals were suggested for karyotyping;and we follow up on whoever showed low risk by NIPT before and after their deliveries.Results(1)Totally 1 676 cases of pregnant women were tested by NIPT,25 cases prompted to be abnormal,with an abnormal rate of 1.49%,karyotype analysis results in 12 cases of abnormalit,the accuracies of NIPT for T21,T18,XO,XXY,and XYY were 99.93%,100.00%,99.66%,100.00%,100.00% respectively;the accuracy of NIPT for women with advanced paternal age and twins were both 100.00%;karyotyping positive individuals underwent abortion,which gives a prenatal intervention rate of 100.00%.(2)Out of 1 651 cases of NIPT low risk testers,1 468 cases were successfully followed up,with a 88.91% success rate.We found chromosome abnormality with one case of inversion of chromosome 9 (maternal).(3)Ultrasound-detection possessed 98.17% accuracy and 7.69% in detection rate;in high-risk pregnant woman,Down screening had an accuracy of 0.88% and false positive rate of 99.12%;98.71% women were avoided prenatal diagnosis via NIPT.ConclusionCompare to ultrasound and maternal plasma screening,NIPT is a far more accurate prenatal screening approach.To build effective follow-up and service systems of NIPT is necessary to reduce birth defects in medical institutions.
[Key words]non-invasive prenatal test;chromosomal abnormality;ultrasonic test;Down screening in high-risk;follow-up study
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.11.015
* 基金项目:国家科技支撑计划项目(2014BAI06B03);广西医疗卫生适宜技术研究与开发项目(S201543)。
作者简介:赖允丽(1986-),助理研究员,硕士,主要从事遗传学分子诊断研究。▲通讯作者,E-mail:laiyunlilyl@163.com。△通讯作者,E-mail:591795605@qq.com。
[中图分类号]R714.55
[文献标识码]A
[文章编号]1671-8348(2016)11-1491-05
(收稿日期:2015-10-30修回日期:2015-12-25)
