尼古丁通过蛋白激酶B和糖原合成酶激酶-3调节γ网络振荡
2016-06-15贺小龙成祥林钱锋路承彪
贺小龙,成祥林,钱锋,路承彪
(长江大学医学院,湖北 荆州 434023)
尼古丁通过蛋白激酶B和糖原合成酶激酶-3调节γ网络振荡
贺小龙,成祥林,钱锋,路承彪
(长江大学医学院,湖北 荆州 434023)
[摘要]目的:探讨尼古丁调节海马γ网络振荡的机制。方法:健康雄性Wistar大鼠,取其脑组织制备海马脑片,制备好的海马脑片放入恒温(30~32℃)界面浴槽式灌流系统孵育。灌流液是充有混合气体(95%O2+5%CO2)的人工脑脊液(pH:7.35~7.50,流速2~3 mL/min)。孵育1h后,采用细胞外微电极方式记录。应用红藻氨酸激动剂(Kainate)对大鼠海马脑片灌流,诱导γ(20~60Hz)网络振荡。分组加入mTOR(Mammalian target of rapamycin)激酶阻断剂雷帕霉素,糖原合成酶激酶-3 (Glycogen synthase kinase-3, GSK-3) 阻断剂SB415286,蛋白激酶B阻断剂Triciribine,待γ网络振荡稳定后再加入尼古丁,观察三者对尼古丁增强γ网络振荡作用的影响。结果:雷帕霉素不能阻断尼古丁增强γ网络振荡的效应,SB415286和Triciribine能阻断尼古丁的效应。结论:尼古丁可能通过激活糖原合成酶激酶-3 (GSK-3)和蛋白激酶B(protein kinase B,Akt)来增强γ网络振荡。
[关键词]γ网络振荡;尼古丁;雷帕霉素;SB415286;Triciribine
神经网络振荡是大脑网络神经元的节律性同步性活动,反映了网络环路的功能特征,是网络神经元信号同步输出的时间标识[1],与脑的高级功能如学习、记忆密切相关[2]。海马网络振荡活动按频率不同主要分为:4~12Hz(theta,θ),13~30Hz(beta,β)和30~80Hz(gamma,γ)[3]。最近研究表明1μM尼古丁能增强γ网络振荡[4],近年来研究表明在离体培养神经元细胞中,NMDA受体通过磷脂酰肌醇三磷酸激酶(PI3K)途径调节细胞外调节蛋白激酶1/2(ERK1/2)和蛋白激酶B(Akt)的磷酸化[5,6]。我们最近还发现NMDA阻断剂完全阻断了尼古丁的作用,表明尼古丁通过激活NMDA受体而调节了神经网络活动[4]。在培养的海马神经细胞内,尼古丁能激活依赖cAMP依赖的蛋白激酶A(PKA)及其下游的ERK1/2[7]。在海马脑片齿状回,PKA, ERK,PI3K参与了尼古丁诱导的LTP,而依赖钙离子的蛋白激酶2(CAMKII)并未参与[8]。尽管报道表明尼古丁影响PI3K-Akt信号通路的上游分子,而尼古丁对PI3K-Akt信号通路的下游分子的作用并不清楚。PI3K-Akt信号通路下游的一个重要激酶是mTOR激酶,后者的导致糖原合成酶激酶-3β(GSK-3β)激活,而Akt对GSK-3β存在抑制作用[9]。Triciribine分别是是一种特异性Akt抑制剂,对其他激酶如PI3K、PKC、PKA、ERK1/2没有作用[10];雷帕霉素是mTOR激酶阻断剂。mTOR激酶主要参与调节细胞周期,最近研究发现其可能还与淀粉样毒性蛋白的产生和Tau蛋白的磷酸化有关[11]; SB415286是GSK-3β阻断剂,对其他蛋白激酶几乎没有活性[12]。淀粉样毒性蛋白能通过抑制PI3K/Akt信号通路而激活GSK-3β,被激活的GSK-3β将介导Tau蛋白的磷酸化[13]。因此,我们拟应用PI3K-Akt信号通路下游的三个重要激酶的阻断剂Triciribine,雷帕霉素,SB415286来研究尼古丁调节γ网络振荡的细胞内机制。
1材料与方法
1.1实验动物
洁净级Wistar大鼠,4周,雄性,共18只,分为3组,每组6只,体重140g,由武汉动物实验中心购买的4对大鼠所繁殖。
1.2仪器与试剂
人工脑脊液成分:KCl 3mmol/L,CaCl22mmol/L,NaCl 126mmol/L,MgSO42mmol/L,Glucose 10mmol/L,NaH2PO41.25mmol/L,NaHCO324mmol/L。切片脑脊液成分:Sucrose 225mmol/L,Glucose 10mmol/L,KCl 3mmol/L,NaHCO324mmol/L,MgSO46mmol/L,NaH2PO41.25mmol/L,CaCl20.5mmol/L。戊巴比妥钠从国药集团化学试剂有限公司购买。尼古丁,红藻氨酸(Kainate),雷帕霉素(RAPA),SB415286,Triciribine从Sigma公司购买。LEICA VT1200S振动切片机购买于Leica(英国);NL125,126FILTERS信号滤波器,Micro1401信号处理器,NL104(A.C.PREAMP)信号放大器和NL106(AC-DC AMP)信号放大器购买于Digitimer有限公司;Spike 2软件购于CED(剑桥,英国),TC324B温控装置购于Warner(USA)。
1.3实验方法
1)局部场点位记录对实验动物进行腹腔麻醉,打开胸腔暴露心脏,用眼科剪剪破右心耳,在心尖处用预冷0℃)的切片脑脊液(pH:7.35~7.50)经左心室灌流至全身,观察到四肢迅速变白时,快速断头取脑,制备脑片(水平位),脑片厚度控制在400μm。切好的脑片放孵育灌中用已接通混合气(95%O2+ 5%CO2)的人工脑脊液(pH:7.35~7.50,流速为2~3mL/min)灌流,75%的大鼠海马脑片与灌流用的人工脑脊液接触,并且灌流液体保持32℃。脑片孵育1h后将玻璃微电极至于海马CA3区,加入200nM Kainate,20~30min后即开始出现γ网络振荡,1.5~2.0h后达到稳定状态,随后分组加入雷帕霉素(100nM),SB415286(10μmol),Triciribine(5μM),待药效稳定后加入尼古丁(1μmol),观察γ网络振荡的改变。
2)电生理记录的数据分析将大鼠脑片置于孵育槽1h候后,可以观察到良好的脑片呈淡黄色,且形态学上完整。在海马脑片的右侧CA3区放置一个记录电极-参比电极双电极记录模式,将充满人工脑脊液的玻璃微电极(电阻:2~5MΩ),放置于小鼠海马CA3区放射层与锥体细胞层交界处,通过NL104放大器将生物信号2倍放大,通过NL106放大器(AC-DC AMP)进一步放大500倍,然后信号经由NL125,NL126(FILTERS)进行(2~200Hz)滤波。最后通过CED1401ADC板将数据以2kHz的采样速率转换为数字信号,在计算机上显示并记录。分析数据使用Spike 2软件(CED,剑桥,英国)。
1.4统计学分析
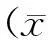
2结果
2.1尼古丁能增强γ网络振荡
大鼠海马脑片在没有加任何药物的情况下,并没有明显的生物学信号(图1A1),当加入200nM红藻氨酸(KA)后,可诱导出明显γ网络振荡(图1A2),再加入尼古丁后γ网络振荡功率谱增加,验证了尼古丁能增强γ网络振荡这一结论。
2.2雷帕霉素对γ网络振荡的影响
当红藻氨酸诱导的γ网络振荡达到稳态后,使用100nM雷帕霉素(RAPA),γ振荡功率谱提高了(12.0±5.2)%(图2B1、B2、C,P>0.05,配对t检验,n=6);再应用尼古丁后,γ振荡功率谱较加入雷帕霉素后相比提高了(17.5±1.9)%(图2B2、B3、C,P<0.01,配对的t检验,n=6)。以上结果表明:雷帕霉素不能阻断尼古丁提高γ振荡功率的作用。
2.3SB415286对γ网络振荡的影响
当γ网络振荡达到稳态后,使用SB415286(10μmol),γ振荡功率谱提高了(11.9±8.1)% (图3B1、B2、C,P>0.05,配对t检验,n=5);再加入尼古丁后γ振荡功率谱较加入SB415286后相比提高了(5.4±1.8)%(图3B2、B3、C,P<0.05,配对的t检验,n=5)。以上结果表明:SB415286能阻断尼古丁提高γ振荡功率的作用。
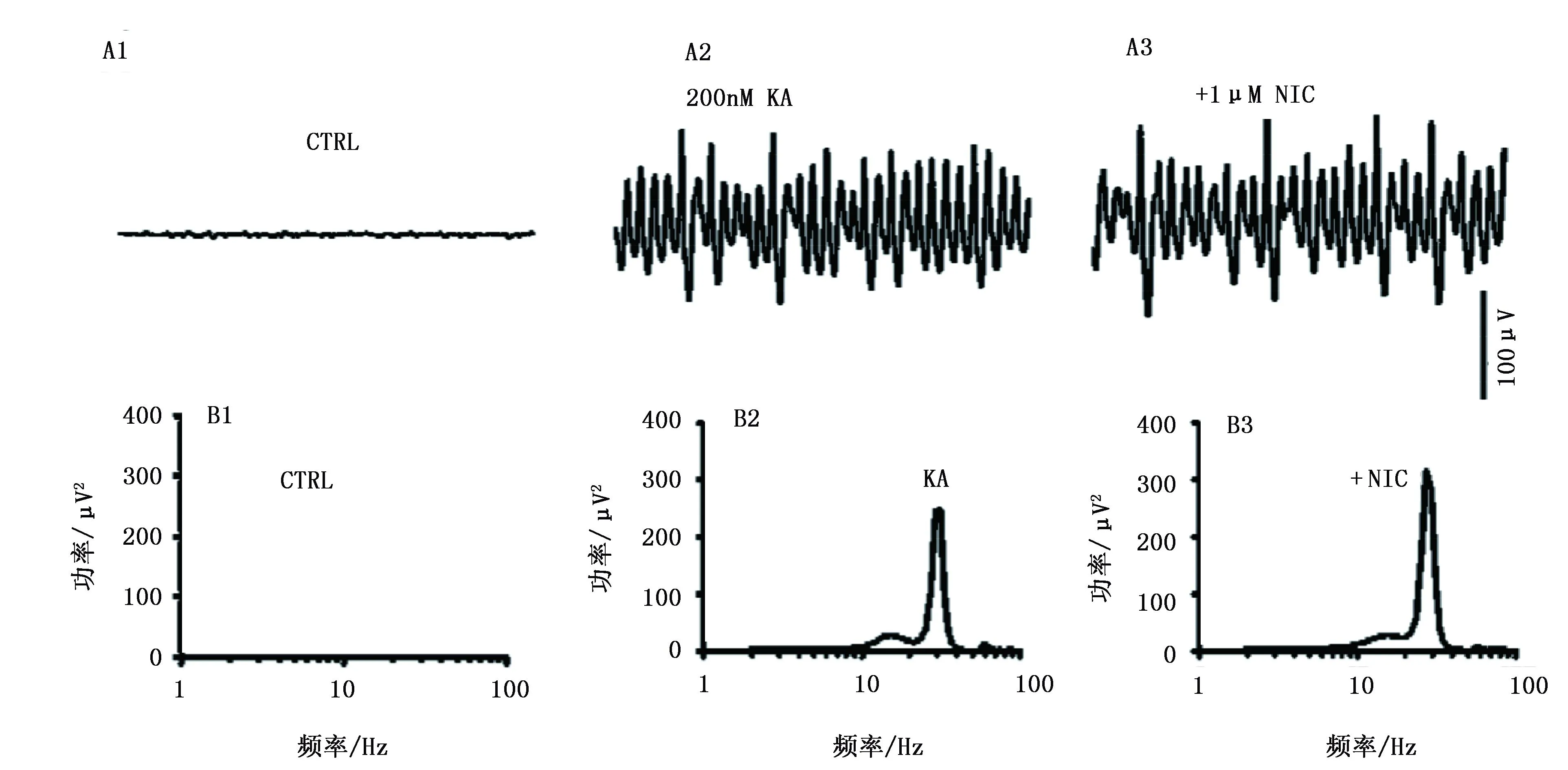
注:A1是未加红藻氨酸(KA)时记录到的细胞外场电位1S原始曲线;A2是应用KA(200nM)后记录到的场电位1S原始曲线;A3是在A2的基础上应用尼古丁(1μM)后记录到的场电位1S原始曲线。B1是未加KA时记录到的能谱图;B2是应用KA(200nM)后记录到的能谱图;B3是应用1μM尼古丁后记录到的能谱图。图1 尼古丁对γ网络振荡的影响

注:A1是应用KA(200nM)后记录到的场电位1S原始曲线;A2是在A1的基础上应用雷帕霉素(100nM)后记录到的场电位1S原始曲线;A3是在A2的基础上应用1μM尼古丁后记录到的场电位1S原始曲线。B1~B3是应用KA,雷帕霉素,尼古丁后记录到的能谱图。C柱状图是应用KA、雷帕霉素、尼古丁后功γ网络振荡的功率谱。图2 雷帕霉素对γ网络振荡的影响
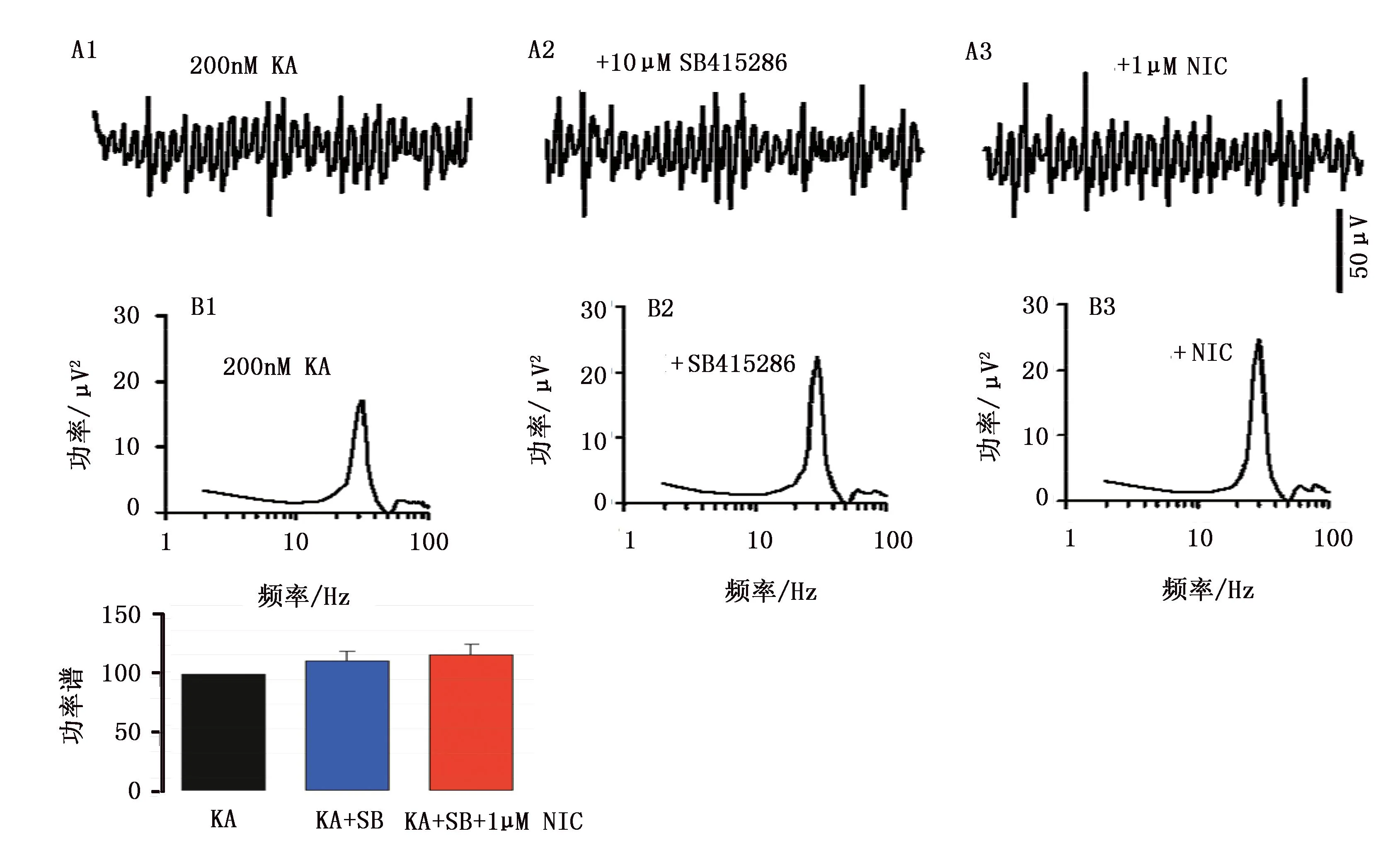
注:A1是应用KA(200nM)后记录到的场电位1S原始曲线;A2是在A1的基础上应用SB415286(10μM)后记录到的场电位1S原始曲线;A3是在A2的基础上应用尼古丁(1μM)后记录到的场电位1S原始曲线。B1~B3是应用KA、SB415286、尼古丁后记录到的能谱图。C柱状图是应用KA、SB415286、尼古丁后γ网络振荡的功率谱。图3 SB415286对γ网络振荡的影响
2.4Triciribine对γ网络振荡的影响
当γ网络振荡达到稳态后,使用5μM Triciribine,γ振荡功率谱提高了(18.2±6.0)% (图4B1、B2、C,P<0.05,配对t检验,n=5);再加入尼古丁后,γ振荡功率谱较加入Triciribine后相比提高了(2.8±3.2)%(图4B2、B3、C,P>0.05,配对的t检验,n=5)。以上结果表明:Triciribine能提高γ振荡功率,并且能阻断尼古丁的作用。

注:A1是应用KA(200nM)后记录到的场电位1S原始曲线;A2是在A1的基础上应用Triciribine(5μM)后记录到的场电位1S原始曲线;A3是在A2的基础上应用尼古丁(1μM)后记录到的场电位1S原始曲线。B1~B3是应KA、Triciribine、尼古丁后记录到的能谱图。C柱状图是应用KA、Triciribine、尼古丁后γ网络振荡的功率谱。图4 Triciribine对γ网络振荡影响
3讨论
低浓度尼古丁(1μM)在海马脑片CA3区能增强持续的γ网络振荡,加入NMDA受体阻断剂后,尼古丁对γ网络振荡的作用消失[4]。由此可见NMDA调节尼古丁的γ网络振荡增强作用。我们结果也显示,Akt或GSK-3β的抑制阻断了尼古丁的γ网络振荡增强作用,但是mTOR的抑制对尼古丁的γ网络振荡增强作用无影响,表明尼古丁通过激活NMDA受体,导致一系列的细胞内信号(激酶)激活,包括PI3K-Akt-GSK-3β信号通路的激活,而调控了γ网络振荡。
有趣的是,在一定条件下Akt抑制剂Triciribine本身增强了γ网络振荡,这种现象提示Akt可能直接参与γ网络振荡的调控。也有报道表明Triciribine 是一个DNA合成的抑制剂,这种现象是否与其对DNA合成的抑制有关待进一步探讨。
mTOR的抑制对尼古丁的γ网络振荡增强作用并无影响,mTOR是GSK-3β上游信号,mTOR的抑制会导致GSK-3β的活性下降,和应用GSK-3β的阻断剂应该有相似作用。说明mTOR的作用的复杂性和细胞种类的特异性。
Akt或者其他蛋白激酶如PKA能磷酸化GSK-3β并阻断其介导的细胞凋亡[14,15]。所以抑制Akt和GSK-3β应该会出相反的结果。然而使用上述两个受体的阻断剂后,尼古丁的效应都被阻断。最近研究表明酒精能同时激活AKT和GSK-3β[16,17],是否尼古丁能通过类似的机制产生作用,待进一步研究。
[参考文献]
[1]Fries P, Nikolic D, Singer W.The gamma cycle[J].Trends in Neurosciences,2007, 30(7): 309~316.
[2]Zheng C, Bieri K W, Trettel S G, et al.The relationship between gamma frequency and running speed differs for slow and fast gamma rhythms in freely behaving rats[J].Hippocampus,2015, 25(8): 924~938.
[3]Traub R D, Bibbig A, LeBeau F E, et al.Cellular mechanisms of neuronal population oscillations in the hippocampus in vitro[J].Annu Rev Neurosci,2004, 27(1):247~278.
[4]Wang Y, Wang Z, Wang J, et al.The modulation of nicotinic acetylcholine receptors on the neuronal network oscillations in rat hippocampal CA3 area[J].Sci Rep,2015,5(1):9493.
[5]Perkinton M S, Ip J K, Wood G L, et al.Phosphatidylinositol 3~kinase is a central mediator of NMDA receptor signalling to MAP kinase (Erk1/2), Akt/PKB and CREB in striatal neurones[J].J Neurochem,2002,80(2):239~254.
[6]Crossthwaite A J, Valli H, Williams R J Inhibiting Src family tyrosine kinase activity blocks glutamate signalling to ERK1/2 and Akt/PKB but not JNK in cultured striatal neurones[J].J Neurochem,2004,88(5):1127~1139.
[7]Dajas-Bailador F A,Soliakov L,Wonnacott S.Nicotine activates the extracellular signal-regulated kinase 1/2 via the alpha7 nicotinic acetylcholine receptor and protein kinase A, in SH-SY5Y cells and hippocampal neurones[J].J Neurochem,2002,80(3):520~530.
[8]Welsby P J, Rowan M J, Anwyl R.Intracellular mechanisms underlying the nicotinic enhancement of LTP in the rat dentate gyrus[J].The European Journal of Neuroscience,2009,29(1):65~75.
[9]Cho C H.Molecular mechanism of circadian rhythmicity of seizures in temporal lobe epilepsy[J].Front Cell Neurosci,2012,6(1):55.
[10]Yang L, Dan H C, Sun M,et al.Akt/protein kinase B signaling inhibitor~2, a selective small molecule inhibitor of Akt signaling with antitumor activity in cancer cells overexpressing Akt[J].Cancer Res,2004,64(13):4394~4399.
[11]Tramutola A,Triplett J C,di Domenico F, et al.Alteration of mTOR signaling occurs early in the progression of Alzheimer disease (AD): analysis of brain from subjects with pre-clinical AD, amnestic mild cognitive impairment and late-stage AD[J].J Neurochem,2015,133(5):739~749.
[12]Coghlan M P, Culbert A,Cross D A,et al.Selective small molecule inhibitors of glycogen synthase kinase~3 modulate glycogen metabolism and gene transcription[J].Chem Biol,2000,7(10):793~803.
[13]Takashima A.GSK-3 is essential in the pathogenesis of Alzheimer's disease[J].J Alzheimers Dis,2006,9(3):309~317.
[14]Li M, Wang X, Meintzer M K, et al.Cyclic AMP promotes neuronal survival by phosphorylation of glycogen synthase kinase 3beta[J].Molecular and Cellular Biology,2000,20(24):9356~9363.
[15]Jo J, Whitcomb D J, Olsen K M, et al.Abeta(1-42) inhibition of LTP is mediated by a signaling pathway involving caspase-3, Akt1 and GSK-3beta[J].Nature Neuroscience,2011,14(5):545~547.
[16]Zeng T, Zhang C L, Song F Y, et al.PI3K/Akt pathway activation was involved in acute ethanol-induced fatty liver in mice[J].Toxicology,2012,296(1/3):56~66.
[17]Neasta J, Ben Hamida S, Yowell Q V, et al.AKT signaling pathway in the nucleus accumbens mediates excessive alcohol drinking behaviors[J].Biological Psychiatry,2011,70(6):575~582.
[编辑]方多
[收稿日期]2016-01-01
[作者简介]贺小龙(1988-),男,硕士生,主要从事神经病学研究工作;通信作者:路承彪,354277140@qq.com。
[中图分类号]R338.2
[文献标志码]A
[文章编号]1673-1409(2016)18-0001-05
[引著格式]贺小龙,成祥林,钱锋,等.尼古丁通过蛋白激酶B和糖原合成酶激酶-3调节γ网络振荡[J].长江大学学报(自科版),2016,13(18):1~5.
