同步荧光光谱法结合分子对接研究金雀花碱与牛血清白蛋白间相互作用
2016-06-15吴雨杭韩忠保马嘉泽刘丽艳辛士刚
吴雨杭, 韩忠保, 马嘉泽, 何 妍, 刘丽艳, 辛士刚, 于 湛*
1. 沈阳师范大学化学化工学院, 辽宁 沈阳 110034
2. 沈阳师范大学实验中心, 辽宁 沈阳 110034
同步荧光光谱法结合分子对接研究金雀花碱与牛血清白蛋白间相互作用
吴雨杭1, 韩忠保1, 马嘉泽1, 何 妍1, 刘丽艳1, 辛士刚2, 于 湛1*
1. 沈阳师范大学化学化工学院, 辽宁 沈阳 110034
2. 沈阳师范大学实验中心, 辽宁 沈阳 110034
金雀花碱(Cy)是一种生物碱, 主要存在于豆科毒豆属植物种子中。 Cy具有较强的生物活性, 特别是作为戒烟药物已得到广泛应用。 在模拟生理条件下, 应用荧光光谱法研究了Cy同牛血清白蛋白(BSA)之间的相互作用以及Cy猝灭BSA荧光发射的机理。 详细考查了水浴温度、 水浴时间以及溶液pH等因素对荧光猝灭的影响, 并且通过Stem-Volmer方程计算了Cy与BSA间的结合类型、 结合位点数目以及结合常数。 结果表明, Cy与BSA可形成摩尔比为1∶1的非共价复合物, 其结合常数为5.6×103, 其猝灭类型为静态猝灭。 同步荧光光谱研究结果表明, Cy的结合主要影响BSA 的Trp残基的荧光发射。 进一步应用分子对接研究表明, 氢键与疏水作用是Cy与BSA形成复合物的主要推动力。 Cy与BSA中Trp213及其周围的氨基酸残基间存在氢键与疏水作用, 这种作用将改变Trp213所处微环境的疏水情况, 从而导致BSA的荧光发生猝灭。
金雀花碱; 牛血清白蛋白; 荧光猝灭; 同步荧光光谱法; 分子对接
引 言
分子间相互作用, 尤其是药物小分子与生物大分子间相互作用研究, 已逐渐成为化学、 生命科学和医药科学等领域中最为活跃的研究热点之一。 血清蛋白是血浆里含量最高的蛋白质, 是体内重要的载体。 药物进入体内后一般无法直接作用于病灶部位, 需通过首先与血清蛋白结合进行运输, 随后再释放为游离态的方式作用于病灶部位。 因此研究血清蛋白与药物分子间相互作用对掌握药物的运输、 药理作用的发挥以及药物代谢都具有十分重要的意义[1]。 牛血清白蛋白(BSA)含有583个氨基酸残基, 分子量为66.4 kDa, 因其结构稳定、 价格不高且与人血清白蛋白(HSA)同源, 因此常用来替代HSA, 研究药物在人体内的转运过程。
金雀花碱(cytisine, Cy)是一种主要存在于豆科毒豆属植物种子中的喹诺里西啶生物碱[2](结构见图1)。 Cy生理功能类似烟碱, 能反射性地兴奋呼吸, 使人心跳加速, 血压急剧上升, 与烟碱乙酰胆碱受体(nAChR)亲和力较强, 用作戒烟药物使用已有超过40年的历史[3]。 最近人们发现, 在体外实验中金雀花碱表现出一定的抗癌活性[4], 因此Cy是一种潜在的抗癌药物。
Cy与蛋白质相互作用的研究未见报道。 在模拟生理条件下, 通过荧光光谱法研究了Cy对BSA荧光的猝灭作用, 并利用同步荧光光谱法以及分子对接分析了Cy在BSA上的结合位点。
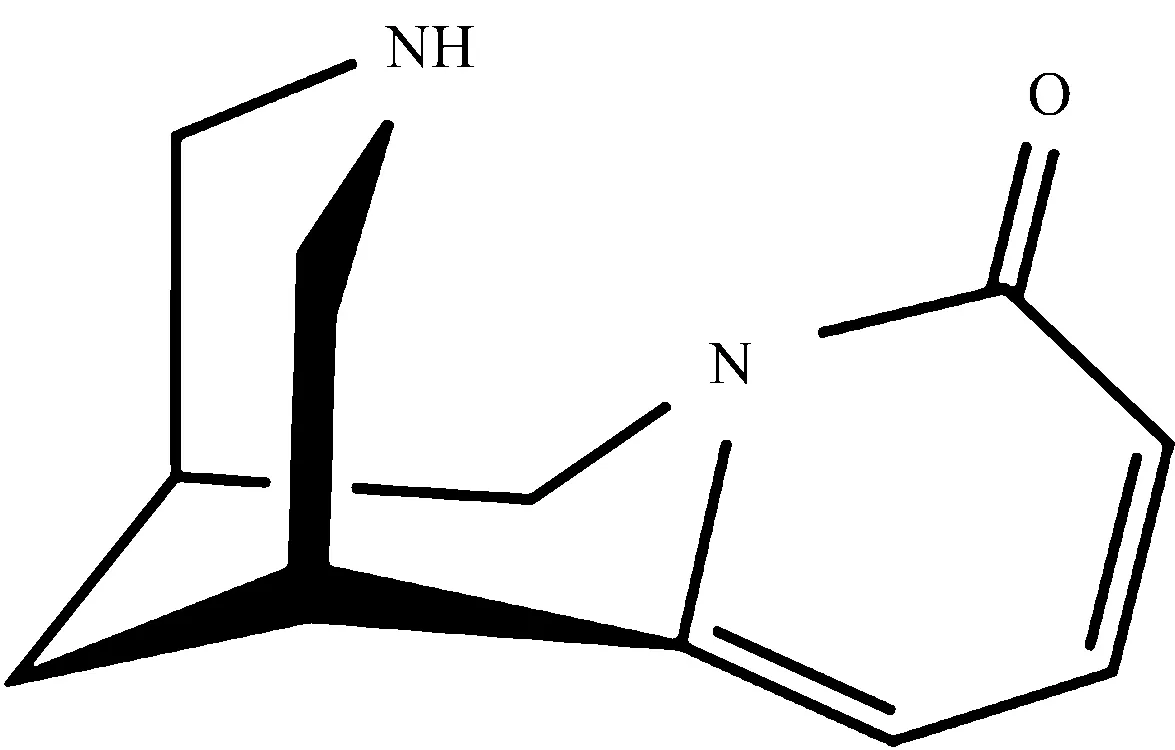
Fig.1 The structure of cytisine (Cy)
1 实验部分
1.1 仪器与试剂
Cary Eclipse 荧光光谱仪(瓦里安公司), FE20K型pH计(梅特勒托利多公司)。
Cy购自上海源叶生物科技有限公司, BSA与三羟甲基氨基甲烷(Tris)均购于美国Amresco公司, NaCl购于北京化工厂, 色谱纯甲醇购于国药集团化学试剂有限公司, HCl与NaOH均购于沈阳化学试剂厂。 所用试剂纯度均为分析纯或更高, 实验用二次去离子水。
1.2 方法
使用HCl, NaOH与Tris分别配制pH为6.4、 7.4与8.4的缓冲溶液, 其中Tris浓度均为0.10 mol·L-1(内含0.10 mol·L-1NaCl以维持离子强度)。 应用上述缓冲溶液将BSA配制成浓度为5.0×10-4mol·L-1的储液。 Cy首先用最少量甲醇溶解, 然后用水稀释为5.0×10-4mol·L-1溶液。
依次准确加入20.0 μL BSA溶液、 1 000.0 μL Tris缓冲溶液以及一定量的Cy储液于一次性离心管中, 加水稀释至4 000.0 μL, 随后进行固定时间恒温水浴, 水浴结束后立即对该溶液进行荧光分析, 光谱仪参数:λex=280 nm,λ(ex slit)=5 nm;λ(em slit)=5 nm; 扫描范围设为285~500 nm。 同步荧光测试Δλ分别为15和60 nm。
BSA的三维结构取自蛋白质晶体结构数据库(http://www.rcsb.org/pdb/), PDB ID: 4F5S[5]。 Cy的三维结构取自pubchem网站(https://pubchem.ncbi.nlm.nih.gov/), 并在Avogadro程序[6]中进行结构优化预处理。 使用Autodock 4.2进行分子对接[7]。 分子对接在立方体格子中进行, 其长、 宽、 高均为126 Å, 格子间隔为0.375 Å, Cy分子结构中可旋转的单键、 非极性氢原子等, 均依照程序默认值未做改动, BSA中Trp134与Trp213残基设为柔性, 采用Lamarckian遗传算法(LGA), 配体产生100个对接构象, ga_pop_size为150, ga_num_evals为2.5×106, ga_num_generations为2.7×104, 其余参数均按照默认值未做改动。 使用LigPlot+[8]程序分析复合物中与Cy存在作用的BSA的氨基酸残基。
2 结果与讨论
2.1 溶液条件对Cy猝灭BSA荧光发射的影响
BSA在水溶液存在较强荧光发射, 其最大发射波长为347 nm[9]。 BSA能够产生荧光发射是由于其结构中含有色氨酸(Trp)、 酪氨酸(Tyr)等氨基酸残基, 其中Trp残基的贡献为BSA具有荧光发射的主要原因[9]。 游离色氨酸的λem为352 nm[10], 与BSA的荧光最大发射波长相接近, 可见BSA中Trp残基所处的微环境较为亲水。 Cy加入后, BSA的荧光发射明显下降, 产生猝灭。 本研究主要考查了时间、 温度以及pH对Cy猝灭BSA的影响。
将含有不同浓度Cy的BSA溶液置于17, 27及37 ℃水浴30 min后立即测试其荧光发射强度, 并利用得到的F0/F(F0为BSA荧光发射强度;F为加入Cy后BSA荧光发射强度)与[Q](Cy浓度)关系作图(图2)。 观察可知, 在三个温度下BSA的F0/F值与[Q]都具有良好线性关系, [Q]相同时低温下的F0/F值要高于高温, 这符合文献[9, 11]所报道的静态猝灭规律。 这可能是由于BSA与Cy所形成的复合物的稳定性随温度上升而下降。 因此, 推测Cy通过与BSA形成复合物猝灭其荧光。 从三条拟合曲线分布来看, 温度对于荧光猝灭的影响并不显著, 但是由于37 ℃为生理温度, 因此后续实验均采用37 ℃为水浴温度。

Fig.2 The effect of bathing temperature to the fluorescence quenching
λex=280 nm;λem=347 nm;cCy=0.0, 2.5, 5.0, 7.5, 10.0, 12.5 and 15.0×10-6mol·L-1respectively;cBSA=2.5×10-6mol·L-1; buffer pH=7.4; bathing time tbath=30 min
在BSA浓度为2.5×10-6mol·L-1、 Cy浓度为7.5×10-6mol·L-1的条件下, 于37℃分别水浴10, 30, 60, 90和120 min后, 其F0/F值分别为1.67, 1.71, 1.73, 1.75及1.65。 由此可见, Cy对BSA荧光的猝灭在水浴时间为90 min时达到峰值, 但是由于其他温度下的F0/F值与其相比相差不大, 水浴时间对Cy猝灭BSA影响不大, 同时考虑到BSA暴露于空气中易发生氧化引起蛋白质结构改变, 因此后续实验的水浴时间定为30 min。
图3为不同pH下Cy猝灭BSA荧光的情况, 由图可以看出pH对于Cy猝灭BSA荧光的影响不很明显。 相对而言pH 7.4条件下Cy对BSA荧光的猝灭作用较强。 一般来说

Fig.3 The effect of solution pH to the fluorescence quenching
λex=280 nm;λem=347 nm;cCy=0.0, 2.5, 5.0, 7.5, 10.0, 12.5 and 15.0×10-6mol·L-1respectively;cBSA=2.5×10-6mol·L-1; buffer pH=6.7, 7.4 and 8.4 respectively; bathing time tbath=30 min; bathing temperature Tbath=37 ℃
pH 7.4最接近BSA的生理条件, 此条件下BSA结构最为舒展, 药物分子与BSA结合后对BSA内部疏水性氨基酸残基的微环境有较大影响。 因此后续实验中pH选择为7.4。
在完成上述实验后, 确定溶液pH为7.4、 水浴温度为37 ℃、 水浴时间为30 min为所得最佳实验条件。 在此条件下进行一系列不同浓度的Cy猝灭BSA荧光, 结果见图4。 由图可见, 随着Cy浓度的增加, BSA的荧光光谱发射强度不断降低, 并且其最大发射波长逐渐红移至355 nm处。 Cy为荧光性物质, pH 7.4条件下在368 nm处存在最大荧光发射, 由此认为在金雀花碱浓度增加的时候, 体系的荧光为BSA与Cy的合并荧光发射。

Fig.4 Fluorescence emission spectra of BSA-Cy
λex=280 nm;λem=347 nm; 1→7:cCy=0.0, 2.5, 5.0, 7.5, 10.0, 12.5 and 15.0×10-6mol·L-1respectively;cBSA=2.5×10-6mol·L-1; buffer pH 7.4; bathing time tbath=30 min; bathing temperature Tbath=37 ℃
2.2 金雀花碱猝灭BSA荧光发射机理
根据Langmuir单分子吸附模型分析配体分子与血清白蛋白发生作用的结合常数、 结合位点数等参数。 以此为模型, 按照Stern-Volmer方程(1)对Cy猝灭BSA的荧光猝灭机理进行分析。
(1)
式中Kq为荧光猝灭速率常数;τ0是无猝灭剂存在时荧光分子的平均寿命, BSA等生物大分子的平均τ0为1.0×10-8s。
将图4中数据代入式(1), 经线性拟合后计算可得Kq=5.2×1011L·(mol·s)-1。 通过查阅文献可知静态猝灭最大散射碰撞猝灭速率常数为2.0×1010L·(mol·s)-1[12], 此值小于本研究中所测Kq值, 由此说明Cy猝灭BSA荧光的动力学模型是静态猝灭, 并且由于Kq值较大, 说明Cy与BSA之间能有效地形成稳定的非共价复合物。
如果荧光分子与猝灭剂之间存在静态猝灭, 那么二者之间的关系可由Scatchard方程(2)推导。
(2)
式中KA为荧光分子与猝灭剂的表观结合常数;n为结合位点数。
将图4中数据代入式(2), 线性拟合后计算可得KA=5.6×103L·mol-1, 说明二者之间结合作用较强。 计算可得n=1.01, 说明Cy与BSA所形成的复合物中二者的比例为1∶1。
同步荧光分析法具有选择性高、 谱图简化、 光散射干扰少等特点[13], 常用来研究小分子对蛋白质构象的影响。 BSA所含有的Trp和Tyr等氨基酸残基的荧光发射峰在普通的荧光光谱图中重叠而无法分辨, 通过同步荧光技术, 在合适的Δλ条件下可分辨Trp和Tyr残基的显性特征峰, 从而实现分析配体猝灭BSA的机理。 由文献[14]可知, 对于BSA的同步荧光发射, Δλ为15 nm时只表现Tyr残基的荧光特性, 而Δλ为60 nm时只表现Trp残基的荧光光谱特性。

Fig.5 Synchronous fluorescence spectra for the interaction between BSA and Cy
λex=280 nm; 1→7:cCy=0.0, 2.5, 5.0, 7.5, 10.0, 12.5 and 15.0×10-6mol·L-1respectively;cBSA=2.5×10-6mol·L-1; buffer pH=7.4; Bath time tbath=30 min; Bath temperature Tbath=37 ℃

Fig.6 Molecular contacts between the amino acid residues of BSA with Cy. Hydrogen bonds are shown as dashed lines with indicated distances (in Å). Residues in hydrophobic contact with Cy are represented by semicircles and radiating spokes
由图5可见, 在Δλ为15及60 nm时, 随着Cy浓度的增加Tyr与Trp残基的特征发射峰均出现一定程度的猝灭, 可见在BSA-Cy复合物中BSA的构象产生了变化。 且在Δλ为15 nm条件下, 最大发射波长由285 nm蓝移至277 nm, 说明Cy可促进BSA中Tyr残基所处的微环境极性减小, 疏水性增加。 对比图5(a)与(b)可见, Trp残基所引起的荧光发射强度下降对BSA荧光猝灭的贡献要高于Tyr残基, 由此可以认为复合物中Cy可能主要结合在BSA的Trp残基。
2.3 分子对接结果分析
为了推测BSA-Cy复合物结构, 使用AutoDock[7]软件对BSA与Cy的识别进行了分子对接研究。 Cy与BSA间相互作用的二维模型如图6所示。
Cy与BSA结合后, 同周围的一些氨基酸残基间存在氢键与疏水作用。 BSA的Phe205, Arg208, Ala209, Ala212, Trp213, Leu346, Lys350, Leu480, Val481等残基形成一个疏水性口袋, Cy结合在BSA表面的这个活性口袋中。 Cy与Trp213残基间距离为2.70 nm, 与Arg208之间距离为3.17 nm, 并且与这两个残基之间存在氢键作用。 由图6可以看出, Cy的引入对Trp213残基周围的微环境影响较大, 从而猝灭BSA的荧光发射。
3 结 论
通过一系列实验及相关计算表明Cy可以通过与BSA形成1∶1型复合物的方式猝灭BSA的荧光发射, 结合常数为5.6×103L·mol-1。 通过同步荧光光谱分析与分子对接研究发现Cy主要通过影响BSA中Trp213残基的微环境引发荧光猝灭。 氢键与疏水作用在Cy-BSA复合物形成过程中起到了重要作用, 是Cy与BSA结合的主要驱动力。
[1] HU Tao-ying, CHEN Lin, LIU Ying(胡涛英, 陈 琳, 刘 颖). Spectroscopy and Spectral Analysis (光谱学与光谱分析), 2014, 34(5): 1343.
[2] Rouden J, Lasne M-C, Blanchet J, et al. Chemical Reviews, 2013, 114(1): 712.
[3] Tzankova V, Danchev N. Biotechnology & Biotechnological Equipment, 2007, 21(2): 151.
[4] Lin Z, Huang C F, Liu X S, et al. Basic & Clinical Pharmacology & Toxicology, 2011, 108(5): 304.
[5] Bujacz A. Acta Crystallogr. D, 2012, 68(10): 1278.
[6] Hanwell M, Curtis D, Lonie D, et al. Journal of Cheminformatics, 2012, 4(1): 17.
[7] Morris G M, Huey R, Lindstrom W, et al. Journal of Computational Chemistry, 2009, 30(16): 2785.
[8] Laskowski R A, Swindells M B. Journal of Chemical Information and Modeling, 2011, 51(10): 2778.
[9] Xu H, Yao N, Xu H, et al. International Journal of Molecular Sciences, 2013, 14(7): 14185.
[10] BI Shu-yun, LIU Chun-ming(毕淑云, 刘春明). Chinese Journal of Analytical Chemistry(分析化学), 2009, 37(z1): 933.
[11] Zhang X, Li L, Xu Z, et al. PLoS ONE, 2013, 8(3): e59106.
[12] Jayabharathi J, Jayamoorthy K, Thanikachalam V, et al. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 108: 146.
[13] HE Li-fang, LIN Dan-li, LI Yao-qun(何立芳, 林丹丽, 李耀群). Progress in Chemistry(化学进展), 2004, 16(6): 879.
[14] Congdon R W, Muth G W, Splittgerber A G. Analytical Biochemistry, 1993, 213: 407.
*Corresponding author
欢迎投稿 欢迎订阅 欢迎刊登广告
Intermolecular Interactions between Cytisine and Bovine Serum Albumin: A Synchronous Fluorescence Spectroscopic Analysis and Molecular Docking Research
WU Yu-hang1, HAN Zhong-bao1, MA Jia-ze1, HE Yan1, LIU Li-yan1, XIN Shi-gang2, YU Zhan1*
1. School of Chemistry and Chemical and Engineering, Shenyang Normal University, Shenyang 110034, China
2. Experimental Center, Shenyang Normal University, Shenyang 110034, China
Cytisine (Cy) is one of the alkaloids that exist naturally in the plant generaLaburnumof the familyFabaceae. With strong bioactivities, Cy is commercialized for smoking cessation for years. In this work, the study of intermolecular interactions between Cy and bovine serum albumin (BSA) was performed by applying fluorescence spectroscopic methods under simulated physiological conditions. The mechanism of fluorescence quenching of BSA by Cy was also studied. Parameters such as bathing temperature, time and solution pH were investigated to optimize the fluorescence quenching. The binding type, binding ratio and binding constant between BSA and Cy were calculated by using the Stem-Volmer equation. Experimental results indicated that Cy can quench the fluorescent emission of BSA statically by forming a 1∶1 type non-covalent complex and the binding constant is 5.6×103L·mol-1. Synchronous fluorescence spectral research shows Cy may affect the fluorescence emission of Trp residues of BSA. Furthermore, molecular docking is utilized to model the complex and probe the plausible quenching mechanism. It can be noted that the hydrogen bindings and hydrophobic interactions between Cy and BSA change the micro-environment of Trp213, which leads to the fluorescence quenching of BSA.
Cytisine; Bovine serum albumin; Synchronous fluorescence spectroscopy; Fluorescence quenching; Molecular docking
Nov. 12, 2014; accepted Mar. 12, 2015)
2014-11-12,
2015-03-12
国家自然科学基金项目(21205080), 教育部留学回国人员科研启动基金项目(教外司留[2012]1707), 沈阳师范大学优秀人才支持计划(2013年)和辽宁省高等学校优秀人才支持计划(LJQ2015105)资助
吴雨杭, 女, 1989年生, 沈阳师范大学硕士研究生 e-mail: wuyuhang1106@hotmail.com *通讯联系人 e-mail: yuzhan@synu.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)03-0765-05
猜你喜欢
杂志排行
光谱学与光谱分析的其它文章
- 基于SVM与RF的苹果树冠LAI高光谱估测
- 基于非均匀B样条的拉曼光谱基线校正算法
- 不同硬实率紫花苜蓿种子的近红外光谱分析
- 衰减全反射红外光谱法快速检测沥青性质的研究
- Study on the Comparisons of the Establishment of Two Mathematical Modeling Methods for Soil Organic Matter Content Based on Spectral Reflectance
- A Relative Humidity Pulse Approach to Observe Mass Transfer Processes Controlled by Bulk and Surface for Aerosols
