氙气联合亚低温对少突胶质前体细胞糖氧剥夺后的保护作用
2016-06-15孙轶袁艳冰刘放云刘海燕
孙轶 袁艳冰 刘放云 刘海燕
氙气联合亚低温对少突胶质前体细胞糖氧剥夺后的保护作用
孙轶 袁艳冰 刘放云 刘海燕
目的 研究氙气联合亚低温对少突胶质前体细胞(OPCs)糖氧剥夺损伤后的保护作用,探讨氙气对新生儿缺氧缺血性脑病(HIE)的保护机制。方法 体外培养大鼠原代OPCs,检测氙气联合亚低温对OPCs糖氧剥夺后凋亡、增殖和分化的影响。结果 各组细胞凋亡率比较差异有统计学意义(P<0.05),其中正常对照组(Ctrl)凋亡率最低为(6.3±1.52)%,而OGD对照组(OGD Ctrl)凋亡率最高为(70.3±4.72)%,氙气组(Xe)和亚低温组(HT)凋亡率分别为(27.3±3.05)%、(31.6±4.5)%,显著低于OGD对照组,比较差异有统计学意义(P<0.05),联合治疗组(Xe+HT)凋亡率为(15.6±2.51)%,低于氙气低温组或亚低温组,比较差异有统计学意义(P<0.05);各组OPCs增殖率比较差异无统计学意义;正常对照组细胞呈健康生长,有明显的三级以上分支的较长网状突起形成,计算成熟细胞率为(81.0±4.58)%;OGD对照组细胞细胞突起短少而紊乱,次级以上分支减少,成熟细胞率为(14.6±3.51)%,OGD对照组与正常对照组相比,差异有统计学意义(P<0.01)。氙气组成熟细胞率(43.6±3.51)%比OGD对照组高,低于亚低温组(53.3±3.21)%,差异均有统计学意义(P<0.05)。联合治疗组成熟细胞率(64.6±4.16)%显著高于单用氙气或亚低温组(P<0.05)。结论 氙气联合亚低温治疗能保护OPCs耐受缺氧缺血性损伤的影响,可能是其对HIE的神经保护机制之一。
氙气;亚低温;糖氧剥夺;少突胶质前体细胞
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是一种能导致新生儿死亡及影响神经预后的严重疾病。亚低温疗法(hypothermia,HT)是目前唯一被循证医学证实能改善足月儿HIE的神经系统预后并降低死亡率的方法,但疗效仍不够理想[1-3]。在缺血缺氧性脑损伤的新生动物中,氙气(Xenon,Xe)具有显著的神经保护特性并可与亚低温起协同效应,可抑制神经元凋亡[4-5]。近年研究证明新生儿缺氧缺血不仅损伤脑灰质而且损伤脑白质[6],脑白质损伤主要表现为少突胶质前体细胞(oligodendrocyte precursor cell,OPCs)增殖,但能分化成熟形成髓鞘的却很少[7]。本研究在体外制备OPCs糖氧剥夺损伤模型,模拟体内缺氧缺血过程,探讨氙气联合亚低温治疗对OPCs增殖和分化的影响,为氙气对HIE的保护作用机制提供更多的基础医学依据。
1 材料与方法
1.1 实验动物与试剂 新生1日龄SPF级SD大鼠,雄性,由中山医科大学动物实验中心提供。Edu细胞增殖检测试剂盒、荧光二抗及所有细胞培养试剂均购自Gibco,氙气混合气体购自深圳特种气体公司。Tunnel细胞凋亡检测试剂盒购自Roche,小鼠抗MBP抗体购自Chemicon。
1.2 少突胶质前体细胞纯化分离培养 参考Chen[8]的方法,新生大鼠取大脑进行混合胶质细胞培养,10~12 d后利用振荡分离和差速贴壁法分离和纯化OPCs。
1.3 糖氧剥夺模型(Oxygen-Glucose Deprivation,OGD)及氙气处理 OPCs增殖培养2 d后更换为经过氮气处理过的无糖无氧DMEM培养基,对照组为高糖DMEM培养基,OGD组细胞置于三气培养箱内调节成95%N2,5%CO2,37℃培养120 min,完成糖氧剥夺过程。氙气组细胞培养基事先通入氙气混合气体(50%Xe,25%N2,20%O2,5%CO2)处理,OPCs加入已处理培养基置于密闭的细胞培养罐中,混合气体充入培养罐10 min后密闭培养24 h。
1.4 实验分组 OGD细胞分为对照组(OGD Ctrl),氙气组(Xe),亚低温组(HT),及联合治疗组(Xe+HT),此外设无OGD的正常培养对照组(Ctrl)。氙气组及联合治疗组充入氙气混合气体,其它治疗组气体为75%N2,20%O2,以及5%CO2。OGD后亚低温组及联合治疗组培养箱温度为33℃,其余组为37℃。
1.5 OPCs凋亡、增殖及分化检测 收集各组处理24 h后细胞,Tunnel免疫荧光染色检测凋亡,凋亡率以Tunnel阳性细胞数占DAPI染色阳性的总细胞数比例来表示;或更换正常OPCs增殖培养基培养48 h,Edu法检测细胞增殖,Edu标记阳性率=阳性细胞数/细胞总数×100%;另外一部分细胞则在处理后进行OPCs分化培养,5 d后进行MBP免疫荧光染色。计算有三级以上分支,且突起长度超过胞体3倍以上的细胞所占的比例,即成熟细胞率。
1.6 统计学方法 采用SPSS 20.0统计软件包分析本研究数据。计量资料以“x±s”表示,多组间比较采用单因素方差分析(ANOVA),之后两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞凋亡率的比较 方差分析显示各组细胞凋亡率比较差异有统计学意义(P<0.05),其中正常对照组(Ctrl)因细胞在正常条件下培养凋亡率最低为(6.3±1.52)%,而OGD对照组(OGD Ctrl)凋亡率最高为(70.3±4.72)%,氙气组(Xe)和亚低温组(HT)凋亡率分别为(27.3±3.05)%、(31.6±4.5)%,显著低于OGD对照组,比较差异有统计学意义(P<0.05),氙气组(Xe)和亚低温组(HT)比较差异无统计学意义,联合治疗组(Xe+HT)凋亡率为(15.6±2.51)%,低于单用氙气或亚低温组,比较差异有统计学意义(P<0.05)。
2.2 各组OPCs增殖率的比较 Ctrl组、OGD Ctrl组、Xe组、HT组、Xe+HT组OPCs增殖率分别为(53.6±3.05)%、(47.6± 2.51)%、(56.0±5.57)%、(48.3±7.76)%、(49.0±4.05)%,方差分析显示各组OPCs增殖率比较差异无统计学意义。
2.3 氙气或/和亚低温处理改善OPCs糖氧剥夺损伤对分化的影响 正常对照组细胞呈健康生长,有明显的三级以上分支的较长网状突起形成,计算成熟细胞率为(81.0±4.58)%;OGD对照组细胞细胞突起短少而紊乱,次级以上分支减少,成熟细胞率为(14.6±3.51)%,OGD对照组与正常对照组相比,差异有统计学意义(P<0.01)。氙气组成熟细胞率(43.6±3.51)%比OGD对照组高,低于亚低温组(53.3±3.21)%,差异均有统计学意义(P<0.05)。联合治疗组成熟细胞率为(64.6±4.16)%,显著高于单用氙气或亚低温组(P<0.05)。见图1。
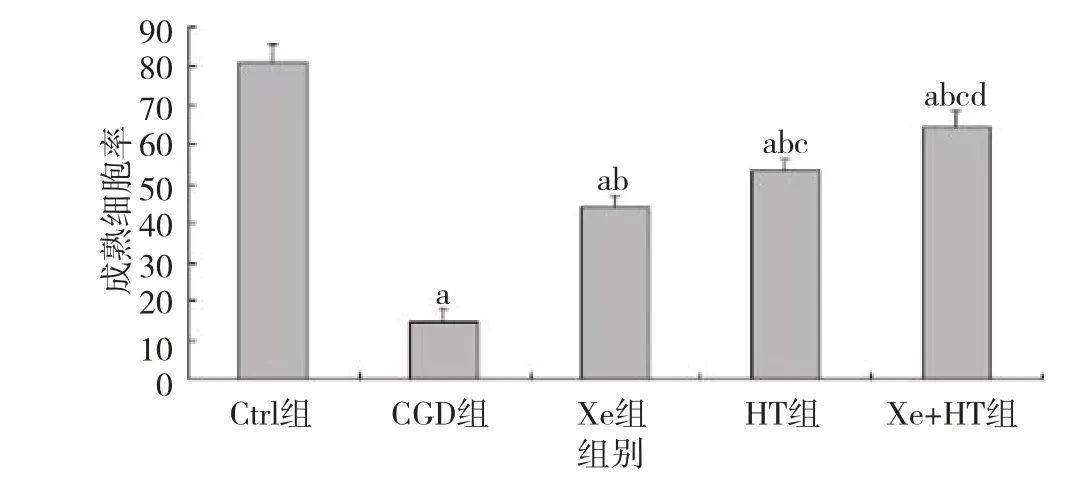
图1 各组细胞分化培养5 d后成熟细胞率(%)
3 讨论
亚低温疗法是目前唯一被循证医学证实的能改善新生儿缺氧缺血性脑病神经系统预后的治疗方法,即通过人工诱导方法将体温下降3℃~5℃,在生后6 h内实施亚低温疗法并持续72 h,维持体温在32℃~34℃。亚低温可抑制缺氧缺血所致生化级联反应中的众多环节,多途径和多靶点对脑组织的保护。但是对重症HIE的疗效仍很差。
氙气是最稳定的惰性气体,在体内不进行生物转化,无毒性和致癌性,吸入后仍以原形式经肺呼出。其不仅是理想的吸入麻醉剂,同时具有良好的器官保护作用,对脑的保护作用尤其突出。在新生动物中,低于麻醉浓度的氙气具有显著的神经保护特性并可以与治疗性亚低温起协同作用。氙气能预防缺血、神经兴奋性毒素及心肺转流所导致的急性神经损伤的形态与功能学变化。体内外动物实验亦发现氙气联合亚低温比单用二者的任何一种,具有更好的神经保护作用,显著地改善了神经系统的长期预后,其保护机制可能与抗凋亡有关[9-10]。
本研究发现,在体外培养的少突胶质前体细胞糖氧剥夺损伤的模型中,氙气或/和亚低温并不影响OPCs的增殖,但是单用氙气或亚低温处理都能减少损伤后OPCs的凋亡,并促进OPCs分化过程中突起的发育和成熟,氙气与亚低温联合使用能增强这种保护作用。OPCs的存活率及是否能正常分化是决定髓鞘能否正常发育的重要因素。本研究结果提示,氙气联合亚低温治疗可能在新生儿缺血缺氧性脑损伤时不仅保护神经元,也可保护OPCs,抑制其凋亡,促进其分化成熟,从而改善髓鞘化障碍,改善患儿的神经系统预后。进一步的研究将来可在体内的动物实验中继续证实。
[1] Jacobs SE,Berg M,Hunt R,et al.Cooling for newborns with hypoxic ischaemic encephalopathy[J].Cochrane Database Syst Rev,2013,1 (4):CD 003311.
[2] 杨传忠,朱小瑜.亚低温治疗与脑保护[J].中华实用儿科临床杂志,2014,29(2):86-89.
[3] 吉玲,朱长连,程秀永,等.全身亚低温治疗新生儿缺氧缺血性脑病的疗效分析[J].中国实用儿科杂志,2007,22(8):609-611.
[4] Sabir H,Walloe L,Dingley J,et al.Combined treatment of xenon and hypothermia in newborn rats--additive or synergistic effect?[J].PLoS One,2014,9(10):e 109845.
[5] 吕黄伟,王俊科.氙气介导心脏和神经预处理的机制[J].中国新药与临床杂志,2007,26(2):147-150.
[6] Volpe JJ.Brain injury in premature infants:a complex amalgam of destructive and developmental disturbances[J].Lancet Neurology, 2009,8(1):110-124.
[7] Back SA,Rosenberg PA.Pathophysiology of glia in perinatal white matter injury[J].Glia,2014,62(11):1790-1815.
[8] Chen Y,Balasubramaniyan V,Peng J,et al.Isolation and culture of rat and mouse oligodendrocyte precursor cells[J].Nat Protoc,2007, 2(5):1044-1051.
[9] 陈盛,郭松雪,洪远,等.惰性气体神经保护作用的研究进展[J].浙江大学学报(医学版),2011,40(1):101-106.
[10] Chankkarapani E,Dingley J,Liu X,et al.Xenon enhances hypothermic neuropretection in asphyxiated newborn pigs[J].Ann Neurol,2010,68(3):330-341.
10.3969/j.issn.1009-4393.2016.1.012
广州医科大学留学归国人员基金项目(2010 C 31)
广东 510260 广州医科大学附属第二医院新生儿科(孙轶 袁艳冰 刘放云 刘海燕)
