ALEX1基因过表达慢病毒载体的构建和鉴定①
2016-06-15邓小芳雷继魁
高 月 邓小芳 雷继魁
(重庆市北碚区中医院检验科,重庆400700)
ALEX1基因过表达慢病毒载体的构建和鉴定①
高月邓小芳雷继魁
(重庆市北碚区中医院检验科,重庆400700)
[摘要]目的:探讨构建Arm重复蛋白1(ALEX1)基因过表达慢病毒表达载体,感染乳腺癌细胞系SK-BR3后观察ALEX1的表达,为研究ALEX1在乳腺癌中的作用及机制奠定基础。方法:利用DNA重组技术将ALEX1基因插入到慢病毒穿梭质粒LV5中,获得重组慢病毒质粒V-ALEX1,经酶切鉴定及DNA测序鉴定后,用 Lipofectamine 2000将重组质粒和慢病毒包装质粒系统(pGag/Pol、pRev、pVSV-G)转染293T细胞中包装成重组慢病毒颗粒,经流式细胞术测定重组慢病毒滴度。将成功包装的ALEX1过表达慢病毒载体(LV5-ALEX1)和阴性对照载体(LV5-NC),感染SK-BR3细胞(MOI为10)48~72 h,Real-time PCR和Western blot法分析ALEX1表达情况。结果:酶切鉴定结果显示:产生约1 500 bp的片段,片段大小与ALEX1基因cDNA大小一致。DNA测序比对说明测序结果与预期ALEX1基因序列完全一致,证实ALEX1基因正确插入载体中,成功构建ALEX1基因过表达载体。经293T细胞包装后,成功获得病毒滴度为4.25×108 TU/ml的重组慢病毒LV5-ALEX1。Real-time PCR和western blot结果显示:与感染LV5-NC的SK-BR3细胞相比,LV5-ALEX1感染可明显增加ALEX1 mRNA及蛋白的表达水平。结论:成功构建ALEX1基因过表达慢病毒载体,ALEX1基因过表达慢病毒能够感染乳腺癌SK-BR3细胞,可使外源基因获得稳定过表达。
[关键词]ALEX1;慢病毒;构建;鉴定
Arm家族蛋白是指含有Armadillo repeat结构的一类蛋白。Armadillo repeat结构是首次在果蝇的极性基因中发现,该基因在果蝇的早期细胞极性形成、维持上皮组织的完整性和早期胚胎形成过程中具有重要作用[1]。ALEX1 (Arm proteins lost in epithelial cancers on chromosome X1)蛋白是Arm重复蛋白家族成员之一,被认为是一种抑癌基因[2]。其在人类多种肿瘤中如肺癌、前列腺癌、结肠癌、胰腺癌、卵巢癌、乳腺癌中表达降低或缺失[3-5]。为进一步研究ALEX1的功能,本研究成功构建人ALEX1基因的慢病毒表达载体并感染人乳腺癌细胞系SK-BR3细胞,为后期进行ALEX1基因的实验研究奠定基础。
1材料与方法
1.1主要材料和试剂SK-BR3和293T细胞由本实验室保存;RPMI1640 培养基(Hyclone 美国);dsDNA oligo由上海吉玛制药技术有限公司合成;慢病毒穿梭质粒LV5和包装质粒 pGag/Pol、pRev、pVSV-G 购于上海吉玛公司;E.Z.N.A.®胶回收试剂盒(Omega,美国);E.Z.N.A.TM质粒提取试剂盒(Omega 美国);限制性内切酶NotI和NsiI(TaKaRa,日本);T4DNA连接酶(NEB 美国);DNA marker(TaKaRa日本);脂质体Lipofectamine 2000(Invi-trogen美国);Western blot 检测试剂盒(上海碧云天生物技术有限公司);兔抗人ALEX1多克隆抗体购自(Abcam 美国);HRP标记的山羊抗兔IgG 抗体、兔抗人β-actin多克隆抗体IgG(北京中杉生物有限公司)。RT-PCR试剂盒和荧光定量PCR试剂盒SYBRGreen,ExTaqTM聚合酶Ⅱ(TaKaRa日本);ALEX1、GAPDH引物由TaKaRa公司合成。
1.2实验方法
1.2.1ALEX1基因获取参考GenBank的ALEX1基因序列( NM_016608)设计出一对ALEX1基因引物序列由上海吉玛制药技术有限公司合成引物序列:ALEX1-NotI-F: 5′-GATTGGCGGCCGCGCCACCATGGGCCGCACTCGGGAAGC-3′(NotⅠ酶切位点标记为下划线)。ALEX1-NsiI-R: 5′-GTATAATGCATTTAGAGTTTGGTTAATACTTTCAGGACT-3′;(Ns-iI酶切位点标记为下划线);按照试剂盒操作说明提取ALEX1 cDNA,并以此为模板进行PCR扩增。PCR循环参数:94℃30 s,60℃15 s,72℃15 s,30个循环回收并纯化ALEX1编码区片段。
1.2.2V-ALEX1重组质粒构建扩增和鉴定使用限制性内切酶NotⅠ和NsiⅠ线性化LV5载体,利用T4 DNA连接酶将线性化的LV5载体和目的基因ALEX1在连接缓冲液中16℃过夜连接。连接后的重组质粒转化大肠杆菌感受态细胞DH5α,经含有氨苄青霉素抗性的LB琼脂培养基筛选后,挑取单克隆并扩大培养以进行质粒酶切鉴定,DNA测序鉴定获取重组质粒V-ALEX1。
1.2.3重组慢病毒及阴性对照慢病毒的包装和浓缩转染前24 h,将生长状态良好的293T细胞胰酶消化重悬接种于15 cm细胞培养皿中;待细胞密度达到60%时,将重组慢病毒质粒V-ALEX1 和pGag/Pol、pRev、pVSV-G经Lipofecta mine2000共转染到293T细胞中,用无血清DMEM培养基培养6 h后,换成含10% FBS的DMEM培养基培养。72 h后收集病毒上清液,4℃ 4 000 r/min,离心4 min;低速离心后用0.45 μm滤器过滤,4℃ 20 000 r/min超速离心2 h,收集浓缩液-80℃冻存。重组慢病毒命名为LV5-ALEX1,用上述相同方法将LV5与 pGag/Pol、pRev、pVSV-G 经Lipofecta mine2000共转染到293T细胞,并包装成能表达GFP的慢病毒颗粒,命名为:LV5-NC作为阴性对照。
1.2.4病毒滴度测定293T细胞培养至80%~90%融合,胰酶消化重悬细胞,于96 孔板加入293T细胞1×104/孔,体积100 μl;取慢病毒原液10 μl,用10% FBS 的DMEM培养液10倍3~5个梯度,吸去96孔板中的培养液,每孔加入100 μl稀释的病毒液,同时设立空白对照组,于 37℃ 5% CO2培养24 h;吸弃96孔板中的稀释病毒液,每孔加入100 μl 10%FBS的DMEM培养液,37℃ 5% CO2继续培养72 h。通过流式细胞仪检测荧光细胞,结合稀释倍数计算病毒滴度。
1.2.5LV5-ALEX1载体及对照载体感染SK-BR3细胞将成功包装的ALEX1过表达慢病毒载体(LV5-ALEX1)和阴性对照载体(LV5-NC),感染SK-BR3细胞(MOI为10)72 h后,荧光显微镜下观察感染效率。
1.2.6Real-time PCR检测ALEX1 mRNA表达筛选后的细胞加入1 ml TRIzol,按照操作说明提取细胞总RNA并测定RNA浓度。以1 μg RNA为模板,按照RT-PCR逆转试剂盒操作说明合成cDNA,以1 μl cDNA为模板,进行PCR反应。 反应条件:95℃10 s预变性,95℃5 s变性,60℃15 s退火,72℃15 s延伸,40个循环。引物序列:ALEX1:5′-TGATATTCTGAGTGCTCCCGACC-3′(上游),5′-TGTTACCC-AGAGTGACCAAGGCT-3′ (下游);GAPDH:5′-CTTTGGTATCGTGGAAGGACTC-3′ (上游),5′- GTAGAGGCAGGGATGAGTTCT-3′ (下游)。
1.2.5Western blot 检测ALEX1蛋白表达以细胞裂解液裂解筛选后的细胞,提取细胞总蛋白,BCA法定量,取40 μg蛋白样品,经SDS-PAGE分离后,电转移至PVDF 膜上,5%脱脂牛奶室温封闭2 h;加入兔抗人ALEX1(1∶500 稀释) 抗体,兔抗人β-actin多克隆抗体(1∶1 000),4℃过夜,次日TBST洗膜10 min×5次,再分别与HRP标记的山羊抗兔二抗( 1∶3 000)室温孵育2 h,TBST清洗10 min×5次,ECL化学发光。
1.3统计学分析使用SPSS17.0统计软件进行统计分析,t检验分析各组ALEX1 mRNA相对表达量的差异,P<0.05表示差异具有统计学意义。
2结果
2.1PCR扩增ALEX1PCR成功扩增出ALEX1序列的DNA片段,电泳可见大小约1 362 bp的特异性条带(图1)。
2.2重组质粒LV5-ALEX1的鉴定将PCR产物与经NotⅠ和NsiⅠ内切酶线性化的LV5载体连接、转化感受态细胞DH5α,提取质粒酶切鉴定,酶切后产生了约1 500 bp的片段,片段大小与ALEX1基因cDNA大小一致(图2)。
2.3LV5-ALEX1测序结果酶切鉴定正确的质粒取10 μl送上海生工基因测序。测序结果与预期ALEX1基因序列完全一致,测序证实获取重组质粒V-ALEX1。
2.4慢病毒滴度测定的结果病毒滴度釆用逐孔稀释法检测,利用1、0.1和0.01 μl的慢病毒悬液分别感染293T细胞(1×104/孔),72 h后观察细胞荧光情况(图3)。流式细胞仪检测0.01 μl慢病毒悬液感染的293T细胞,其中GFP阳性细胞比率为42.5% (图4)。经计算,慢病毒滴度为104×42.5%/(0.01×10-3ml)=4.25×108TU/ml。
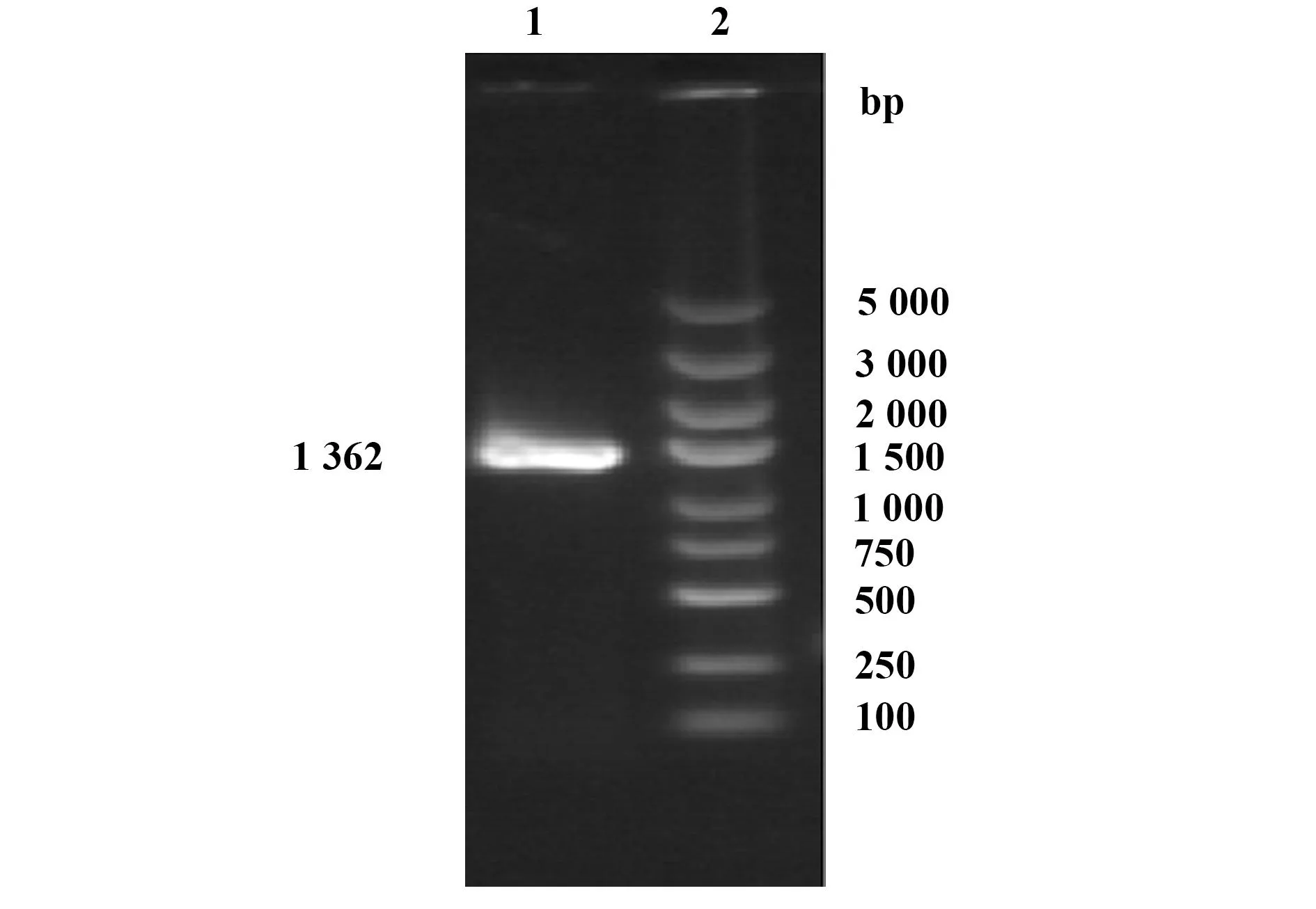
图1 PCR扩增产物凝胶电泳分析结果Fig.1 Gel electrophoresis of PCR productNote: 1.ALEX1;2.Marker.

图2 NotI/NsiI酶切重组质粒鉴定图Fig.2 Map of recombinant plasmids digested by NotⅠ/NsiⅠNote: 1.ALEX1;2.Marker.
2.5LV5-ALEX1载体及对照载体感染SK-BR3细胞的效率将成功包装的ALEX1过表达慢病毒载体(LV5-ALEX1)和阴性对照载体(LV5-NC),感染SK-BR3细胞(MOI为10),72 h荧光显微镜观察细胞感染效率达到90%左右(图5)。
2.6LV5-ALEX1载体及对照载体感染SK-BR3 细胞后ALEX1的表达利用Real-time PCR和Western blot检测ALEX1的表达变化(P<0.01) (图6,7),Real-time PCR和Western blot数据结果显示:

图3 慢病毒LV5-ALEX1感染293T细胞(×100)Fig.3 Lentivirus LV5-ALEX1 infection in 293T cells(×100)
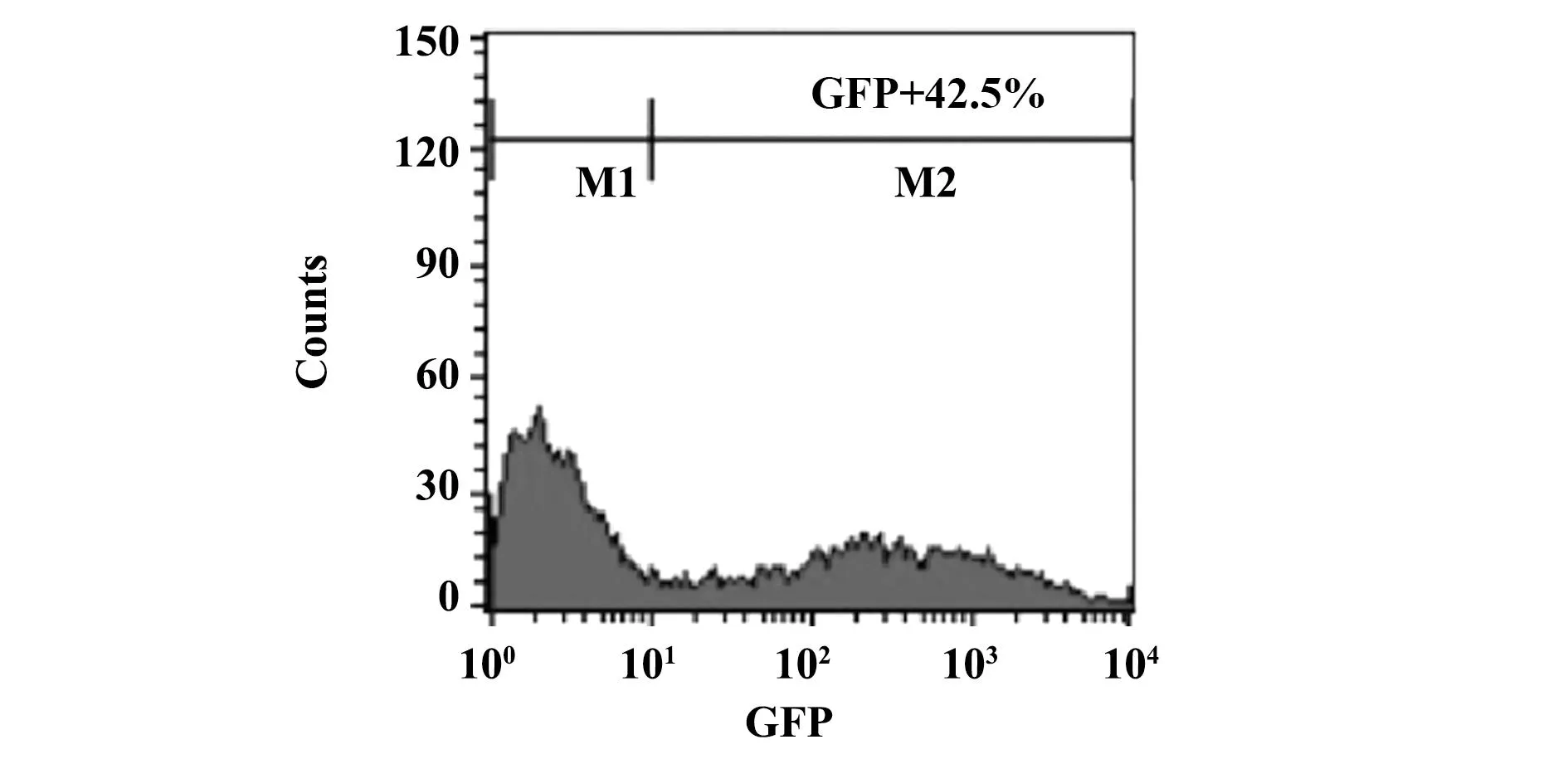
图4 流式细胞术检测慢病毒LV5-ALEX1的滴度Fig.4 Titer of lentivirus LV5-ALEX1 detected by flow cytometry

图5 慢病毒LV5-ALEX1感染乳腺癌细胞的效率(×200)Fig.5 Efficiency of LV5-ALEX1 infection in breast cancer cells (×200)

图6 Real-time PCR检测ALEX1mRNA表达水平Fig.6 ALEX1 mRNA expression detected by real-time PCRNote: LV5-ALEX1 vs.LV5-NC,*.P<0.01.

图7 Western blot检测ALEX1蛋白表达水平Fig.7 ALEX1 protein expression detected by western blotNote: 1.LV5-NC;2.LV5-ALEX1.
与感染LV5-NC的SK-BR3细胞相比,LV5-ALEX1感染可明显增加ALEX1在SK-BR3细胞mRNA和蛋白表达水平。
3讨论
随着分子生物学技术的不断发展,改变基因表达水平的方法和手段日趋成熟。目前,利用慢病毒载体导入外源性基因的方法远比普通质粒应用脂质体导入目的基因的手段更具转染效率高及表达稳定等优点因而备受学者青睐[6]。慢病毒载体是将人类免疫缺陷I型病毒(HIV-1)的全部HIV-1编码基因删除进而改造成的病毒载体系统,能高效地将目的基因导入真核生物细胞中并随着细胞不断分裂持久且稳定地表达目的基因[7]。本研究采用上海吉玛公司提供的慢病毒表达系统。即1个穿梭质粒(LV5)和3个包装质粒(pGag/Pol、pRev、pVSV-G)。其中,穿梭质粒中包含目的基因的慢病毒骨架及其包装产生相应基因组RNA的所有顺式作用元件,可以稳定表达目的基因。另外,三个辅助包装质粒可以提供病毒包装所需的反式作用因子,采用“自我灭活”修饰,阻止子代病毒自我复制,从而确保慢病毒具备良好的生物安全性。
ALEX 蛋白是Arm蛋白家族的成员之一,因具有一或二个Arm repeat结构不同于经典的Arm蛋白具有的6~13个Arm repeat结构而被单独列为ALEX蛋白家族。其家族成员包括ALEX1,ALEX2和ALEX3[2,8,9]。基因表达分析显示ALEX1 mRNA在人类多种正常组织中高表达而在上皮组织来源的癌组织低表达或不表达[1]。除此之外,Hiroyoshi Iseki 等[3,10]于2010年和2012年先后报道ALEX1基因受CREB和Wnt/β-catenin 通路调节并能够抑制人直肠癌细胞的克隆形成。这些结果均表明ALEX1基因在上皮来源的肿瘤中发挥抑癌作用。 目前,ALEX1在乳腺癌中的表达及其作用机制仍不清楚。
为了使ALEX1基因能够在乳腺癌细胞中稳定表达,本实验构建了ALEX1过表达慢病毒。我们利用PCR扩增得到目的基因ALEX1,利用T4 DNA连接酶将线性化的LV5载体和目的基因ALEX1连接,通过转化、质粒提取,重组慢病毒质粒酶切鉴定和DNA测序最终鉴定重组质粒V-ALEX1构建成功。在包装质粒辅助下,利用293T细胞成功包装成ALEX1的过表达慢病毒载体(LV5-ALEX1)和相应的对照载体(LV-NC)。随后利用上述病毒载体感染SK-BR3细胞,荧光显微镜观察发现慢病毒LV5-ALEX1能高效地感染SK-BR3细胞,real-time PCR 和western blot 显示LV5-ALEX1能显著增加ALEX1 mRNA 和蛋白水平的表达。这些结果说明包装的重组慢病毒载体LV5-ALEX1能有效介导ALEX1的过表达,为接下来研究过表达ALEX1对乳腺癌细胞生物学行为的影响以及其分子机制奠定了良好的实验基础。
参考文献:
[1]Riggleman B,Wieschaus E,Schedl P.Molecular analysis of the armadillo locus:Uniformly distributed transcripts and a protein with novel internal repeats are associated with a Drosophila segment polarity gene [J].Genes.1989,11:96-113.
[2]Kurochkin IV,Yonemitsu N,Funahashi SI,etal.ALEX1,a novel human armadillo repeat protein that is expressed differentially in normal tissues and carcinomas [J].Biochem Biophys Res Commun,2001,280:340-347.
[3]Iseki H,Takeda A,Andoh T,etal.Human Arm protein lost in epithelial cancers,on chromosome X1 (ALEX1) gene is transcriptionally regulated by CREB and Wnt/β-catenin signaling [J].Cancer Sci,2010,101:1361-1366.
[4]张勇.人ALEX2基因的克隆、表达与纯化及生物信息学分析[J].第四军医大学学报,2004,25(3):197-200.
[5]Hiroyoshi I,Akihiko T,Toshiwo A.ALEX1 suppresses colony formation ability of human colorectal carcinoma cell lines [J].Cancer Sci,2012,103 (7):1267-1271.
[6]Thrasher A J.Progress in lentiviral vector technologies [J].Hum Gene Ther.2013,24 (2):117-118.
[7]Heilbronn R,Weger S.Viral vectors for gene transfer:current status of gene therapeutics [J].Handb Exp Pharmacol,2010,197:143-170.
[8]Smith CA,McClive PJ,Sinclair AH.Temporal and spatial expression profile of the novel armadillo-related gene,ALEX2,during testicular differentiation in the mouse embryo [J].Dev Dyn,2005,233:188-193.
[9]Mou Z,Tapper AR,Gardner PD.The armadillo repeat-containing protein,ARMCX3,physically and functionally interacts with the developmental regulatory factor Sox10 [J].J Biol Chem,2009,284:13629-13640.
[10]Iseki H,Takeda A,Andoh T.ALEX1 suppresses colony formation ability of human colorectal carcinoma cell lines[J].Cancer science,2012,103 (7):1267-1271.
[收稿2015-03-02修回2015-06-04]
(编辑许四平)
Construction and identification of ALEX1-gene-over-expressed lentivirus vector
GAOYue,DENGXiao-Fang,LEIJi-Kui.
DepartmentofClinicalLaboratory,theChineseTraditionalMedicineHospitalofBeibeiDistrict,Chongqing400700,China
[Abstract]Objective:To construct ALEX1-gene-over-expressed lentivirus vector and study expression of ALEX1 in SK-BR3 breast cancer cells after transfection,which is conducive to studying the function of ALEX1 in breast cancer.Methods: The ALEX1 gene was inserted into plasmid LV5 of lentiviral vector by recombinant DNA technology.Lentivirus vector V-ALEX1 was got after recombination.The combinant lentivirus vector was detected by restriction endonuclease digestion and DNA sequencing.The recombinant lentiviral plasmid V-ALEX1 was transfected into 293T cells with the packaging plasmids including pGag/Pol,pRev and pVSV-G by Lipofecta mine 2000.The recombinant lentivirus expressing ALEX1 was obtained from the cells supernatant and the viral titer was tested by flow cytometry.The ALEX1-gene-over-expressed recombinant lentivirus (LV5-ALEX1) and negative control recombinant lentivirus (LV5-NC) were transfected into SK-BR3 cells.The expression of ALEX1 was detected by real-time PCR and western blot.Results: The results of recombinant plasmids digestion identification showed that the fragment is about 1 500 bp,which is the same size as ALEX1 gene cDNA fragments.The blast results of ALEX1 cDNA sequence showed that the sequencing results and expected ALEX1 gene sequence is completely consistent.It was confirmed that the ALEX1 was correctly inserted into the vector,and that ALEX1-gene-over-expressed lentivirus vectors was successfully constructed.After packing 293T cells,we successful got recombinant lentivirus LV5-ALEX1 with virus drops to 4.25×108 TU/ml.The results of real-time PCR and western blot showed that the expression of ALEX1 was significantly upregulated in mRNA and protein levels in LV5-ALEX1 group campared with LV5-NC group in SK-BR3 cells.Conclusion: The lentiviral vector over-expressing ALEX1 gene was successfully constructed,and lentivirus can transfect SK-BR3 cells and exnous gene was expressed stably.
[Key words]ALEX1;Lentivirus;Construction;Identification
doi:10.3969/j.issn.1000-484X.2016.05.017
作者简介:高月(1974年-),女,博士,主要从事肿瘤分子生物学方面的研究,E-mail:moon19740000@163.com。
中图分类号R329.26;R329.28
文献标志码A
文章编号1000-484X(2016)05-0678-04
①本文为辽宁省科技厅项目(2015020353)。