MicroRNA-124a对SCI继发性损伤的影响及相关机制研究
2016-06-15张芬
张 芬
(同济大学 生命科学与技术学院 上海 200092)
MicroRNA-124a对SCI继发性损伤的影响及相关机制研究
张芬
(同济大学 生命科学与技术学院 上海 200092)
摘要:探究microRNA-124a(miR-124a)对脊髓损伤(spinal cord injury,SCI)继发性损伤的影响及相关机制.取90只健康成年Wistar大鼠建立SCI模型,随机分为3组,第1组术后仅注射生理盐水,为未治疗组;第2组术后注射骨髓基质细胞源神经干细胞(BMSCs-D-NSCs)治疗,为正常移植组;第3组术后注射携带miR-124a的骨髓基质细胞源神经干细胞(miR-124a-BMSCs-D-NSCs),为转染移植组.另选取60只健康成年Wistar大鼠作为对照组,仅给予假手术处理.采用HE染色观察大鼠的组织形态学变化,采用实时荧光定量PCR技术检测大鼠的miR-124a表达情况,并对损伤灶进行显微测量计算,比较脊髓功能恢复的BBB评分情况及脊髓组织损伤大小的情况.结果显示,SCI后,脊髓组织中miR-124a基因表达显著降低,脊髓神经功能也明显降低,miR-124a-BMSCs-D-NSCs能够有效地改善SCI,减少脊髓损伤组织范围及体积,还能改善中枢神经的功能.
关键词:microRNA-124a; 脊髓损伤; 神经功能; 作用机制
0引言
脊髓损伤(spinal cord injury,SCI)是中枢神经系统的一种严重创伤,也是一种危害较大的急性病损.脊髓损伤后,其损伤部位节段以下的感觉和运动功能将出现明显的障碍,甚至发生永久性丧失,发达国家的发病率为13.3~45.9万人/年.2012年的统计结果显示我国SCI患者约为100万人,且正于每年1万人的速率增长,故临床上应对SCI引起足够的重视[1].SCI后脊髓难以进行组织修复,且功能重建也较为困难,这不仅与神经元微弱的再生能力密切相关,还与脊髓损伤后快速出现的阻碍轴突再生的胶质疤痕有关.因此,对SCI治疗的关键在于恢复和重建神经功能,这也成为目前一直困扰医学界的核心问题[2].最近20年来,临床上新发现了一种基因表达调节因子,即microRNAs(miRNAs).这一调节因子可广泛表达于多种组织中,作为一种内源性的小分子非编码RNA,对3′端非编码区的保守性极高,可在转录、翻译水平上对基因表达起到很好的调控作用[3].MicroRNA是内源的单链非编码RNA(18~25个核苷酸),在转录后水平上负调控基因表达[4—5].自从1993年第一个miRNA(line4)的发现,在生物体中,数千的miRNAs已经被发现.miRNAs具有组织特异功能,能够总体调控基因的表达,且可调控的人类蛋白编码基因较多,至少有20%~30%的编码基因可被调控[1],miRNAs在哺乳动物中枢神经系统内表达的种类更多、含量更高,呈高表达.近年来,多数学者[6—9]对中枢神经系统疾病如创伤性脑损伤、SCI、脑卒中等的大量基因芯片实验研究发现,miRNAs能够有效地调控细胞的生长、分化、增殖[10]和凋亡过程,从而调节脊髓损伤、脊髓可塑性及脊髓损伤后的病理改变.miRNAs 包含的种类较多,如miRNA-9、 miRNA-21、miRNA-124、miRNA-155等,其中神经系统特异性表达最为富含的是microRNA-124a(miR-124a),即miRNA-124的一种亚型.在细胞的增殖和分化过程中,miR-124a的表达水平可发生较大的变化[11—14].目前,学者对中枢神经中miRNA-124表达情况的研究多集中在果蝇、小鼠的中枢神经系统(central nervous system,CNS)和人类相关组织中,较为局限,尽管在大鼠动物中的研究尚较少[15],但大鼠更适宜建立SCI模型.miR-124a作为神经系统特异的microRNA,能够对神经元的细胞周围、细胞分化及脊髓发育等一系列重要生理活动起到很好的调控作用,但尚未明了miR-124调控神经系统病理损伤的机制.有研究发现,miR-124a是miRNAs中的一种能够作为脊髓损伤的有效干预性治疗靶点,但多数学者的报道尚存在一定的争议[16],本文进一步探究了miR-124a对SCI继发性损伤的影响及相关机制.
1材料与方法
1.1研究对象
选取140只正常成年雄性Wistar大鼠,大鼠体重在190~250 g之间,平均体重为(227.2±8.2)g,其中80只大鼠经改良Allen’s法建立SCI模型,另60只大鼠给予假手术处理,分别为观察组和对照组.
选取10只4周龄雄性Wistar大鼠,用于提取骨髓间充质干细胞(bone marrow stroma cells, BMSCs).
1.2实验仪器及试剂
仪器:台式高速低温离心机(Eppendorf公司)、Milli-Q 纯水仪(Milipore公司)、凝胶成像系统(YNGENE公司)、Bio-Rad C1000 实时 PCR 仪(Bio-Rad公司)、M651型手术显微镜(Leica公司).
试剂:TRIZOL Reagent (Invitrogen公司)、焦碳酸二乙酯(DEPC)和溴化乙锭(EB)(Sigma公司)、NcodeTMVILOTMmiRNA cDNA Synthesis Kit(Invitrogen公司)、SYBR® Premix Ex TaqTMII Kit(Takara 公司)、以及氯仿、异丙醇、无水乙醇(均为上海生工生物工程有限公司).
实时荧光定量qRT-PCR的引物:英潍捷基有限公司.
1.3实验方法
1.3.1大鼠SCI模型的构建根据改良Allen’s制作大鼠脊髓夹伤动物模型,模型构建过程如下:先采取10%水合氯醛(3 mL/kg)对大鼠进行腹腔内注射麻醉,麻醉完成且效果满意后,将大鼠取俯卧位置于手术台上,四肢远端用皮绳固定于台上,并采用软垫将胸部垫高.定位手术切口位置,以T10棘突作为切口中心,以中心为起点沿脊柱向两侧切开背侧的皮肤及肌肉,并分离开,使脊柱T8节段清晰地暴露出来.在显微镜下,手术去除T8脊椎的椎板,再将特制的镊子沿椎板腹侧深入两侧的脊髓,并夹住脊髓,持续20 s后松开并取出镊子,将肌肉、皮肤逐层进行缝合,术后人工辅助SCI大鼠排尿.
1.3.2干细胞的制备及移植从大鼠骨髓提取BMSCs[17],收集培养并纯化第3代BMSCs[18].经流式细胞仪检测,75%的BMSCs处于G1期,以1×108细胞/L的密度进行接种,通过MTT实验鉴定符合干细胞的增殖规律,通过细胞免疫化学的方法对细胞表面抗原表型的CD34和CD44进行鉴定[19],结果显示CD34为阴性,而CD44为阳性,进而证实了分离的细胞为BMSCs,可开展下一步的实验.随后加入生物诱导培养液[20—22],模拟人体内环境,诱导9 d[23],促使上述分离纯化的BMSCs向神经细胞方向分化,同样采用细胞免疫化学的方法检测显示对胶质纤维酸性蛋白阴性,神经丝蛋白和神经元特异性烯醇化酶阳性,细胞具有神经细胞活性,即得到BMSCs-D-NSCs.
通过查询基因库,合成引物前链和反义链引物,扩增Rno-miR-124a,使用相同的限制性内切酶来酶切PCR产物和慢病毒载体pCDH-CMV-MCS-EF1-copGFP.得到酶切产物后,使用T4连接酶在16 ℃连接酶切片段.使用感受态细胞体外进行转化,挑取克隆,进行质粒小提,并测序鉴定.转染前培养293T细胞[24],使其密度达到85%左右.使用磷酸钙转染法将构建好的质粒转入293T细胞中,进一步进行病毒制备得到含有miR-124a的病毒液.对病毒液体进行离心浓缩,密度达到1.5×107pfu/mL左右,在37 ℃、5%CO2的培养条件下,用病毒液转染36小时后,在相同条件下,更换新鲜培养液,转染36 h,检测转染率(显微镜中绿色荧光蛋白细胞的比例)达到85%.获取病毒上清液感染BMSCs,并利用qRT-PCR测定miR-124a转染BMSCs后及诱导成NSCs后的表达情况.结果显示miR-124a的表达量、转染后BMSCs的表达量是转染前的29-fold.并进一步观察BMSCs-D-NSCs分化为神经元与胶质细胞的情况,其中 BMSCs-D-NSCs组的神经元的分化比例为(31.4±3.53)%,胶质细胞比例为(49.9±3.03)%;miR-124a-BMSCs-D-NSCs组的神经元分化比例为(51.5±3.81)%,胶质细胞的分化比例为(40.1±1.88)%.
将SCI模型大鼠分为3组,分别为未治疗组、BMSCs-D-NSCs组和miR-124a-BMSCs-D-NSCs组.在SCI大鼠模型制备后的第7天,将BMSCs-D-NSCs和miR-124a-BMSCs-D-NSCs液进行离心,使用1 mL的注射器抽取悬浮液,从而制备成为细胞悬液(1×106细胞/mL),两种悬液分别经鼠尾静脉注射给BMSCs-D-NSCs移植组和miR-124a-BMSCs-D-NSCs移植组,未治疗组注射生理盐水1 mL.
1.3.3取材用于RT-PCR的检测的取材方法如下:在原手术切口上切开皮肤,使脊髓阶段暴露出来,截取SCI大鼠模型损伤区段的新鲜脊髓组织,对照组大鼠取相同脊髓区段的新鲜脊髓组织,将从两组大鼠中取出的脊髓组织置于冰上,并剥离脊髓表面的硬脊膜及剔除脊髓中的血管,完成后立即放入液氮罐内保存,并转移至冰箱(-80 ℃).用于制备石蜡切片进行原位杂交实验的取材参考文献[25]的研究,采用4%多聚甲醛灌注取材的方法.
1.3.4标本组织病理学检测对脊髓组织进行苏木素-伊红(HE)染色,染色过程依次经过:脱蜡-苏木素染色5 min-盐酸乙醇分化30 s-自来水浸泡1 min-伊红液染色2 min-固定封片,最后在显微镜下对脊髓组织及细胞情况进行观察.
1.3.5RT-PCR检测miR-124a及计算方法严格按照试剂盒说明书上的操作提取microRNA.随后以此为模板进行RT-PCR对miR-124a的测定.实验中使用Takara 公司的SYBR® Premix Ex TaqTMII Kit,以U6 snRNA为内参对照基因,引物序列由英潍捷基有限公司合成.引物序列如下:U6 snRNA引物信息英潍捷基公司对此保有解释权,miR-124a的引物信息为:UAAGGCACGCGGUGAAUGCC.
miR-124a的相对表达量的计算方法是使用相对定量法:2-△△Ct用于表示miR-124a在脊髓的损伤组织的表达量和正常脊髓组织中表达量的倍数.△△Ct=损伤脊髓组织(CtmiR-124a-CtU6 snRNA)-正常脊髓组织(CtmiR-124a-CtU6 snRNA).
1.3.6原位杂交技术检测miR-124a采用原位杂交技术检测miR-124a的表达情况.先处理石蜡切片,再进行预杂交、杂交,杂交操作如下:先用2×SSC 冲洗切片15 min,再加入4×SSC/50%去离子甲酰胺,在37 ℃下进行15 min的孵育,将50 μL的预杂交液加入每张切片中并放入湿盒内,于42 ℃下进行2 h 孵育;将每张片中的预杂交液去除,加入50 μL的杂交液并放湿盒中,于42 ℃下杂交12~18 h.杂交完毕后,用2×SSC洗涤约1~2 min,然后加入2×SSC/50%去离子甲酰胺,并于42 ℃下孵育10 min;再加入1×SSC/50%去离子甲酰胺,于37 ℃下孵育30 min;紧接着加入 4×SSC/10 mmol DTT,1 h后再加入 0.1×SSC 40 ℃,放置30 min,连续加入两次.
其中miR-124a的探针序列为:G+GCA+TAC+A+C+CG+CGT+GCC+TTAA-DIG( “+”表示经过LNA的修饰;DIG表示地高辛,用于标记探针.)
1.4BBB评分法
根据BBB (Basso-Beattie-Bresnahan score, BBB)评分法[26]标准判断SCI损伤大鼠和正常大鼠术后不同时相的脊髓神经功能情况.检测并计算术后各个时相SCI损伤大鼠和正常大鼠脊髓中miR-124a的相对表达量,再对SCI大鼠中未治疗组、正常移植组和转染移植组3组大鼠术后不同时相的神经功能BBB评分结果.
1.5统计学分析
本文中所有数据都是采用统计学软件SPSS 13.0来进行分析的,用均数±标准差的形式来表示计量资料.t检验用来比较两组间计量资料的差异,ANOVA中的LSD法用来比较3组间BBB评分的差异,P<0.05认为数据具有统计学意义.
2结果
2.1正常大鼠及SCI模型大鼠术后不同时相的脊髓功能BBB评分情况
本文中参照改良的Allen’s建立SCI模型大鼠,为了检测建立的大鼠SCI模型,对对照组和观察组进行BBB评分.结果显示,观察组大鼠术后各个时相的BBB评分均明显低于对照组大鼠,两组大鼠各个时相的BBB评分比较差异显著(P<0.05);观察组大鼠随着时相的延长,BBB评分不断升高,至术后7 d,BBB评分升高较其他时相更明显,说明神经系统有一定的自我修复功能(图1).
2.2正常大鼠及SCI模型大鼠术后不同时相脊髓组织的HE染色结果
基于上述BBB评分情况,进一步采用HE染色的方法来观察大鼠的组织形态(图2).
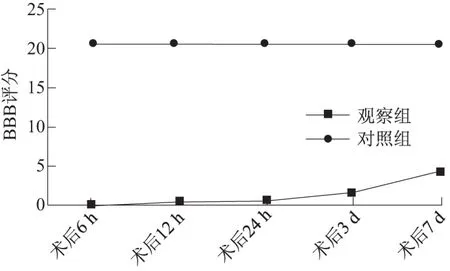
图1 正常大鼠和SCI损伤大鼠术后不同时相的脊髓功能BBB评分Fig.1 The BBB score of normal rats and SCI rats at different phases
图2A为正常大鼠脊髓组织神经元结构,图2B为SCI损伤后6 h脊髓组织神经元结构,图2C为SCI损伤后12 h脊髓组织神经元结构,图2D为SCI损伤后24 h脊髓组织神经元结构,图2E为SCI损伤后3 d脊髓组织神经元结构,图2F为SCI损伤后7 d脊髓组织神经元结构.(黑色箭头指示红细胞,白色箭头指示炎症细胞).
从图2可以看出,正常大鼠脊髓组织的神经元细胞形态结构正常;SCI模型大鼠术后不同时相脊髓组织的神经元细胞形态随着时间的增加,出现不同程度的变化.HE染色结果显示,术后6 h,脊髓组织水肿广泛出现;术后12 h~24 h,脊髓组织出现明显坏死;术后3 d,脊髓组织灰白质神经元大片溶解、坏死,并伴有大量炎症细胞的浸润;术后7 d,脊髓组织广泛严重坏死.

图2 正常大鼠及SCI模型大鼠术后不同时相脊髓组织的HE染色结果(20×)
2.3正常大鼠及SCI模型大鼠术后不同时相脊髓组织中miR-124a的相对表达量
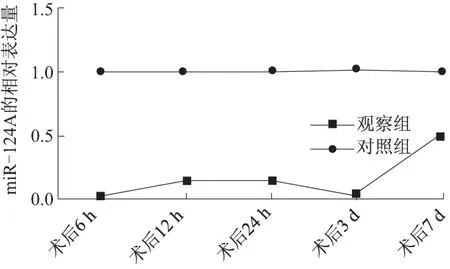
图3 正常大鼠及SCI损伤大鼠术后不同时相脊髓组织中miR-124a的相对表达量Fig.3 The expression of miR-124a in each time phase after the operation
为了观察SCI模型大鼠术后miR-124a的表达情况,通过实时定量荧光PCR定时检测上述SCI模型大鼠各个时相脊髓组织中miR-124a的含量.结果显示观察组大鼠各个时相脊髓组织中miR-124a的相对表达量均明显低于对照组各个时相的表达量,统计学分析显示有明显差异(P<0.05);观察组大鼠术后7 d脊髓组织中miR-124a的表达量最高,明显高于其他时相,不同时相的miR-124a的表达量比较具有统计学意义(P<0.05)(图3),表明在SCI的不同病理阶段,miR-124a的表达量不同.同时miR-124a表达变化与BBB评分的升高趋势(图1)基本一致,推测miR-124a高表达与神经系统的重建有关.
2.4正常大鼠及SCI模型大鼠术后不同时相脊髓组织中miR-124a的分布
采用原位杂交技术检测miR-124a的分布,其中以胞浆的染色作为细胞定位的指标.阳性反应结果为胞浆被染成蓝紫色,阴性反应为胞浆未被染成蓝紫色(图4).
图4中,A为正常大鼠,B为SCI损伤后6 h,C为SCI损伤后12 h,D为SCI损伤后24 h,E为SCI损伤后3 d,F为SCI损伤后7 d.

图4 原位杂交检测miR-124a的表达结果(25×)
结果显示,正常大鼠的阳性细胞数较多,为强阳性,脊髓损伤7 d后同样呈强阳性.而脊髓损伤6 h、12 h、24 h、3 d后,阳性细胞数较少,表现为弱阳性.这一结果也与荧光定量PCR的结果类似.
2.53组SCI模型大鼠术后各时间点的神经功能BBB评分情况
3组SCI模型大鼠术后1 w的神经功能BBB评分比较无统计学意义(P>0.05);术后2 w,正常移植组和转染移植组大鼠的BBB评分均明显高于未治疗组(P<0.05),正常移植组和转染移植组大鼠的BBB评分比较无统计学意义(P>0.05);术后4 w、6 w,3组大鼠的BBB评分存在显著差异(F=5.136、5.743,P<0.05),其中正常移植组、转染移植组的BBB评分高于未治疗组,转染移植组高于正常移植组(见图5).结果表明BMSCs-D-NSCs移植组和miR-124a-BMSCs-D-NSCs移植组均能促进SCI的运动功能的恢复.
2.63组 SCI模型大鼠术后4 w脊髓组织损伤灶范围大小情况
参考文献[27]的计算方法,将组织切片经显微测量计算后,结果显示,相对于未治疗组,正常移植组SCI大鼠脊髓组织损伤灶减少的体积为(3.36±0.23)%,转染移植组SCI大鼠脊髓组织损伤灶减少的体积为(6.39±0.33)%,两组大鼠脊髓组织空洞减少比例的差异具有统计学意义(P<0.05)(见图6).
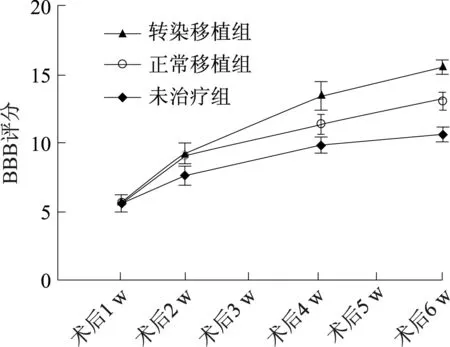
图5 3组SCI模型大鼠术后各个

图6 与治疗组相比,正常移植组与
3讨论
miRNA是调节脊髓发育和可塑性的重要因子,其在脊髓组织中特异性表达,且呈高度表达,能够严格调控脊髓的发育.多数关于脊髓发育过程中miRNA表达变化的研究显示,miRNA的差异性表达与脊髓的发育密切相关[27].多数国外学者通过RT-PCR、原位杂交等技术检测发现成年小鼠的中枢神经系统组织中存在较多种类的miRNA表达,且呈高度表达的miRNA与CNS的特定功能密切相关[28—32].在CNS中研究最多的miRNA是miR-124.miR-124在脊髓组织和其他非神经组织中表达的含量存在显著差异,在脊髓组织中的含量较非神经组织高出100倍,具有CNS组织特异性.miR-124对脊髓发育的影响主要是通过Sox9这一靶分子实现的,其另一个靶分子小C端磷酸酶1具有抑制神经元性基因表达的作用,miR-124通过这一靶分子可对神经元细胞的分化成熟起到很好的促进作用[33].miR-124具有3种亚型,其中以miR-124a最为常见,并参与CNS的发育、损伤及肿瘤等进展.
文献[16]发现,miR-124a在SCI损伤小鼠模型中的表达与时间存在明显的依赖性,其表达的下调可能是由于神经细胞死亡导致.利用基因芯片技术与RFPCR技术对缺氧缺血脑损伤小鼠损伤前后脑组织中miR-124a的表达量进行检测的结果显示,与正常的脑组织相比,缺氧缺血性脑损伤小鼠脑组织中miR-124a的表达明显上调,提示缺血缺氧条件可促进miR-124a的表达,进而促进内源性神经干细胞的增殖和分化,使脑损伤得到修复.文献[34]等还发现,阻断CNS中miR-124a的表达后,神经再生出现明显的延迟.上述研究均表明miR-124a在CNS损伤机制中发挥着重要作用,可作为有效靶点干预CNS损伤.本文对正常大鼠及SCI损伤大鼠脊髓组织中的miR-124a表达情况进行了检测.结果显示,与正常大鼠相比,SCI损伤大鼠术后各个时相的miR-124a表达量均明显下调,且SCI损伤大鼠各个时相的miR-124a表达量存在一定差异,以术后7 d最高(P<0.05),上述结果表明在正常脊髓组织内大量表达的miR-124a在SCI后可出现明显下调,这与CNS中大量细胞损伤有关.
目前,临床上认为有效治疗SCI的方法是神经干细胞移植,神经干细胞移植后分化产生的多种细胞如神经元细胞、星形胶质细胞及少突胶质细胞等,可填补脊髓损伤区域内缺失的神经细胞,对神经功能修复十分有帮助.SCI损伤后小鼠的运动和感觉功能均明显减退,甚至永久性丧失.在SCI大鼠脊髓损伤处植入的干细胞可很快被诱导分化为神经元,对神经功能的恢复十分有帮助,有效改善了SCI损伤大鼠的感觉和运动功能.本文还对正常大鼠及SCI损伤大鼠术后不同时间的神经功能BBB评分进行了对比.数据显示,两组大鼠术后不同时间的BBB评分存在较大差异,具有统计学意义(P<0.05),表明SCI后,大鼠的神经功能开始显著降低.miR-124a能够有效调控神经细胞的分化,在后期神经元分化成熟过程中呈高表达.对神经干细胞体外培养的实验发现,干细胞经miR-124a转染后,神经元细胞的分化过程受到明显促进,更利于神经功能的恢复.本研究对比了未治疗组、正常移植组(BMSCs-D-NSCs)和转染移植组(miR-124a-BMSCs-D-NSCs)大鼠术后不同时间的BBB评分.结果显示,3组大鼠术后4 w、6 w的BBB评分两两比较差异具有统计学意义(P<0.05),尤以转染miR-124a后神经干细胞移植组大鼠的BBB评分最高,这说明SCI后,选择移植转染miR-124a的神经干细胞较移植普通神经干细胞对神经元的修复作用更好,可促进脊髓神经功能更好地恢复.
本文中BMSCs-D-NSCs移植组和miR-124a-BMSCs-D-NSCs移植组,都表现出了SCI后对神经功能的修复作用,且miR-124a-BMSCs-D-NSCs的效果更为显著.因此,miR-124a在大鼠SCI的治疗过程中,可以明显地促进神经功能的恢复,为SCI后的细胞替代治疗提供了一个新思路,这可能是与miR-124a促进干细胞向神经元的分化的机制密切相关.
参考文献:
[1]LEE B B,CRIPPS R A,FITZHARRIS M,et al.The global map for traumatic spinal cord injury epidemiolopy:update 2011,global incidence rate[J].Spinal cord, 2014,52(2):110—115.
[2]STRICKLAND E R, HOOK M A, BALARAMAR S, et al.MicroRNA dysregulation following spinal cord contusion: implications for neural plasticity and repair[J]. Neuroscience,2011,186(186):146—160.
[3]KRICHEVSKY A M. MicroRNA profiling: from dark matter to white matter, or identifying new players in neurobiology[J]. Scientific world journal, 2007, 7(S2):155—166.
[4]KOSIK K S. The neuronal microRNA system[J].Nature reviews neuroscience,2006,7(12):911—920.
[5]SHAFI G, ALIYA N, MUNSHI A. MicroRNA signatures in neurological disorders[J]. The Canadian journal of neurological sciences Le journal Canadien des sciences neurologiques, 2010, 37(2): 177—185.
[6]BAREYRE F M, SCHWAB M E. Inflammation, degeneration and regeneration in the injured spinal cord: insights from DNA microarrays[J]. Trends in neurosciences,2003,26(10): 555—563.
[7]di GIOVANNI S, KNOBLACH S M, BRANDOL C, et al.Gene profiling in spinal cord injury shows role of cell cycle in neuronal death[J].Annals of neurology, 2003, 53(4): 454—468.
[8]NESIC O, SVRAKIC N M, XU G Y, et al. DNA microarray analysis of the contused spinal cord: effect of NMDA receptor inhibition[J]. Journal of neuroscience research, 2002, 68(4): 406—423.
[9]NIETO-DIAZ M, ESTEBAN F J, REIGADA D, et al. MicroRNA dysregulation in spinal cord injury: causes, consequences and therapeutics[J]. Frontiers in cellular neuroscience, 2014, 8(9): 53.
[10]张雨禄,胡三元,等.乳腺癌转移抑制因子(BRMS1)在人乳腺癌细胞系中的表达受体研究[J].郑州大学学报 (理学版),2014,46(1):94—97.
[11]BAK M, SILAHTAROGLU A, MOLLER M, et al. MicroRNA expression in the adult mouse central nervous system[J]. RNA, 2008,14(3): 432—444.
[12]HOHJOH H, FUKUSHIMA T. Expression profile analysis of microRNA (miRNA) in mouse central nervous system using a new miRNA detection system that examines hybridization signals at every step of washing[J]. Gene, 2007, 391(s1/s2):39—44.
[13]FARH K K, GRIMSON A, JAN C, et al. The widespread impact of mammalian microRNAs on mRNA repression and evolution[J]. Science, 2005, 310(5755): 1817—1821.
[14]LANDGRAF P, RUSU M, SHERIDAN R, et al. A mammalian microRNA expression atlas based on small RNA library sequencing[J]. Cell, 2007, 129(7): 1401—1414.
[15]YUNTA M, NIETO-DIAZ M, ESTEBAN F J, et al. MicroRNA dysregulation in the spinal cord following traumatic injury[J]. PLoS one,2012,7(4):120—123.
[16]NAKANISHI K, NAKASA T, TANAKA N, et al. Responses of microRNAs 124a and 223 following spinal cord injury in mice[J]. Spinal cord,2010, 48(3):192—196.
[17]HUANG Y,JIA X,BAI K,et al.Effect of fluid shear stress on cardiomyogenic differentiation of rat bone marrow mesenchymal stem cells[J]. J Arch Med Res,2010,41(7):497—505.
[18]张春燕,张自强,刘玉梅,等. 大鼠雪旺细胞体外分离培养纯化及鉴定[J].河南科技大学学报 (自然科学版),2015,36(4):82—84.
[19]MARL P,HINDOCHA S,MARL R, et al.Adult mesenchymal stem cells and cell surface characterization:a systematic review of the literature[J].J Open Orthop J,2011,5(suppl2):253—260.
[20]BARNAB G F, SCHWINDT T T,CALCAGNOTTO M E,et al.Chemically-induced rat mesenchymal stem cells adopt molecular properties of neuronal.like cells but do not have basic neuronal functional properties[J].PLoS one,2009,4(4):e5222.
[21]RADTKE C,SCHMITZ B, SPIES M, et al.Peripheral glial cell differentiation from neurospheres derived from adipose mesenchymal stem cells[J].Int J Devl Neuroscience,2009, 27(8):817—823.
[22]程腾,李佳佳,贺小英,等. 培养方法及胎牛血清浓度对人胎儿成纤维细胞体外生长的影响[J].信阳师范学院学报(自然科学版),2013,26(4):523—526.
[23]WISLET-GENDEBIEN S, LAUDET E, NEIRINCKX V,et al.Adult bone marrow: which stem cells for cellular therapy protocols in neurodegenerative disorders?[J]. J biomed biotechnol, 2012, 2012(1):111—113.
[24]MIN K J, JIN S J, JEE C, et al.MicroRNA 486 is a potentially novel target for the treatment of spinal cord injury[J].Brain,2012,135(4):1237—1252.
[25]李佳佳,程腾,贺小英,等. 二甲基亚砜和胎牛血清对293T细胞冷冻效果的影响[J].信阳师范学院学报(自然科学版),2013,26(2):217—220.
[26]BASSO D M,BEATTIE M S,BRESNAHAN J C.Graded histological and motor outcomes after spinal cord contusion using the NYU weight.drop device versus transaction[J].Exp Neur,1996,139(6):244—256.
[27]CHOPP M,ZHANG X H,LI Y,et al.Spinal cord injury in rat:treatment with bone marrow stromal cell transplantation[J].Neuroreport,2000,11(13):3001—3005.
[28]BERNSTEIN E, KIM S Y, CARMELL M A, et al. Dicer is essential for mouse development[J]. Nature genetics, 2003,35(3): 215—217.
[29]CUELLAR T L, DAVIS T H, NELSON P T, et al. Dicer loss in striatal neurons produces behavioral and neuroanatomical phenotypes in the absence of neurodegeneration[J]. Proceedings of the national academy of sciences of the United States of America, 2008, 105(14): 5614—5619.
[30]ZEHIR A, HUA L L, MASKA E L, et al. Dicer is required for survival of differentiating neural crest cells[J]. Developmental biology, 2010, 340(12):459—467.
[31]KAWASE-KOGA Y, OTAEGI G, SUN T. Different timings of Dicer deletion affect neurogenesis and gliogenesis in the developing mouse central nervous system[J]. Developmental dynamics: an official publication of the American association of anatomists, 2009,238(11): 2800—2812.
[32]FIORE R, SIEGEL G, SCHRATT G. MicroRNA function in neuronal development, plasticity and disease[J]. Biochimica et biophysica acta, 2008,1779(8): 471—478.
[33]BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell,2004,116(2):281—297.
[34]CHENG X,HE D,DONG X D, et al.miR-124a is epigenetically regulated and acts as a tumor suppressor by controlling multiple targets in uveal melanoma[J].Investigative ophthalmology visual science,2013,54(3):2248—2256.
(责任编辑:王浩毅)
Effects of MicroRNA-124a on SCI Secondary Injury and the Underlying Mechanism
ZHANG Fen
(CollegeofLifeScienceandTechnology,ShanghaiTongjiUniversity,Shanghai200092,China)
Abstract:How miR-124a affects the secondary injury of spinal cord injury (SCI) and its related mechanism were studied. SCI model was established by gathering 80 healthy adult Wistar rats, which were divided into three groups. The first group, injected with saline only after operation, was the untreated group. The second group, injected with BMSCs-D-NSCs for treatment after operation, was the normal transplantation group. The third group, injected with miR-124a-BMSCs-D-NSCs for treatment after operation, was the transfected transplantation group. Another 60 healthy adult rats were used as the control group, which only accepted sham-operation. Histomorphology change was observed via HE staining, the miR-124a expression was tested via quantitative real-time PCR, and the lesion site was micro-measured and calculated. The result showed that after SCI, the expression of miR-124a in spinal cord tissue remarkably decreased, so did the spinal cord nerve function. miR-124a-BMSCs-D-NSCs can, decrease the injured area and size of spinal cord and improve the function of CNS.
Key words:microRNA-124a; spinal cord injury; neurological; mechanism
收稿日期:2015-11-09
作者简介:张芬(1989—),女,河南郑州人,硕士研究生,主要从事神经生物学研究,E-mail:93fenzhang@tongji.edu.cn.
中图分类号:Q6-33
文献标志码:A
文章编号:1671-6841(2016)01-0073-08
DOI:10.3969/j.issn.1671-6841.201511007
引用本文:张芬.microRNA-124a对SCI继发性损伤的影响及相关机制研究[J].郑州大学学报:理学版,2016,48(1):73—80.
