血液净化在危重症患儿中的应用研究
2016-06-14杨镒宇武志远左云龙
党 润,杨镒宇,洪 婕,武志远,余 莉,左云龙
(广州市妇女儿童医疗中心儿童重症监护室 510120)
·经验交流·
血液净化在危重症患儿中的应用研究
党润,杨镒宇△,洪婕,武志远,余莉,左云龙
(广州市妇女儿童医疗中心儿童重症监护室510120)
[摘要]目的探讨血液净化(BP)在危重症患儿救治过程中的作用及其机制 。方法回顾性分析了2012年10月到2014年5月在该院儿童重症监护室(PICU)进行BP治疗的30例危重症患儿的临床表现和治疗过程。30例患儿中, 年龄2个月至12岁,男16例,女14例,其中13例为重症噬血细胞综合征(HPS),10例为重度急性呼吸窘迫综合征(ARDS),7例为急性肝功能衰竭(ALF)。结果30例患儿中单纯进行连续性静脉-静脉血液滤过治疗(CVVH)9例,单纯进行血浆置换(PE)5例, CVVH联合PE治疗16例。共进行PE治疗63次,CVVH治疗47次。30例患儿中存活21例,死亡9例,总体存活率达到70%,其中重症HPS的生存率为61.5%(8/13),重度ARDS的生存率达到80.0%(8/10)。结论BP治疗逐步应用于PICU,在重度ARDS患儿等危重症患儿的救治中可能发挥重要作用。
[关键词]血浆置换;血液滤过;危重病;儿童
血液净化(blood purification,BP)是将患者的血液引出体外通过一定的净化装置,除去其中的某些致病物质,达到净化血液目的的一种治疗技术。近年来,BP技术迅速发展,已经从单纯的肾脏替代治疗扩展到多器官功能支持,与机械通气和全胃肠外营养并称为重症监护病房中最重要的治疗手段[1]。BP技术在成人脓毒症及多器官功能障碍综合征(multiple organdys function syndrome,MODS)中已广泛使用,并逐步应用于儿童危重症的救治。本文总结了本院儿童重症监护室(pediatric intensive care unit,PICU)进行BP治疗的30例危重症患儿的临床资料,现分析如下。
1资料与方法
1.1一般资料选择2012年10月至2014年5月在本院PICU进行BP治疗的30例危重症患儿为研究对象,年龄2个月至12岁,其中男16例,女14例。13例为重症噬血细胞综合征(hemophagocytic syndrome,HPS),10例为重度急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),7例为急性肝功能衰竭(acute liver failure,ALF)。
1.2方法采用颈内静脉或股静脉穿刺术置入8F单针双腔中心静脉导管用于进行BP,并尽可能再建立另外一条中心静脉通路用于泵入血管活性药物和进行中心静脉压监测。使用Baxter公司 BM25血液净化机,BP前用新鲜冰冻血浆或全血100~200 mL预冲管路。主要采取连续性静脉-静脉血液滤过治疗(continuous vena-venous hemofiltration,CVVH)和血浆置换(plasmapheresis,PE)两种血液净化方式单独或组合进行治疗。血浆置换量为患儿血浆量的1.5倍,计算方法:(60~70)mL×体质量(kg)×(1-HCT)×1.5,其中HCT为红细胞压积,部分体质量较大患儿用5%人血清蛋白替代部分血浆。血泵速度为5~10 mL·kg-1·min-1,置换液速度为50~75 mL·kg-1·h-1,超滤速度=(估计累计总入超量+生理需要量)/血滤时间(mL/h)。肝素首剂20~50 U/kg,检测活化凝血时间(activated clotting time,ACT)或部分凝血活酶时间(activated partial thromboplastin time,APTT)达到正常值的1.5倍开机,随后肝素20~50 U·kg-1·h-1持续泵入,每1~2小时检测ACT,保持ACT 180~220 s。如有出血风险患儿,可使用肝素10~40 U·kg-1·h-1局部抗凝,并在滤器后按1 mg∶1 mg(鱼精蛋白∶肝素)比例持续输注鱼精蛋白,使滤器前ACT>220 s和患儿外周血ACT<180 s。停机前0.5 h停用肝素,停机后复测ACT,大于160 s则使用与末2 h肝素用量等比例的鱼精蛋白中和。
2结果
2.1重症HPS13例重症HPS患儿,年龄3个月至6岁,其中男7例,女6例, 2例单纯进行PE治疗,其余11例均进行PE联合CVVH治疗。13例患儿除有持续发热,血两系或三系降低,肝脾肿大,血清铁蛋白升高等HPS表现外,同时合并呼吸衰竭,入室后均予气管插管呼吸机辅助通气。8例存活患儿中,3例(2例为EB病毒相关性HPS,1例为幼年型类风湿性关节炎合并HPS)经过BP治疗后病情缓解,继续使用激素和免疫抑制剂巩固治疗,病情稳定后转专科继续治疗。另外5例无明确病因,采用多次PE联合CVVH治疗后病情缓解,未使用激素和免疫抑制剂,临床症状好转,实验室指标基本恢复正常,病情稳定后转普通内科继续治疗,最终临床痊愈出院,28 d生存率为61.5%(8/13)。死亡5例患儿早期乳酸脱氢酶(LDH)显著升高(LDH>2 500 U/L),在治疗过程中乳酸进行性升高(LAC>10 mmol/L),最后因肺出血或多器官功能衰竭死亡。
2.2重度ARDS10例重度ARDS患儿,年龄4个月至12岁,其中男4例,女6例,均达到2011年欧洲重症医学会关于重度ARDS的柏林诊断标准[2]:起病或呼吸症状加重后1周X线片或CT扫描示双肺致密影;无法用心力衰竭或液体过负荷完全解释的呼吸衰竭;顽固性低氧血症[氧合指数(P/F)<100,呼气末正压(PEEP)>10 cm H2O]。在高参数机械通气下采用ARDS的治疗策略:保护性小潮气量通气,适当的PEEP,液体控制,部分患儿采取俯卧位通气,间断肌肉松弛及肺复张等治疗策略[3]。1例患儿采用高频振荡通气。在常规抗感染及支持治疗基础上采用BP治疗,10例患儿共进行PE治疗5次,CVVH治疗17次,每次24~48 h,每24小时更换血液滤过器1次。10例患儿经过BP治疗后呼吸机参数均有所下降,氧合改善见表1,其中8例病情逐渐好转稳定,2周至1个月撤机后转普通病房,最后痊愈出院。其余2例死亡,1例为系统性红斑狼疮并ARDS患儿,经CVVH联合PE治疗后肺部情况也明显好转,但后期合并消化道大出血、急性肾功能衰竭死亡;另外1例为脓毒血症合并ARDS患儿,经过血液净化治疗肺部情况好转,但由于出现脑功能衰竭家长要求放弃治疗后死亡。
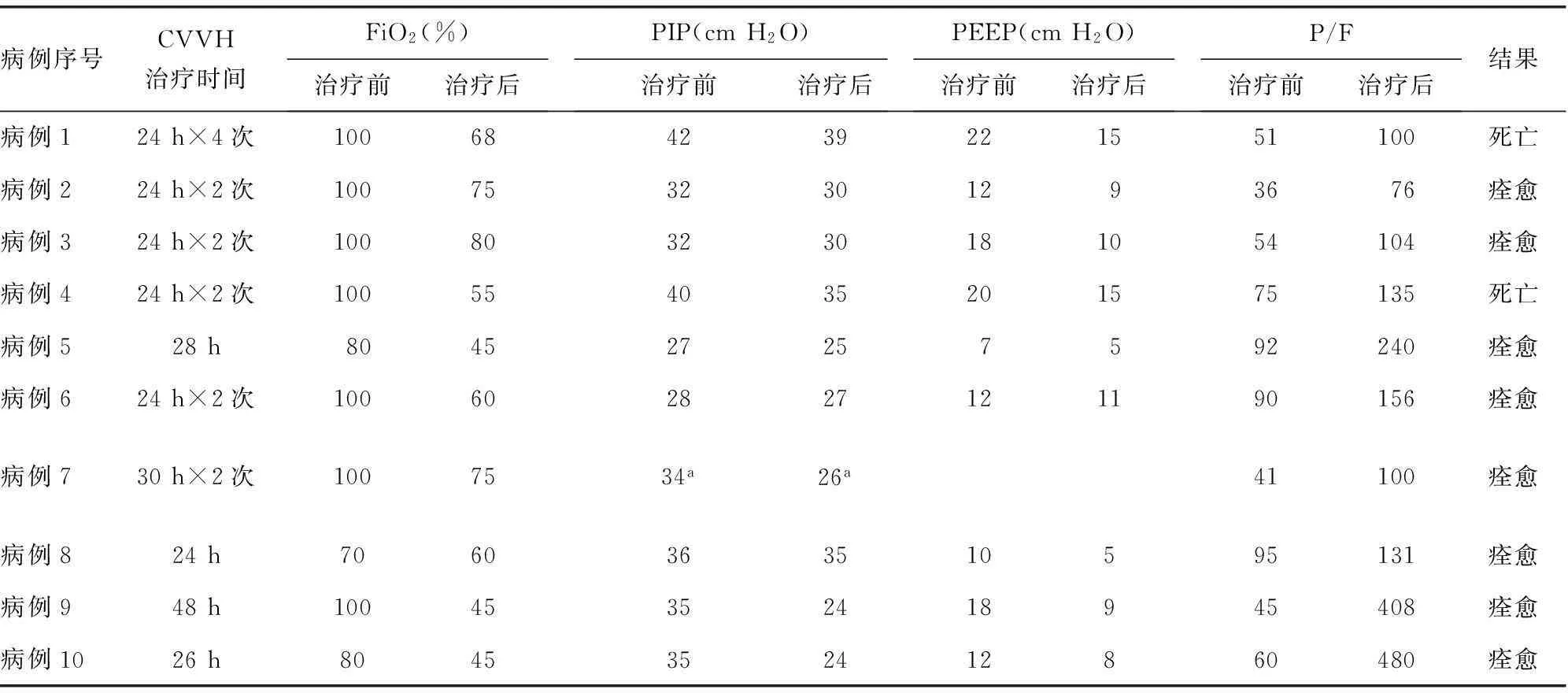
表1 重度ARDS患儿血液净化治疗前、后相关指标的变化
FiO2:吸氧分数;PIP:吸气峰压;a:高频振荡通气平均气道压;-:此项无数据。
2.3ALF7例ALF患儿年龄2个月至3岁,其中男5例,女2例,6例为不明原因肝功能衰竭,另外1例考虑为瑞氏综合征,所有患儿均达到儿童ALF的诊断标准[4]。3例经过单纯PE治疗,其余4例经过PE联合CVVH治疗,共进行PE治疗32次,CVVH治疗14次,其中5例患儿经过BP治疗凝血功能明显改善,血氨水平下降,意识状态好转,转普通病房继续治疗,其中1例肝功能有所改善后顺利完成肝移植;另2例死亡,1例为家属放弃治疗后患儿死亡,1例为瑞氏综合征患儿BP治疗后病情无改善,最后出现肺出血死亡。
2.4并发症本研究观察到的主要并发症包括低血压、低体温、出血、凝血/堵管、血小板减少等,处理方法见表2。

表2 血液净化过程中的并发症及其处理
3讨论
近年来BP技术迅速发展,逐步从单一血液透析向血液透析滤过、血液灌流、血浆置换、免疫吸附、持续性肾脏替代治疗、人工肝等多种治疗模式转变,已从单纯肾脏替代治疗扩展到多器官的支持。BP不仅可以纠正代谢紊乱,稳定内环境,还可以清除毒素和炎症介质,调整免疫状态和改善器官功能,因此对于严重的代谢紊乱、脓毒血症、免疫紊乱及多器官功能障碍都有效果[5]。重症监护病房常用的BP模式是PE和CVVH,前者主要清除大分子的免疫复合物、改善凝血功能,常用于免疫系统疾病和凝血功能障碍,如溶血尿毒症、血栓性血小板减少性紫癜、HPS及ALF,而后者则更利于炎症因子和水分的清除,多用于脓毒血症和多器官功能障碍。HPS是导致多器官功能障碍(MODS)的常见危重症之一,病情进展迅速,病死率高。HPS分为原发性HPS和继发性HPS,前者为常染色体隐性遗传病,后者的发病机制虽尚未完全清楚,但免疫功能紊乱在继发性HPS发病中的重要作用已得到公认[6]。尽管原发性HPS和继发性HPS的发病机制不同,但病理生理机制相同,其特点为细胞毒性T细胞和巨噬细胞增殖与活化,高细胞炎症因子血症,T细胞和自然杀伤(NK)细胞功能缺陷。BP治疗可迅速控制发热、清除大量细胞因子、调整免疫状态、改善器官功能、维持内环境的稳定,因此对于HPS所导致的MODS理论上应该有效。临床上也有越来越多的PICU医生将BP技术应用于重症HPS的救治,并取得一定效果[7]。本研究主要采取了PE和CVVH两种BP方式治疗继发性HPS,采取PE是基于纠正免疫功能紊乱和改善凝血功能,采取CVVH则是利用它清除炎症介质,维持内环境稳定及器官支持等功能。13例重症HPS患儿中,8例经过BP治疗后病情缓解至痊愈,总体生存率达到61.5%(8/13)。
ARDS是指肺内、外严重疾病导致以肺毛细血管弥漫性损伤、通透性增强为基础,以肺水肿、透明膜形成和肺不张为主要病理变化,以进行性呼吸窘迫和难治性低氧血症为临床特征的综合征。连续性血液净化(continuous blood purification,CBP)救治全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)及MODS患者取得很大进展,ARDS常作为MODS在肺部的表现,是MODS的重要组成部分,两者有着相同的发病机制,鉴于CBP治疗在MODS治疗中的良好效果,CBP也越来越多地用于ARDS的治疗,并且陆续出现用于小儿ARDS的相关报道[8]。本组10例ARDS患儿基础疾病不同,均达到重度ARDS的诊断标准,在常频或高频高参数机械通气下、抗感染及支持治疗同时,采取CVVH治疗,合并有免疫系统疾病患儿(如1例系统性红斑狼疮)同时联合PE治疗,所有患儿均顺利完成BP治疗,比较治疗前后呼吸机参数均明显下调,P/F得到改善。本组重度ARDS的治愈率达到80.0%(8/10),显示CVVH在重度ARDS合并脓毒症治疗中发挥的积极作用,其机制可能是由于CVVH治疗可清除大量炎性介质及水分,改善毛细血管通透性,减轻ARDS所致的肺水肿等。
ALF在儿童期主要原因为先天性胆道闭锁,遗传代谢性疾病及药物、毒物和不明原因导致,其中不明原因的ALF在大于1岁ALF患儿中占到近50%[9],本文7例ALF病例中6例为病因不明,且均已达到重度ALF及肝移植的指征[10]。虽然肝移植已成为儿童终末期肝病的标准治疗手段,但由于供体受限及儿童肝移植技术在国内尚未广泛开展,这使得大部分ALF患儿无法及时获得根治的机会。现代人工肝支持技术之一BP治疗作为非生物型人工肝治疗手段,可以暂时替代肝脏功能,为肝细胞再生和肝移植提供机会,不仅如此,人工肝技术还可以改善患者的一般状态和多器官功能,增加手术安全性。非生物型人工肝技术包含PE、血液透析、血液滤过、血液/血浆灌流、分子吸附再循环系统,CBP等,临床医生根据患者病情选择单用或联合应用以上技术。本研究采取的BP和CVVH联合应用是最常使用的人工肝治疗方法,7例患儿中6例经过BP治疗后临床表现(意识状态)及实验室指标(胆红素、血氨、凝血功能等)均有明显改善,但BP治疗间期上述指标又升高,仅1例患儿最终进行肝移植可能获得长期生存。本组患儿治疗效果不佳的原因可能因为患儿采取PE时已处于肝功能衰竭晚期有关,因此,作者认为BP对部分早期ALF患儿可能有效,对于重度ALF的患者来说,肝移植可能是惟一可靠治愈的方法。
BP技术在成人脓毒症及MODS的应用价值中已经得到证实,但在儿童危重症中的应用还缺乏经验。由于儿童血管细小,血容量少,血流动力学不稳定,耐受能力较差等,因此BP过程中并发症可能较成人多。大部分患儿在开机时会出现血压下降,使用血浆或全血预冲管路可有效减轻或避免这一现象发生。如BP过程中出现血压波动,可调整血泵或置换液速度,调节血管活性药物剂量以改善血压,如血压仍不稳定,则需暂停PE,方法是将动静脉端夹闭断开,接50~100 mL生理盐水空转以免管路堵塞,10~30 min后评估是否可以继续BP治疗。各种休克本身已是危重患儿监护治疗的难点,对循环不稳定儿童进行BP治疗时更加需要密切监测和维持血流动力学的稳定,对可能出现的休克进行早预防、早发现和早干预[11]。低体温也是BP治疗过程中的普遍现象,适当的低体温对于原发病的控制和脑功能保护起到积极作用,部分体温过低患儿(低于33 ℃)可通过加温血液净化管路、提高室温及保暖等措施进行处理。BP治疗中常见的并发症还包括出血或凝血,对于出血风险高的成人患者越来越多的指南推荐使用局部枸橼酸抗凝[12],然而对于儿童患者枸橼酸抗凝的经验仍不足。本研究仍采用普通肝素抗凝,床旁动态监测ACT(每1~2小时检测1次),密切观察出血倾向,对于有高出血风险患儿,使用局部抗凝,即滤器前使用肝素10~40 U·kg-1·h-1持续输注,并在滤器后按1 mg∶1 mg(鱼精蛋白∶肝素)比例持续输注鱼精蛋白中和肝素,使滤器前ACT>220 s和患者外周血ACT<180 s,并根据病情需要间断补充新鲜冰冻血浆和血小板,本组30例患儿无1例发生威胁生命的消化道出血或颅内出血表现。
小儿血管通路建立困难,BP过程中并发症的发生率高且复杂,因此,快速建立有效的血管通路,把握BP治疗的时机,治疗过程中的严密监护是儿童危重症BP治疗的关键。由于危重患儿血流动力学多不稳定,因此持续动脉血压监测,对保证BP的顺利进行非常重要。另外本研究的经验是,除BP使用的中心静脉通路,尽可能再建立另外一条双腔导管的中心静脉通路,一方面保证血管活性药物持续稳定泵入,另外可作中心静脉压监测,指导临床补液。随着儿童危重症的不断发展,PE治疗逐渐成为危重患儿的重要治疗手段,应掌握指征和时机,为危重患儿争取更多的救治机会。
参考文献
[1]Ronco C.Recent evolution of renal replacement therapy in the critically ill patient[J].Critical Care,2006,10(1):123.
[2]Ferguson ND,Fan E,Camporota L,Antonelli M,et al.The Berlin definition of ARDS:an expanded rationale,justification,and supplementary material[J].Intensive Care Med,2012,38(10):1573-1582.
[3]Brower RG,Ware LB,Berthiaume Y.et al.Treatment of ARDS[J].Chest,2001,120(4):1347-1367.
[4]邓朝晖,王莹.小儿急性肝功能衰竭的实验室评价[J].中国小儿急救医学,2012,19(6):564-566.
[5]Kellum JA,Venkataraman R.Application of blood purification to non-renal organ failure[J].Int J Artif Organs,2005,28(5):445-449.
[6]Rouphael NG,Talati NJ,Vaughan C,et al.Infections associated with hemophagocytic syndrome[J].Lancet Infect Dis,2007(12):814-822.
[7]张育才,戎群芳,陈荣欣,等.连续性血液净化救治小儿重症噬血细胞综合症[J].中华急诊医学杂志,2013,22(7):749-754.
[8]Elbahlawan L,West NK,Avent Y,et al.Impact of continuous renal replacement therapy on oxygenation in children with acute lung injury after allogeneic hematopoietic stem cell transplantation[J].Pediatr Blood Cancer,2010,55(3):540-545.
[9]Dhawan A.Etiology and prognosis of acute liver failure in children[J].Liver Transpl,2008,14 Suppl 2:S80-84.
[10]D′Agostino D,Diaz S,Sanchez MC,et al.Management and prognosis of acute liver failure in children[J].Current Gastroenterology Reports,2012,14(3):262-269.
[11]杨镒宇,郑亦男,曾萍,等.危重症患儿血液净化治疗的并发症和意外事件与防治[J].中国实用儿科杂志,2007,22(5):376-379.
[12]Hetzel GR,Schmitz M,Wissing H,et al.Regional citrate versus systemic heparin for anticoagulation in critically ill patients on continuous venovenous haemofiltration:a prospective randomized multicentre trial[J].Nephrol Dial Transplant,2011,26(1):232-239.
作者简介:党润(1977-),硕士,主治医师,主要从事儿童重症研究。△通讯作者,E-mail:yangyy65@yahoo.com。
doi:10.3969/j.issn.1671-8348.2016.01.041
[中图分类号]R459.5
[文献标识码]B
[文章编号]1671-8348(2016)01-0115-03
(收稿日期:2015-09-06修回日期:2015-10-01)
