不同产地杜仲·紫苏和亚麻种子油中亚麻酸含量及出油率的GC-MS分析
2016-06-14唐传球沈志鹏
唐传球,沈志鹏
(郧阳师范高等专科学校生物化学与环境工程系,湖北十堰 442000)
不同产地杜仲·紫苏和亚麻种子油中亚麻酸含量及出油率的GC-MS分析
唐传球,沈志鹏
(郧阳师范高等专科学校生物化学与环境工程系,湖北十堰 442000)
摘要[目的]开展我国不同产地杜仲、紫苏和亚麻种子油的亚麻酸成分评价,为进一步筛选和培育优良亚麻酸作物提供参考。[方法]采用索氏提取和GC-MS法,对11个产地的亚麻、7个产地的紫苏及10个产地的杜仲种子的出油率及α-亚麻酸的含量进行了比较和分析。[结果]不同品种的种子亚麻酸含量差异显著,最高为湖北十堰杜仲种子油(61.49%),其次为吉林延边紫苏种子油(59.92%),最低为山西大同亚麻种子油(48.09%);干重中亚麻酸含量最高为吉林延边紫苏种子(230.1 mg/g 干重),最低为云南邵通杜仲种子(140.4 mg/g 干重);不同品种作物的出油率差异显著,亚麻和紫苏种子平均出油率分别为35.21% 和36.80%,显著高于杜仲种子(26.40%)。[结论]在亚麻酸产业开发方面,要综合考虑不同品种、不同地区之间的种子品质差异性。内蒙古亚麻、长春紫苏和湖北杜仲种子油是最经济实惠,又能满足食用健康的油品,故提倡合理开发利用。
关键词杜仲;紫苏;亚麻子;亚麻酸;出油率;气相色谱-质谱法
目前,开发木本食用油已成为各国解决食用油紧缺的主要渠道和趋势,西欧部分国家基本实现了食用油木本化,而我国近年食用植物油供需形势日益严峻,自给率只有40%左右[1]。 食用油中主要成分是脂肪酸,根据其结构特点,分为饱和脂肪酸和不饱和脂肪酸,其组成和配比在很大程度上决定了它的营养价值[2]。其中α-亚麻酸,学名 9,12,15-十八碳三烯酸(ALA,C18∶3),是全顺式高度不饱和脂肪酸,具有明显的降血压、抗动脉粥样硬化和益智等作用,被认为是评价植物油脂价值的重要指标,已成为近几年的研究热点[3-4]。目前亚麻酸含量高的经济作物有亚麻和紫苏种子,杜仲为我国特有树种,资源丰富,杜仲种子中α-亚麻酸含量可达60%左右。这3种经济作物生长环境各不相同。杜仲主要分布于陕西、甘肃、河南、湖北等省区,紫苏主要分布于我国华北、华中、华南及西南,而亚麻在我国各地皆有栽培,但以北方和西南地区较为普遍。冯晓等仅对山西、内蒙和甘肃3个地区的亚麻种子中α-亚麻酸含量进行了研究报道[5];李曼杰等曾对不同产地紫苏种子中油含量进行了研究报道[6],但采集的样品数有限,限制了对3种作物的全面认识。此外,3种作物出油率及亚麻酸含量的比较均鲜有系统的报道。为了对不同品种、不同产地的杜仲、紫苏和亚麻种子油的品质特征进行深入了解,最终实现亚麻酸综合高效利用,笔者选择了国内11个产地的亚麻、7个产地的紫苏及10个产地的杜仲种子的出油率及α-亚麻酸的含量进行了系统分析研究,可有效揭示不同产地的3种作物种子油脂肪酸组成的特征与差异,进而为亚麻酸资源的开发利用以及原料质量控制提供科学依据。
1材料与方法
1.1材料
1.1.1原料。试验采用的亚麻、紫苏与杜仲种子样品,均于2014 年在种子成熟期采集于不同产地,自然阴干,湿度均<3%。
1.1.2主要试剂。硫酸、硫酸钠、甲醇,分析纯;正己烷,色谱纯,Fisher Scientific公司;37种脂肪酸甲酯标准品(Supelco® 37 Component FAME Mix),Sigma-Aldrich 公司;内标物十九酸甲酯标准品(C19∶0),Sigma-Aldrich 公司。
1.1.3主要仪器设备。Agilent 7890A/5975c气相色谱-质谱联用仪;超声波清洗仪,昆山市超声仪器有限公司;氮吹仪,瑞士Buchil;低温高速离心机,美国Beckman;涡旋混匀器,德国IKA;电子天平,瑞士梅特勒托利多;迷你干式恒温器,杭州聚同电子有限公司。
1.2标准溶液配制内标溶液的配制:将100 mg十九烷酸甲酯标准品溶于10 mL正己烷中,配成质量浓度为10 mg/mL的标准液,待用。
外标溶液的配制:用色谱级正己烷溶剂将1 mL的浓度为10 mg/L的37种脂肪酸混合标准品稀释成不同梯度标准溶液(所有标液中均含有0.1 mg/mL 内标)。
1.3色谱-质谱条件
1.3.1色谱条件。HP-88石英毛细管柱(30 m×0.25 mm,0.25 μm),载气:高纯He(99.99%);进样口温度:250 ℃;升温程序:175 ℃保持5 min,以3 ℃/min的速率升至220 ℃,停留5 min;进样量:1 μL;进样方式:20∶1分流进样;柱流量:1.0 mL/min;GC-MS接口温度:250 ℃。
1.3.2质谱条件。EI源,离子源温度 230 ℃,传输线温度230 ℃,电离电压70 eV,质量扫描范围m/z40~460。
1.4试验方法
1.4.1样品中目标物的提取。取不同产地的3种样品的粉末各40 g,精密称定,分别置于索氏提取器中,加入无水乙醚200 mL,提取6 h,于真空旋转蒸发器上回收溶剂至干,得淡黄色半透明油状总脂肪油,计算得油率。低温保存,组成含量待测[7]。
1.4.2样品中目标提取物的甲酯化。取均匀油样50 mg于20 mL具塞试管中,加入2 mL 4%硫酸-甲醇溶液摇匀 ,再加入10 mg 2,6-二叔丁基-4-甲基苯酚(BHT)抗氧化剂,80 ℃水浴加热甲酯化60 min,冷却后依次加入1 mL正己烷和1 mL饱和氯化钠溶液摇匀,过无水硫酸钠干燥,静置,取上层溶液,加入内标液,过滤后进行气相色谱-质谱(GC-MS)分析[8]。
2结果与分析
2.137种脂肪酸甲酯的GC-MS 图按照“1.3”中的色谱条件,经过GC-MS分析得到总离子流图,图 1 为37种脂肪酸甲酯混合标准品色谱峰保留时间,根据各相关色谱峰的离子质量,并检索NIST2011谱库,确定种子油中脂肪酸的种类。
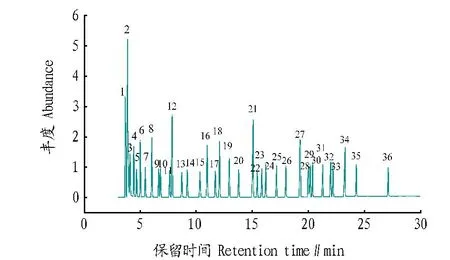
注:1.C4∶0;2.C6∶0;3.C8∶0;4.C10∶0;5.C11∶0;6.C12∶0;7.C13∶0;8.C14∶0;9.C14∶1;10.C15∶0;11.C15∶1;12.C16∶0;13.C16∶1;14.C17∶0;15.C17∶1;16.C18∶0;17.C18∶1(t);18.C18∶1(c);19.C19∶0;20.C18∶2(c,t);21.C20∶0;22.C18∶3(γ);23.C18∶3(α);24.C20∶1;25.C21∶0;26.C20∶2;27.C22∶0;28.C20∶3(c,t);29.C20∶4;30.C22∶1;31.C23∶0;32.C22∶2;33.C20∶5;34.C24∶0;35.C24∶1;36.C22∶6。Note:1.C4∶0,2.C6∶0,3.C8∶0,4.C10∶0,5.C11∶0,6.C12∶0,7.C13∶0,8.C14∶0,9.C14∶1,10.C15∶0,11.C15∶1,12.C16∶0,13.C16∶1,14.C17∶0,15.C17∶1,16.C18∶0,17.C18∶1(t),18.C18∶1(c),19.C19∶0,20.C18∶2(c,t),21.C20∶0,22.C18∶3(γ),23.C18∶3(α),24.C20∶1,25.C21∶0,26.C20∶2,27.C22∶0,28.C20∶3(c,t),29.C20∶4,30.C22∶1,31.C23∶0,32.C22∶2,33.C20∶5,34.C24∶0,35.C24∶1,36.C22∶6.图1 37种脂肪酸甲酯混合标准品SIM模式离子流色谱Fig.1 Ion current chromatograms of SIM mode of 37 mixed standard samples of fatty acid methyl ester
根据不同质量浓度混合标准品的总离子流图,以标准品与内标物的质量浓度比为横坐标(x),相对应的标准品与内标物峰面积比为纵坐标(y),进行线性回归,得到亚麻酸甲酯的标准曲线y=-0.005 12+1.483 38x,相关系数0.999 8,说明在测定质量浓度范围内,总离子流色谱峰面积与质量浓度成良好的线性关系。
2.2不同产地亚麻子脂肪酸组成分析表1为11个不同产地亚麻子的脂肪酸含量。从表1中可以看出,11个产地亚麻子油中脂肪酸组成统一,α-亚麻酸含量较高,介于48.09%~55.63%。不同产地亚麻子亚麻酸含量存在着明显差异,亚麻酸含量最多的是内蒙古呼和浩特产地(195.4 mg/g干重),其次为甘肃兰州(185.3 mg/g干重),含量最少的是产自山西大同的(154.6 mg/g干重);而在这些产地的亚麻子中,出油率最高的来自青海海东的亚麻子,高达36.3%,其他亚麻子油出油率介于30.1%~35.5%。由此可见,亚麻子中的亚麻酸含量随着产地的海拔高度增加呈现递增趋势,这也符合亚麻子是一种高寒作物的属性。因此,适宜在内蒙古和青海两产区大面积推广亚麻子的种植。

表1 不同地区亚麻子的脂肪酸组成、亚麻酸含量和出油率
2.3不同产地紫苏种子脂肪酸组成分析表2为7个产地紫苏种子的脂肪酸组成、出油率及亚麻酸含量。从表2中可以看出,紫苏种子与亚麻子的脂肪酸组成基本相同,α-亚麻酸含量为 51.49%~59.92%,含量极为丰富。产于吉林省高寒山区的紫苏种子亚麻酸组分最为丰富,其出油率和亚麻酸的含量明显高于产于暖温带地区江苏连云港的。另外,同是产于吉林的紫苏种子,产于吉林省高寒山区(白山、延边)的紫苏种子α-亚麻酸的含量(58.65% 和59.92%)均高于产于平原地区的(长春57.58%)。此项研究结果表明(表3),亚麻酸在紫苏种子内的合成同样受温度影响大,紫苏种子应以产于东北为佳,东北高寒山区宜大面积种植紫苏。
2.4不同产地杜仲种子脂肪酸组成分析该研究以湖北、贵州、重庆、四川等10个不同产地杜仲种子为材料,研究了其脂肪酸组成、亚麻酸的含量及出油率。分析检测结果表明(表3),所检测的10个产地杜仲种子中α-亚麻酸的含量在55.21%~61.49% ,其中湖北省十堰市的杜仲种子中α-亚麻酸含量为61.49%,为所分析材料中亚麻酸含量最高的样品。从表3中可以看出,气候环境对不同产地的杜仲种子亚麻酸含量影响也比较大,温暖湿润气候的湖北地区更适宜开发高含量亚麻酸的杜仲种子油。

表2 不同地区紫苏种子的脂肪酸组成、亚麻酸含量和出油率
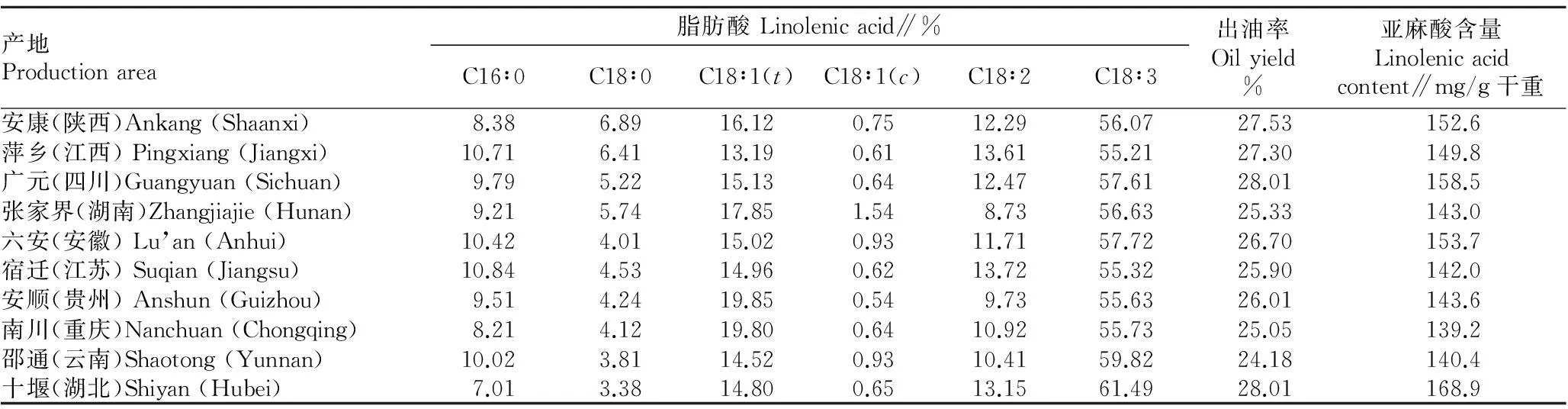
表3 不同地区杜仲种子的脂肪酸组成、亚麻酸含量和出油率
3结论
试验测得杜仲、紫苏和亚麻子3种作物种子油中主要脂肪酸的种类与前人测定结果一致[9-11],包括α-亚麻酸、油酸、亚油酸。不同品种种子油中亚麻酸含量和出油率差异显著。亚麻和紫苏种子中亚麻酸含量高低与高寒种植环境呈显著相关性,这与高寒环境使不饱和脂肪酸的脱氢酶活性增加,更有利于不饱和脂肪酸的形成有关[12];而杜仲种子亚麻酸含量与高寒环境无关,中部地区温暖湿润气候的湖北十堰产地的杜仲种子亚麻酸含量最高。因此,在今后亚麻酸产业开发方面,要综合考虑不同品种、不同地区之间的种子品质差异性。内蒙古亚麻、长春紫苏和湖北杜仲种子油是最经济实惠,又能满足食用健康的油品,因此提倡合理开发利用。
参考文献
[1] 王汉中.我国食用油供给安全形势分析与对策建议[J].中国油料作物学报,2007,29(3):347-349.
[2] 李焕,陈侨侨,刘辉,等.定量结构-色谱保留相关联方法分析食用植物油中脂肪酸组成[J].食品科学,2014,35(4):86-90.
[3] 张海满,刘福祯.α-亚麻酸的功能、资源及生产方法[J].食品科学,2007,28(5):208-211.
[4] NGUEMENT C,GOUIX E,BOUROUROU M,et al.Alpha-linolenic acid:A promising nutraceutical for the prevention of stroke[J].Pharma Nutr,2013,1(1):1-8.
[5] 冯晓,宋国新,胡耀铭.GC-MS法测定亚麻籽中脂肪酸含量[J].实验技术与管理,2011,28(11):278-279.
[6] 李曼杰,范胜华.不同产地紫苏中油及亚麻酸含量测定[J].长春中医药大学学报,2006,22(2):50-51.
[7] 李高阳,丁霄霖.亚麻籽油中脂肪酸成分的GC-MS分析[J].食品与机械,2005,21(9):30-31.
[9] 邱财生,郭媛,龙松华,等.亚麻籽的营养及开发研究进展[J].食品研究与开发,2014,35(17):122-125.
[10] 吴丽雅,杨万根,黄群,等.杜仲籽油中不饱和脂肪酸的分离及其α-亚麻酸含量分析[J].食品研究与开发,2013,5(4):1393-1399.
[11] 董文江,倪永年.高效液相色谱全轮廓指纹图谱结合化学计量学区分不同地区的紫苏叶[J].分析测试学报,2014,33(5):506-511.
[12] STUMPF P K,BRADBEEK C.Fat metabolism in higher plants [J].Ann Rev Plant Physiol,1959,10:197-222.
GC-MS Analysis of Linolenic Acid Contents and Oil Yields in Seed Oils ofEucommiaulmoides,PerillafrutescensandLinumusitatissimumGrowing in Different Areas
TANG Chuan-qiu*, SHEN Zhi-peng
(Department of Biochemical and Environmental Engineering, Yunyang Teachers’ College, Shiyan, Hubei 442000)
Abstract[Objective]To evaluate the inolenic acid contents and oil yields in seed oils of Eucommia ulmoides, Perilla frutescens and Linum usitatissimum growing in different areas of China, and to provide references for the further screening and cultivation of high-quality linolenic acid crops. [Method] Soxhlet extraction and GC-MS method were used to compare and analyze the oil yields and α-linolenic acid contents in seed oils of L. usitatissimum from 11 production areas, P. frutescens from 7 production areas and E. ulmoides from 10 production areas. [Result] Linolenic acid contents in different seed varieties showed significant differences: E. ulmoides seed oil from Shiyan of Hubei Province was the maximum (61.49%), followed with P. frutescens seed oil from Yanbian City of Jilin Province (59.92%); and L. usitatissimum seed oil from Datong City in Shanxi Province was the minimum. As for the dry weight, P. frutescens seeds from Yanbian City of Jilin Province had the maximum inolenic acid content (230.1 mg/g dry weight); while E. ulmoides seed from Shaotong City of Yunnan Province was the minimum (140.4 mg/g dry weight). At the same time, oil yields of different crops had significant differences. The average oil yields of L. usitatissimum and P. frutescens seeds were 35.21% and 36.80%, respectively, which were significantly higher than that of E. ulmoides seeds(26.40%). [Conclusion] In the aspect of industry development of linolenic acid, we should consider the difference of seed oil quality among different region. L. usitatissimum from Inner Mongolia, P. frutescens from Changchun and P. frutescens from Hubei were the most economical, which can meet the requirements of healthy food, so that rational development and utilization should be promoted.
Key wordsEucommia ulmoides; Perilla frutescens; Linum usitatissimum seeds; Linolenic acid; Oil yield; GC-MS
作者简介唐传球(1980- ),男,安徽枞阳人,讲师,硕士,从事天然物质分离与分析研究。
收稿日期2016-02-07
中图分类号S 509.9
文献标识码A
文章编号0517-6611(2016)08-098-03
