真菌漆酶的性质、生产及应用研究进展
2016-06-13刘家扬焦国宝有小娟廖祥儒孙利鹏
刘家扬焦国宝有小娟廖祥儒孙利鹏
(1. 黄淮学院生物工程系,驻马店 463000;2. 河南仰韶生化工程有限公司,三门峡 472400;3. 江南大学生物工程学院,无锡 214122)
真菌漆酶的性质、生产及应用研究进展
刘家扬1,2焦国宝2有小娟1廖祥儒3孙利鹏2
(1. 黄淮学院生物工程系,驻马店 463000;2. 河南仰韶生化工程有限公司,三门峡 472400;3. 江南大学生物工程学院,无锡 214122)
作为一种含铜的多酚氧化酶,真菌漆酶比细菌漆酶、植物漆酶等具有更好的热稳定性、金属离子耐受性及更高的底物催化氧化性,在工农业及环境领域的应用中得到了较高的关注。目前普遍认为,限制漆酶广泛应用的因素在于漆酶的生产规模、成本与性质。真菌漆酶的生产模式包括固态发酵和液体发酵,工业生产基本以液体发酵为主。除了在染料脱色、染织废水处理、纸浆漂白等过程中的应用,最新的研究不断拓展了漆酶新的用途,对近年来真菌漆酶的发酵生产、酶学性质及应用研究中的最新结果进行了概述。
白腐真菌;漆酶;发酵;酶学性质;应用
漆酶(EC 1.10.3.2)是一种含铜的多酚氧化酶,以分子氧作为最终电子受体,能催化一大类酚类及芳胺类物质的聚合、降解及转化。由于具有广泛的底物作用性,漆酶作为一种绿色生物催化剂在工业、农业、食品、环保和医药等领域均有巨大的应用潜力,具有广阔的市场前景[1]。漆酶的研究可以追溯到1883年,日本学者吉田发现了漆树汁液中的一种蛋白可以使汁液氧化变硬。现在研究表明,漆酶在自然界中广泛存在,在植物、动物、细菌和真菌中等都发现了漆酶或漆酶的类似物,但其主要生产者还是真菌,尤其是白腐真菌。漆酶在不同来源的生物中起着不同的生理作用。漆酶活性中心含有4个铜原子,在底物的催化过程中起着电子转移的作用。由于具有广泛的底物作用性,漆酶已经在很多领域得到应用。本文就近年来真菌漆酶的性质、生产及应用研究作一综述,供研究者参考。
1 白腐真菌及胞外木质素降解酶系
1.1 白腐真菌
真菌界是生物圈中一个重要的分支,在自然界生物进化及物质的循环中有着不可或缺的地位。木腐菌因能生长在木质材料上引起腐烂或腐朽而得名,英文名为wood-rotting fungi、wood-destroying fungi、wood-decay fungi等[2,3]。根据引起木材腐变类型的不同,可以将木腐菌分为白腐菌(white-rot fungi)、褐腐菌(brown-rot fungi)和软腐菌(soft-rot fungi)3类[4]。白腐菌能选择性地降解木材中的木质素或同时降解木质素及纤维素,使白色的纤维素暴露出来呈纤维状连接,因此木质腐变成白色[5]。常见的白腐真菌有栓菌属(Trametes)、侧耳属(Pleurotus)、木耳属(Auricularia)、密孔菌属(Pycnoporus)和伞菌属(Agaricus)等[6]。在白腐真菌的研究历史中较为经典的是黄孢原毛平革菌(Phanerochaete chrysosporium)[7]。
白腐真菌在自然界生态系统的碳循环中起着非常重要的作用。木质纤维类生物质是自然界中最大的有机碳源库,主要包括木质素、纤维素和半纤维素等成分。植物在光合作用下固定的碳约有20%用来合成木质素,而这些木质素约占木质干重的25%-30%,纤维素被这些木质素包裹着并与之形成复杂的木材基质,用以保护植物免受微生物的侵染[8]。木质素是一类“顽强的”酚类生物大分子,基本结构单元是苯基丙烷,是形成松伯醇、芥子醇和香豆醇的前体物质[9],木质素的降解在木材的腐烂及降解中起限制性作用。目前唯一能对木质素进行实质性并彻底降解的微生物就是白腐真菌[10]。
1.2 白腐真菌的胞外酶系
白腐真菌对木质纤维素的降解利用主要依靠其菌丝强大的穿透能力及胞外相关酶系的协调作用而实现。真菌的胞外木质素降解酶系主要包括两大类:过氧化物酶(peroxidases,PODs)类及漆酶(laccase)。PODs又包括4类:即木质素过氧化物酶(LiP)、锰过氧化物酶(MnP)、versatile peroxidase(VP)和generic peroxidase(GP)[10]。研究表明,这些酶类直接或间接参与木质素的降解,黄孢原毛平革菌的LiP借助其表面的色氨酸残基(Trp171),通过一系列的电子转移能够实现对木质素的直接降解;MnP中的残基Glu35、Glu39和Asp175,可以结合Mn并发生相关的催化作用[10]。漆酶较LiP与MnP而言存在一定的争议[11],有的学者认为漆酶不能降解木质素,只有LiP及MnP才是真正能降解木质素的酶;但同时也有研究表明漆酶失活(deactivation)的鲜红密孔菌(Pycnoporus cinnabarinus)突变株不具备去除木质素的能力,而野生菌则可以有效对纸浆漂白及脱除木质素[12]。白腐真菌中通常含有5-26个这些酶的基因拷贝,因此能有效地降解木质素,褐腐菌却没有[10]。某些真菌如扁韧革菌可同时分泌漆酶、LiP和MnP[13],然而并非所有的白腐菌都能同时分泌这3种酶,如灰隔孢伏革菌仅分泌漆酶[14]。
2 漆酶简介
2.1 漆酶来源及分泌形式
漆酶(EC 1. 10. 3. 2)是一种多酚氧化酶,可氧化酚类和芳香胺类化合物,同时将分子氧还原成水,是一种绿色催化剂。漆酶最早于1883年在漆树的汁液中发现,后来研究表明漆酶其实广泛存在于自然界中,如植物、真菌、细菌、动物及昆虫中[15]。进一步的研究表明,漆酶属于铜蓝氧化酶家族,其活性中心和抗坏血酸氧化酶、血浆铜蓝蛋白及胆红素氧化酶的活性中心极为相似[16,17]。漆酶在不同的生物体中充当着不同的角色,主要参与木质化、去木质化、真菌形态发生、去毒、植物感染和植物氧化胁迫等过程[15]。自然界中真菌是漆酶的主要产生菌,包括担子菌、子囊菌及半知菌等,其中又以是担子菌门的白腐真菌为主[2]。漆酶一般以同工酶的形式被分泌出来,少数真菌仅分泌1种漆酶,多数真菌会分泌2种甚至更多种的同工酶,如灰隔孢伏革菌可分泌8种漆酶同工酶[14]。漆酶同工酶的分子量、活力和等电点等极为相似,其最大的不同在于其表达量及稳定性有差异[18,19]。此外,即使是同一种真菌,当以不同的形式生长时,所产的漆酶也会有差异,如香菇(Lentinula edodes)有分泌型的漆酶lcc1及在子实体中的形式lcc4(非分泌型)[20]。这可能是真菌适应生存环境的一种机制。
2.2 漆酶的活力测定方法
由于漆酶具有广泛的底物特异性,因此测定漆酶活力的方法较多。目前常用的方法主要有分光光度法[21]及HPLC法等[22]。用分光光度法测定漆酶的活力时常见的底物有ABTS、丁香醛连氮、阿魏酸、DMP及愈创木酚等[23]。不同来源的漆酶对不同底物的亲和力及催化能力不同,表现出不同的Km和Vmax;同一种酶用不同的底物测定所得出的酶活力也相差较大。以酚类物质为底物测定漆酶的活力时,容易受到酚类物质自氧化的干扰,尤其在酶活力低到一定范围时干扰更大[24]。酶活的测定方法不同,酶活力的定义也不同,漆酶的活力一般定义为1 min内催化1 μmol底物或产生1 μmol产物所需要的酶量,但也有人用反应体系在最大吸收波长处的吸光值每增加1为一个酶活单位[25]。目前有关漆酶的文献中,使用的漆酶测定方法及测定体系差异较大,对酶活、产量之间的比较存在一定的难度[26]。
3 真菌漆酶性质及结构特征
3.1 漆酶的理化特性
3.1.1 漆酶的分子量 真菌漆酶的分子量一般在50-90 kD之间,尤其在担子菌漆酶中比较普遍[6,27-29]。最近的研究还发现了小分子量的漆酶,如灰隔孢伏革菌所分泌的同工酶中分子量较小的仅有26.2 kD[14]。
3.1.2 漆酶的等电点 真菌漆酶多为酸性蛋白,如灰隔孢伏革菌所分泌的同工酶其等电点为3-6之间[14],杂色云芝漆酶等电点为4.2[27],密孔菌L3漆酶等电点为4.7[28]。也有报道发现等电点为碱性的真菌漆酶,如侧耳属真菌POXA1a与POXA1b漆酶的等电点分别为6.7及6.9[6]。
3.1.3 漆酶的糖基化 漆酶一般都有不同程度的糖基化,其含糖量为10%-30%,分子中的糖可能为阿拉伯糖、木糖、甘露糖、半乳糖及葡萄糖的一种或多种[30]。Phanerochaete flavido-alba漆酶分子量为98.7 kD,去掉糖基后变为81.3 kD,即含糖17.7%[31],然而番茄灰霉菌漆酶的含糖量可高达70%[30]。糖基可能对胞外漆酶的分泌、活性中心的维持、防止蛋白酶的降解、温度稳定及pH稳定等构像有重要影响[32,33]。漆酶的活力除受菌种来源的影响外,可能还受糖基化及含糖量的影响。
3.1.4 漆酶的氧化还原电势 真菌漆酶一般低于漆树漆酶的氧化还原电势,表现出更高的催化活性。影响漆酶氧化还原电势的因素很多,如分子量、与铜原子配位的氨基酸的差异等。真菌漆酶的氧化还原电势一般为0.4-0.8 V,其中又可以分为两类:0.4-0.6 V为低电势,如灰盖鬼伞漆酶;0.6-0.8 V为高电势,如云芝漆酶,其分子中I铜原子附近独特的结构使得该漆酶具有较高的电势,为0.78-0.79 V[15]。某些真菌如担子菌C30漆酶的电势非常低,仅有0.17 V[34]。
3.1.5 漆酶的最适反应条件(温度、pH值) 漆酶的最适反应温度和pH值具有很强的底物依赖性。最适反应温度普遍偏高,50-80℃较为常见,如密孔菌L3漆酶催化不同底物的最适温度在55-75℃之间[28]。Zhang等[35]研究的云芝漆酶,以DMP为底物时最适温度则高达85℃。有些真菌漆酶则嗜好较低的催化温度,胶质射脉革菌(Phlebia tremellosa)漆酶的最适温度仅为20℃[36]。大多数漆酶在酸性的环境下能发挥其最大的催化活性,最适pH值在2-5之间[28]。个别真菌漆酶的最适pH值在中性,只有极少数的真菌漆酶在碱性的条件下有高效的催化能力,如Panaeolus papilionaceus漆酶以DMP为底物时的最适pH值为8.0[6]。
3.1.6 漆酶的稳定性(温度、pH值) 真菌漆酶普遍具有良好的热稳定性。云芝栓菌漆酶在65℃和75℃下的半衰期分别为5 h和70 min[35],朱红栓菌漆酶在70℃时的半衰期为60 min[37],密孔菌漆酶在70℃及60℃时的半衰期分别为3 h、5 h[28]。尽管大部分漆酶都在酸性范围内有最高的催化效率,很多真菌漆酶在中性及偏碱性条件下(pH值为6-10)保存比较稳定[28,38]。通过对漆酶进行固定化可以有效提高漆酶对温度、pH值及抑制剂等的稳定性,扩大漆酶的应用范围[39]。
3.1.7 漆酶的激活及抑制 漆酶的活性会受到金属离子如铜离子、锰离子等的激活,有的则被抑制。铁离子、银离子及汞离子通常抑制漆酶的活性[28]。此外,卤化物、硫化物、碳酸盐、有机溶剂等也可抑制漆酶活性[15],如二硫苏糖醇、巯基乙醇、叠氮化钠、L-半胱氨酸和碘化钾等对漆酶抑制效果比较大,有机溶剂中甲醇、乙醇和乙腈等对漆酶影响不大,二甲亚砜则明显抑制漆酶的活力[19,38,40]。不同的抑制剂对漆酶的抑制机理互不相同,如羟基甘氨酸和脂肪酸通过阻碍底物进入漆酶的结合部位而抑制了漆酶的催化能力,卤化物则阻碍了电子通往三核铜位点的路径[15]。
3.2 漆酶的催化特性
漆酶具有广泛的底物作用性,能催化一系列底物的氧化,诸如单酚、二酚、多酚、二胺、芳香胺、甲基酚、抗坏血酸及非酚类的化合物等[41],其主要机理为通过单电子的转移体系并伴随着分子氧作为电子受体进而被还原为水[42]。漆酶分子中的铜离子在催化过程中起着重要的作用,漆酶介导的催化过程主要有3步:(1)底物将I类铜离子还原;(2)I类铜离子将电子传递给含有二类和三类铜原子组成的三核中心;(3)在三核中心氧被还原为水(图1)。
漆酶催化不同的底物时其机理不尽相同,小分子酚类化合物如α-萘酚、儿茶酚等通常在漆酶的介导下形成二聚体、三聚体等聚合物并进一步发生沉淀[43,44]。当小分子介体(如HBT)存在时,漆酶对酚类化合物的聚合作用常被抑制,而漆酶对这些化合物的降解作用则占主导[45]。但对于某些非酚类大分子,如环境中的污染物、激素和染料等,漆酶则无法直接作用。漆酶的氧化还原电势比非酚类化合物的氧化还原电势低,因此漆酶通常不能催化此类底物的氧化或分解,但如果存在电子转移介体的情况下,漆酶也可以作用于非特异性底物[46]。介体可以起着桥梁的作用,首先被漆酶氧化,然后再介导底物的氧化。常见的介体有:ABTS、1-hydroxybenzotriazole(HBT)、N-hydrox yphthalimide(NHPI)、3-hydroxyanthranilic acid和violuric acid(VIO)等[3,47]。漆酶介体体系(LMS)已被广泛地用于纸浆的脱木质素、燃料电池、有机污染物的转化、生物传感器及染料的降解等。
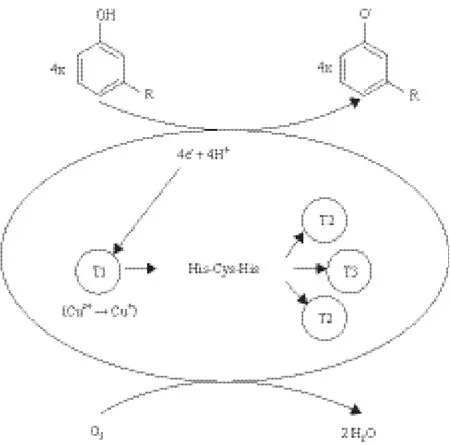
图1 漆酶对酚类底物催化的过程

图2 Trametes versicolor漆酶的空间结构(二级结构)
3.3 漆酶的结构特征
到目前为止,已经有很多真菌漆酶被结晶出来用以结构分析。下面以Trametes versicolor为例对漆酶的空间结构做一说明:如图2[48],漆酶分子成球形(大小为7 × 5 × 5 nm),主要由折叠结构组成,其次有少量的无规则卷曲和极少量的螺旋结构;漆酶分子中有3个结构域,T1铜离子(Cu 1)位点位于第3个结构域,T2/T3铜离子(Cu2、Cu3a和Cu3b)位于另外两个结构域的交界处,为三核中心;漆酶为糖基化蛋白,糖结合位点分别位于N54、N217、N333及N436;催化疏水口袋位于左侧中间位置,在Cu1附近,该处的电子云密度比较稀疏,有较大的空间来容纳底物,如底物2,5-二甲基苯胺(左侧中间的棍棒结构);漆酶催化底物时,从底物获得电子(His 458起着重要的作用),然后将电子从Cu1位点传递到Cu2/Cu3位点的三核中心,氧配位结合在Cu2/Cu3位点处,在此处氧被还原成水。也有研究发现杂色云芝(Coriolus versicolor)漆酶二级结构中含有更多的α-螺旋(68%),并非β-折叠[27]。
4 漆酶的生产
研究表明,真菌既可以固态培养也可以液态培养,但二者在漆酶产量及生产成本等方面具有差异,目前漆酶的生产多采用液态发酵方法。
4.1 真菌漆酶的生产周期
大部分真菌在培养的初始阶段仅有菌体的生长而几乎没有漆酶的分泌,漆酶的大量合成主要集中在培养的第二阶段,即漆酶为次生代谢产物[13],因此真菌漆酶的生产周期普遍较长,几天甚至几十天。扁韧革菌在第4 d时到达产酶高峰(约25 U/mL)[13],密孔菌L3液体培养6 d后产酶72 U/mL[49],栓菌在第6 d时最高酶活为18 U/mL[50],虎皮香菇菌在优化后的培养基中培养11 d时产酶2.2 U/mL[51],Lentinus sp.在培养16 d时酶活达到58 U/mL的最高活力[38],木硬孔菌则需要24 d的培养时间达到产酶高峰[52]。与液体发酵相比,固态培养真菌产漆酶所需要的周期更长,如侧耳需要50 d[53],密孔菌L3以柳枝稷(switchgrass)为培养基质时分泌漆酶的高峰在36 d[54]。
4.2 培养基组成的影响
培养基的组成对真菌分泌漆酶的影响较大,尤其是碳源和氮源,其中碳氮比对漆酶分泌的影响尤其显著,一般在“氮饥饿”时漆酶的分泌会增强[55]。真菌用于自身生长及合成漆酶所需要的碳源有:甘油、葡萄糖、果糖、麦芽糖、乳糖、纤维二糖、蔗糖、纤维素及一些木质纤维类生物质等。常用的氮源包括:酒石酸铵、磷酸氢二铵、氯化铵、尿素、酵母膏、豆粕和玉米浆等[14],其中有些不仅可充当氮源,同时具有漆酶诱导剂的作用,如玉米浆等[56]。
4.3 培养条件的影响
影响微生物发酵产漆酶的培养条件主要有温度、pH值、转速和接种量等。大部分漆酶产生菌嗜好的培养条件为:转速150-250 r/min,温度25-35℃,培养基pH值2-6[57,58],如Lentinus sp.相对喜欢较低的温度(25℃)和转速(150 r/min)[38]。真菌产漆酶的最适初始pH值多为酸性。虎皮香菇的培养基初始pH值为5.0,培养温度28℃,摇瓶转速140 r/min[51]。在机械搅拌式发酵罐上,转速对大部分真菌生物量及漆酶的产量影响较大,但有的真菌则不受影响[2],如Fenice等[59]发现虎皮香菇在3 L搅拌式发酵罐中培养时最佳的转速是500 r/min。培养基中的溶氧水平受转速及通气量的影响(在摇瓶中主要受转速的影响),搅拌式发酵罐上通气量为1.0 VVm(即每分钟的通气量等同于培养基的体积)时似乎对很多真菌的产酶都有利。
4.4 提高漆酶产量的策略
对漆酶进行诱导是提高漆酶产量常用的方法,其中铜离子[51]、醇类[60]、芳香族化合物等常被用作漆酶的诱导剂[56,61]。诱导剂的添加时期也是影响漆酶分泌的因素之一,如Lentinus sp.是在培养3 d后添加终浓度2 mmol/L的二甲基苯胺来对漆酶进行分泌诱导[38]。反转录PCR分析表明,二甲基苯胺等通过提高漆酶基因的转录水平而使漆酶的分泌水平提高,而芳香化合物则可能是激发了漆酶启动子上的外源化合物响应原件(XRE),进而促使漆酶大量的分泌[51]。
4.5 漆酶的生产规模
目前关于漆酶的生产研究大部分集中在摇瓶水平上,仅有少部分菌株在发酵罐水平上得到尝试,整体发酵规模偏小。在发酵罐水平上比较有潜力的真菌菌株主要是栓菌属(Trametes)和密孔菌属(Pycnoporus)[2]。单色云芝在20 L搅拌式发酵罐中生长14 d后达到最高的漆酶产量142 000 nkat/L[62],绒毛栓菌在20 L搅拌式发酵罐中产酶高达333 U/mL,流加后产生更高的酶活力740 U/mL[63,64]。Liu等[49]在65 L气升式发酵罐中培养Pycnoporus sp. SYBC-L3菌株,在第6 d达到漆酶最高活72 U/mL。
4.6 漆酶的异源表达
由于漆酶的后加工过程比较复杂,其中涉及引导肽的切除等过程,因此真菌漆酶一般需要在真核生物中异源表达[2]。真菌漆酶由1 500-2 500 bp左右的核苷酸编码520左右的氨基酸所组成,如Lentinus sp.漆酶lcc3的cDNA包括1 563 bp的碱基,编码含有521个氨基酸残基的多肽[38]。真菌漆酶基因一般包含数量不等的外显子,如虎皮香菇漆酶lac1和lac2的基因分别有9个和4个外显子[51]。现在已经有很多真菌漆酶的基因被克隆并在黑曲霉及李氏木霉等菌株中异源表达[2]。此外,漆酶基因的表达具有一定的宿主选择性,如香菇漆酶基因在Escherichia coli、Saccharomyces cerevisiae和Pichia pastoris中表达出的蛋白虽具备了和漆酶相似的大小,却没有漆酶的活性,在Aspergillus oryzae中却能成功表达并分泌至胞外[20]。
相对液态发酵,固态发酵成本较低,因此也常被采用,尤其是在农业废弃物的资源化利用方面。Sharma等[65]用麦糠为固态培养基质,在添加矿物质盐溶液后于搪瓷盒中培养灵芝真菌,5 d后得到漆酶活力高达11 589 U/g基质,发酵规模达到10 kg基质。
5 漆酶的应用
漆酶在工农业生产及环境保护中具有潜在的应用价值,近年来的研究在漆酶的应用方面有了新的进展。
5.1 造纸工业
在漂白过程中去除木质素可提高纸张的质量及色泽,传统的纸浆漂白过程采用氯化物对木质素选择性的降解,但副产物如二噁英等则对环境形成一定的负面影响。漆酶及漆酶介体系统(LMS)可以作为传统试剂的替代剂对纸浆处理达到较好的漂白效果[66]。Sharma等[65]研究发现在纸浆漂白过程中依次使用木聚糖酶及漆酶比单独使用二者更有效,能减少过程中35%的二氧化氯使用量,提高纸浆性能(撕裂指数增加15.7%,褪色值降低50%),并使最终废液的可吸附有机卤化物含量减少34%。
5.2 食品工业
漆酶还能有效地降解黄曲霉毒素(AFB1),这对于控制食品中的生物毒素水平具有重要的价值[67]。联合使用漆酶和纳米颗粒(如氧化铽Tb4O7)可以作为酒中多酚物质检测的一种新方法[68]。此外,由于漆酶具有催化酚类化合物及同时消耗氧的特点,其在净化水质及防止食品变质等方面也有应用。
5.3 染料脱色
合成类染料种类繁多、结构复杂且难降解,具有生物毒性及致畸作用,利用漆酶能有效地对染料进行降解,且多数在10 min内即可达到80%以上的脱色率[38,69]。在废水处理过程中,可利用酶的固定化技术提高效率、降低成本。如将漆酶分子上的氨基与聚苯醚砜分子上的环氧树脂基共价结合获得固定化漆酶可降解酸性红染料,降解率可达88%以上[70]。在小分子介体如丁香醛连氮或草酸盐等的参与下,漆酶对染料的降解速率可明显提高[14],也有报道发现介体如ABTS等对脱色过程没有明显的促进作用[71]。某些真菌可以利用染织废水作为培养基,在添加农业废弃物刺激后生产胞外漆酶,实现同步脱色的效果[72]。菌株对染料的脱色过程中,生物降解与菌体吸附同时起作用,提高了脱色效果[73]。
5.4 生物修复
漆酶在去除环境水体及市政污水中的固醇类激素方面表现出了潜力,这些激素包括雌酮(E1)、雌二醇(E2)、雌三醇(E3)[74]。在橄榄油生产过程中排放的废水中含有多种酚类化合物、漆酶及介体系统可以将大部分此类化合物转化、降解[75]。抗生素等药物在真菌漆酶的催化下也可有效去除[76]。
5.5 化学合成
漆酶能将底物3-氨基-4-羟基苯磺酸(AHBS)聚合,形成新的产物吩恶嗪酮染料(phenoxazinone dye)[77]。4-氟-2-甲氧基酚(4-fluoroguaiacol)在漆酶的介导下通过去氟、聚合反应生成具有荧光性的物质,在胶片生成方面表现出了巨大潜力[78]。乳清蛋白和甜菜果胶在漆酶的参与下发生共价偶联、聚合和乳化等可形成大小为109 nm的纳米颗粒[79]。
5.6 医药方面
Zhang等[80]用大伞杯漆酶对肿瘤及HIV反转录酶活性进行抑制能力研究发现,随着漆酶用量的增加(2.5-20 mmol/L),Hep G2和MCF-7细胞都受到了不同程度的抑制,抑制率分别为9.1%-80.5%及40.2%-95.4%,对这两种细胞的IC50分别为12.3和3.0 mmol/L;在漆酶浓度为20 mmol/L时对HIVRT的抑制达到70.4%,IC50值为14.4 mmol/L。漆酶能转化某些酚类底物生产抗菌素,如将4-甲基-3-羟基邻氨基苯甲酸转化成放线菌素(actinocin),该产物通过阻断肿瘤细胞DNA的转录而起到对抗癌症的功效[81]。
5.7 园艺
沙质土壤出现斥水性(SWR)是高尔夫球场草坪维护管理中的难题之一,斥水土壤将导致草皮的大面积死亡进而导致草坪质量下降及管理成本增加。最近的研究发现,漆酶处理斥水性较强的高尔夫球场浅层土壤可以有效去除其斥水性,有望结合或替代传统保水剂的使用来提高草坪的管理水平、降低管理成立成本[82,83]。同时漆酶的喷洒可以减少草坪浅层土壤中的有机层厚度及有机质含量(thatch),利于草坪的生长及维护[84,85]。
6 结语
高效率、规模化生产是实现漆酶广泛应用的前提。在自然界中产漆酶的菌株虽多,但能进行大规模工业化生产的菌株却较少,通过筛选自然菌株乃至对原始菌株改造有望满足不同领域的需求。此外,从实验室的摇瓶水平到小型发酵罐上的中试水平、再到工业化的生产水平还有一道很大的鸿沟,过程优化控制及工艺放大是规模化生产的必要环节。在未来的研究中,漆酶应用领域的不断拓展必然推动新型漆酶的开发与研制,通过代谢工程学、分子生物学、结构生物学等研究进一步深入了解漆酶,利用定点突变技术对漆酶分子在蛋白质水 平上进行改造等获得具有特殊性质、功能的漆酶是新的趋势。
[1]司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2):48-55.
[2]Couto SR, Toca-Herrera JL. Laccase production at reactor scale by filamentous fungi[J]. Biotechn ol Adv 2007, 25:558-569.
[3]Eggert C, Temp U, Er iksson KE. Laccase is essential for lignin degradation by the white-rot fungus Pycnoporus cinnabarinus[J]. FEBS Lett, 1997, 407:89-92.
[4]魏玉莲, 戴玉成. 木材腐朽菌在森林生态系统中的功能[J].应用生态学报, 2004, 15:1935-1938.
[5]Rodríguez Couto S, Rodríguez A, Paterson RRM, et a l. Laccase activity from the fungus Trametes hirsuta using an air-lift bioreactor[J]. Lett Appl Microbial, 2006, 42:612-616.
[6]Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiol Rev, 2006, 30:215-242.
[7]Tien M, Kirk TK. Lignin-Degrading Enzyme from the Hymenomycete Phanerochaete chrysosporium Bur ds[J]. Science, 1983, 221:661-663.
[8]Martínez ÁT, Ruiz-Dueñas FJ, Martínez MJ, et al. Enzymatic delignification of plant ce ll wall:from nature to mill[J]. Curr Opin Biotech, 2009, 20:348-357.
[9]Vivekanand V, Dwivedi P, Sharma A, et al. Enhanced delignification of mixed wood pulp by Aspergillus fumigatus laccase mediator system[J]. World J Microbiol Biotechnol, 2008, 24:2799-2804.
[10]Floudas D, Binder M, Riley R, et al. The paleozoic origin of enzymatic lignin decomposition reconstructed from 31 fungal genomes[J]. Science, 2012, 336:1715-1719.
[11]Arora DS, Gill PK. Laccase production by some white rot fungi under different nutritional conditions[J]. Bioresour Technol, 2000, 73:283-285.
[12]Bermek H, Li K, Eriksson L. Laccase-less mutants of the white-rot fungus Pycnoporus cinnabarinus cannot delignify kraft pulp[J]. J Biotechnol, 1998, 66:117-124.
[13]Praveen K, Viswanath B, Usha KY, et al. Lignolytic enzymes of a mushroom Stereum ostrea isolated from wood logs[J]. Enzyme Res, 2011, 2011:ID:749518.
[14]Moreira S, Milagres AMF, Mussatto SI. Reactive dyes and textile effluent decolorization by a mediator system of salt-tolerant laccase from Peniophora cinerea[J]. Sep Purif Technol, 2014, 135:183-189.
[15]Rodgers CJ, Blanford CF, Giddens SR, et al. Designer laccases:a vogue for high-potential fungal enzymes?[J]Trends Biotechnol, 2009, 28:63-72.
[16]Briving C, Gandvik EK, Nyman PO. Structural studies around cysteine and cystine residues in the “blue” oxidase funga l laccase B. Similarity in amino acid sequence with ceruloplasmin[J]. Biochem Bioph Res Commun, 1980, 93:454-461.
[17]Hoegger PJ, Kilaru S, James T Y, et al. Phylogenetic comparison and classification of laccase and related multicopper oxidase protein sequences[J]. FEBS J, 2006, 273:2308-2326.
[18]Chernykh A, Myaso edova N, Kolomytseva M, et al. Laccase isoformswith unusual properties from the basidiomycete Steccherinum ochraceum strain 1833[j]. J Appl Microbi ol, 2008, 105:2065-2075.
[19]Wang ZX, Cai YJ, Liao XR, et al. Purification and characterization of two thermostable laccases with high cold adapted characteristics from Pycnoporus sp. SYBC-L1[J]. Proc Bio chem, 2010, 45:1720-1729.
[20]Yano A, Kikuchi S, Nakagawa Y, et al. Secretory expression of the non-secretory-type Lentinula edodes laccase by Asper gillus oryzae[J]. Microbiol Res, 2009, 164:642-649.
[21]Cantarella G, d’Acunzo F, Galli C. Determination of laccase activity in mixed solvents:comparison between two chromogens in a spectrophotometric assay[J]. Biotech Bioeng, 2003, 8 2:395-398.
[22]Carunchio F, Crescenzi C, Girelli AM, et al. Oxidation of ferulic acid by laccase:identification of the products and inhibitory effects of some dipeptides[J]. Talan ta, 2001, 55:189-200.
[23]Bose S, Mazumder S, Mukherjee M. Laccase production by the white-rot fungus Termitomyces clypeatus[J]. J Basic Microb, 2007, 47:127-131.
[24]Badiani M, Felici M, Luna M, et al. Laccase assay by means of high-performance liquid chromatography[J]. Anal Biochem, 1983, 133:275-276.
[25]Kahraman S, Yesilada O. Industrial and agricultural wastes as substrates for laccase produ ction by white-rot fungi[J]. Folia Microbiol, 2001, 46:133-136.
[26]Elisashvili V, Kachlishvili E. Physiological regulation of laccase and manganese peroxidase production by white-rot Basidiomycetes[J]. J Biotechnol, 2009, 144:37-42.
[27]Que Y, Sun S, Xu L, et al. High-level coproduction, purification and characterisation of laccase and exopolysaccharides by Corio lus versicolor[J]. Food Chem, 2014, 159:208-213.
[28]Liu J, Cai Y, Liao X, et al. Purification and Characterization of a novel thermal stable laccase from Pycnoporus sp. SYBC-L3 and its use in dye decolorization[J]. Biol Environ, 2012, 113:1-13.
[29]Yan J, Chen D, Yang E, et al. Purification and characterization of a thermotolera nt laccase isoform in Trametes trogii strain and its potential in dye decolorization[J]. Int Biodeter Biodegr, 2014, 93:186-194.
[30]Marbach I, Harel E, Mayer AM. Molecular properties of extracellular Botrytis cinerea laccase[J]. Phytochemistry, 1984, 23:2713-2717.
[31]de la Rubia T, Ruiz E, Perez J, et al. Properties of a laccase produced by Phanerochaete flavido-alba induced by vanillin[J]. Arch Microbiol, 2002, 179:70-73.
[32]Hatakka A. Lignin-modifying enzymes from selected white-rot fungi:production and role from in lignin degradation[J]. FEMS Microbiol Rev, 1994, 13:125-135.
[33]Kurtz MB, Champe SP. Purification and characterization of the conidial laccase of Aspergillus nidulans[J]. J Bacteriol, 1982, 151:1338-1345.
[34]Klonowska A, Gaudin C, Fournel A, et al. Characterization of a low redox potential laccase from the basidiomycete C30[J]. Eur J Biochem, 2002, 269:6119-6125.
[35] Haibo Z, Yinglong Z, Feng H, et al. Purification and characterization of a thermostable laccase with unique oxidative characteristics from Trametes hirsuta[J]. Biotechnol Lett, 2009, 31:837-843.
[36]Kim Y, Yeo S, Kim MK, et al. Removal of estrogenic activity from endocrine-disrupting chemicals by purified laccase of Phlebia tremellosa[J]. FEMS Microbiol Lett, 2008, 284:172-175.
[37]Eggert C, Temp U, Eriksson K. T he ligninolytic system of the white rot fungus Pycnoporus cinnabarinus:purification and characterization of the laccase[J]. Appl Environ Microbiol, 1996, 62:1151-1158.
[38]Hsu CA, Wen TN, Su YC, et al. Biological degradation of anthroquinone and azo dyes by a novel laccase from Lentinus sp.[J]. Environ Sci Technol, 2012, 46:5109-5117.
[39]Abadulla E, Tzanov T, Costa S, et al. Decolorization and detoxification of textile dyes with a laccase from Trametes hirsuta[J]. Appl Environ Microbiol, 2000, 66:3357-3362.
[40]Lu L, Zhao M, Zhang BB, et al. Purification and characterization of laccase from Pycnoporus sanguineus and decolorization of an anthraquinone dye by the enzyme[J]. Appl Microbiol Biotechnol, 2007, 74:1232-1239.
[41]Kurniawati S, Nicell JA. Characterization of Trametes versicolor laccase for the transformation of a queous phenol[J]. Bioresour Technol, 2008, 99:7825-7834.
[42]Couto SR, Sanromán MÁ. The effect of violuric acid on the decolourization of recalcitrant dyes by laccase from Trametes hirsuta[J]. Dyes Pigments, 2007, 74:123-126.
[43]Aktas N, Cicek H, U nal AT, et al. Reaction kinetics for laccasecatalyzed polymerization of 1-naphthol[J]. Bioresour Technol, 2001, 80:29-36.
[44]Aktas N, Sahiner N, Kantoglu O, et al. Biosynthesis and characte rization of laccase catalyzed poly(catechol)[J]. J Polym Environ, 2003, 11:123-128.
[45]Alcantara T, Gomez J, Pazos M, et al. Enhanced production of laccase in Coriolopsis rigida grown on barley bran in flask or expanded-bed bioreactor[J]. World J Microbiol Biotechnol, 2007, 23:1189-1194.
[46]Call HP, Mücke I. History, overview and applications of mediated lignolytic systems, especially laccase-mediator-systems(Lignozym®-process)[J]. J Biotechnol, 1997, 53:163-202.
[47]Brogioni B, Biglino D, Sinicropi A, et al. Characterization of radical intermediates in laccase-mediator systems. A multifrequency EPR, ENDOR and DFT/PCM investigation[J]. Physical Chemistry Chemical Physics, 2008, 10:7284-7292.
[48]Bertrand T, Jolivalt C, Briozzo P, et al. Crystal structure of a four-copper laccase complexed with an arylamine:insights into substrate recognition and correlation with kinetics[J]. Biochemistry, 2002, 41:7325-7333.
[49]Liu J, Cai Y, Liao X, et al. Efficiency of laccase production in a 65-liter air-lift reactor for potential green industrial and environmental application[J]. J Clean Prod, 2013, 39:154-160.
[50]司静, 崔宝凯, 戴玉成. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38:405-416.
[51]Quaratino D, Ciaffi M, Federici E, et al. Response surface methodology study of laccase production in Panus tigrinus liquid cultures[J]. Biochem Eng J, 2008, 39:236-245.
[52]Cambria M, Ragusa S, Ca labrese V, et al. Enhanced laccase production in white-rot fungus Rigidoporus lignosus by the addition of selected phenolic and aromatic compounds[J]. Appl Biochem Biotechn ol, 2010, 163(3):415-422.
[53]Liu L, Lin Z, Zheng T, et al. Fermentation optimization and characterization of the laccase from Pleurotus ostreatus strain 10969[J]. Enzyme Microb Technol, 2009, 44:426-4 33.
[54]Liu J, Wang ML, Tonnis B, et al. Fungal pretreatment of switchgrass for improved saccharification and simultaneous enzyme production[J]. Bioresour Technol, 2013, 135:39-45.
[55]D’Souza- Ticlo D, Sharma D, Raghukumar C. A thermostable metal-tolerant laccase with bioremediation potential from a marinederived fungus[J]. Mar Biotechnol, 2009, 11:725-737.
[56]Wang F, Hu JH, Guo C, et al. Enhanced laccase production by Trametes versi color using corn steep liquor as both nitrogen source and inducer[J]. Bioresour Technol, 2014, 166:602-605.
[57]Thurston CF. The structure and function of fungal laccases[J]. Microbiology, 1994, 140:19-26.
[58]Pointing SB, Jones EBG, Vrijmoed LLP. Opti mization of laccase production by Pycnoporus sanguineus in submerged liquid culture[J]. Mycologia, 2000, 92:139-144.
[59]Fenice M, Giovannozzi Sermanni G, Federici F, et al. Submerged an d solid-state production of laccase and Mn-peroxidase by Panus tigrinus on olive mill wastewater-ba sed media[J]. J Biotechnol, 2003, 100:77-85.
[60]Meza JC, Auria R, Lomascolo A, et al. Role of ethanol on growth, laccase production and protease activity in Pycno porus cinnabarinus ss3[J]. Enzyme Microb Technol, 2007, 41:162-168.
[61]Kuhar F, Papinutti L. Optimization of laccase production by two strains of Ganoderma lucidum using phenolic and metallic inducers[J]. Revista Argentina de Microbiología, 2014, 46:144-149.
[62]Jamroz T, Sencio B, Ledakowicz S. Efficiency of laccase biosynthesis in various types of fermenters[J]. J Biotechnol, 2007, 131S:S161.
[63]Galhaup C, Haltrich D. Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper[J]. Appl Microbiol Biotechnol, 2001, 56:225-232.
[64]Galhaup C, Wagner H, Hinterstoisser B, et al. Increased production of laccase by the wood-degrading basidiomycete Trametes pubescens[J]. Enzyme Microb Technol, 2002, 30:529-536.
[65]Sharma A, Thakur VV, Shrivastava A, et al. Xylanase and laccase based enzymatic kraft pulp bleaching reduces adsorbable organic halogen(AOX)in bleach effluents:A pilot scale stud y[J]. Bioresour Technol, 2014, 169:96-102.
[66]Eugenio ME, Santos SM, Carbajo JM, et al. Kraft pulp biobleaching using an extracellular enzymatic fluid produced by Pycnoporus sangui neus[J]. Bioresour Technol, 2010, 101:1866-1870.
[67]Alberts JF, Gelderblom WCA, Botha A, et al. Degradation of aflatoxin B1 by fungal laccase enzymes[]J[. Int J FoodMicrobiol, 2009, 135:47-52.
[68]Godoy-Navajas J, Aguilar-Caba llos MP, Gómez-Hens A. Automatic determination of polyphenols in wines using laccase and terbium oxide nanoparticles[J]. Food Chem, 2015, 166:29-34.
[69]袁海生, 戴玉成, 曹云, 等. 白腐真菌染料脱色菌株筛选及一色齿 毛菌脱色条件的研究[J]. 菌物学报, 2010, 29:429-436.
[70]Misra N, Kumar V, Goel NK, et al. Laccase immobilization on radiation synthesized epoxy functionalized polyethersulfone beads and their application for degradation of acid dye[J]. Polymer, 2014, 55:6017-6024.
[71]司静, 崔宝凯, 戴玉成. 东方栓孔菌在染料脱色中的应用及其脱色条件的优化[J]. 基因组学与应用生物学, 2011, 30:364-371.
[72]Liu J, Cai Y, Liao X, et al. Simultaneous laccase production and color removal by culturing fungus Pycnoporus sp. SYBC-L3 in a textile wastewater effluent supplemented with a lignocellulosic waste Phragmites australis[J]. Bull Environ Contam Toxicol, 20 12, 89:269-273.
[73]司静, 崔宝凯, 贺帅, 等. 微酸多年卧孔菌产漆酶条件优化及其在染料脱色中的应用[J]. 应用与环境生物学报, 2011, 26:130-137.
[74]Auriol M, Filali-Meknassi Y, Adams CD, et al. Removal of estrogenic activity of natural and synthetic hormones from a municipal wastewater:efficiency of horseradish peroxidase and laccase from Trametes versicolor[J]. Chem osphere, 2008, 70:445-452.
[75]Canfora L, Iamarino G, Rao MA, et al. Oxidative transformation of natural and synthetic phenolic mixtures by Trametes versicolor laccase[J]. J Agric Food Chem, 2008, 56:1398-1407.
[76]Shi L, Ma F, Han Y, et al. Removal of sulfonamide antibiotics by oriented immobilized laccase on Fe3O4nanoparticles with natural mediators[J]. J Hazard Mater, 2014, 279:2 03-211.
[77]Polak J, Jarosz-Wilkolazka A. Whole-cell fungal transformation of precursors into dyes[J]. Microb Cell Fact, 2010, 9:51.
[78]López J, Alonso-Omlin EM, Hernández-Alcántara JM, et al. Novel photoluminescent material by laccase-mediated polyme rization of 4-fluoroguaiacol throughout defluorination[J]. J Mol Catal B Enzym, 2014, 109:70-75.
[79]Gazme B, Madadlou A. Fabrication of whey protein-pectin conjugate particles through laccase-induced gelation of microemulsified nanodroplets[J]. Food Hydrocolloids, 2014, 40:189-195.
[80]Zhang GQ, Wang YF, Zhang XQ, et al. Purification and characterization of a novel l accase from the edible mushroom Clitocybe maxima[J]. Proc Biochem, 2010, 45:627-633.
[81]Kunamneni A, Camarero S, Garcia-Burgos C, et al. Engineering and applications of fungal laccases for organic synthesis[J]. Microb Cell Fact, 2008, 7:32.
[82]Liu J, Zeng L, Carrow RN, et al. Novel approach for alleviation of soil water repellency using a crude enzyme extract from fungal pretreatment of switchgrass[J]. Soil Res, 2013, 51:322-329.
[83]Zeng L, Liu J, Carrow RN, et al. Evaluation of direct application of enzymes to remediate soil water repellency[J]. HortScience, 2014, 49:662-666.
[84]Sidhu SS, Huang Q, Carrow RN, et al. Use of fungal laccases to facilitate biodethatching:a new approach[J]. HortScience, 2012, 47:1536-1542.
[85]Sidhu SS, Huang Q, Carrow RN, et al. Efficacy of fungal laccase to facilitate biodethatching in Bermud agrass and Zoysiagrass[J]. Agronomy Journal, 2013, 105:1247-1252.
(责任编辑 狄艳红)
A Review on Properties,Production,and Application of Fungal Laccases
LIU Jia-yang1,2JIAO Guo-bao2YOU Xiao-juan1LIAO Xiang-ru3SUN Li-peng2
(1. Department of Bioengineering,Huanghuai University,Zhumadian 463000;2. Henan Yangshao Biochemical Engineering Co. Ltd.,Sanmenxia 472400;3. School of Biotechnology,Jiangnan University,Wuxi 214122)
As one of copper-containing oxidoreductases,fungal laccase shows better thermal stability,higher metal tolerance and catalytic oxidative to substrates than bacterial or plant ones,and thereby draws great attentions on applications in industry,agriculture and environmental protection. It is widely considered that the factors limiting the extensive application of laccase are production scale,process cost as well as its properties. Laccase can be produced via solid or liquid state fermentation,and the latter is usually adopted for industrial purposes. Recent progress has expanded the novel applications of laccase in addition to its conventional uses such as dye decolorization,treating wastewater of dyeing and paper pulp bleaching. This paper reviews the published literatures in recent years while focusing on the production,properties,and application of fungal laccase.
white-rot fungi;laccase;fermentation;enzymatic properties;application
10.13560/j.cnki.biotech.bull.1985.2016.04.003
2015-06-14
黄淮学院引进人才科研项目(1000.12.10.1342)
刘家扬,男,博士,副教授,研究方向:酶的生产及应用;Email:liujiayang5@sohu.com
