一测多评法测定保健食品中6种大豆异黄酮类成分
2016-06-13李丽敏程益清杨盈盈毛秀红季申上海市食品药品检验所上海201203
李丽敏,程益清,杨盈盈,毛秀红,季申(上海市食品药品检验所,上海201203)
一测多评法测定保健食品中6种大豆异黄酮类成分
李丽敏,程益清,杨盈盈,毛秀红,季申
(上海市食品药品检验所,上海201203)
摘要:建立一测多评方法实现只用一个对照品同时测定保健食品中6种大豆异黄酮类成分的含量,以解决含大豆异黄酮类成分保健食品对照品昂贵不易获得的难题。样品经甲醇超声波辅助提取后,采用Waters XbridgeC18(150 mm× 4.6 mm,3.5μm)色谱柱,以2%乙酸和乙腈为流动相进行梯度洗脱,260nm并辅以DAD紫外检测器检测。通过5种待测成分与染料木苷的相对保留时间、DAD光谱及参照图谱完成待测成分确认;通过研究确立其他5种待测成分与染料木苷的校正系数进行含量测定,一定线性范围内得到不同浓度对照品在不同仪器、人员及色谱柱上的校正系数RSD为0.4%~3.5%;3批不同来源保健食品中6种大豆异黄酮类成分测定结果与常规外标法所得结果结果偏差为0.3%~5.8%;所建立的一测多评方法可用以大豆异黄酮及其相关保健食品的定量分析及质量评价方法。
关键词:一测多评;含量测定;高效液相色谱;大豆异黄酮;保健食品
大豆异黄酮(Soybean isoflavones,ISO)是从大豆中提取分离的一类具雌激素作用的活性成分,属黄酮类化合物中异黄酮类成分[1-2],具有抗癌、抑制生物体内产生的活性氧等功能,在癌症预防、保护心血管系统、改善和预防妇女更年期综合症等方面具有独特作用[3],近年来在保健食品领域应用较广[4-5]。
大豆异黄酮包括染料木素、大豆黄素和黄豆黄素及其7-O-葡萄糖苷衍生物共12种[1],用于保健食品原料的大豆异黄酮多含有大豆苷、黄豆黄素、染料木苷、大豆素、黄豆黄素苷元、染料木素6种成分,目前保健食品国家标准(GB/T23788-2009《保健食品中大豆异黄酮的测定方法高效液相色谱法》)中保健食品大豆异黄酮成分的检测方法为高效液相色谱法测定上述6种成分[6],但实际由于市场供应的高纯度标准品价格昂贵且不易获得,同时测定6种成分时不仅提高检测成本且降低检测效率。有研究者曾采用对照品替代法测定6种大豆异黄酮类成分,但其待测成分确认需采用质谱方法,分析成本较高[7]。“一测多评”法(quantitative analysis of multi-components by singlemarker,QAMS)是近年来中药领域用于多成分质量控制的研究思路,它运用同系列成分间存在的内在函数比例关系,采用单个易获得的对照品对多个成分进行定量,实现多个成分(对照品没有或难以供应)的同步监控,目前已用于解决中药质量控制中缺乏对照品这一瓶颈问题[8-9]。
本研究以染料木苷对照品为参照,采用高效液相色谱与二极管阵列检测技术,通过确定准确的待测成分指认参数和校正系数,建立了保健食品中大豆异黄酮类成分的一测多评测定方法,实现以一种对照品同时测定6种大豆异黄酮类成分,达到降低检验成本、提高检测效率的目的,可为含大豆异黄酮类保健食品的质量控制提供技术方案。
1 仪器与试药
Agilent 1100液相色谱仪:安捷伦科技有限公司;乙腈、甲醇(色谱纯):Merck公司;乙酸(分析纯):上海化学试剂有限公司。
大豆苷、黄豆黄苷、染料木苷、大豆素、黄豆黄素苷元和染料木素等对照品均购自中国食品药品检定研究院、北京百灵威科技有限公司和上海同天生化生物科技有限公司。
收集3个不同来源的市售大豆异黄酮类保健食品(见表1),方法学验证均采用样1作为研究对象。
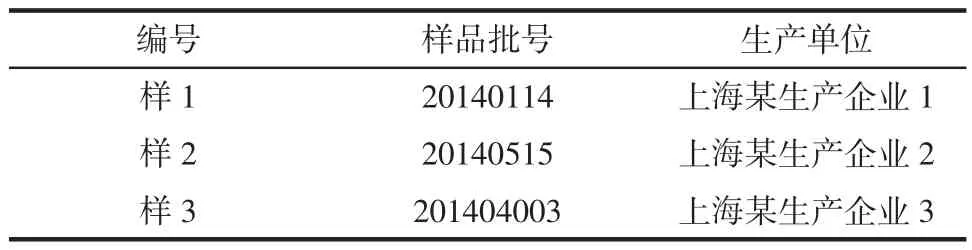
表1 样品来源及批号Table 1 The source and batch of samples
2 方法与结果
2.1对照品溶液的制备
取大豆苷、黄豆黄苷、染料木苷、大豆素、黄豆黄素苷元、染料木素对照品适量,配置成系列标准曲线溶液用以方法学研究。
另取染料木苷适量,加甲醇制成每1mL含染料木苷20 μg/mL的对照品溶液,用于一测多评法含量测定。
2.2供试品溶液的制备
取供试品粉末约0.2g,精密称定,置50mL量瓶中,加入甲醇适量,超声30 min使溶解,取出,放冷,用甲醇定容至刻度,摇匀,离心,取上清液,作为供试品溶液。
2.3色谱条件与分析方法
色谱柱:Waters XbridgeC18色谱柱(150mm×4.6mm,3.5 μm,沃特世科技有限公司),柱温:25℃,检测波长260 nm;以乙腈为流动相A,2%乙酸为流动相B,按表2进行梯度洗脱;分别精密吸取对照品溶液和供试品溶液各5 μL进样分析。在此条件下,不同来源样品中6种待测成分分离以及其与样品中其他杂质峰分离符合要求,见图1。

表2 流动相梯度洗脱表Table 2 The list of mobile phase gradient elution
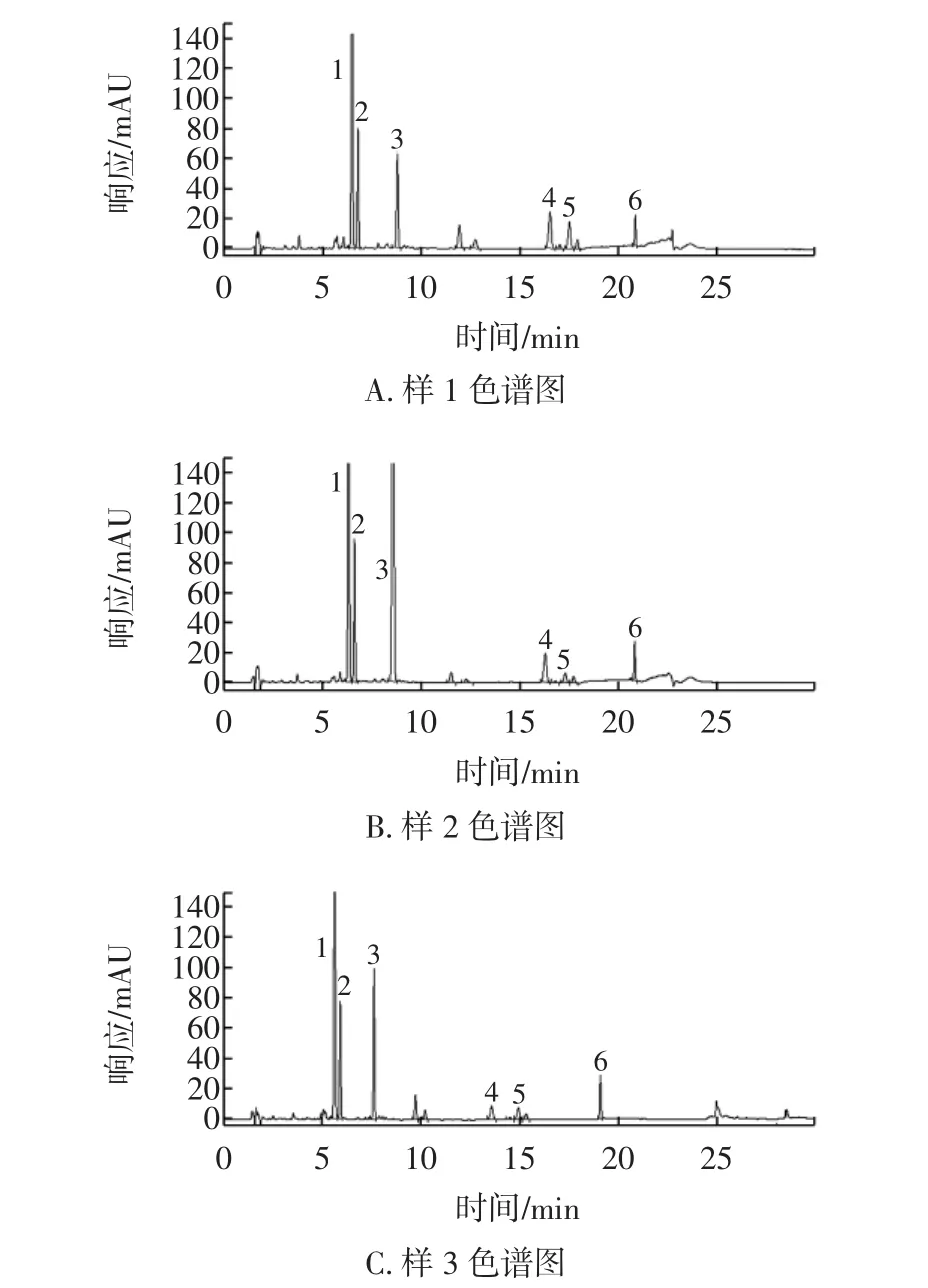
图1 保健食品中大豆异黄酮类分析色谱图Fig.1 HPLC chromatogram of ISO in health food
2.4方法学考察
2.4.1线性关系考察
分别吸取6种大豆异黄酮对照品混合溶液,配置系列浓度,按照既定方法进样分析,测定峰面积,以各成分的峰面积为纵坐标,含量为横坐标,绘制标准曲线,结果表明,在给定范围内线性关系良好,见表3。
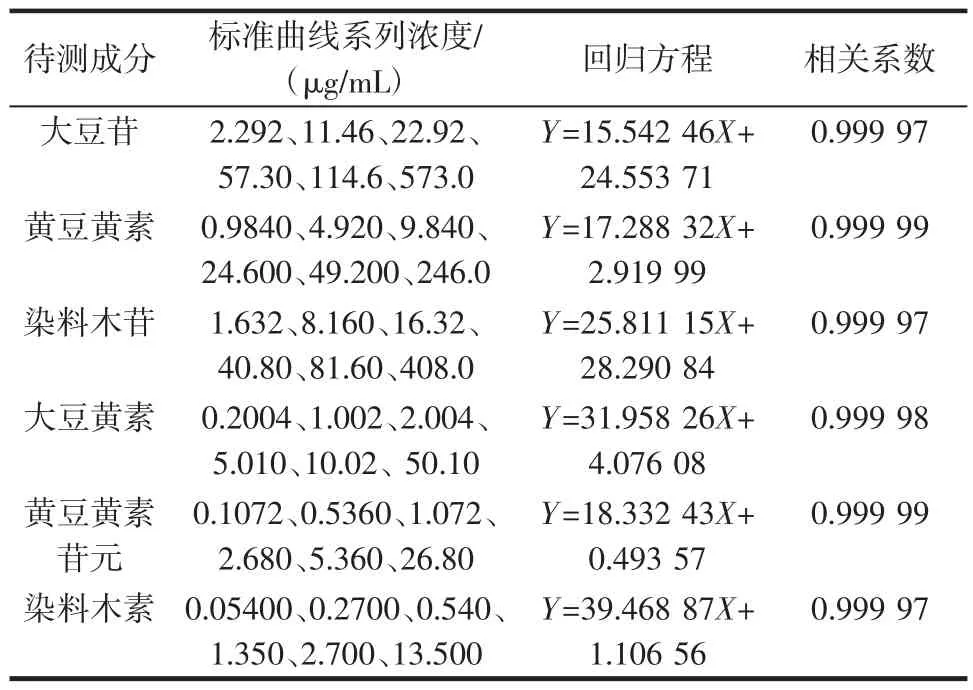
表3 大豆异黄酮类成分线性关系及范围Table 3 Regressive equation and liner of six ISOs
2.4.2重复性试验
取样1内容物粉末0.2 g,一式6份,按照2.2项,分析平行操作6份样品中各待测成分含量及其RSD,考察方法重复性。结果表明方法重复性较好。
2.4.3供试品溶液的稳定性
取制备好的供试品溶液,分别于不同时间进样,比较一定放置时间内各成分分面积变化,考察供试品溶液的稳定性,结果表明测定24 h内6种大豆异黄酮类成分峰面积RSD小于1%,供试品溶液在24 h内稳定。
2.4.4准确度试验
取样1粉末0.1 g,精密称定,一式9份,置50 mL量瓶中,分别按照样品中含有的大豆异黄酮类成分的80%、100%、120%精密加入混合对照品,作为低、中、高3种浓度加样回收试验,每个浓度点各3份,按照
2.2项下分析,进行低、中、高3个浓度水平的准确度试验,结果表明见表4。
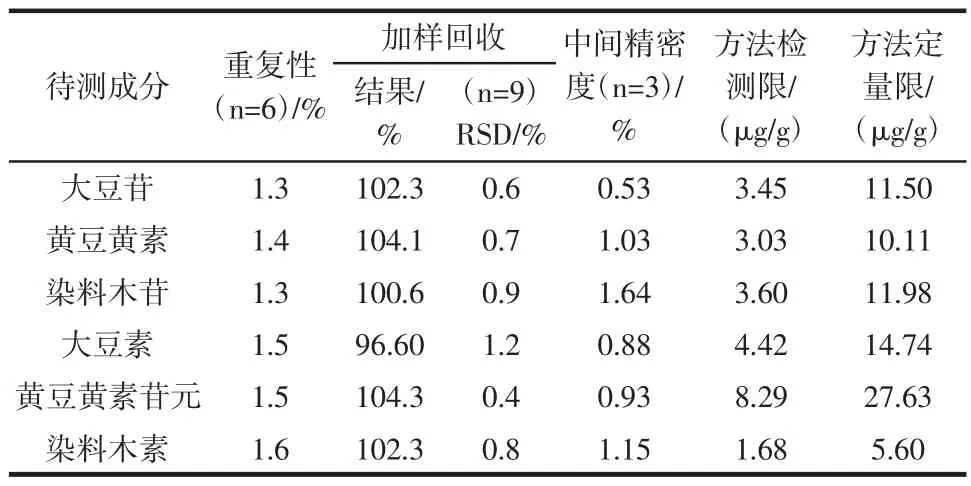
表4 方法学试验结果Table 4 The result of method validation
供试品中6种待测成分的加样回收率均在95%~105%之间,方法准确可靠。
2.4.5检测限与定量限
取经一定比例稀释后混合对照品,进样,计算各色谱峰信噪比,以3倍和10信噪比时分别作为最低检测限和最低定量限;再按照供试品含量计算公式分别计算得出方法最低检出限及方法最低定量限(定容体积50 mL,称样量0.2 g),结果见表4。
2.4.6中间精密度
采用不同仪器、不同色谱柱,由不同人员按照拟订的方法进行试验,考察方法的中间精密度,评价方法耐用性,结果表明,既定条件下,方法耐用性较好。2.4.7一测多评方法研究
染料木苷对照品易获得,且其出峰时间适中,故以染料木苷作为参照峰,以相对保留时间进行其他色谱峰确认,通过确定待测成分与染料木苷的校正系数,计算待测成分含量。
2.4.7.1相对保留时间及待测成分确认研究
采用不同液相色谱及不同品牌色谱柱考察6种待测成分保留时间,以染料木苷为参照计算相对保留时间,结果见表5。
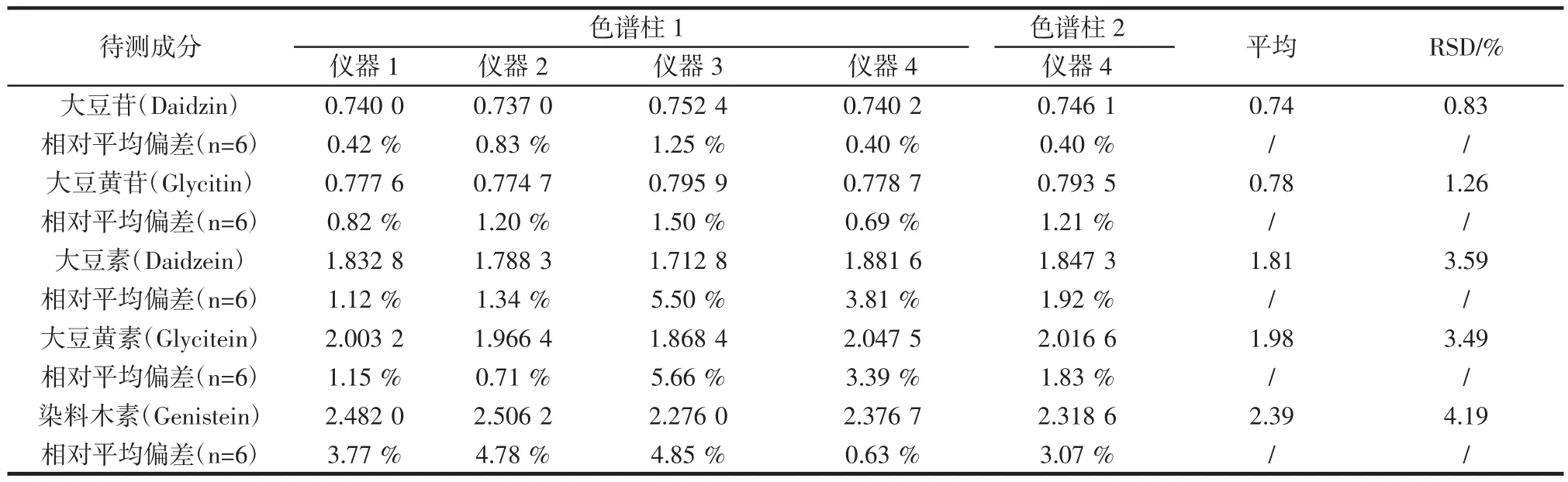
表5 相对保留时间结果Table 5 The result of relative retention time
待测成分的相对保留时间较稳定,RSD均小于5%,以不同条件得到的平均相对保留时间,并设定10%的偏差范围,可作为待测成分确认指标。
2.4.7.2校正系数的确定
分别由两位分析人员对收集到的2个不同来源的6种大豆异黄酮对照品按照低、中、高浓度范围的配置4组标准系列溶液(每组n=6);分别在不同仪器、不同色谱柱等条件下分析,得出各待测成分校正因子,计算其与染料木苷的校正系数。最终得到108个数据,采用依拉格法进行可疑值的剔除,计算平均值(X)及样本总体标准偏差(SD),以X±3SD为可信范围,超出即为可疑值,予以剔除,结果表明108个数据中无可疑值,说明分析中得到的校正系数误差较小,最终以平均值作为一测多评方法含量计算校正系数,见表6。
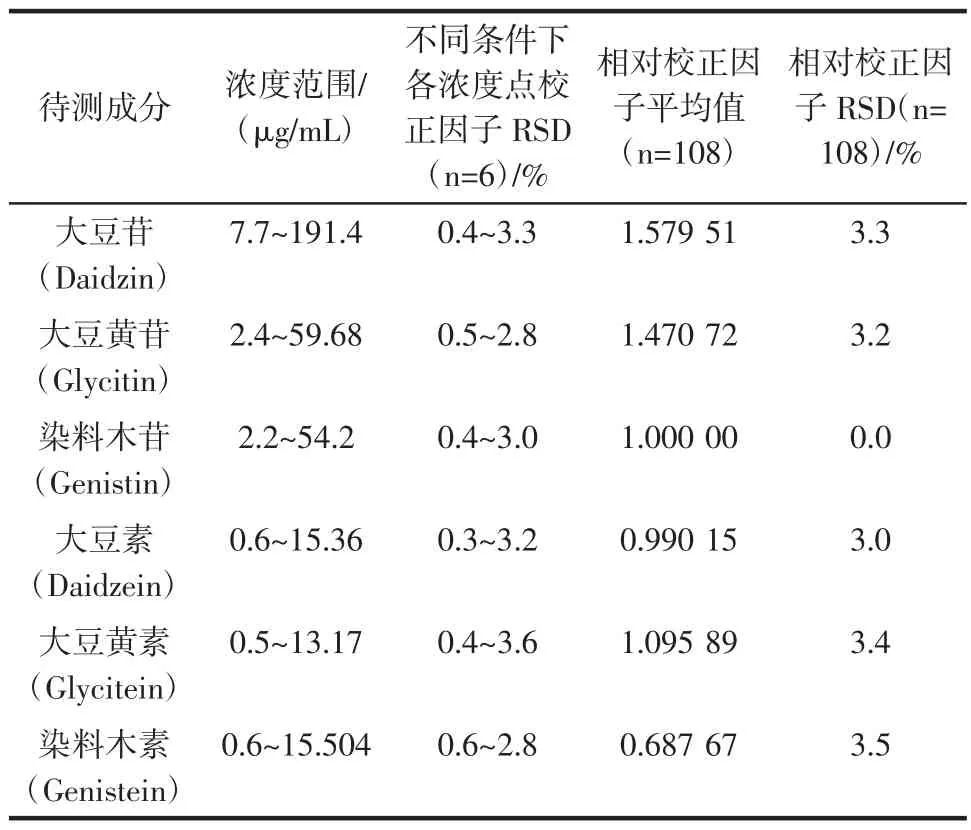
表6 校正系数测定结果Table 6 The result of the correction coefficient
2.4.7.3一测多评方法准确性验证
3批样品中按照确定的校正系数计算6种大豆异黄酮含量,并与常规对照品法进行比较,验证一测多评校正系数准确性,结果表明一测多评计算结果与对照品法接近,偏差小于6%,见表7。
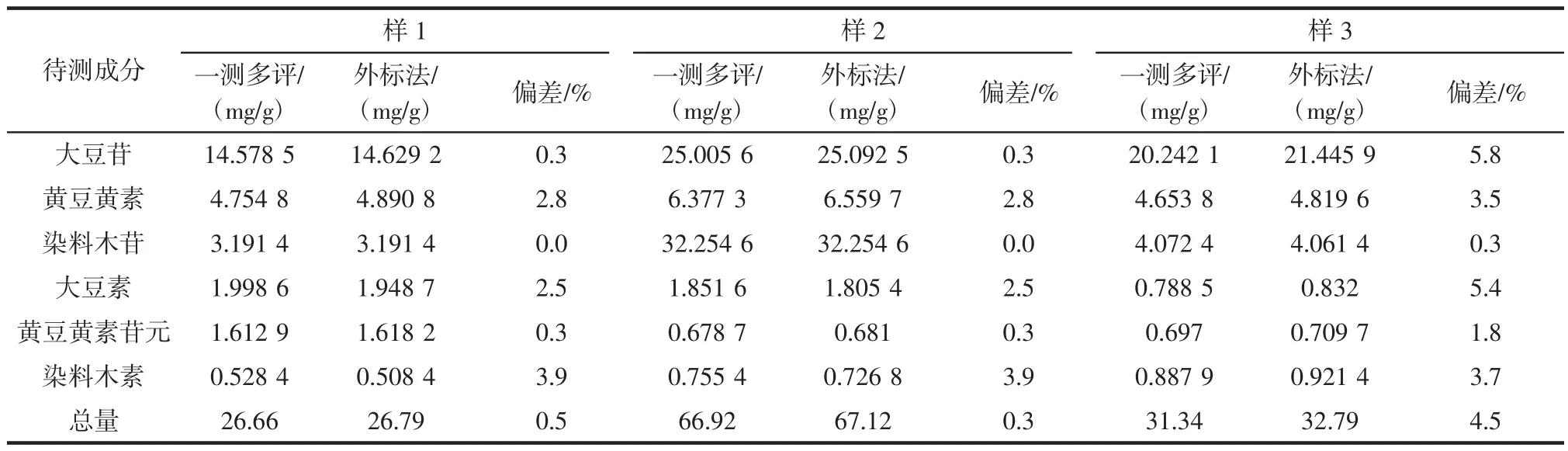
表7 一测多评法与常规对照品法结果比较Table 7 Comparison of contents of ISO in health foods by two methods
3 讨论
3.1一测多评方法研究的影响因素
一测多评方法应用时通过与参照物的相对保留时间进行待测成分指认,保留时间受色谱柱、仪器等因素影响较大,因此建立方法时应全面考察影响因素,并对保证方法耐用性的参数进行明确[10]。
3.1.1相对保留时间及准确待测成分指认
考察了不同色谱柱及仪器,结果表明必需明确规定色谱柱填料、粒度、长度、粒径等参数,才能保证既定条件下相对保留时间在一定范围内稳定;研究中发现大豆苷与大豆黄苷、大豆素与大豆黄素的相对保留时间范围交叉覆盖,仅相对保留时间指标难以精确指认待测峰,因此需给出方法参照图谱,以便给分析人员明确待测成分色谱峰出峰顺序及其与杂质峰分离情况,同时结合DAD光谱图信息在245 nm~265 nm具有最大吸收峰的条件设置,可准确确定待测成分。
3.2校正系数
待测成分校正系数需要大量全面的数据考察,对照品来源、纯度、不同浓度、人员配置偏差等可能会带来的误差均会影响最终结果,进而影响方法准确性,同时仪器、色谱柱等因素也可能带来一定偏差,因此研究中全面考虑各种因素可能带来的误差,考察了不同来源、不同浓度、不同人员、不同仪器和不同色谱柱的校正系数,得到较为全面的试验数据,进行统计分析,以确保方法耐用性和准确性。
3.2一测多评方法应用的实际意义
目前有关大豆异黄酮含量测定共均采用对照品外标法测定测定6种大豆异黄酮类成分[6,11],但大多数保健食品企业由于对照品昂贵、不易获得,在企业标准中仅设定其中1种成分限量,个别企业最多也仅设定大豆苷、大豆素,染料木苷和染料木素4种成分;大豆异黄酮成分不同致使性质有所差异,进而其在体内作用也会有所不同[12],对照的不易获得制约了产品质量控制设定合理质控指标,一测多评方法的建立可为各生产企业在其质量标准中明确规定大豆异黄酮类成分的含量限度提供方法依据,利于甄别产品质量优劣和进行质量控制。
参考文献:
[1]李小满.大豆异黄酮分子结构、生物活性及其市场现状[J].中国食品添加剂,2002(2):66-71
[2]梅忠,孙健,孙恺,等.大豆异黄酮的保健功效、生物合成及种质发掘与遗传育种[J].核农学报,2014,2(7):1208-1213
[3]郭小虎,代晓曼,张波.大豆异黄酮的生物活性剂毒理学研究进展[J].大豆科学,2011,30(4):693-696
[4]宛超,徐海滨,刘珊,等.我国大豆异黄酮保健食品的概况分析[J].华南预防医学,2008,24(5):30-33
[5]邵剑钢,段奇,李晓莉.大豆异黄酮在军用功能食品中的应用[J].食品研究与开发,2015,36(1):145-147
[6]中华人民共和国国家质量监督检验检疫总局,中国国家标准管理委员会.GB/T 23788-2009保健食品中大豆异黄酮的测定方法高效液相色谱法[S].北京:中国标准出版社,2009:1-14
[7]魏锋,李启艳,马玲云,等.对照品替代法同时测定中药和保健食品中6种大豆异黄酮类成分的含量[J].药物分析杂志,2009,9 (5):725-730
[8]王智民,高慧敏,付雪涛,等.“一测多评”法中药质量评价模式方法学研究[J].中国中药杂志,2006,31(23):1925-1928
[9]罗祖良,仇峰,韦日伟,等.相对校正因子在中药多指标测定中的应用研究进展[J].中草药,2012,43(7):1448-1452
[10]王智民,钱忠直,张启伟,等.一测多评法建立的技术指南[J].中国中药杂志,2011,36(6):657-658
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准管理委员会.GB/T 26625-2011粮油检验大豆异黄酮含量测定高效液相色谱法[S].北京:中国标准出版社,2011:1-9
[12]井乐刚,张永忠.大豆异黄酮及其在保健食品中的应用[J].生命的化学,2002,22(4):379-381
A Quantitative Method Using One Marker for Simultaneous Assay of Soybean Isoflavones in Health Food
LI Li-min,CHENG Yi-qing,YANG Ying-ying,MAO Xiu-hong,JI Shen
(Shanghai Institute for Food and Drug Control,Shanghai 201203,China)
Abstract:A quantitative analysis method of multi-components with single marker(QAMS)was established and validated to simultaneously determine six Soybean isoflavones(ISO)in health foods,which can solve the dilemma of natural chemical reference substances are expensive and unavailable. The samples were ultrasonicassisted extracted with methanol,the column was Waters XbridgeC18(150 mm×4.6 mm,3.5 μm),using 2% acetic acid and acetonitrile as the mobile phase with gradient elution,260 nm and with DAD detection was used. The component to be measured were confirmed by DAD spectrum,reference chromatogram and the relative retention time of genistin. The relative correction factors(RCF)of the other five soybean isoflavones were determined within the linear ranges,the RCF had a good reproducibility in various instruments,chromatographic columns(RSD = 0.4%-3.5%). According to their RCF,six ISO in health food could be quantified.The results of QAMS method were validated by comparing with that of external standard method by quantified three different sources of health food,and the relative average deviation of the two method were 0.3%-5.8%. The method can be used for the quantitative analysis and quality evalution for ISOs and its related health food.
Key words:quantitative analysis method of multi-components with single marker(QAMS);assay;HPLC;soybean isoflavones(ISO);health food
DOI:10.3969/j.issn.1005-6521.2016.09.040
作者简介:李丽敏(1975—),女(汉),副主任药师,硕士,主要从事中药及保健食品检测方法及质量标准研究。
收稿日期:2015-03-10
