富硒紫色马铃薯多酚类组成及主要微量元素分析
2016-06-13姚兰雷灿艾训儒湖北民族学院湖北省生物资源保护与利用重点实验室湖北恩施445000湖北民族学院林学园艺学院湖北恩施445000
姚兰,雷灿,艾训儒,*(1.湖北民族学院湖北省生物资源保护与利用重点实验室,湖北恩施445000;2.湖北民族学院林学园艺学院,湖北恩施445000)
富硒紫色马铃薯多酚类组成及主要微量元素分析
姚兰1,2,雷灿1,2,艾训儒1,2,*
(1.湖北民族学院湖北省生物资源保护与利用重点实验室,湖北恩施445000;2.湖北民族学院林学园艺学院,湖北恩施445000)
摘要:研究紫色马铃薯的总多酚主要组分和快速定量检测方法,紫色马铃薯的总多酚主要包括绿原酸、花青素和咖啡酸,其中除花青素以外的总多酚可以采用绿原酸为对照品在325nm处直接测定,方法简单易行,准确度高,回收率在97.67%~103.15%;并针对硒元素对紫色马铃薯酚类化合物如绿原酸、咖啡酸和花青素的代谢积累进行研究,结果表明,硒元素显著的促进了紫色马铃薯的绿原酸、咖啡酸和花青素以及有益微量元素有机硒元、锌和铁的积累;因此富硒紫色马铃薯是一种更好的功能食品。
关键词:紫色马铃薯;多酚类;硒;锌;铁
作为一种重要的功能食品,酚类化合物是马铃薯的主要功能成分,紫色马铃薯块茎中的花青素是紫色马铃薯的特征性功能成分[1]。花青素具有抗氧化[2-4]、抗肿瘤[5]和保护肝脏[6]等方面的功效,易被人体吸收[7],与普通马铃薯相比,紫色马铃薯更具保健价值。目前,在欧洲、北美和很多东南亚国家,紫色马铃薯被广泛食用。
硒是一种微量元素,是硒蛋白和很多重要酶类如GSH-Px和脱氢酶的组成成分。硒元素有抗氧化[8]、抗癌[9]、提高免疫力[10]以及抗HIV病毒[11]等生理功能。硒元素的生物活性有赖于其化学形式,与无机硒相比有机硒如硒代蛋氨酸和甲基化硒代半胱氨酸显示出了更强的抗癌活性[12]。许多植物具有吸收转化无机硒为有机硒的能力[13],那么耐硒植物也就能被用作硒强化剂。事实上,富硒食品的保健价值还取决于硒元素能促进植物体内很多活性物质的合成与积累[14]。据有关研究表明,硒元素可以促进马铃薯内碳水化合物、有机硒、总氨基酸的积累,提高马铃薯的抗氧化能力和光合作用能力[15-19]。不过目前,尚未见富硒的紫色马铃薯研究报道。本文检测了硒元素对紫色马铃薯块茎生长、酚类物质和花青素合成两方面的影响作用。
1 材料和方法
1.1试剂和仪器
PS-40超声波清洗机(40kHz,240 W):深圳洁泰超声洗净设备有限公司;UV-752紫外可见分光光度计:上海佑科仪器仪表有限公司;STI501高效液相色谱仪:杭州赛智科技有限公司,包括N2000色谱工作站,STI501泵,STI501紫外检测器以及C18硅胶色谱柱(4.6 mm×250 mm,江苏汉邦科技有限公司)。
1.2富硒栽培
栽培基质:粉碎的珍珠岩过40目筛,用纯水洗净再烘干。
硒-MS培养液:将亚硒酸钠添加于MS无机培养液中,设置0、10、20、30、40、50 mg/kg 6个硒浓度梯度;按0.15 kg硒-MS培养液/1.0 kg干燥珍珠岩粉末混匀配制成富硒基质。种薯栽种于富硒基质内,置于室外,加盖玻璃罩防雨,施加蒸馏水保湿。经151 d生长期后收获块茎,洗净称重,用于检测分析。
1.3多酚类物质和微量元素的分析检测
主要酚类物质的分离和鉴定:取紫色马铃薯块茎称重切片,用50%乙醇研磨,再经超声提取0.5 h后离心取上清液得到粗提物。将粗提物置于190 nm~1 100nm范围内紫外扫描,对多酚类物质进行初步检测(图1),主吸收峰在325.5 nm和535.5 nm处,表明粗提物中的多酚类物质可能是花青素、绿原酸或其衍生物。
用乙酸乙酯萃取去除花青素的紫外吸收干扰,再在190 nm~1 100 nm范围内紫外扫描,主吸收峰在325.5 nm处(图2)。以液相色谱分离多酚,乙腈为流动相A(1.0%醋酸为流动相B),按0~18 min 15%~60%,18 min~20 min 60%~100%,柱温25℃,进样20 μL,流速1.0 mL/min,检测波长为325 nm,以绿原酸和咖啡酸标准品作对照,对分离的单一组分进行鉴定。
总酚类物质的定量分析:以绿原酸为检测总酚类物质的标准品。将绿原酸溶于50%乙醇中,在325 nm检测波长下,以1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00 μg/mL为浓度梯度获得标准曲线方程。紫色马铃薯块茎50%乙醇提取物中多酚的检测采用分光光度法在325 nm处直接测定,根据该标准方程计算多酚类的含量。
花青素的定量分析参照文献报道的方法进行[1]。
微量元素检测分析:取新鲜紫色马铃薯块茎切片,经60℃真空干燥后打粉,粉末过40目筛,称取500 g干燥粉末送湖北省农科院质检所分析硒元素、锌元素和铁元素含量。
2 结果
2.1紫色马铃薯内主要酚类物质:绿原酸、花青素、咖啡酸
溶于70%乙醇的紫色马铃薯块茎粗提物经紫外扫描后,主吸收峰出现在325.5 nm和535 nm(图1)。325.5 nm可能为绿原酸或咖啡酸的吸收峰,535.5 nm为花青素的特征吸收峰。
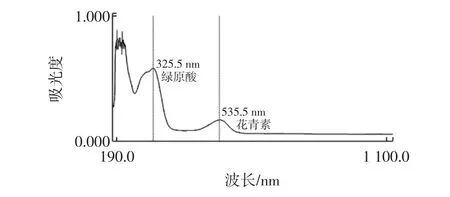
图1 紫色马铃薯50%乙醇提取物全波长扫描光谱Fig.1 UV-visible spectra of 50%ethanol extract of purple potato tubers
将提取液用乙酸乙酯萃取去除花青素和黄酮类化合物之后再进行全波长扫描,其主要吸收峰仍旧在325.5 nm处(图2),这表明总多酚中主要组分可能是绿原酸。
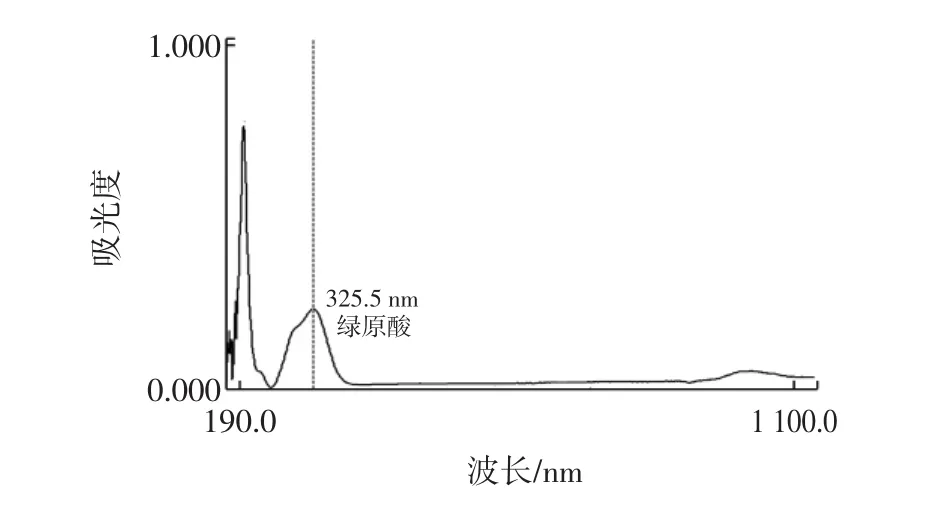
图2 紫色马铃薯50%乙醇提取物取出花青素后全波长扫描光谱Fig.2 UV-visible spectra of purple potato extract by 50%ethanol and ethyl acetate
乙酸乙酯萃取后的粗提物在325 nm处经高效液相色谱仪分离,以绿原酸和咖啡酸作对照,其主要组分为绿原酸,其次是少量的咖啡酸(图3)。由此可知,紫色马铃薯的主要多酚类成分为绿原酸和咖啡酸。
2.2紫色马铃薯的多酚类可以直接定量分析
以绿原酸为标准品制作标准曲线方程:Y=0.7623X+ 0.0459,R2=0.9998,Y是吸光度,X是绿原酸浓度(μg/mL)在绿原酸标准曲线的基础上,以紫色马铃薯块茎的50%乙醇提取液作为直接测定的溶液。如表1所示,加标回收率97.76%~103.15%,精密度和准确度(intra-和inter-run)分别是0.49%~0.75%,1.17%~1.32% 和98.1%~97.3%,91.71%~95.33%,表明此检测方法对总酚类的量化检测是准确适宜的。本文以此方法定量分析紫色马铃薯的总多酚含量。
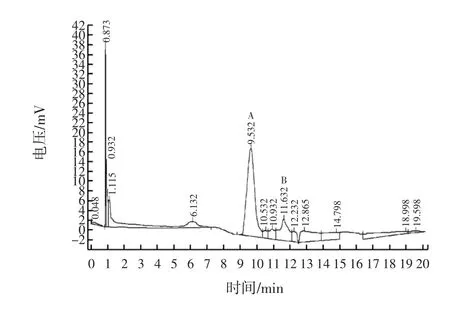
图3 紫色马铃薯50%乙醇提取液去除花青素后HPLC分离(检测波长325nm,A=绿原酸;B=咖啡酸)Fig.3 HPLC separation of purple potato extract with 50%ethanol and ethyl acetate
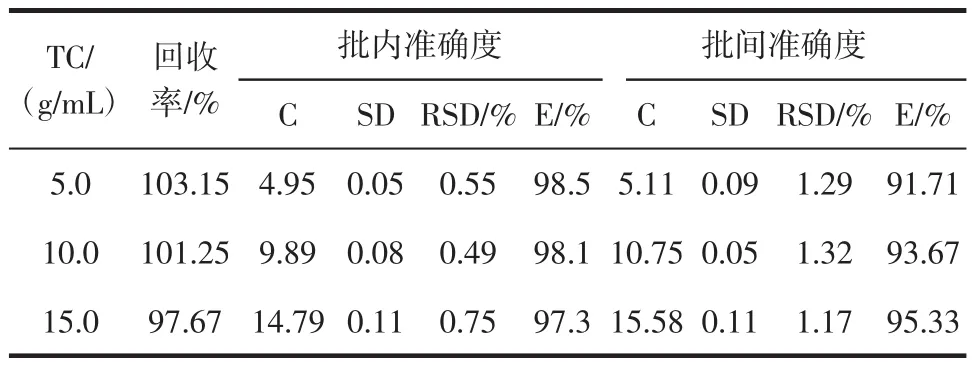
表1 紫色马铃薯总多酚分析方法的回收率、精确度和准确度Table 1 Recovery,precision and accuracy analysis on total phenolics
2.3硒元素提高花青素、绿原酸及总多酚的含量
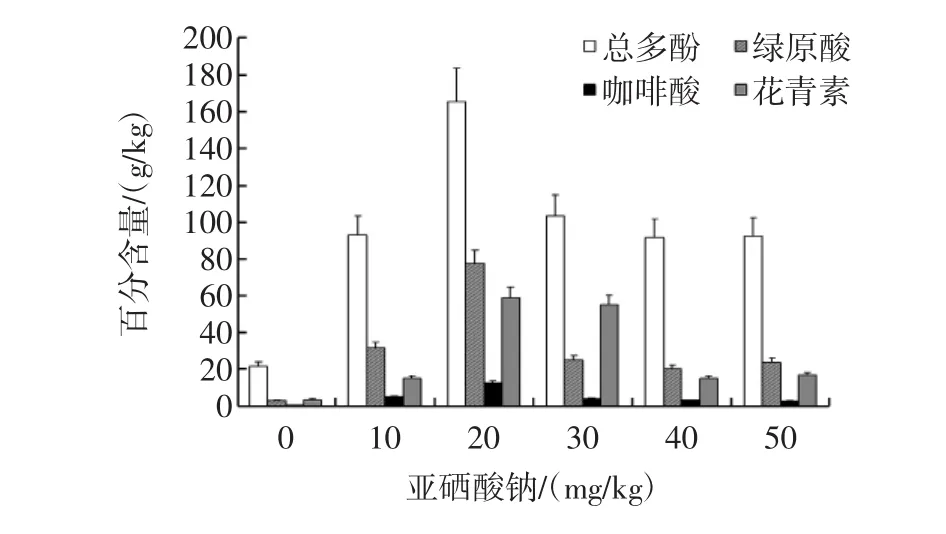
图4 硒元素对紫色马铃薯块茎多酚类物质积累的促进作用Fig.4 Concentrations of phneolics of purple potato tubers from different selenium cultivation
从图4可以看出,硒元素显著地促进了紫色马铃薯块茎总酚类物质(P=0.016)和绿原酸、咖啡酸、以及花青素(P<0.05)的积累,其中,硒元素对绿原酸积累的促进作用最为明显,这种促进作用在硒浓度为20 mg/kg处达到最大。该研究结果跟我们前期报道的结果相一致[14]。
2.4低浓度的硒元素促进有益微量元素的吸收
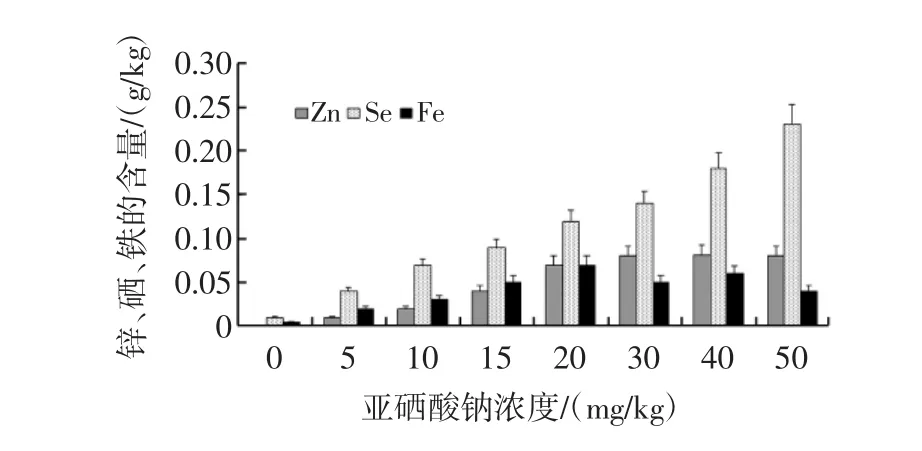
图5 紫色马铃薯块茎的微量元素分析Fig.5 Trace minerals of purple potato tubers from different selenium cultivation
如图5所示,在0~50 mg/kg的硒浓度范围内,紫色马铃薯块茎的硒元素积累与栽培基质的硒浓度呈现出极显著的正相关性,这表明紫色马铃薯具有很强的耐硒能力,也是一种很好的富硒食品;在较低的硒浓度范围内(5 mg/kg~20 mg/kg),铁元素与硒元素的积累呈现正相关,但是20 mg/kg之后,铁元素开始有所下降,说明,高浓度的硒元素对铁的吸收有一定的抑制作用;在5 mg/kg~30 mg/kg的硒浓度范围内,锌元素的积累呈现出硒元素依赖性,超过30 mg/kg后,锌元素的积累增加缓慢。
3 讨论
3.1紫色马铃薯块茎所含主要酚类的组成与含量
据报道[20],普通马铃薯块茎所含有的酚类化合物包括1-O-咖啡酰奎宁酸,3-O-咖啡酰奎宁酸,5-O-咖啡酰奎宁酸(绿原酸)。在本试验中,紫色马铃薯块茎粗提物中去除花青素之后所含的酚类物质经液相色谱分析鉴定,主要为绿原酸和咖啡酸。以绿原酸为标准品,在325 nm处,可对粗提物中的酚类组分直接量化检测。
有研究报道[21],在普通马铃薯的块茎中,绿原酸是主要的多酚类成分,普通马铃薯块茎的总多酚可以以绿原酸为标准品采用分光光度法直接测定。在本文中,去除花青素之后的紫色马铃薯块茎的总多分提取物的主要多酚类成分是绿原酸和咖啡酸,以绿原酸为主,采用绿原酸做标准品可以准确地测定总多酚的含量。多酚类物质易被人体吸收,绿原酸可抗癌[22],保护神经[23];咖啡酸有抗神经毒素[24]和抗病毒[25]等功效;花青素是一种抗氧化活性极强的水溶性多酚类,在人体内吸收效率高[7],具有抗癌保肝等功效[2-6],因此,与普通马铃薯相比,紫色马铃薯含有更多的功能性成分,是一种良好的功能食品。近些年来,我国紫色马铃薯日益受到消费者的青睐和食品界的重视,紫色马铃薯的种植面积也逐渐扩大。
3.2硒元素增加紫色马铃薯块茎中多酚类物质含量
本试验中,硒元素对块茎总酚类、花青素和绿原酸、咖啡酸的积累都有显著的促进作用,这种促进效应在0~20 mg/kg硒浓度范围内呈现正相关。但是在20 mg/kg之后,多酚类物质的积累不再上升,因此在紫色马铃薯的生产中,需严格控制硒肥的施入量以获得更多的酚类物质。紫色马铃薯块茎以花青素为特征性功能成分,花青素含量越高,其食用价值越高,因此生产高含量花青素的紫色马铃薯是紫色马铃薯产业的一个关键技术。有研究证明,较低的温度和较高的海拔有利于花青素的积累[26]。高海拔的主要气候特征为低温低热量和强紫外线,在花青素的代谢途径中,黄酮类化合物是花青素生物合成的前体,而黄酮类化合物具有抵抗紫外线保护植物叶片组织的作用。因此紫外线可以显著促进黄酮类化合物的积累[27],其结果导致花青素的代谢积累增加;此外,紫外线导致植物体内氧化压力增强[28],而花青素的主要生理功能之一就是抗氧化作用,这也可能是紫外线导致花青素积累的机制之一。在我国紫色马铃薯的主产地主要分布在青海和云南两个高原地区,其他地区也有零星栽培,地栽培地点也是大多分布在高原或高山,这说明低温和强紫外线是紫色马铃薯的花青素代谢积累的关键因素。
在本研究中,硒元素显著促进了紫色马铃薯和多酚类和花青素的代谢积累,因此硒元素也成为紫色马铃薯花青素积累的另一个关键因素,其生理机制尚待进一步研究。
3.3硒元素提高有益微量元素的含量
从图5可以看出,硒元素显著地提高了紫色马铃薯块茎的硒含量、锌含量和铁含量,这表明在紫色马铃薯块茎内,硒元素和锌、铁元素之间存在着互相促进吸收的作用。大量的科学研究证明,锌元素是人体必须的微量元素,对人体生长激素的合成和生长发育至关重要;铁元素是人体需求量最大的微量元素,缺铁导致贫血。本研究证明,富硒紫色马铃薯含有更多的锌元素和铁元素,所以紫色马铃薯既是良好的补硒食品,也是补充锌和铁的功能食品。
4 结论
紫色马铃薯块茎内所含有的主要酚类物质为绿原酸、咖啡酸和花青素。块茎中的总酚类物质以绿原酸为标准品,可以直接在325 nm处直接检测含量。硒元素对块茎的多酚类的积累有显著促进作用,而且还能够提高有益微量硒、锌、铁的含量,因此富硒紫色马铃薯可能作为更具有保健价值的功能食品。
参考文献:
[1]Jansen G,Flamme W. Coloured potatoes(Solanum tuberosum L.)-anthocyanin content and tuber quality. Genet. Resour[J]. Crop Ev,2006,53(7):1321-1331
[2]Steed L E,Truong V D. Anthocyanin Content,Antioxidant Activity,and Selected Physical Properties of Flowable Purple-Fleshed Sweet potato Purees[J]. J Food Sci,2008,73(5):215-221
[3]Han K H,Matsumoto A,Shimada K. Effects of anthocyanin-rich purple potato flakes on antioxidant status in F344 rats fed a cholesterol-rich diet[J]. Brit J Nutr,2007,98(5):914-921
[4]Brown C R,Culley D,Bonierbale M,et al. Anthocyanin,carotenoid content,and antioxidant values in native South American potato cultivars[J]. Hortsci,2007,42(7):1733-1736
[5]Kazuya H,Hiroshige H. Induction of apoptosis in cultured human stomach cancer cells by potato anthocyanins and its inhibitory effects on growth of stomach cancer in mice[J]. Food Sci Technol Res,2006,12(1):22-26
[6]Han K H,Sekikawa M,Shimada K. Anthocyanin-rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in rats[J]. Brit J Nutr,2006,96(6):1125-1134
[7]Harada K,Kano M,Takayanagi T. Absorption of acylated anthocyanins in rats and humans after ingesting an extract of Ipomoea batataspurplesweetpotatotuber[J]. BiosciBiotechnolBiochem,2004,68(7):1500-1507
[8]Wong Y Y,Moon A,Duffin R,et al. Cordycepin inhibits protein synthesis and cell adhesion through effects on signal transduction [J]. J Biol Chem,2010,285(4):2610-2621
[9]Tara F,Rayman M P,Boskabadi H. Prooxidant-antioxidant balance in pregnancy:a randomized double-blind placebo-controlled trial of selenium supplementation[J]. Perinat Med,2010,38(5):473-478
[10]Ramoutar R R,Brumaghim J L. Antioxidant and anticancer properties and mechanisms of inorganic selenium,oxo-sulfur,and oxo-selenium compounds[J]. Cell Biochem Biophysic,2010,58(1):1-23
[11]Silva I C M,Ribeiro A M L,Canal C W. The impact of organic and inorganic selenium on the immune system of growing broilers submitted to immune stimulation and heat stress[J]. Braz J Poultry Sci,2010,12(4):247-254
[12]Yu R M,Yang W,Song L Y,et al. Structural characterization and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordycceps militaris[J]. Carbohydr Polym,2007,70(4):430-436
[13]Sors T G,Ellis D R,Salt D E. Selenium uptake,translocation,assimilation and metabolic fate in plants[J]. Photosynth Res,2005,86 (3):373-389
[14]Dong J Z,Wang Y,Wang S H,et al. Selenium increases chlorogenic acid,chlorophyll and carotenoids of Lycium chinense leaves[J]. J Sci Food Agric,2013,93(2):310-315
[15]Turakainen M,Hartikainen H,Seppänen M M. Effects of Selenium Treatments on Potato(Solanum tuberosum L.)Growth and Concentrations of Soluble Sugars and Starch[J]. J Agric Food Chem,2004,52 (17):5378-5382
[16]Cyrus B,Nell M,Mondy I. Effect of selenium fertilization on the concentration of selenium,other minerals,and ascorbic acid in potatoes[J]. J Food Quality,1991,14(6):521-527
[17]Seppänen M,Turakainen M,Hartikainen H. Selenium effects on oxidative stress in potato[J]. Plant Sci,2003,165(2):311-319
[18]Cuderman P,Kreft I,Germ M,et al. Selenium Species in Selenium-Enriched and Drought-Exposed Potatoes[J]. J Agric Food Chem,2008,56(19):9114-9120
[19]Germ M,Kreft I,Stibilj V,et al. Combined effects of selenium and drought on photosynthesis and mitochondrial respiration in potato. Plant Physiol[J]. Bioch,2007,45(2):162-167
[20]Zhu F,Cai Y Z,Ke J,et al. Compositions of phenolic compounds,amino acids and reducing sugars in commercial potato varieties and their effectson acrylamide formation[J]. J Sci Food Agri,2010,91 (13):2254-2262
[21]Fuleki T,Francis F J. Quantitative methods for anthocyanins. 1. Extraction and determination of total anthocyauln in cranberries[J]. J Food Sci,1968,33(1):72-77
[22]Yagasaki K,Miura Y,Okauchi R,et al. Inhibitory effects of chlorogenic acid and its related compounds on the invasion of hepatoma cells in culture[J]. Cytotechnol,2000,33(1):29-35
[23]Cho E S,Jang Y J,Hwang M K,et al. Attenuation of oxidative neuronalcelldeathbycoffeephenolicphytochemicals[J]. MutatRes2009,661(1):18-24
[24]Sul D Kim,H S,Lee D,et al. Protective effect of caffeic acid against beta-amyloid-induced neurotoxicity by the inhibition of calcium influx and tau phosphorylation[J]. Life Sci,2009,84(9):257-262
[25]Ikeda K,Tsujimoto K,Uozaki M,et al. Inhibition of multiplication of herpes simplex virus by caffeic acid[J]. Int J Mol Med,2011,28(4):595-598
[26]Hamouz K,Lachman J,Dvorak P,et al. The effect of site conditions,variety and fertilizationon the content of polyphenols in potato tubers. Plant Soil[J]. Environ,2006,52(9):407-412
[27]Ken G R,Ewald E S,Chris W,et al. Flavonoids and UV Photoprotection in Arabidopsis Mutants[J]. Zeitschrift für Naturforschung C,2015,56(9):745-754
[28]Xue TL. Association of antioxidative enzymes with the synergistic effect of selenium and UV irradiation in enhancing plant growth[J]. Agricultural and food science in fnland,2000(9):177-186
Phenolic Compostion and Beneficial Trace Minerals of Selenium Enriched Purple Potatoes
YAO Lan1,2,LEI Can1,2,AI Xun-ru1,2,*
(1. Key Laboratory of Biologic Resources Protection and Utilization of Hubei Province,Enshi 445000,Hubei,China;2. College of Forestry and Horticulture,Hubei Minzu University,Enshi 445000,Hubei,China)
Abstract:In this study,selenium enriched purple potatoes were studied. The results were:the main phenolics of purple potato tubers were chlorogenic acid,caffeic acid and anthocyanins;total phenolics could be quantified bydirectspectraphotographicmethodat325nm,withchlorogenicacidasstandard,recovery 97.67%-103.15%;trace minerals as zinc,iron and selenium and the total phenolics as chlorogenic acid,caffeic acid and anthocyanins were significantiy increased by selenium. In conclusion,selenium enriched purple potatoes could be used as a more valuable functional food.
Key words:purple potato;phenolics;selenium;zinc;iron
DOI:10.3969/j.issn.1005-6521.2016.09.001
基金项目:国家科技支撑计划(旱作农业关键技术研究与示范,2006BAD29B01);湖北省教育厅重点项目(D20122901)
作者简介:姚兰(1982—),女(土家),讲师,博士,研究方向:农业生态工程。*通信作者
收稿日期:2015-03-26
