紫阳富硒茶中硒的赋存形态及浸出率研究
2016-06-13谢娟平安康学院化学化工系陕西安康725000
谢娟平(安康学院化学化工系,陕西安康725000)
紫阳富硒茶中硒的赋存形态及浸出率研究
谢娟平
(安康学院化学化工系,陕西安康725000)
摘要:研究紫阳富硒茶中硒的赋存形态及其浸出率。采用盐酸浸提法提取硒蛋白,硒多糖用[(1∶1酚-二氯甲烷)-异戊醇](24∶1,mL/mL)法除去蛋白质后进行提取,同法提取硒核酸,去除蛋白质后,酸法提取。采用氢化物发生原子荧光法测定茶叶总硒含量及与蛋白质、多糖、核酸结合的硒含量。结果表明:硒蛋白、硒多糖分别占样品总硒的51.65% 和25.23%;浸泡温度,浸泡时间和浸泡次数是影响硒浸出率的主要因素,冲泡水温为95℃时硒浸出率高达46.35%;浸泡3min时,硒的浸出率为25.80%,达最大值。浸泡次数为3次时,茶汤中硒的含量极微。富硒茶中的硒绝大部分是对人体有益的有机硒,硒蛋白>硒多糖>硒核酸;饮茶时应选择水温95℃下浸泡茶叶,且浸泡3min,浸泡2次为佳。
关键词:富硒茶;硒蛋白;硒多糖;硒核酸;浸出率
硒是人体的必需微量元素,具有增强免疫力,防止心脑血管疾病、糖尿病、白内障、克山病、大骨节病、关节炎等,与人类健康有着密切的关系[1-5]。紫阳富硒茶是以含硒而著名的保健茶,文献表明紫阳富硒茶中硒的平均含量约为0.6531mg/kg,最高可达3.853mg/kg,在我国非富硒地区,茶叶中硒的平均含量为0.15 mg/kg,比紫阳富硒茶低约5.5倍,国内浙、苏、皖地区的茶叶和日本、英国等地区的茶叶含硒量较少,比紫阳富硒茶低5.6倍~19倍[6-8]。通过饮茶,能够获取溶于热水中的有机硒,用于硒元素的补充和保健[9-12]。但是,国内外对紫阳富硒茶的研究报道较少且不够深入,大多集中在含硒量的测定[12-15],而硒在茶叶中的赋存形态、茶叶冲泡时硒的浸出率是目前紫阳富硒茶研究中急需解决的问题。本文通过氢化物发生原子荧光法测定硒含量的方法研究了富硒茶中硒的赋存形态及冲泡时的浸出率,旨在为人们泡茶时合理的选择浸泡温度、浸泡次数,充分吸收硒元素提供依据,也为利用安康地区的秋茶、开发有机硒保健食品提供参考。
1 材料与方法
1.1仪器、试剂与原料
PF6-2非色散原子荧光分光光度计:北京普析通用仪器有限公司;101-1AB电热鼓风干燥箱、DK-2000-III L型电热恒温水浴锅:天津市泰斯特仪器有限公司;FA2104型电子天平:良平仪器有限公司;TD5A离心机:长沙英泰仪器有限公司。
乙醇、异戊醇、醋酸、二氯甲烷、草酸、氯化钠、盐酸、硝酸、高氯酸,均为分析纯;硒标准液(200 mg/L);硼氢化钾溶液(现配现用):称取15 g硼氢化钾(KBH4),溶于氢氧化钾溶液(5%)中,然后定容至1 000 mL混匀;铁氰化钾:准确称取1 g铁氰化钾K3Fe(CN)6,用三重蒸馏水定容至100 mL混匀;载液:5%盐酸溶液(量取50.0 mL浓盐酸,定容至1 000 mL,混匀);氩气:纯度为99.99%。
富硒绿茶(产于陕西省安康市紫阳县):市场购买。
1.2方法
1.2.1样品的预处理
将市售紫阳茶于50℃~60℃干燥箱中烘干,取部分干燥后的茶叶粉碎,过40目筛制成茶粉,用于硒蛋白、硒核酸、硒多糖的提取,未粉碎的干燥茶叶用于冲泡时硒浸出率的测定。
1.2.2硒蛋白、硒核酸、硒多糖的提取
1.2.2.1硒蛋白的提取
称取茶粉1 g,平行2份,各加入适量蒸馏水,室温放置3d,浸提蛋白[16-18],过滤,收集滤液,加盐酸调节pH到蛋白质等电点,蛋白质沉淀完全后离心(5 000 r/min)分离,95%乙醇冲洗2次后,按1.2.4项所述方法消化,测定硒的含量。
1.2.2.2硒核酸的提取
称取茶粉1 g,平行2份,各加入一定量2 moL/L 的NaCl溶液,沸水浴中提取30 min后过滤,重复提取两次,合并滤液,[(1∶1酚-二氯甲烷)-异戊醇](24∶1,mL/mL)法除去蛋白质后[19-21],用醋酸调节pH至2.5,冰水中静置过夜,得核酸沉淀。离心(5 000 r/min)分离沉淀,95%乙醇冲洗2次后,按1.2.4项所述方法消化,测定硒的含量。
1.2.2.3硒多糖的提取
在提取核酸后的样品残渣中分别加入一定量3%草酸溶液[19-22],沸水浴中提取30 min,过滤,重复提取两次,合并滤液,[(1∶1酚-二氯甲烷)-异戊醇](24∶1,mL/mL)法除去蛋白质后,加入4倍量的95%乙醇,冰箱中静置过夜,得多糖沉淀。离心(5 000 r/min)分离沉淀,85%的乙醇洗涤2次后,按1.2.4项所述方法消化,测定硒的含量。
1.2.3富硒茶中硒的浸出率的测定
称取4 g干燥茶叶,加入100℃热水200 mL,在相同温度的水浴锅中浸泡2、3、4 min,每一浸泡时间分别浸泡3次,并且过滤,收集每一次浸泡后的茶汤。同样方法分别进行95、90、85、80℃下浸出试验,按1.2.4项所述方法消化,测定硒的含量。
1.2.4硒含量的测定
1.2.4.1样品处理
1)混酸的配制:用量筒移取300 mL硝酸于带塞玻璃瓶中,然后加入200 mL高氯酸,充分摇匀,盖上塞子,存于阴凉处,备用。
2)茶粉处理:称取0.5 g茶粉于50 mL锥形瓶中,平行3份,同时做空白试验。
3)茶汤处理:量取15.00 mL泡好的茶汤于50 mL锥形瓶中,平行3份;提取的硒蛋白、硒多糖、硒核酸置于50 mL锥形瓶中。
4)冷消化:用移液管量取15.00 mL混酸[硝酸与高氯酸=3∶2(体积比)提前配制好]加入三角瓶中,过夜冷消化。
5)热消化:电热板砂浴,160℃~180℃加热消解,消解时要尽量将HNO3赶尽(少量HNO3会使硒的荧光强度下降),消化至清亮无色冒白烟后,1 min~2 min内取下稍冷。
6)还原:向三角烧瓶中加入5.0 mL盐酸溶液(1∶1,体积比),置于沸水浴中加热20 min,取下三角瓶,冷却至室温,加三重水5 mL稀释,准备过滤。
7)过滤定容:样品液过滤至25 mL容量瓶中,用三重蒸馏水清洗三角瓶,清洗液合并,用三重蒸馏水定容,混匀,上机测试。
1.2.4.2样品检测
仪器自动计算结果方式测量:设定好仪器最佳条件,在样品参数画面,输入以下参数:样品名称、样品状态和个数,稀释倍数,并选择结果的浓度单位。逐步将炉温升至所需温度后,稳定30 min后开始测量。连续用硒标准溶液的1号管进样,待读数稳定之后,转入标准系列测量,绘制标准曲线。在转入样品测定之前,再进入空白值测量状态,用样品空白消化液进样,让仪器取其均值作为扣底的空白值,随后即可依次测定样品。测定不同样品前均用载液清洗进样器,整个测定过程由仪器自动完成。仪器工作条件参数如表1所示,样品测定结果按以下公式计算:
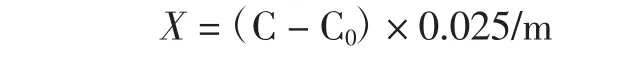
式中:X为样品中硒的含量,μg /g;C为样品消化液测定浓度,μg/L;C0为样品空白消化液测定浓度,μg/L;m为样品质量,g;0.025为处理的试样定容至25 mL。

表1 仪器工作参数Table 1 Instrument parameters
2 结果与分析
2.1硒标准曲线
配制浓度在0~21 μg/L的硒标准液,按顺序装入试管架,同时做试剂空白,按1.2.4项所述方法调整仪器,测试,得标准曲线,见图1。
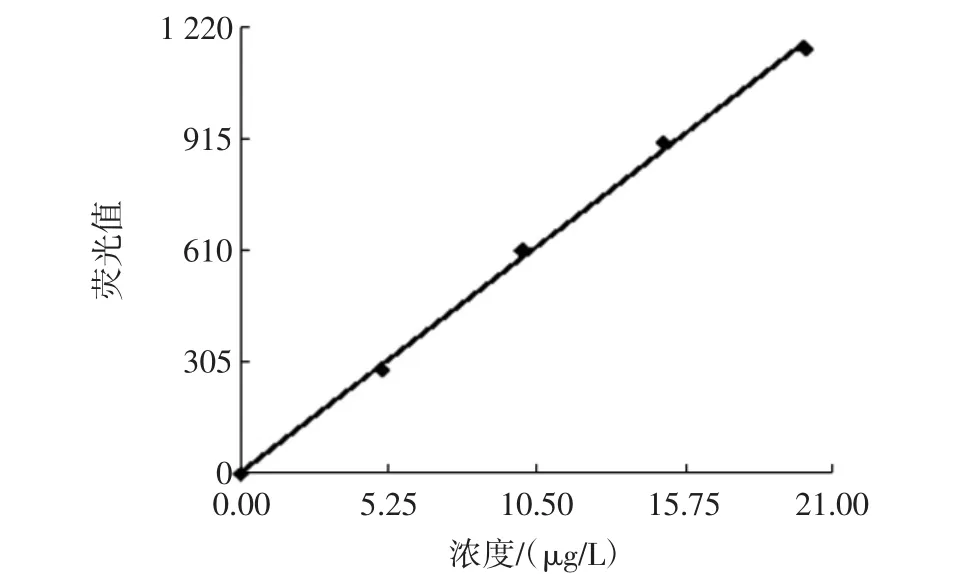
图1 硒标准曲线Fig.1 Selenium standard curve
线性方程为IF=58.919 4C+2.791 9,相关系数为0.999 3,表明设定试验条件及参数合适,可以用于测定样品中的硒含量。
2.2紫阳富硒茶中总硒的含量
按1.2.4项下方法测定紫阳富硒茶中总硒含量,测定结果如表2所示。

表2 富硒茶中总硒的含量Table 2 Total selenium content in Se-enriched tea
结果表明紫阳富硒茶中总硒含量约为0.78 μg/g。硒含量较高。
2.3紫阳富硒茶硒的赋存形态及其含量
用1.2.2中方法提取出硒蛋白、硒多糖、硒核酸,按1.2.4项下方法测定各赋存形态中硒含量,并以所取茶粉样品总量为基数换算,测定结果如表3所示。
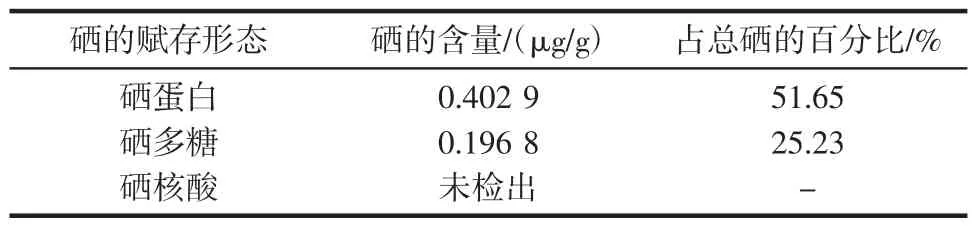
表3 不同赋存形态的硒及其含量Table 3 Different forms of selenium and its content
表3结果表明:紫阳富硒茶硒的赋存形态中,与蛋白质结合的硒为0.402 9 μg/g,占样品总硒的51.65%,与多糖结合的硒为0.1968μg/g,占样品总硒的25.23%,两者占总硒的76.88%。可见紫阳富硒茶中的硒绝大部分是对人体有益的有机硒,且硒蛋白>硒多糖>硒核酸,说明在紫阳富硒茶中与蛋白质结合是硒的主要赋存形态。
2.4紫阳富硒茶硒的浸出率结果
按1.2.4所述方法测定了茶汤中硒的浓度,浸出率测定结果如表4、表5所示。
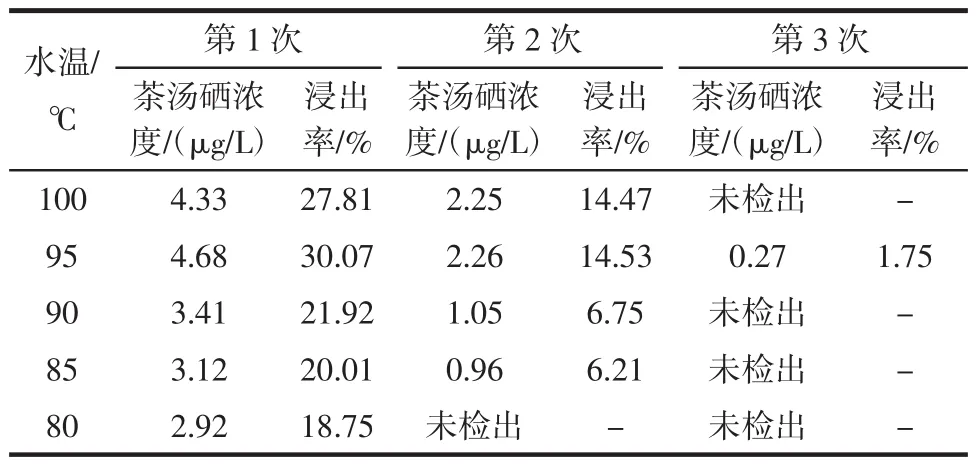
表4 浸泡次数对硒的浸出率的影响Table 4 Influence of soak times on the dissovled rate of selenium
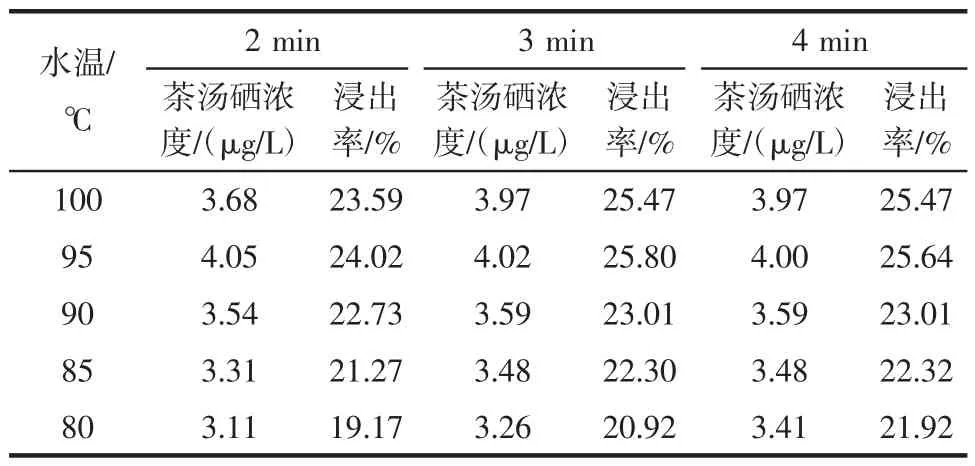
表5 浸泡时间对硒的浸出率的影响Table 5 Influence of soak time on the dissovled rate of Selenium
从表中数据可以看出,不同浸泡时间及浸泡温度浸出率相差不明显,为此进行方差分析,结果如下表。
由表4、表5可以看出:3次浸泡中茶叶硒浸出率不同,浸泡温度高,茶汤中硒含量高,但浸泡水温为95℃时硒浓度最大;第1次浸泡茶叶硒浸出率约为第2次浸泡的2倍左右,第3次浸泡后茶叶中溶出的硒已不能用现有方法检测到;茶汤中浸出的硒主要为与蛋白结合的硒,其次为与多糖结合的硒,两者合计占总硒的76%以上,均为有利于人体吸收的有机硒形态;就浸泡时间而言,浸泡时间不同,茶叶中硒的浸出率不同,在本试验中浸泡3 min时硒的浸出率总体高于浸泡2、3 min时最大浸出率为25.80%。虽然浸泡4 min浸出率与3 min相近,但根据文献报道[23],浸泡时间过长,茶多酚等会因浸泡时间过长而氧化变质,降低茶叶的色香味。此外,方差分析F值大于临界值,有统计学意义,P值小于0.01,有显著差异。综上所述,富硒绿茶浸泡应以95℃水温,冲泡2次,每次3 min为宜。
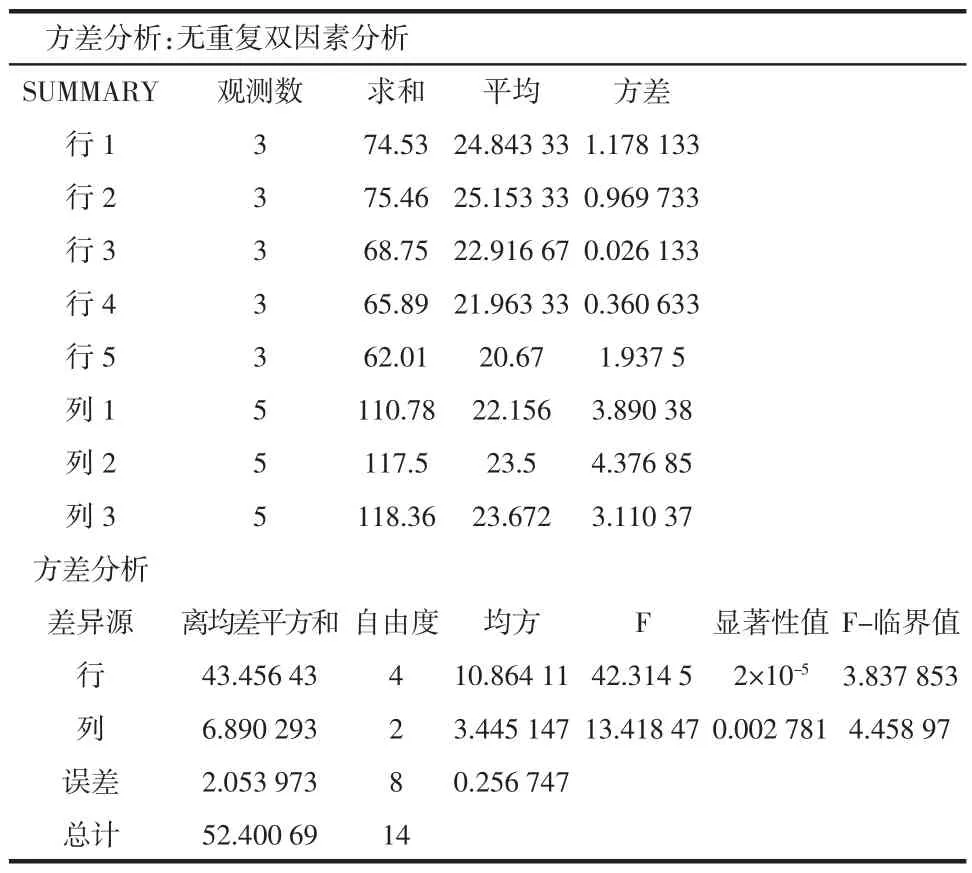
表6 SPSS双因素方差分析Table 6 Double factor variance analysis
3 结论与讨论
1)紫阳富硒茶中硒赋存形态的研究表明,茶叶中的硒绝大部分是有机硒,其赋存形态主要为硒蛋白和硒多糖,硒蛋白含量远大于硒多糖的量,硒元素大多与蛋白质结合在一起。
2)紫阳富硒茶中硒浸出率的研究表明,浸泡时间,浸泡温度,浸泡次数都会影响硒的浸出量,冲泡水温95℃左右,冲泡时间3 min时为佳,茶叶冲泡到第3次几乎没有硒浸出,从硒的浸出角度出发,富硒绿茶不宜多次冲泡饮用,以2次为佳。
3)提取到的核酸中未检出硒,这可能是由于:①与核酸结合的硒占茶叶中总硒的质量分数低,用现有方法检测不到;②试验中称取的样品的量过少或试验方法不当。
4)紫阳富硒绿茶硒含量较高,研究表明富硒绿茶中硒主要以蛋白和多糖结合的有利于人体吸收的形式存在,每天饮用有助于人们补充一定量的微量元素硒。试验结果对紫阳富硒绿茶的饮用及开发利用提供了参考。
参考文献:
[1]温立香,郭雅玲.富硒茶的研究进展[J].热带作物学报,2013,34(1):201-206
[2]徐凯明,刘懿,雷勇,等.控量富硒茶研发技术研究[J].陕西农业科学,2010(1):53-57
[3]Abd E L,Ghany Hefnawy J L,Tortora-Perez. The importance of selenium and the effects of its deciency in animal health[J]. Small Ruminant Research,2010,26(1):185-192
[4]Stranges A,Navas-Acien M P,Rayman F E,et al. Selenium status and eardiometabolie health:State of the evidence[J]. Nutrition,Metabolism and Cardiovascular Diseases,2010,20(10):754-760
[5]陈志荣,古锋,马青,等.硒的生物医学功效及茶叶富硒研究进展[J].湖南林业科技,2010,37(2):82-84
[6]肖永绥,许春霞,方学良,等.陕南富硒茶的分布与开发利用[J].环境科学学报,1989,9(3):277-282
[7]谢娟平,王浩东.安康地区富硒资源研发的现状与思考[J].安康学院学报. 2009,21(5):83-85
[8]谢娟平.安康地区农副产品硒含量调查与评价[J].广东微量元素科学,2013,20(8):14-18
[9]郭胡津,赵振军.富硒茶中硒的存在形态及其保健作用[J].长江大学学报(自科版),2013,10(11):81-83
[10]翁昆,刘铁兵,胡国桥,等.富硒茶的质量与标准[J].中国茶叶加工,2014,133(1):5-7
[11]马一校,何佳宁,黄亚辉.茶叶中的硒及富硒茶的研究[J].广东茶业,2013,134(4):10-12
[12]Molan A L,Flanagan J,Wei W,et al. Selenium-containing green tea has higher antioxidant and prebiotic activities than regular green tea [J]. Food Chemistry,2009,114(3):829-835
[13]刘有芹,伦韦峰.茶叶中硒含量测定[J].微量元素与健康研究,2008,25(2):54-57
[14]梁春燕,唐颢,罗一帆.广东茶区茶叶含硒量初步调查分析[J].广东农业科学,2014,41(8):43-46
[15]严和平,罗宇,李自静,等.云南普洱茶中硒的测定条件及含量研究[J].食品科技,2010,35(12):263-266
[16]余芳,汪社英,方勇,等.富硒绿茶硒蛋白的提取工艺研究[J].南京农业大学学报,2008,31(4):140-143
[17]焦自明,杨建雄,张小飞,等.紫阳富硒茶中茶多糖、碱溶性茶蛋白结构形貌及硒赋存形态[J].陕西师范大学学报:自然科学版,2012,40(1):72-76
[18]Fang W,Goldberg M L,Pohl N M,et al. Functional and physical interaction between the selenium-binding protein-1(SBPl)and the glutathione peroxidase 1 selenoprotein[J]. Carcinogenesis,2010,31 (8):1360-1366
[19]张驰,刘信平,张升辉.莴苣中硒含量分布和赋存形态研究[J].湖北农业科学,2003,368(5):70-71
[20]张龙翔.生化实验方法和技术[M].北京:高等教育出版社,1998:238
[21]Wenbiao Wu,Xiujian Long. Correlation of Dispersibility of proteins with that of Selenium in Teas[J]. Biol Trace Elem Res,2011,142(2):137-142
[22]周志,汪兴平,张家年.茶多糖分离提取技术研究[J].食品与发酵工业,2001,28(3):83-84
[23]王银华,李凯,王金戌,等.茶叶硒含量测定及影响富硒茶硒浸出率的因素[J].河北科技大学学报,2006,24(2):144-145
Study on the Dissovled Rate of Selenium and Combined of Selenium in Selenium-riched Tea with Hydride Generation-atomic Fluorescence Method
XIE Juan-ping
(Department of Chemistry and Chemical Engineering,Ankang University,Ankang 725000,Shaanxi,China)
Abstract:The extraction of selenium and combined of selenium in selenium-riched tea were studied. Protein combined of selenium was extracted by hydrochloric acid,polysaccharide combined of selenium and nucleic combined of selenium were extracted by removing protein combined selenium with[(1∶1 phenol-methylene chloride)-isoamyl alcohol](24∶1,mL/mL). The selenium content of tea and nucleic,polysaccharide and protein combined of selenium were determined by atomic fluorescence spectrometry. The results showed that:Seprotein and Se-polysaccharide accounted for about 51.65%and 25.23%of the total selenium,the most important factors influencing the dissolution rate of selenium from tea was the soaking temperature,the dunking time and frequency. The dissolution rate was 46.35%at 95℃,and soaking three minutes,the dissolution rate of selenium was 25.80%. Content of selenium could not be detected when dunked three times. The selenium extracted from tea is almost organic selenium,selenium-protein>selenium-polysaccharide>selenium-nucleic. Socking tea should be three minutes and no more than two times at 95℃.
Key words:Se-riched tea;selenium-protein;selenium-polysaccharide;selenium-nucleic;dissolution rate
DOI:10.3969/j.issn.1005-6521.2016.09.036
基金项目:陕西省科技厅农业攻关项目(2010k01-19)
作者简介:谢娟平(1972—),女(汉),副教授,硕士研究生,研究方向:天然产物研发。
收稿日期:2015-04-07
