癌间质细胞与卵巢癌治疗相关性研究进展
2016-06-13陈亚萍
梁 凡,陈亚萍,杨 恭
1.复旦大学附属上海市第五人民医院妇产科,复旦大学上海医学院妇产科学系,上海 200240 ;2.复旦大学附属上海市第五人民医院中心实验室,复旦大学上海医学院妇产科学系,上海 200240 ;3.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
癌间质细胞与卵巢癌治疗相关性研究进展
梁 凡1,2,陈亚萍1,杨 恭2,3
1.复旦大学附属上海市第五人民医院妇产科,复旦大学上海医学院妇产科学系,上海 200240 ;2.复旦大学附属上海市第五人民医院中心实验室,复旦大学上海医学院妇产科学系,上海 200240 ;3.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
[摘要]卵巢癌是死亡率最高的妇科恶性肿瘤,其5年生存率仅为30%。尽管70%~80%的卵巢癌为上皮性癌,但越来越多的证据表明,癌间质细胞如内皮细胞、成纤维细胞和巨噬细胞等对卵巢癌的恶性进展具有重要的调控作用,因此研究这些间质细胞的相关功能可能会找到有效治疗卵巢癌的新靶点。该文就目前已发表的关于卵巢癌间质细胞功能及其相关作用蛋白为主要线索,对其与卵巢癌治疗的相关性研究进行综述分析,旨在总结和寻找卵巢癌治疗的新途径和新方法。
[关键词]卵巢癌;肿瘤间质;内皮细胞;成纤维细胞;巨噬细胞;靶向治疗。
Correspondence to:CHEN YapingE-mail:chenyaping@5thhospital.com
卵巢癌是妇科常见恶性肿瘤,发病率在女性生殖系统恶性肿瘤中为第三位,死亡率居首位[1]。由于卵巢癌发病和进展隐匿,且缺乏早期诊断指标,70%的卵巢癌患者就诊时已属晚期,且多数伴有盆、腹腔广泛转移。肿瘤细胞减灭术联合铂类和紫杉醇为基础的化疗,是当今该病的标准治疗方案,尽管起初化疗的反应率为50%~80%,由于最终的耐药或复发,晚期患者的5年生存率并未得到明显改善。
肿瘤间质细胞是肿瘤微环境的重要组分,在肿瘤进展和转移中起了关键作用。最近研究表明,多种类型的间质细胞,如巨噬细胞、成纤维细胞及内皮细胞等均参与了肿瘤恶性进展的调控[2]。肿瘤间质细胞可通过分泌多种细胞因子、组织因子、蛋白酶及细胞外间质等成分,调节肿瘤微环境,达到肿瘤细胞恶性进展的目的[3]。越来越多的证据表明,肿瘤细胞与多种肿瘤间质细胞间的相互作用在肿瘤进展中起关键作用;并且,与肿瘤细胞相比,间质细胞在基因水平更加稳定,更不容易产生耐药[4],这些发现为卵巢癌的治疗策略提供了新的思路。现综述几种主要的肿瘤间质细胞(内皮细胞、成纤维细胞和巨噬细胞等)与卵巢癌生物行为学关系以及靶向肿瘤间质细胞的新一代药物研究进展。
1 内皮细胞与卵巢癌
1.1内皮细胞与卵巢癌血管生成、侵袭转移
内皮细胞是卵巢肿瘤微环境间质细胞中研究最为广泛和深入的一种细胞。多项研究表明,微血管密度和血管内皮生长因子(vascular endothelial growth factor,VEGF)与疾病范围、进展时间、生存率及腹水形成有关,可以作为评价预后的预测指标[5]。血管生成包括了内皮祖细胞的募集,内皮细胞增殖、成熟、迁移,血管形成等动态过程,这些环节被一系列促血管生成因子和抑血管生成因子所调节。关键的促血管生成因子包括VEGF、血小板源生长因子(platelet-derived growth factor,PDGF)、成纤维细胞生长因子-2(fibroblast growth factor 2,FGF-2)、血管生成素(angiopoietin)、IL-6和IL-8等。在这些因子中,VEGF-A是在卵巢癌中高表达的主要促血管生成因子之一[6],并被证实通过改变血管通透性,在腹水形成中发挥重要作用[7]。
1.2VEGF抑制剂靶向血管生成
临床上大量关于VEGF抑制剂疗效的临床试验评估已经完成。VEGF信号通路抑制剂作用机制主要有两种:① 抑制配体;② 抑制VEGF受体的酪氨酸激酶活性。
1.2.1抑制配体
贝伐单抗(bevacizumab)是此类药中研究最为广泛和深入的一种。贝伐单抗是人源单克隆抗体,可以封闭所有亚型的VEGF,阻断VEGF诱导的血管内皮细胞增殖、迁徙以及存活,并且抑制内皮细胞通透性以及一氧化氮和组织因子的产生,从而抑制肿瘤生长和腹水形成。其于2004年被FDA批准用于转移性结直肠癌的一线治疗。对铂敏感复发患者,OCEANS试验:一项在铂敏感复发性上皮卵巢癌患者中进行化疗加或不加贝伐单抗的随机、双盲、安慰剂对照Ⅲ期试验结果表明,贝伐单抗添加到标准化疗中,可延长无进展生存期4个月。此外,可明显改善客观反应率和缓解时间[8]。对铂类药物耐药的复发性卵巢癌患者,贝伐单抗同样有效。在2012年进行的一项针对铂类药物耐药的卵巢癌试验(AURELIA)结果表明,加用了贝伐单抗的患者无进展生存期(progression-free survival,PFS)延长了1倍,即由3.4个月延长至6.7个月(HR=0.48)[9]。近期发表的标准化疗联合贝伐单抗治疗卵巢癌的Ⅲ期临床试验ICON7研究结果表明,将贝伐单抗作为一线化疗治疗的一部分,持续到病情进展前,这些患者PFS可延长6~8个月;贝伐单抗在持续治疗结束后10个月仍显示出其自身的优势,故贝伐单抗维持治疗可延长PFS(P<0.05)[10]。从目前多项临床试验结果可以看出,贝伐单抗作为晚期卵巢癌一线治疗和复发性卵巢癌的治疗已显示出显著的效果,延长了PFS并提高了总体反应率。贝伐单抗在试验中出现的主要不良反应有高血压、蛋白尿、出血、静脉血管栓塞、切口愈合差及胃肠道穿孔等,更多的评价贝伐单抗联合新的靶向药物治疗卵巢癌安全性的临床试验正在进行中。阿柏西普(aflibercept)是另一种抑制配体的融合蛋白,由IgG恒定区和两种不同的VEGFR(VEGFR-1、VEGFR-2)融合而成,其作为VEGF受体的可溶性阱(VEGF-trap),能结合VEGF并使其失活,有着和贝伐单抗相似的作用。2008年在ASCO年会上有1篇关于VEGF-trap用于控制恶性腹水的初步报道结果显示,12例伴腹水的晚期卵巢癌患者接受2周1次的VEGFTrap(4 mg,静脉注射)治疗后,接受穿刺抽液治疗的时间都有不同程度的延长,严重的不良反应主要包括肠梗阻、恶心呕吐等,后继试验结果还有待报道。
1.2.2抑制VEGF受体的酪氨酸激酶活性
酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)是另一类重要的抗血管生成药物。索拉非尼(sorafenib)是一种口服小分子多种激酶抑制剂,能同时靶向几种酪氨酸受体,包括VEGFR-2、VEGFR-3、血小板源生长因子受体-β、c-kit以及RAF家族中的丝/苏氨酸激酶,从而抑制肿瘤生长[11]。在一项索拉非尼单药治疗复发性卵巢癌的Ⅱ期临床试验中,59 例患者中2例有部分缓解,20例疾病稳定,30例疾病进展[12]。Azad等[13]将贝伐单抗和索拉非尼联用治疗39例肿瘤患者,其中13例卵巢癌患者中有6例部分缓解。可见,索拉非尼在卵巢癌的治疗中有一定的前景。另外,新研发的舒尼替尼(sunitinib)、西地尼布(cediranib)和帕唑帕尼(pazopanib)等酪氨酸激酶抑制剂能抑制所有亚型的VEGF受体及PDGF受体。其中,舒尼替尼作为单药治疗复发性卵巢癌疗效不明显[14]。对于Cediranib等[15]在复发性卵巢癌治疗疗效以及帕唑帕尼[16]用于卵巢癌患者一线化疗缓解期维持治疗的作用的临床试验评价正在进行中。
2 肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)与卵巢癌
2.1CAFs
CAFs是肿瘤微环境中重要的间质成分。不同于正常静止的成纤维细胞,CAFs高表达如α平滑肌动蛋白(α-smooth muscle actin,α-SMA)和成纤维细胞活化蛋白(fibroblast activation protein,FAP)等成肌纤维细胞以及活化的成纤维细胞标志分子。CAFs来源于多种细胞类型,其中两个重要的来源是间充质干细胞(mesenchymal stem cell,MSC)和组织成纤维细胞。MSC在白色脂肪组织中非常丰富,如网膜,是卵巢癌最常见转移部位。研究证实,卵巢肿瘤细胞分泌的细胞因子如TGF-βl,溶血磷脂酸(lysophosphatidic acid,LPA)等,能促使正常网膜成纤维细胞以及脂肪组织中的MSC向CAFs转化[17]。其他肿瘤研究表明,CAFs也能来源于被肿瘤细胞募集的骨髓MSC[18-19]。有证据表明,在乳腺癌中,一些CAFs来源于经过上皮间质转化的肿瘤细胞[20]。然而,一项卵巢癌移植瘤模型研究发现,间质中α-SMA阳性细胞并不来源于肿瘤细胞本身,表明卵巢癌细胞并不是CAFs的主要来源[21]。
与正常的网膜成纤维细胞相比,CAFs高表达IL-6、CXCL12和VEGF-A等因子,从而更高效地刺激卵巢肿瘤细胞和内皮细胞生长[21]。CAFs在卵巢癌中的数量与微血管密度呈正相关[22],其能高表达TGF-β,基质金属蛋白酶(matrix metalloproteinase,MMP)和大量细胞外基质蛋白[23],从而促进卵巢肿瘤细胞的侵袭[22]。大量研究表明,CAFs促进肿瘤增殖、血管生成以及转移,与卵巢肿瘤的恶性进展密切关联,因此可以作为治疗靶标。
2.2CAFs靶向药物与卵巢癌治疗
CAFs对肿瘤细胞生物学行为有显著影响,发展靶向CAFs的药物正成为目前研究的热点。Leung等[24]研究证实,来源于CAFs的一种分泌因子微纤丝关联蛋白5(microfibrillar-associated protein 5,MFAP5),能诱导卵巢癌细胞内F-actin细胞骨架重排和应力纤维形成,与卵巢癌患者预后呈负相关。Leung等[24]在一项卵巢癌细胞内注射动物模型研究中发现,使用纳米粒为载体的siRNA技术靶向间质中MFAP5能显著降低肿瘤生长与转移,表明靶向CAFs来源的分泌因子有希望成为治疗卵巢癌的一条新途径[24]。
一些方法通过靶向FAP来抑制CAFs,一种靶向FAP的人源单抗被证实耐受良好,但是在转移性结直肠癌患者临床试验中疗效欠佳[25]。在一项临床前期研究中发现,一种靶向FAP的DNA疫苗抑制肿瘤生长,并且在小鼠结肠癌模型中提高了小鼠的生存率[26]。Bren-nen等[27]研究证实了FAP在CAFs中高表达,同时发现FAP具有蛋白水解活性。他们将FAP特异肽链与作为毒性部分的毒胡萝卜素类似物偶联,合成了一种药物前体,并证实这种化合物在乳腺癌和前列腺癌肿瘤移植模型中能通过诱导间质细胞死亡抑制其生长。FAP靶向治疗能够成通过多种不同机制在各种肿瘤中发挥抗癌效应,说明FAP可能成为一个潜在的治疗靶标,其在卵巢癌中的靶向治疗效果值得进一步研究。
另一项潜在的抑制CAFs的方法是通过抑制转化生长因子β(transforming growth factor-β,TGF-β)信号转导通路阻碍正常的MSC和成纤维细胞转化成为CAFs。TGF-β信号通路抑制剂包括:TGF-β配体阱(ligand trap)、反义寡核苷酸和TGF-βⅠ型受体激酶小分子抑制剂,对这些药物的临床试验评估正在进行中[28]。目前,TGF-β抑制剂在卵巢癌中的疗效还不明确。在一项研究中,经TGF-βⅠ型受体抑制剂 A83-01处理后,小鼠卵巢癌移植瘤纤维成分减少,但是生存时间并未延长[29]。
3 肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)与卵巢癌
3.1TAMs与卵巢癌侵袭浸润
巨噬细胞正常存在于健康女性腹腔内,在卵巢癌患者腹水中非常丰富。巨噬细胞在不同的微环境中表现出不同的极性,由病原微生物或INF-γ刺激后,巨噬细胞表现出具有免疫刺激性的M1型细胞;相反,在肿瘤缺氧区的微环境中,巨噬细胞被诱导分化为免疫抑制性的M2型细胞[30]。TAMs能释放多种生长因子以及蛋白酶,是肿瘤间质细胞的主要免疫组分[30]。
在卵巢癌患者腹水中呈高表达的细胞因子,如IL-6、IL-10和白血病抑制因子(leukemia inhibitory factor,LIF)等,能刺激和诱导巨噬细胞向M2型分化[31]。趋化因子(C-C motif)配体 12(CCL12)与TGF-β2在卵巢癌细胞和CAFs中也有表达,这些配体最近被发现能诱导正常的腹腔巨噬细胞获得M2表型[32]。CCL2也是导致巨噬细胞向肿瘤细胞浸润的关键的趋化因子[30]。
TAMs与肿瘤患者预后呈显著的负相关。TAMs主要通过抑制适应性免疫来促进肿瘤进展。M2型巨噬细胞特征性高表达免疫抑制细胞因子和趋化因子,如CCL17、CCL18、CCL22、IL-10和TGF-β1等[30]。IL-10和TGF-β1都可以抑制T细胞增殖和树突细胞成熟[30],此外,IL-10还能影响卵巢癌肿瘤微环境中T细胞亚群分化,导致Treg/Th17失衡。CCL18能诱导幼稚T细胞发生免疫无反应性,被证实是卵巢癌患者腹水中最丰富的趋化因子[33]。CCL17和CCL22能促进Treg细胞募集[34]。研究发现,Treg细胞能抑制效应T细胞的活性并且促进卵巢肿瘤生长,可作为卵巢癌患者预后差的预测指标[35]。除了表达抑制适应性免疫的分子,TAMs还表达MMP、VEGF-A和其他的生长因子来刺激转移和血管生成[30]。在一项研究中发现,抑制腹腔内巨噬细胞可以抑制移植瘤模型腹水形成和腹腔内扩散[36]。
3.2靶向TAMs治疗卵巢癌
巨噬细胞的募集以及向促肿瘤-M2型细胞极化提供了两个潜在的治疗干预靶点。一些方法已被证实能够“再教育”TAMs向有肿瘤杀伤性的M1型巨噬细胞转化。
抑制集落刺激因子-1受体已被证实能抑制巨噬细胞向M2型极化,在动物模型中能阻断神经胶质瘤进展[37]。抑制TAMs内的NF-κB信号途径也能诱导巨噬细胞由M2型向M1型转化,增加肿瘤杀伤活性并导致卵巢癌移植瘤消退[38]。CD40是肿瘤坏死因子受体超家族成员之一,活化后在胰腺癌小鼠模型中能诱导巨噬细胞的肿瘤杀伤活性[39]。在一项晚期胰腺癌患者Ⅰ期临床试验中,竞争性CD40单克隆受体联合吉西他滨化疗被证实有抗肿瘤活性并且有良好的耐受性[40]。唑来膦酸(zoledronic acid)在临床上多用于预防骨折,其也能阻碍巨噬细胞向M2型极化[41]。
CCL2由于其能刺激单核细胞趋化以及能诱导巨噬细胞M2型极化,可能成为具有潜力的新靶点。一项研究表明,中和CCL2导致前列腺癌移植瘤的退缩[42]。一种靶向CCL2的单克隆抗体最近正在经受临床评估[43]。宾达利(bindarit)是一种抗炎化合物,临床上常用于抗风湿治疗,能抑制CCL2合成,被证实能抑制乳腺癌和前列腺癌移植瘤的生长[44]。
曲贝替啶(trabectedin)是一种生物碱,能结合小沟DNA,阻断细胞周期运转。在复发性卵巢癌的Ⅲ期临床试验中,发现与单独用聚乙二醇脂质体多柔比星(pegylated liposomal doxorubicin,PLD)相比,曲贝替定联合PLD治疗组的PFS平均延长1.5个月[45]。曲贝替定也能抑制CCL2和IL-6的产生,抑制单核细胞向巨噬细胞分化[46]。Germano等[47]最近研究发现,曲贝替定在卵巢癌移植瘤模型及其他一些实体肿瘤中,对巨噬细胞有选择性毒性作用。
最近,在另外一项研究中,Cieslewicz等[48]发现一种肽(M2pep)能选择性结合M2型巨噬细胞。在经过含M2pep和促凋亡部位的融合肽治疗后,移植瘤小鼠生存率显著提高[48],因此,M2pep可以作为运送药物进入TAMs的潜在载体。
4 其他间质细胞与卵巢癌
4.1MSC
MSC也被大量招募到肿瘤微环境中。肿瘤相关MSC(CA-MSC)在卵巢癌标本中被鉴定出来,具有非致瘤的正常表型。MSC具有多种潜能,具有分化成脂肪组织、软骨和骨骼的潜能,在体内与肿瘤细胞联合时,CA-MSC比MSC更能够有效地促进肿瘤生长。体内和体外研究发现,CA-MSC通过增加肿瘤干细胞的数量来促进肿瘤生长[49]。基于MSC在肿瘤微环境中的趋向性,众多研究表明,MSC可能作为肿瘤潜在的治疗载体。
4.2脂肪细胞
卵巢癌会向网膜转移,但机制不明。人网膜脂肪细胞能促进卵巢癌细胞的归巢、移动和入侵。脂肪因子,包括IL-18,介导了生物学活动。Nieman等[50]研究表明,脂肪酸结合蛋白4(fatty acid-binding protein 4,FABP4)在网膜转移后较原发卵巢癌呈上调表达,且只表达在脂肪细胞和肿瘤细胞的交界面,当抑制FABP4表达时可导致脂肪细胞与癌细胞间的脂质传递显著减少,从而抑制了肿瘤生长及新血管生成,这表明FABP4在卵巢癌的转移中发挥了关键性的作用。脂肪细胞是肿瘤微环境中的重要组分,因此脂质的代谢和运输成为肿瘤新的干预靶点。
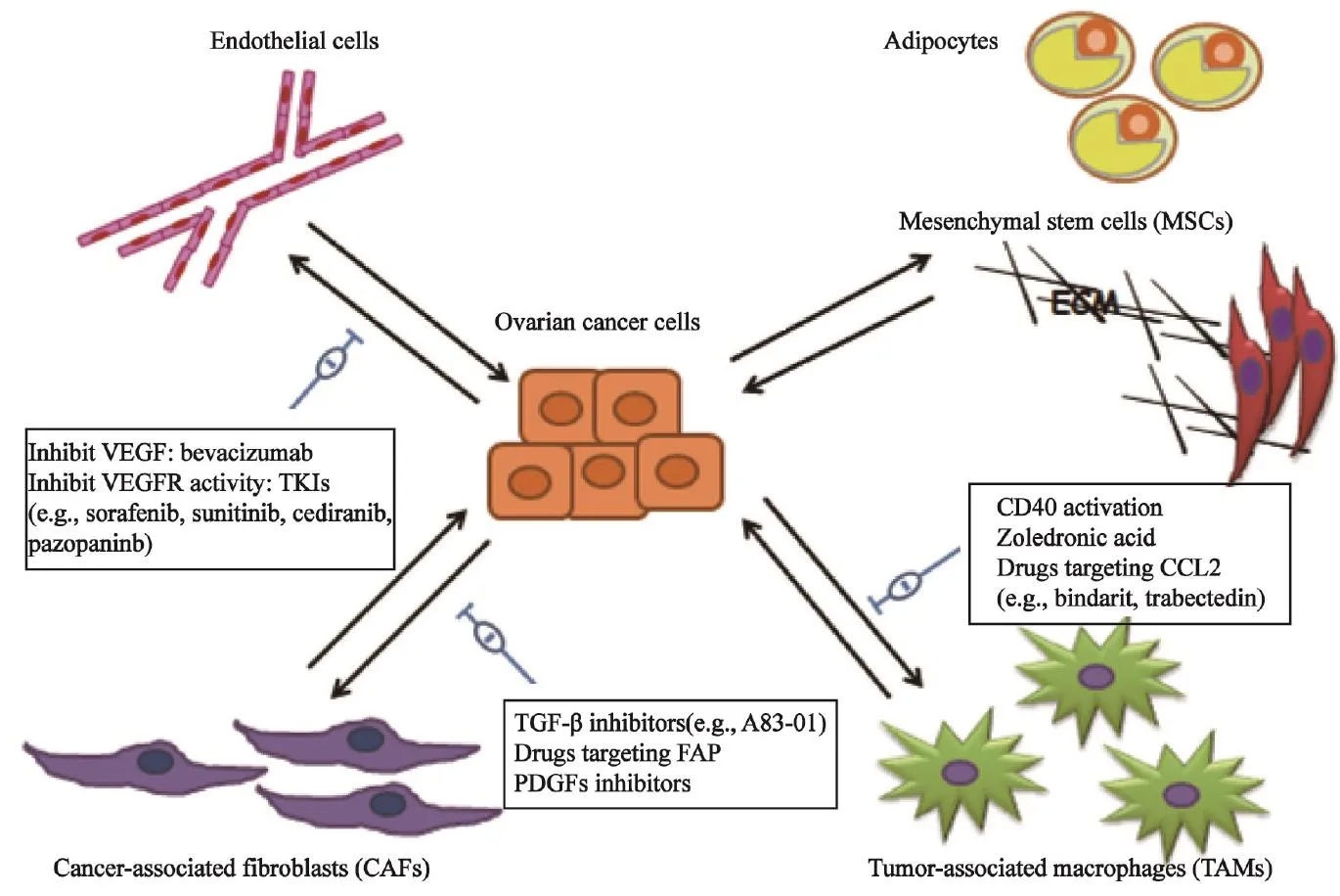
图1 卵巢癌细胞与各种间质细胞间相互作用及相关靶向治疗Fig. 1 Interactions between ovarian cancer cells and various stromal cells and associated targeted therapies
5 结语
多数的靶向间质细胞的药物作为单药治疗的效果仍然很局限,卵巢癌的异质性以及患者个体化差异性也会导致药效与不良反应出现个体差异。因此,发现新的卵巢癌分子治疗靶点,确定和规范有效的联合用药方案以及联合用药的临床适应证,以获得最好疗效和最小的不良反应是未来需要解决的问题之一。
[参 考 文 献]
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1):5-29.
[2] HEMMINGS C. Is carcinoma a mesenchymal disease? The role of the stromal microenvironment in carcinogenesis[J]. Pathology, 2013, 45(4):371-381.
[3] LI H, FAN X, HOUGHTON J. Tumor microenvironment:the role of the tumor stroma in cancer[J]. J Cell Biochem, 2007, 101(4):805-815.
[4] HALE M D, HAYDEN J D, GRABSCH H I. Tumourmicroenvironment interactions:role of tumour stroma and proteins produced by cancer-associated fibroblasts in chemotherapy response[J]. Cell Oncol (Dordr), 2013, 36(2):95-112.
[5] STONE P J, GOODHEART M J, ROSE S L, et al. The influence of microvessel density on ovarian carcinogenesis [J]. Gynecol Oncol, 2003, 90(3):566-571.
[6] BURGER R A. Overview of anti-angiogenic agents in development for ovarian cancer[J]. Gynecol Oncol, 2011, 121(1):230-238.
[7] BYRNE A T, ROSS L, HOLASH J, et al. Vascular endothelial growth factor-trap decreases tumor burden, inhibits ascites, and causes dramatic vascular remodeling in an ovarian cancer model[J]. Clin Cancer Res, 2003, 9(15):5721-5728.
[8] AGHAJANIAN C, BLANK S V, GOFF B A, et al. OCEANS:a randomized, double-blind, placebo-controlled phase Ⅲtrial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian, primary peritoneal, or fallopian tube cancer[J]. J Clin Oncol, 2012, 30(17):2039-2045.
[9] PUJADE-LAURAINE E, HILPERT F, WEBER B, et al. Bevacizumab combined with chemotherapy for platinumresistant recurrent ovarian cancer:The AURELIA open-label randomized phase Ⅲ trial[J]. J Clin Oncol, 2014, 32(13):1302-1308.
[10] STARK D, NANKIVELL M, PUJADE-LAURAINE E, et al. Standard chemotherapy with or without bevacizumab in advanced ovarian cancer:quality-of-life outcomes from the International Collaboration on Ovarian Neoplasms (ICON7)phase 3 randomised trial[J]. Lancet Oncol, 2013, 14(3):236-243.
[11] WILHELM S M, CARTER C, TANG L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progressionand angiogenesis [J]. Cancer Res, 2004, 64(19):7099-7109.
[12] MATEI D, SILL M W, LANKES H A, et al. Activity of sorafenib in recurrent ovarian cancer and primary peritoneal carcinomatosis:a gynecologic oncology group trial [J]. J Clin Oncol, 2011, 29(1):69-75.
[13] AZAD N S, POSADAS E M, KWITKOWSKI V E, et al. Combination targeted therapy with sorafenib and bevacizumab results in enhanced toxicity and antitumor activity[J]. J Clin Oncol, 2008, 26(22):3709-3714.
[14] CAMPOS S M, PENSON R T, MATULONIS U, et al. A phase Ⅱ trial of sunitinib malate in recurrent and refractory ovarian, fallopian tube and peritoneal carcinoma [J]. Gynecol Oncol, 2013, 128(2):215-220.
[15] LIU J F, BARRY W T, BIRRER M, et al. Combination cediranib and olaparib versus olaparib alone for women with recurrent platinum-sensitive ovarian cancer:a randomised phase 2 study[J]. Lancet Oncol, 2014, 15(11):1207-1214.
[16] RAHMAN A. Maintenance pazopanib in ovarian cancer[J]. Lancet Oncol, 2014, 15(12):e530.
[17] JEON E S, MOON H J, LEE M J, et al. Cancer-derived lysophosphatidic acid stimulates differentiation of human mesenchymal stem cells to myofibroblast-like cells[J]. Stem Cells, 2008, 26(3):789-797.
[18] DIREKZE N C, HODIVALA-DILKE K, JEFFERY R, et al. Bone marrow contribution to tumor-associated myofibroblasts and fibroblasts [J]. Cancer Res, 2004, 64(23):8492-8495.
[19] QUANTE M, TU S P, TOMITA H, et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth [J]. Cancer Cell, 2011, 19(2):257-272.
[20] PETERSEN O W, NIELSEN H L, GUDJONSSON T, et al. Epithelial to mesenchymal transition in human breast cancer can provide a nonmalignant stroma [J]. Am J Pathol, 2003, 162(2):391-402.
[21] KO S Y, BARENGO N, LADANYI A, et al. HOXA9 promotes ovarian cancer growth by stimulating cancer-associated fibroblasts [J]. J Clin Invest, 2012, 122(10):3603-3617.
[22] ZHANG Y, TANG H, CAI J, et al. Ovarian cancer-associated fibroblasts contribute to epithelial ovarian carcinoma metastasis by promoting angiogenesis, lymphangiogenesis and tumor cell invasion[J]. Cancer Lett, 2011, 303(1):47-55.
[23] MARSH T, PIETRAS K, MCALLISTER S S. Fibroblasts as architects of cancer pathogenesis [J]. Biochim Biophys Acta, 2013, 1832(7):1070-1078.
[24] LEUNG C S, YEUNG T L, YIP K P, et al. Calcium-dependent FAK/CREB/TNNC1 signalling mediates the effect of stromal MFAP5 on ovarian cancer metastatic potential[J]. NatCommun, 2014, 5:5092.
[25] HOFHEINZ R D, AL-BATRAN S E, HARTMANN F, et al. Stromal antigen targeting by a humanised monoclonal antibody:an early phase Ⅱtrial of sibrotuzumab in patients with metastatic colorectal cancer [J]. Onkologie, 2003, 26(1):44-48.
[26] WEN Y, WANG C T, MA T T, et al. Immunotherapy targeting fibroblast activation protein inhibits tumor growth and increases survival in a murine colon cancer model [J]. Cancer Sci, 2010, 101(11):2325-2332.
[27] BRENNEN W N, ROSEN D M, WANG H, et al. Targeting carcinoma-associated fibroblasts within the tumor stroma with a fibroblast activation protein-activated prodrug. [J]. J Natl Cancer Inst, 2012, 104(17):1320-1334.
[28] CONNOLLY E C, FREIMUTH J, AKHURST R J. Complexities of TGF-beta targeted cancer therapy[J]. Int J Biol Sci, 2012, 8(7):964-978.
[29] CAI J, TANG H, XU L, et al. Fibroblasts in omentum activated by tumor cells promote ovarian cancer growth,adhesion and invasiveness [J]. Carcinogenesis, 2012, 33(1):20-29.
[30] SICA A, SCHIOPPA T, MANTOVANI A, et al. Tumourassociated macrophages are a distinct M2 polarised population promoting tumour progression:potential targets of anti-cancer therapy [J]. Eur J Cancer, 2006, 42(6):717-727.
[31] MATTE I, LANE D, LAPLANTE C, et al. Profiling of cytokines in human epithelial ovarian cancer ascites [J]. Am J Cancer Res, 2012, 2(5):566-580.
[32] KO S Y, LADANYI A, LENGYEL E, et al. Expression of the homeobox gene HOXA9 in ovarian cancer induces peritoneal macrophages to acquire an M2 tumor-promoting phenotype [J]. Am J Pathol, 2014, 184(1):271-281.
[33] SCHUTYSER E, STRUYF S, PROOST P, et al. Identification of biologically active chemokine isoforms from ascitic fluid and elevated levels of CCL18/pulmonary and activation-regulated chemokine in ovarian carcinoma [J]. J Biol Chem, 2002, 277(27):24584-24593.
[34] MIZUKAMI Y, KONO K, KAWAGUCHI Y, et al. CCL17 and CCL22 chemokines within tumor microenvironment are related to accumulation of Foxp3+ regulatory T cells in gastric cancer [J]. Int J Cancer, 2008, 122(10):2286-2293.
[35] CURIEL T J, COUKOS G, ZOU L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival [J]. Nat Med, 2004, 10(9):942-949.
[36] ROBINSON-SMITH T M, ISAACSOHN I, MERCER C A, et al. Macrophages mediate inflammation-enhanced metastasis of ovarian tumors in mice [J]. Cancer Res, 2007, 67(12):5708-5716.
[37] PYONTECK S M, AKKARI L, SCHUHMACHER A J, et al. CSF-1R inhibition alters macrophage polarization and blocks glioma progression [J]. Nat Med, 2013, 19(10):1264-1272.
[38] HAGEMANN T, LAWRENCE T, MCNEISH I, et al. “Reeducating” tumor-associated macrophages by targeting NF-kappa B [J]. J Exp Med, 2008, 205(6):1261-1268.
[39] BEATTY G L, CHIOREAN E G, FISHMAN M P, et al. CD40 agonists alter tumor stroma and show efficacy against pancreatic carcinoma in mice and humans[J]. Science, 2011, 331(6024):1612-1616.
[40] BEATTY G L, TORIGIAN D A, CHIOREAN E G, et al. A phase I study of an agonist CD40 monoclonal antibody (CP-870,893) in combination with gemcitabine in patients with advanced pancreatic ductaladenocarcinoma [J]. Clin Cancer Res, 2013, 19(22):6286-6295.
[41] TSAGOZIS P, ERIKSSON F, PISA P. Zoledronic acid modulates antitumoral responses of prostate cancer-tumor associated macrophages [J]. Cancer Immunol Immunother, 2008, 57(10):1451-1459.
[42] LOBERG R D, YING C, CRAIG M, et al. Targeting CCL2 with systemic delivery of neutralizing antibodies induces prostate cancer tumor regression in vivo [J]. Cancer Res, 2007, 67(19):9417-9424.
[43] PIENTA K J, MACHIELS J P, SCHRIJVERS D, et al. Phase 2 study of carlumab (CNTO 888), a human monoclonal antibody against CC-chemokine ligand 2 (CCL2), in metastatic castration-resistant prostate cancer [J]. Invest New Drugs, 2013, 31(3):760-768.
[44] ZOLLO M, DI DATO V, SPANO D, et al. Targeting monocyte chemotactic protein-1 synthesis with bindarit induces tumor regression in prostate and breast cancer animal models [J]. Clin Exp Metastasis, 2012, 29(6):585-601.
[45] MONK B J, HERZOG T J, KAYE S B, et al. Trabectedin plus pegylated liposomal doxorubicin in recurrent ovarian cancer [J]. J Clin Oncol, 2010, 28(19):3107-3114.
[46] ALLAVENA P, SIGNORELLI M, CHIEPPA M, et al. Antiinflammatory properties of the novel antitumor agent yondelis (trabectedin):inhibition of macrophage differentiation and cytokine production[J]. Cancer Res, 2005, 65(7):2964-2971.
[47] GERMANO G, FRAPOLLI R, BELGIOVINE C, et al. Role of macrophage targeting in the antitumor activity of trabectedin [J]. Cancer Cell, 2013, 23(2):249-262.
[48] CIESLEWICZ M, TANG J, YU J L, et al. Targeted delivery of proapoptotic peptides to tumor-associated macrophages improves survival[J]. Proc Natl Acad Sci U S A, 2013, 110(40):15919-15924.
[49] LIS R, TOUBOUL C, HALABI N M, et al. Mesenchymal cell interaction with ovarian cancer cells induces a background dependent pro-metastatic transcriptomic profile[J]. J Transl Med, 2014, 12:59.
[50] NIEMAN K M, KENNY H A, PENICKA C V, et al. Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth[J]. Nat Med, 2011, 17(11):1498-1503.
Advances in cancer stromal cells and their association with ovarian cancer therapy
LIANG Fan1,2,CHEN Yaping1,YANG Gong2,3(1.Department of Gynecology and Obstetrics,the 5thPeople's Hospital Affiliated to Fudan University;Department of Gynecology and Obstetrics,Shanghai Medical College,Fudan University,Shanghai 200240,China;2.Central Laboratory,the 5thPeople's Hospital Affiliated to Fudan University;Department of Gynecology and Obstetrics,Shanghai Medical College,Fudan University,Shanghai 200240,China;3.Cancer Research Laboratory,Fudan University Shanghai Cancer Center;Depatment of Oncology,Shanghai Medical College,Fudan University,Shanghai 200032,China)
[Key words]Ovarian cancer;Tumor stroma;Endothelial cells;Fibroblasts;Macrophages;Targeted therapy
[Abstract]Ovarian cancer bears the highest mortality in gynecologic cancer,and its 5-year survival rate is about 30%. Although 70% to 80% ovarian cancer is epithelial origin,increasing evidence indicates that reciprocal interactions between tumor cells and various types of stromal cells also play important roles in driving ovarian tumor progression and that these stromal cells represent attractive therapeutic targets. This review discusses the biological significance of the cross-talk between ovarian cancer cells and three major types of stromal cells (endothelial cells,fibroblasts and macrophages) and the development of new-generation therapies that target the ovarian tumor microenvironment.
DOI:10.3969/j.issn.1007-3969.2016.04.011
中图分类号:R737.31
文献标志码:A
文章编号:1007-3639(2016)04-0351-07
通信作者:陈亚萍 E-mail:chenyaping@5thhospital.com
收稿日期:(2015-11-12 修回日期:2016-01-27)
