Ca2+在顺铂诱导人卵巢癌SKOV3细胞自噬反应中的作用
2016-06-13曾林川邓慧敏窦茗瀚吉林医药学院公共卫生学院吉林吉林303吉林医药学院医学科研实验室吉林吉林303
曾林川,邓慧敏,陈 君,窦茗瀚,徐 冶.吉林医药学院公共卫生学院,吉林 吉林 303;.吉林医药学院医学科研实验室,吉林 吉林 303
Ca2+在顺铂诱导人卵巢癌SKOV3细胞自噬反应中的作用
曾林川1,邓慧敏2,陈 君2,窦茗瀚2,徐 冶2
1.吉林医药学院公共卫生学院,吉林 吉林 132013;2.吉林医药学院医学科研实验室,吉林 吉林 132013
[摘要]背景与目的:Ca2+在维持细胞生物活性方面扮演着很重要的角色,其在细胞内的储存、释放和摄取主要受内质网调节,细胞内Ca2+浓度的稳态是维持细胞生物能量代谢、蛋白质折叠和分泌的基础条件。本研究探讨Ca2+在顺铂诱导SKOV3细胞内质网应激-自噬反应中的作用机制。方法:取人卵巢癌SKOV3细胞系为研究对象,按以下步骤分组:① 探讨顺铂诱导内质网应激与自噬反应,用6 μg/mL的顺铂处理SKOV3细胞0、6、12和24 h;② 了解顺铂和毒胡萝卜内酯(thapsigargin,TG)诱导内质网应激释放的Ca2+与自噬的关系,分别用TG和顺铂处理SKOV3细胞0、9和12 h;③ 探究Ca2+对自噬的作用机制,分成对照组、顺铂组、TG组、BAPTA-AM组、顺铂联合BAPTA-AM组和TG联合BAPTA-AM组。用蛋白[质]印迹法(Western blot)检测内质网应激相关蛋白GRP78和自噬标志性蛋白LC3蛋白的表达水平;用Fluo-4钙离子荧光探针检测细胞质中的Ca2+浓度变化;间接免疫荧光染色后,用共聚焦显微镜检测LC3蛋白的表达情况。结果:SKOV3细胞经6 μg/mL顺铂作用6 h时GRP78灰度值(1.393±0.004)与其对照组(0.679±0.011)相比显著提高(t=113.2,P=0.000),在12 h时LC3灰度值(0.072±0.002)与其对照组(0.038±0.000)相比显著提高(t=25.5,P=0.000)。间接免疫荧光结果显示,顺铂(6 μg/mL)组和TG(3 μmol/L)组随作用时间的延长,细胞内LC3荧光斑点会逐渐增多,并伴随着细胞质Ca2+浓度上升。后经钙离子络合剂BAPTA-AM干预后,细胞内LC3荧光强度进一步增强。Westren blot结果显示,顺铂组LC3灰度值(0.039±0.000)小于顺铂联合BAPTA-AM组(0.071±0.001),TG组(0.035±0.001)小于TG联合BAPTA-AM组(0.065±0.001),差异有统计学意义(P=0.000)。结论:顺铂诱导SKOV3细胞内质网应激和自噬的发生,并伴随着细胞质内Ca2+浓度的上升。络合细胞质内Ca2+能增强顺铂诱导的自噬反应。
[关键词]顺铂;Ca2+;内质网应激;自噬
Correspondence to:XU YeE-mail:xuye_9707@163.com
卵巢癌是临床上常见的妇科恶性肿瘤之一,发病率高居女性最常见癌症的第3位,严重威胁女性的生命健康。由于卵巢癌早期没有具体的临床症状,再加上很多女性忽视了定期体检,造成绝大多数女性到卵巢癌晚期才被发现[1-2]。目前,卵巢癌在我国的死亡率高达3.13/10万[3]。临床上治疗卵巢癌的主要手段是化疗,顺铂是临床上治疗癌症的主要化疗药物之一,它的主要抗癌机制是抑制癌症细胞的DNA复制过程[4]。已有研究报道,顺铂在诱导卵巢癌细胞凋亡过程中促发了内质网应激和自噬,抑制自噬增加了卵巢癌细胞对顺铂的敏感性[5]。
自噬是细胞吞噬自身蛋白质或细胞器并使之包被进入囊泡,最终与溶酶体融合降解其内容物的过程,自噬在细胞器的更新、体内蛋白质的平衡和细胞内环境的稳定方面发挥着主要的作用。同时,自噬也是程序性细胞死亡的一种形式。因此,自噬是细胞内的一把双刃剑,但自噬在细胞内的作用以前者为主[6]。最近,越来越多的文献表明,Ca2+在自噬发生过程中发挥重要的作用[7-8]。Ca2+是细胞的重要第二信使之一,在维持细胞代谢、增殖、分化和凋亡过程中发挥着重要的作用。细胞内的Ca2+浓度依赖于内质网中Ca2+的释放和细胞外Ca2+的摄入。内质网应激会诱导细胞内Ca2+浓度的增高和自噬的增强[9-10]。本文旨在探讨Ca2+在顺铂诱导卵巢癌细胞发生自噬中的作用。
1 材料和方法
1.1实验材料
本研究所用的人卵巢癌细胞株SKOV3购自中国科学院,RPMI 1640培养基和胎牛血清由Hyclone公司提供,BAPTA-AM、钙离子探针Fluo-4和顺铂均购自美国Sigma公司,LC3B抗体、GRP78抗体和β-actin抗体均购自美国Santa Cruz公司,PVDF膜(0.45 μm)购自Millipore公司。其他试剂为进口或国产分析纯。
1.2细胞培养
人卵巢癌细胞株SKOV3用含10%胎牛血清、青霉素(100 U/mL)和链霉素(100 U/mL)的RPMI 1640培养液培养,置于37℃、CO2体积分数为5%、饱和湿度的培养箱中培养。每天换液1次,待细胞生长至对数生长期时,用0.25%胰酶进行消化,按1∶4比例进行传代,待细胞传至第3代后进行实验。实验分组:① 探讨顺铂诱导内质网应激与自噬的关系,按顺铂给药时间分成0、6、12和24 h 4组;② 观察顺铂和毒胡萝卜内酯(thapsigargin,TG)诱导内质网应激释放的Ca2+与自噬的关系,分别检测0、9和12 h 3个时间点;③ 探讨Ca2+对自噬的影响,实验分为对照组、顺铂组、TG组、BAPTA-AM组、顺铂联合BAPTA-AM组和TG联合BAPTA-AM组。每次实验重复3次。
1.3Fluo-4检测细胞质内Ca2+
将SKOV3细胞用不含乙二胺四乙酸的胰蛋白酶消化,收集总细胞。计数后,按每孔5×104个细胞铺在24孔板内,放置在恒温培养箱中过夜。第2天,细胞长至80%密度,实验组分为顺铂(6 μg/mL)和TG(3 μmol/L)9、12 h两组和无药物作用的阴性对照组,每组设3个对照组。吸出每孔药物,并加入D-Hanks液洗3次,然后各加入稀释后的Fluo-4(5 μmol/L)。30 min后用D-Hanks液洗3次,处理完后在激光扫描共聚焦显微镜下观察并取图分析。
1.4间接免疫荧光法检测自噬标志性蛋白LC3
高压消毒后无菌盖玻片置于24孔板中,取细胞密度1×105/mL,每孔500 μL接种过夜,第2天,细胞长至80%密度,实验组分别用顺铂6 μg /mL处理9、12 h,同时设置未加顺铂的阴性对照组。弃去培养基,加入200 μL固定液(4%多聚甲醛)作用10 min,吸去固定液加0.01 mol/L 的PBS洗涤后,爬片固定后经0.1%的PBS-Triton作用5 min,用0.01mol/L的PBS洗涤,非免疫山羊血清封闭30 min,加入预混的一抗4 ℃过夜,用0.01mol/L的PBS洗涤,加入预混的荧光二抗Alexa Fluor 488抗兔的IgG抗体作用30 min,用0.01 mol/L的PBS洗涤,抗荧光淬灭剂封片,用激光共聚焦显微镜观察并取图分析。
1.5蛋白[质]印迹法(Western blot)检测
通过Western blot检测人卵巢癌SKOV3细胞中内质网应激和自噬反应中相关蛋白的表达。提取细胞总蛋白,不同的药物处理后,经消化收集到离心管中,175×g离心取上清液转移到1.5 mL离心管中,进一步混匀,4 ℃,900×g再次离心。吸净上清液,每管加入200~300 μL 的RIPA蛋白裂解液(含1%PMSF),超声5 s左右打碎基因组后4 ℃放置45 min(以上全程冰上操作)。Bradford法测蛋白浓度,-20 ℃备用。取待测样本按30~60 μg上样,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳常规电泳、半干转膜法将蛋白转移至PVDF膜,5%脱脂奶粉封闭、一抗4 ℃过夜,二抗温育2 h,用0.01 mol/L的PBS洗膜3次,1次15 min,2次5 min,加ECL显色液进行显影结果。数据采用天能图像分析系统以及Quantity One软件进行分析。
1.6统计学处理
2 结果
2.1顺铂诱导SKOV3细胞内GRP78表达和LC3的活化
用顺铂6 μg/mL处理SKOV3细胞0、6、12和24 h。Western blot检测结果表明,顺铂能够诱导SKOV3细胞GRP78和LC3高表达,且GRP78表达增强早于LC3,差异有统计学意义(P<0.05,图1)。
2.2顺铂诱导SKOV3细胞细胞质内Ca2+水平的增加和LC3的活化
根据上述实验结果,用共聚焦显微镜观察细胞质中Fluo-4所标记的Ca2+荧光,通过间接免疫荧光法检测自噬标记蛋白LC3。结果显示,TG和顺铂处理9 h后,SKOV3细胞内荧光强度增强,表明细胞质中的Ca2+水平增加;与此同时,LC3荧光结果显示,细胞质中出现荧光斑点,说明顺铂和TG在诱导自噬的活化过程中,可能与细胞质中Ca2+浓度变化有关(图2)。2.3BAPTA-AM增强顺铂和TG所诱导LC3的表达免疫荧光结果显示,10 μmol/L BAPTA-AM作用于SKOV3细胞后出现LC3荧光小斑点。分别用6 μg/mL顺铂和3 μmol/L TG联合钙离子络合剂BAPTA-AM时,LC3的绿色荧光要明显强于各自的单独作用组(图3)。此外,采用Western blot对顺铂和TG的单独作用组及各自联合钙离子络合剂后的LC3蛋白表达结果进行验证,结果显示,LC3的蛋白表达情况与LC3免疫荧光结果一致,差异有统计学意义(P<0.05,图4)。

图1 Western blot检测顺铂对SKOV3细胞GRP78、LC3蛋白表达的影响Fig. 1 Western blot detection of the expression of GRP78 and LC3 in SKOV3 cells treated with 6 μg/mL cisplatin

图2 共聚焦显微镜观察顺铂和TG处理不同时间后SKOV3细胞细胞质中Ca2+浓度变化和LC3蛋白的表达Fig. 2 Observation of the distribution of Ca2+and LC3 in the cytoplasm of SKOV3 cells treated with 6 μg/mL cisplatin or 3 μmol/L TG for 0,9,and 12 h by confocal microscopy
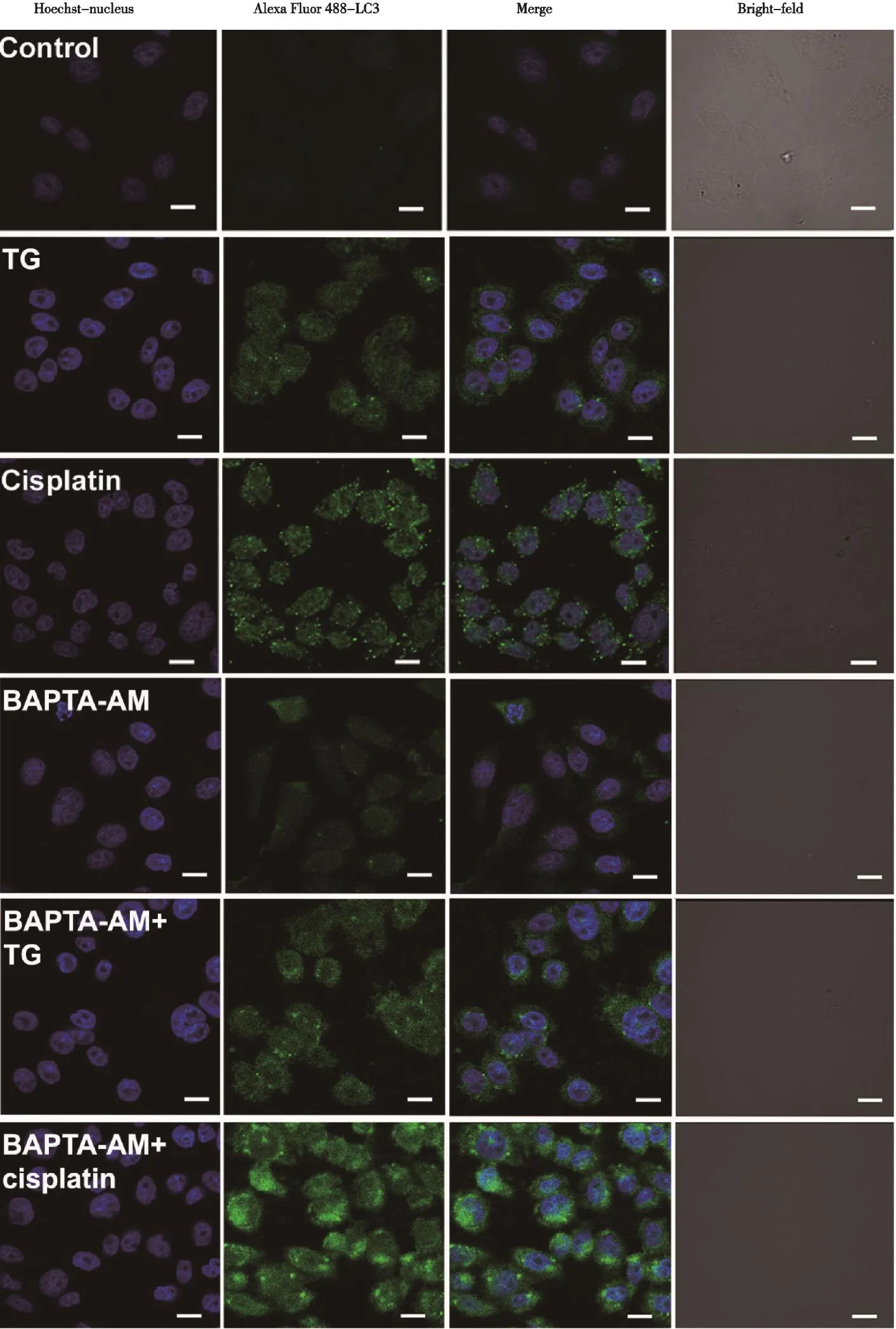
图3 免疫荧光染色检测顺铂、TG、BAPTA-AM及联合用药组中LC3蛋白的表达情况Fig. 3 Immunofuorescence staining for the LC3 expressions in SKOV3 cells treated with cisplatin,TG and/or BAPTA-AM
(×1 200)


图4 Western blot检测顺铂、TG、BAPTA-AM以及联合用药组中LC3蛋白的表达情况Fig. 4 Western blot analysis for the protein expressions of LC3Ⅱ/LC3Ⅰin SKOV3 cells treated with cisplatin,TG and/or BAPTA-AM
3 讨论
内质网应激与自噬之间复杂的调控机制,具有促进细胞存活和死亡的双向选择效应[11-12]。通过揭秘内质网应激与自噬复杂网络,有可能提高化疗药物的治疗效果和克服肿瘤的耐药性[13-14]。GRP78作为一种内质网伴侣蛋白,在内质网应激状态下会高表达,被视为内质网应激反应的标志性蛋白[15]。细胞发生自噬时,参与自噬体形成的LC3蛋白活化,由LC3-Ⅰ转化为脂质化的LC3-Ⅱ。LC3-Ⅱ/ LC3-Ⅰ比值的多少在某种程度上反映了细胞的自噬活性[16]。本实验结果显示,顺铂作用SKOV3细胞6 h时,GRP78蛋白就已经明显上调,然而,LC3蛋白的表达发生12 h左右。这说明顺铂能诱导SKOV3细胞发生内质网应激和自噬反应,且自噬的发生可能是内质网应激所介导的下游效应。
已有研究表明,刺激内质网内的Ca2+进入细胞质会促发自噬反应的活化[17-18],如维生素D3、离子霉素和三磷酸腺苷,TG诱导细胞中的Ca2+水平升高,通过激活Ca2+/钙调蛋白依赖激酶β使下游AMPK兴奋而诱导自噬。也有研究显示,Ca2+进入细胞质具有抑制自噬活化的作用[19],如Xestospongin B/siRNA阻滞剂,抑制内质网的Ca2+释放通道1,4,5-三磷酸肌醇受体后,会促发自噬。L型钙通道阻滞剂通过抑制钙蛋白酶活性也能诱导自噬。以上资料表明,钙信号对自噬活化起着重要的调节作用,但是具体的作用机制一直存在争议。这可能是由于探究的肿瘤细胞种类不同及技术条件限制,导致很多机制都未被阐明所引起的。随着对细胞内钙信号检测手段的完善,我们选择目前灵敏度较高的Fluo-4作为钙离子探针,检测细胞质中的Ca2+浓度的变化,运用国际公认的标准Ca2+络合工具药BAPTA-AM,探究顺铂诱导SKOV3内质网应激介导的自噬反应与细胞质中的Ca2+浓度波动的关系,并以TG作为内质网应激模型组。实验结果表明,单独顺铂或TG可以诱导SKOV3发生自噬,在联合钙离子络合剂BAPTA-AM后,自噬标志性蛋白LC3的表达明显上调。这说明缓冲顺铂和TG所诱导的细胞质中的Ca2+上升后,能够增强其下游的自噬反应。这一过程可能与溶酶体的功能有关,由于络合细胞质中的Ca2+,使得溶酶体对自噬体的降解被抑制,从而抑制了自噬的降解[20]。也有可能是由于络合了细胞质中的Ca2+,使得进入线粒体内的Ca2+减少,导致通过线粒体内呼吸链的电子流减少,三磷酸腺苷生成被抑制,激活下游AMPK途径诱导的自噬反应等[21]。
综上所述,顺铂能诱导SKOV3细胞发生内质网应激和自噬反应,并伴随着细胞质中的Ca2+浓度上升,络合细胞质中的Ca2+,增强其下游自噬反应的强度,说明细胞质中的Ca2+对自噬的发生具有抑制效应。这一结果有助于进一步探索Ca2+对自噬的调节机制,为肿瘤的治疗及药物开发提供新的思路。
[参 考 文 献]
[1] WU X, ZHI X, JI M, et al. Midkine as a potential diagnostic marker in epithelial ovarian cancer for cisplatin/paclitaxel combination clinical therapy[J]. Am J Cancer Res, 2015, 5(2):629-638.
[2] XIAO K, SUBY N, LI Y, et al. Telodendrimer-based nanocarriers for the treatment of ovarian cancer [J]. Ther Deliv, 2013, 4(10):1279-1292.
[3] DONG H, ZHANG Y, XI H. The effects of epidural anaesthesia and analgesia on natural killer cell cytotoxicity and cytokine response in patients with epithelial ovarian cancer undergoing radical resection [J]. J Int Med Res, 2012, 40(5):1822-1829.
[4] VAN HAAFTEN C, BOOT A, CORVER W E, et al. Synergistic effects of the sesquiterpene lactone, EPD, with cisplatin and paclitaxel in ovarian cancer cells [J]. J Exp Clin Cancer Res, 2015, 34(1):3-8.
[5] HE J, YU J J, XU Q, et al. Downregulation of ATG14 by EGR1-MIR152 sensitizes ovarian cancer cells to cisplatininduced apoptosis by inhibiting cyto-protective autophagy [J]. Autophagy, 2015, 11(2):373-384.
[6] TAIT S W, ICHIM G, GREEN D R. Die another way-nonapoptotic mechanisms of cell death [J]. J Cell Sci, 2014, 127(Pt 10):2135-2144.
[7] VICENCIO J M, LAVANDERO S, SZABADKAI G. Ca2+, autophagy and protein degradation:thrown off balance in neurodegenerative disease [J]. Cell Calcium, 2010, 47(2):112-121.
[8] MEDINA D L, DI PAOLA S, PELUSO I. Lysosomal calcium signalling regulates autophagy through calcineurin and TFEB [J]. Nat Cell Biol, 2015, 17(3):288-299.
[9] BITTREMIEUX M, BULTYNCK G. p53 and Ca(2+) signaling from the endoplasmic reticulum:partners in anti-cancer therapies [J]. Oncoscience, 2015, 2(3):233-238.
[10] SHEN S, ZHANG Y, ZHANG R, et al. Ursolic acid induces autophagy in U87MG cells via ROS-dependent endoplasmic reticulum stress [J]. Chem Biol Interact, 2014, 21(8):28-41.
[11] MALLICK A, MORE P, GHOSH S, et al. Dual drug conjugated nanoparticle for simultaneous targeting of mitochondria and nucleus in cancer cells [J]. ACS Appl Mater Interfaces, 2015, 7(14):7584-7598.
[12] DECUYPERE J P, BULTYNCK G, PARYS J B. A dual role for Ca(2+) in autophagy regulation[J]. Cell Calcium, 2011, 236(1):163-170.
[13] HART L S, CUNNINGHAM J T, DATTA T, et al. ER stressmediated autophagy promotes Myc-dependent transformation and tumor growth [J]. J Clin Invest, 2012, 122(12):4621-4634.
[14] SCHONTHAL A H. Endplasmic reticulum stress and autophagy as targets for cancer therapy [J]. Cancer Lett, 2008, 275(2):163-169.
[15] MATSUMURA K, SAKAI C, KAWAKAMI S, et al. Inhibition of cancer cell growth by GRP78 siRNA lipoplex via activation of unfolded protein response [J]. Biol Pharm Bull, 2014, 37(4):648-653.
[16] KLIONSKY D J, ABDALLA F C, ABELIOVICH H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy [J]. Autophagy, 2012, 48(4):445-544.
[17] HOYER-HANSEN M, BASTHOLM L, SZYNIAROWSKI P, et al. Control of macroautophagy by calcium, calmodulindependent kinase kinase-beta, and Bcl-2 [J]. Mol Cell, 2007, 25(2):193-205.
[18] GAO W, DING W X, STOLZ D B, et al. Induction of macroautophagy by exogenously introduced calcium [J]. Autophagy, 2008, 4(6):754-761.
[19] WILLIAMS A, SARKAR S, CUDDON P, et al. Novel targets for Huntington’s disease in an TOR-independent autophagy pathway[J]. Nat Chem Biol, 2008, 4(5):295-305.
[20] WILLIAMS J A, HOU Y, NI H M, et al. Role of intracellular calcium in proteasome inhibitor-induced endoplasmic reticulum stress, autophagy, and cell death [J]. Pharm Res, 2013, 30(9):2279-2289.
[21] RIZZUTO R, DE STEFANI D, RAFFAELLO A, et al. Mitochondria as sensors and regulators of calcium signaling [J]. Nat Rev Mol Cell Biol, 2012, 13(9):566-578.
The effect of cytoplasmic Ca2+on cisplatin-induced autophagy in ovarian carcinoma SKOV3 cells and its mechanism
ZENG Linchuan1,DENG Huimin2,CHEN Jun2,DOU Minghan2,XU Ye2(1.School of Public Health,Jilin Medical University,Jilin 132013,Jilin Province,China;2.Medical Research Laboratory,Jilin Medical University,Jilin 132013,Jilin Province,China)
[Key words]Cisplatin;Ca2+;ER Stress;Autophagy
[Abstract]Background and purpose:Ca2+plays a very important role in the maintenance of cell biological functions. The storage,release and uptake capacity of Ca2+is controlled by endoplasmic reticulum (ER). Ca2+homeostasis is essential for cellular energy metabolism and proper protein folding. This study aimed to investigate the effect of cytoplasmic Ca2+on cisplatin induced ER stress-mediated autophagy in ovarian carcinoma SKOV3 and its underlying mechanism. Methods:The ovarian cancer SKOV3 was used as a study object. The experiment consisted of three parts:① To explore the possible relationship between cisplatin-induced ER stress and autophagy,SKOV3 cells were treated with cisplatin for 0,6,12 and 24 h,respectively;② To explore the possible relationship between ER stress induced Ca2+efux and autophagy,SKOV3 cells were treated with cisplatin for 0,9 and 12 h,respectively,and TG was used asa positive control;③ To explore the effects of blocking calcium efux on autophagy,SKOV3 cells were divided into control group,cisplatin group,TG group,BAPTA-AM group,cisplatin combined with BAPTA-AM group and TG combined with BAPTA-AM group. Western blot was used to detect the protein levels of GRP78 and LC3. Fluo-4 calcium fluorescent probe was used to examine cytoplasmic Ca2+levels. Confocal microscopy was used to detect LC3 level by immunoflurescence staining. Results:Compared to control group (0.679±0.011),GRP78 was significantly accumulated at 6,12 and 24 h after cisplatin treatment and reached the maximum value at 6 h (1.393±0.004,P=0.000). Similarly,compared to control group (0.038±0.000),LC3 puncta were clearly seen after cisplatin treatment and reached the maximum value at 12 h (0.072±0.002,P=0.000). Using confocal microscopy,we found that cisplatin and TG increased LC3 punctate accumulation and cytoplasmic Ca2+levels in a time-dependent manner. Immunofluorescent method showed that treatment with cisplatin combined with BAPTA-AM or TG combined with BAPTA-AM increased LC3 punctate accumulation induced by cisplatin or TG. The results of Western blot showed that cisplatin combined with BAPTA-AM (0.071±0.001) or TG combined with BAPTA-AM (0.065±0.001) significantly increased LC3Ⅱ/LC3Ⅰ ratio induced by cisplatin (0.039±0.000,P=0.000) or TG (0.035±0.001,P=0.000). Conclusion:Cisplatin induces intracellular ER stress and autophagy in SKOV3 cells,accompanied by increased cytoplasmic Ca2+levels. Chelating cytoplasmic Ca2+enhances cisplatin-induced autophagy.
DOI:10.3969/j.issn.1007-3969.2016.04.005
中图分类号:R737.31
文献标志码:A
文章编号:1007-3639(2016)04-0313-07
基金项目:国家自然科学基金面上项目(81372793);吉林省教育厅十三五科技项目(2016237);2014吉林省大学生创新创业项目(2014001)。
通信作者:徐 冶 E-mail:xuye_9707@163.com
收稿日期:(2015-04-24修回日期:2015-06-07)
