乙醛脱氢酶2调节内皮祖细胞氧化应激反应的机制
2016-06-13姜其钧龚志刚李志刚丁世芳
姜其钧,龚志刚,李志刚,丁世芳
乙醛脱氢酶2调节内皮祖细胞氧化应激反应的机制
姜其钧,龚志刚,李志刚,丁世芳
摘要
目的:探讨乙醛脱氢酶2( ALDH-2)在内皮祖细胞(EPCs) 的氧化应激反应中的调节作用和机制。
方法:培养人外周血EPCs,分别用空白对照、1 μmol/L ALDH-2特异性激活剂 (Alda-1)、1 μmol/L叔丁基过氧化氢(tBHP)和1 μmol/L Alda-1预处理+1 μmol/L tBHP干预,再分别用2',7'-Dichlorofluorescein diacetate (DCFH-DA)和5,5',6,6'-Tetrachloro-1,1',3,3'-tetraethyl-imidacarbocyanine iodide(JC-1)染色EPCs,检测EPCs的自由氧水平和线粒体膜电位,采用Transwell小室评价EPCs的迁移能力,采用蛋白免疫印迹(Western blot)评价EPCs的p38信号通路激活情况。
结果:tBHP干预和Alda-1预处理+ tBHP干预后的自由氧水平相对于空白对照分别为(441.7±24.8)%和(237.4±12.0)%,差异均有统计学意义(P<0.05)。空白对照、tBHP干预和Alda-1预处理+ tBHP干预的EPCs发生线粒体膜电位丢失的细胞比率分别为(5.7±2.1)%,(81.7±3.7)%和(37.4±3.2)%;EPCs的迁移细胞数分别为108±9/高倍视野,22±4/高倍视野和67±7/高倍视野,三者间差异均有统计学意义(P<0.05)。加入tBHP后EPCs 的p38信号通路增强[信号强度为空白对照的(259.1±7.7)%],激活ALDH-2后,tBHP引起的p38信号活动被减弱[为空白对照的(186.4±8.0)%]。
结论:ALDH-2能够减少EPCs氧化应激反应,减少EPCs线粒体膜损伤,保护EPCs的迁移功能。而这可能与p38信号通路有关。
关键词内皮祖细胞;乙醛脱氢酶2;氧化应激;线粒体膜电位
作者单位:430070湖北省武汉市,广州军区武汉总医院心血管内科
(Chinese Circulation Journal,2016,31:502.)
内皮祖细胞(EPCs)是成人最重要的调节血管新生和形成血管内皮的一组干细胞。它在冠心病患者血管内皮细胞修复中起关键作用。既往的研究表明EPCs具有较强的抗氧化能力,能够避免氧化应激导致的损伤。而最近的研究表明,在急性心肌梗死等严重状态下,EPCs的氧化应激显著增加,凋亡率显著增加[1],其机制还不十分明确。乙醛脱氢酶2 (ALDH-2)是机体醛类代谢中的关键限速酶,被认为能够起到明显抗氧化的作用。而最近的研究发现ALDH-2在EPCs是普遍高表达[2],但其在EPCs功能调节和抗氧化中的作用却未被全面了解。而本文的研究重点是探讨ALDH-2在EPCs的氧化应激调节中的作用及其分子机制。
1 材料和方法
1.1 材料
硫氰酸荧光素标记荆豆凝集素-I(FITCUEA-I)、0.25%的胰酶、叔丁基过氧化氢(tBHP,模拟氧化应激损伤的常用试剂,化学性质与过氧化氢(H2O2)相似,但更稳定,不易降解)、ALDH-2特异性激活剂Alda-1、2',7'-Dichlorofluorescein diacetate (DCHF-DA)和5,5',6,6'-Tetrachloro-1,1',3,3'-tetraethyl-imidacarbocyanine iodide(JC-1)均购自美国Sigma公司;Histopaque1077淋巴细胞分离液购自美国Amersham Biosciences公司;血管内皮生长因子 (VEGF),成纤维细胞生长因子(bFGF)购于英国Peprotech公司;乙酰化低密度脂蛋白(Dil-Ac-LDL)购自美国Molecular Probe公司;M199培养液,胎牛血清 (FBS)购于美国Gibco公司;24孔Transwell小室购自美国Millipore公司。
1.2 内皮祖细胞的分离与培养
采用密度梯度离心法分离人外周血单个核细胞,加入VEGF、bFGF体外诱导培养EPCs[3]。本实验取健康志愿者外周血,以1∶2比例磷酸盐缓冲液(1×PBS缓冲液,pH7.4)稀释后,缓慢移至Histopaque 1077淋巴细胞分离液上方,400×g室温离心30 min,分离出中间单个核细胞层。将分离好的单核细胞用含有10%FBS、20%FBS、VEGF10 ng/ ml、bFGF 10 ng/ml的M199培养液稀释成5×106/ ml,放置于37℃,5%二氧化碳(CO2)孵箱中培养;培养到第4天,用1×PBS洗去非贴壁细胞,换培养液继续培养;取第7天的细胞,加入2.4 mg/L DiIAc-LDL和10 mg/L FITC-UEA-I于37℃孵育1 h后,用荧光显微镜检测双染色阳性细胞百分比。另取第7天的细胞,用0.25%胰酶消化,分别加入10 mg/L藻红蛋白(PE)标记的血管内皮生长因子受体2 (VEGF-R2)单克隆抗体、10 mg/L FITC标记的CD34抗体,4℃孵育30 min后,上流式细胞仪检测细胞表面标志物表达率。于第7天,加入无血清的培养液同步化细胞24 h,进行后续实验。
1.3 细胞内自由氧水平测定
采用DCFH-DA检测细胞内自由氧水平[4]。DCHF-DA是一种通透性很强的小分子,能够迅速进入细胞内,与自由氧结合后在激发光源的作用下呈绿色荧光,是一种很好的细胞内自由氧的标记物质。培养至第8天的EPCs培养基中分为空白对照、及分别加入1 μmol/L Alda-1、1 μmol/L tBHP、1 μmol/L Alda-1预处理30 min+1 μmol/L tBHP,干预6 h后,采用1×PBS清洗2次,采用10 μmol/L DCFH-DA荧光探针的培养液替换原培养液,于37℃细胞培养箱内孵育20 min,用无血清细胞培养液洗3次以去除探针,采用荧光显微镜(激发波长488 nm)拍照检测绿色荧光强度,Image-proplus6.0软件分析荧光强度。DCF相对荧光强度(%)=处理组的荧光值/对照组的荧光值×100%。
1.4 细胞线粒体膜电位的检测
采用JC-1检测细胞内线粒体膜电位[5]。JC-1因浓度不同以不同形态存在,发射光谱各异,低浓度时为单体,呈绿色荧光,高浓度时为多聚体,呈现红色荧光。在正常细胞内,JC-1被迅速摄入细胞线粒体内,形成多聚体,呈现红色荧光或红绿混合的黄色;在线粒体膜通透性发生改变时,由于线粒体膜电位去极化,线粒体内释放JC-1,多聚体分解,红光强度减弱,胞质内JC-1逐渐以单体形式存在并呈绿色荧光。培养至第8天的EPCs培养基中分为空白对照、及分别加入1 μmol/L Alda-1、1 μmol/L tBHP、1 μmol/L Alda-1预处理30 min+1 μmol/L tBHP,干预24 h后,除去培养基,1×PBS洗2次,滴加JC-1工作液100 μl,37℃,5%CO2孵箱中培养20 min,1×Incubation Buffer洗2次,于荧光显微镜下观察细胞内膜电位丢失细胞比例。
1.5 内皮祖细胞迁移能力检测
采用Transwell小室评价EPCs的迁移能力[6]。选中间滤膜孔径为8 μm的Transwell小室,将EPCs加入上室,下室加入含VEGF的培养液,通过计算迁移入下室的EPCs数量评价EPCs的迁移能力。本实验将同步化后的EPCs用0.25%胰酶消化,用无血清的M199培养基重悬后,以2×104/孔的密度重新种植于24孔板Transwell的上室,下室加入含50 μg/L VEGF的培养基,1 h后分为空白对照、及分别加入1 μmol/L Alda-1、1 μmol/L tBHP、1 μmol/L Alda-1预处理30 min+1 μmol/L tBHP,干预30 min后,CO2孵箱孵育24 h,4%的多聚甲醛固定30 min,棉签擦去膜上侧的细胞,结晶紫染色3 min,清水洗去结晶紫,在高倍光学显微镜(×100)下计数6个随机视野的EPCs数量。
1.6 蛋白免疫印迹(Western blot)法检测
将药物干预结束之后的EPCs加入蛋白提取裂解液,于4℃裂解细胞30 min,4℃ 8000×g离心30 min,去除沉淀,加入上样缓冲液后煮沸10 min,于12%SDS-聚丙烯酰胺凝胶电泳,并转入硝酸纤维素膜,5%的无脂牛奶封闭1 h,分别给予鼠抗人磷酸化p38 IgG抗体和鼠抗人p38 IgG抗体,4℃孵育12 h,1×TBST(pH值7.4)洗3次,羊抗鼠二抗室温下孵育1 h,电化学发光(ECL)显影,Image-proplus6.0软件分析信号强度。
1.7 统计学处理
2 结果
2.1 内皮祖细胞的形态与鉴定
EPCs体外培养48 h后出现集落,4天后多数集落已经形成,于第8天后加入DiI-Ac-LDL和FITC-UEA-I染色,其中90%细胞吞噬DiI-Ac-LDL(荧光显微镜下呈红色),及FITC-UEA-I(荧光显微镜下呈绿色)染色阳性,见图1。采用FITC标记的鼠抗人CD34以及PE标记的鼠抗人VEGF-R2抗体于流式细胞仪检测细胞表面标志,CD34及VEGF-R 2阳性率分别达到80%以上细胞进行后续实验。

图1 内皮祖细胞的形态和荧光显微镜图
2.2 乙醛脱氢酶2调节内皮祖细胞的自由氧水平(图2)
结果显示相对于空白对照加入tBHP和Alda-1+tBHP后的荧光强度分别为(441.7±24.8)%和(237.4±12.0)%,差异有统计学意义(P<0.05)。
2.3乙醛脱氢酶2稳定内皮祖细胞的线粒体膜电位(图3)
结果显示空白对照、加入tBHP和加入Alda-1+tBHP膜电位丢失EPCs的比率分别为(5.7±2.1)%,(81.7±3.7)%和(37.4±3.2)%,三者间差异存在统计学意义(P<0.05)。
2.4 乙醛脱氢酶2保护内皮祖细胞的迁移能力(图4)
结果显示空白对照、加入tBHP和Alda-1 +tBHP下室EPCs的数量分别为108±9/高倍视野、22±4/高倍视野和67±7/高倍视野,三者间差异存在统计学意义(P<0.05)。
2.5 p38信号通路的作用
Western blot法检测结果示:相对于空白对照,加入tBHP后p38信号通路增强[信号强度为空白对照的(259.1±7.7)%],而激活ALDH-2后,tBHP引起的p38信号活动被减弱[信号强度为空白对照的(186.4±8.0)%]。
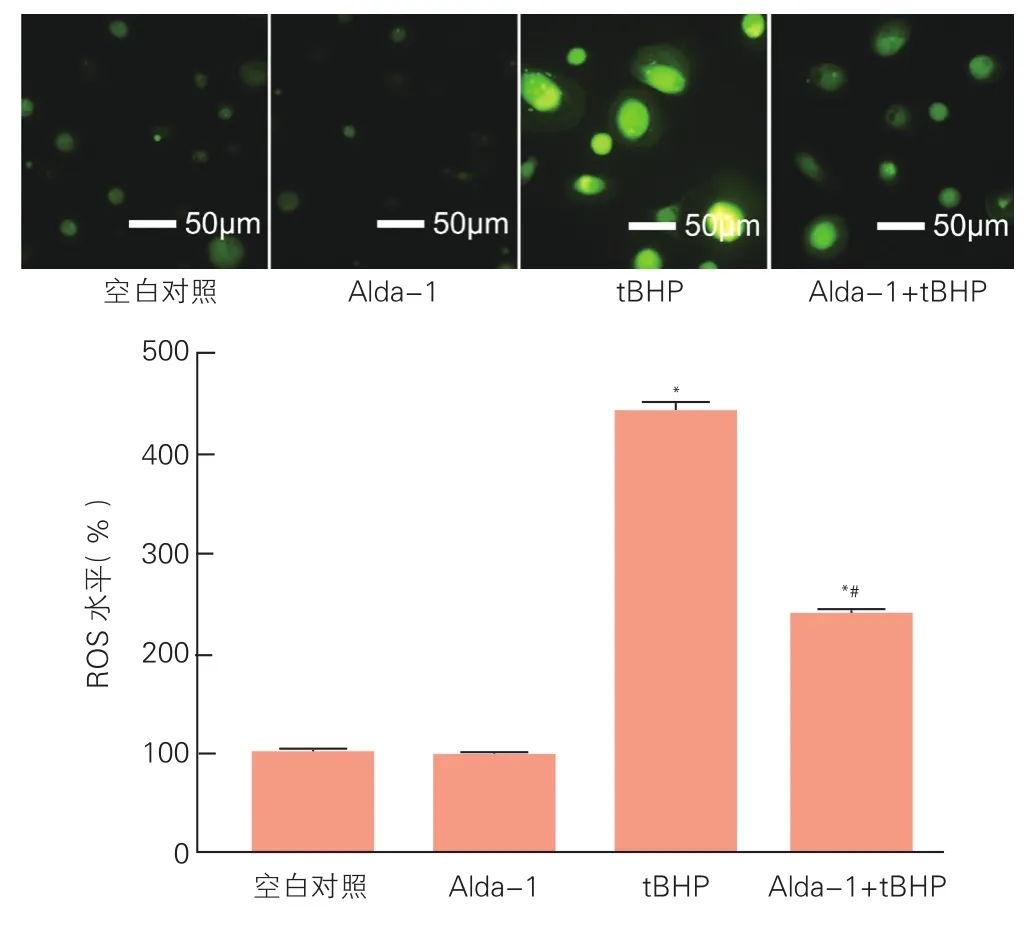
图2 DCHF-DA染色显示乙醛脱氢酶2调节内皮祖细胞的自由氧水平

图3 JC-1染色显示乙醛脱氢酶2能够稳定内皮祖细胞的线粒体膜电位
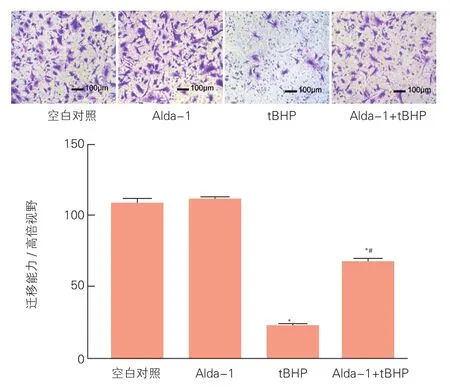
图4 Transwell小室实验显示乙醛脱氢酶2保护内皮祖细胞的迁移能力
3 讨论
EPCs在缺血组织的血管新生和损伤血管的再内皮化中发挥着至关重要的作用[7]。EPCs的功能与其抗氧化能力是密不可分的[8]。氧化应激严重影响了EPCs的数量和功能,导致内皮功能紊乱,与心血管疾病的发病机制密切相关[9]。EPCs的再生能力部分要归功于它们高表达抗氧化蛋白、产生的自由氧水平低以及对自由氧诱导的细胞凋亡的敏感性降低。既往的研究发现EPCs中同时存在超氧化物歧化酶、过氧化氢酶和过氧化物酶等重要抗氧化酶[10],但EPCs中的各种抗氧化酶的地位仍未被完全研究清楚。既往的研究发现分别抑制上述三种酶都不足以升高EPCs的自由氧水平,只有联合抑制这3种抗氧化酶才能显著增加EPCs的自由氧水平,削弱其存活和迁移能力。但是在同样的条件下,联合抑制EPCs这3种抗氧化酶后产生的自由氧水平仍然较人脐静脉内皮细胞低[11],提示还有另外的抗氧化酶在EPCs中发挥清除自由氧的作用。
本研究采用DCHF-DA评价氧化应激水平,采用JC-1评价EPCs线粒体膜电位情况。DCHF-DA是一种通透性很强的小分子,能够迅速进入细胞内,与自由氧结合后在激发光源的作用下呈绿色荧光,是一种很好的细胞内自由氧的标记物质。而JC-1常被用来评价细胞线粒体膜电位。JC-1因浓度不同以不同形态存在,发射光谱各异,低浓度时为单体,呈绿色荧光,高浓度时为多聚体,呈现红色荧光。在正常细胞内,JC-1被迅速摄入细胞线粒体内,形成多聚体,呈现红色荧光或红绿混合的黄色;在线粒体膜通透性发生改变时,由于线粒体膜电位去极化,线粒体内释放JC-1,多聚体分解,红光强度减弱,胞质内JC-1逐渐以单体形式存在并呈绿色荧光。tBHP是一种氧化剂,能够生成自由氧,具有很强的细胞毒性效应。Alda-1是一种小分子物质,可显著增强ALDH-2酶活性,目前被作为ALDH-2的外源性激活剂应用在动物和细胞实验中。我们前期的研究表明1 μmol/L tBHP可引起EPCs氧化应激,诱导EPCs凋亡[5]。本研究显示,tBHP刺激EPCs后,能引起EPCs 内 DCHF-DA的绿色荧光增强,JC-1的荧光由黄色转化为绿色,迁移能力明显降低,而激活ALDH-2后,再加入tBHP,EPCs内 DCHF-DA的荧光强度和JC-1的荧光转化现象均弱于未激活ALDH-2的时候,迁移能力明显恢复。Western blot实验还发现tBHP干预后,EPCs的p38信号增强,而预激活ALDH-2后,再加入tBHP,EPCs的p38的信号强度要弱于未预激活ALDH-2时。这说明,tBHP能引起EPCs的氧化应激反应、线粒体膜电位降低和迁移能力降低,而激活ALDH-2能够促进EPCs内的抗氧化机制,减少tBHP对EPCs的伤害,可能与p38信号通路有关。
ALDH-2可以通过保护机体对抗氧化应激损伤,抑制自由氧相关毒性产物的生成,从而起到抑制细胞凋亡发生的作用。既往的研究表明ALDH-2活性与应激对细胞造成的损伤程度密切相关;ALDH-2基因缺失型小鼠遭受到氧化应激损伤的概率较正常小鼠显著升高,且转染ALDH-2缺失型基因后细胞更易遭受四羟基壬烯醛(4-HNE)和氧化应激损伤[12];提高ALDH-2活性可拮抗氧化产物和缺血再灌注对细胞造成的损伤,然而,转染野生型ALDH-2基因能明显抑制细胞内的自由氧的生成[13]。这些结果表明ALDH-2可能是组织或细胞拮抗氧化应激损伤的重要保护因子。
ALDH-2主要通过对抗氧化应激造成的线粒体损伤起到抗氧化作用,对维持线粒体的正常功能发挥重要作用[14]。生理水平下的自由氧对转录因子激活、调节细胞功能、增殖和分化等方面具有重要意义,但过量的自由氧可导致细胞功能障碍,引起凋亡[15]。正常情况下,EPCs存在抗氧化酶系统,但是当细胞正常的氧化还原稳态失衡时,自由氧过度产生而聚积,引起氧化应激,使DNA、蛋白质和碳水化合物被氧化,引起蛋白质的氧化损伤和DNA突变,同时自由氧还可与细胞膜和线粒体膜上脂质相互作用,产生4-HNE、丙二醛(MDA)等醛类物质,增加膜通透性,破坏其完整性,导致细胞损伤、衰老和凋亡。线粒体是细胞中自由氧的主要来源[16]。ALDH-2是线粒体内的重要的醛类氧化酶,具有脱氢酶和酯酶等多种酶功能,不仅在乙醛代谢中起重要作用,还可以氧化MDA和4-HNE等氧化产物,发挥间接抗氧化作用,使其转化为无毒性的相应酸,从而对抗醛类和自由氧对细胞造成的损伤作用。因此ALDH-2失活可导致醛类物质和自由氧堆积,对机体组织、器官等造成不可逆性损伤。
综上分析,ALDH-2可能通过清除EPCs内脂质过氧化产物,减少EPCs内自由氧水平,抑制氧化应激相关信号通路的激活,保护线粒体膜电位,改善EPCs的功能,减少其凋亡。本研究为后续研究提高EPCs在缺血或缺血再灌注等高氧化应激环境中存活率的方法提供基础。
参考文献
[1]Zhang LJ,Liu WX,Chen YD,et al.Proliferation,migration and apoptosis activities of endothelial progenitor cells in acute coronary syndrome.Chin Med J,2010,123:2655-2661.
[2]Nakamura K,Tsurushima H,Marushima A,et al.A subpopulation of endothelial progenitor cells with low aldehyde dehydrogenase activity attenuates acute ischemic brain injury in rats.Biochem Biophys Res Commun,2012,418 :87-92.
[3]Jiang Q,Ding S,Wu J,et al.Norepinephrine stimulates mobilization of endothelial progenitor cells after limb ischemia.PLoS One,2014,9:e101774.
[4]Kangting J,Cheng X,Fengchun J,et al.Benzo[a]pyrene induces oxidative stress and endothelial progenitor cell dysfunction via the activation of the NF-κB pathway.Int J Mol Med,2013,31:922-930.
[5]龚志刚,姜其钧,丁世芳.虾青素对体外氧化应激诱导人外周血内皮祖细胞凋亡的影响及机制.临床心血管病杂志,2014,30:349-353.
[6]Hayakawa K,Pham LD,Arai K,et al.Reactive astrocytes promote adhesive interactions between brain endothelium and endothelial progenitor cells via HMGB1 and beta-2 integrin signaling.Stem Cell Res,2014,12:531-538.
[7]董莉,孙佳音,康丽娜,等.氨氯地平对糖尿病大鼠心肌梗死后骨髓内皮祖细胞动员及血管新生的改善作用.中国循环杂志,2014,29 :718-722.
[8]Chen S,Sun L,Gao H,et al.Visfatin and oxidative stress influence endothelial progenitor cells in obese populations.Endocr Res,2015,40:83-87.
[9]谈红,王雪,李晓燕,等.培哚普利对冠心病患者循环血内皮祖细胞及血管内皮功能的影响.中国循环杂志,2015 ,30:22-25.
[10]Marrotte EJ,Chen DD,Hakim JS,et al.Manganese superoxide dismutase expression in endothelial progenitor cells accelerates wound healing in diabetic mice.J Clin Invest,2010,120:4207-4219.
[11]He T,Peterson TE,Holmuhamedov EL,et al.Human endothelial progenitor cells tolerate oxidative stress due to intrinsically high expression of manganese superoxide dismutase.Arterioscler Thromb Vasc Biol,2004,24:2021-2027.
[12]Garcia-Bou R,Rocha M,Apostolova N,et al.Evidence for a relationship between mitochondrial Complex I activity and mitochondrial aldehyde dehydrogenase during nitroglycerin tolerance:effects of mitochondrial antioxidants.Biochim Biophys Acta,2012,1817:828-837.
[13]Zhang Y,Mi SL,Hu N,et al.Mitochondrial aldehyde dehydrogenase 2 accentuates aging-induced cardiac remodeling and contractile dysfunction:role of AMPK,Sirt1,and mitochondrial function.Free Radic Biol Med,2014,71:208-220.
[14]Garcia-Bou R,Rocha M,Apostolova N,et al.Evidence for a relationship between mitochondrial complex I activity and mitochondrial aldehyde dehydrogenase during nitroglycerin tolerance:effects of mitochondrial antioxidants.Biochim Biophys Acta,2012,1817:828-837.
[15]Song X,Wang B,Lin S,et al.Astaxanthin inhibits apoptosis in alveolar epithelial cells type II in vivo and in vitro through the ROS-dependent mitochondrial signalling pathway.J Cell Mol Med,2014,18 :2198-2212.
[16] Edalat A,Schulte-Mecklenbeck P,Bauer C,et al.Mitochondrial succinate dehydrogenase is involved in stimulus-secretion coupling and endogenous ROS formation in murine beta cells.Diabetologia,2015,58:1532-1541.
(编辑:常文静)
病例报告
Mechanism of Aldehyde Dehydrogenase-2 Regulated Human Endothelial Progenitor Cells Oxidative Stress Reaction
JIANG Qi-jun,GONG Zhi-gang,LI Zhi-gang,DING Shi-fang.
Department of Cardiology,Wuhan General Hospital of Guangzhou Military,Wuhan (430070),Hubei,China
Abstract
Objective:To investigate the role of aldehyde dehydrogenase-2 (ALDH-2) for regulating human endothelial progenitor cells (EPCs) oxidative stress reaction and its mechanism.
Methods:Human EPCs were isolated from peripheral blood of healthy adults and the cells were cultured in 4 groups:①Blank control group,②Alda-1 group,the cells were treated by 1μmol/L Alda-1,a specific activator of ALDH-2,③tBHP (10μg/ml) group and④Alda-1 pretreatment+tBHP group.EPCs reactive oxygen species (ROS) levels were evaluated by DCFH-DA staining,mitochondrial membrane potentials were detected by JC-1 method,migration capacity was measured by transwell chamber method and the activation of p38 signal pathway was examined by Western blot analysis.
Results:Compared with Blank control group,ROS levels in tBHP group and Alda-1 pretreatment+tBHP group were (441.7 ± 24.8) % and (237.4 ± 12.0) %,all P<0.05.In Blank control group,tBHP group and Alda-1 pretreatment+tBHP group,the proportion of EPCs lost their mitochondrial membrane potentials were (5.7 ± 2.1) %,(81.7 ± 3.7) % and (37.4 ± 3.2) % respectively,all P<0.05; the number of EPCs migration were (108 ± 9)/HP,(22 ± 4)/HP and (67 ± 7)/HP respectively,all P<0.05.Compared with Blank control group,the activation of p38 signal pathway increased to (259.1 ± 7.7) % in tBHP group,while it was reduced to (186.4 ± 8.0) % in Alda-1 pretreatment+tBHP group.
Conclusion:ALDH-2 could reduce ROS level in human EPCs,it may decrease mitochondrial membrane damage,protect migration which might be related to p38 signal pathway.
Key wordsEndothelial progenitor cells; Aldehyde dehydrogenase-2; Oxidative stress; Mitochondrial membrane potentials
基金项目:湖北省自然科学基金面上资助项目(2014CFC1055)
作者简介:姜其钧主治医师博士主要研究方向为冠心病的干细胞治疗Email:jqjraymond@qq.com通讯作者:丁世芳Email:DingSFMD@gmail.com
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)05-0502-06
doi:10.3969/j.issn.1000-3614.2016.05.020
Corresponding Author:DING Shi-fang,Email:DingSFMD@gmail.com
收稿日期:(2015-11-13)
