通络药物对血管内皮细胞与单核细胞黏附作用的影响
2016-06-13李红蓉位庚孙颖李辉欣梁俊清贾振华
李红蓉,位庚,孙颖,李辉欣,梁俊清,贾振华
通络药物对血管内皮细胞与单核细胞黏附作用的影响
李红蓉,位庚,孙颖,李辉欣,梁俊清,贾振华
摘要
目的:观察氧化低密度脂蛋白(ox-LDL)损伤的血管内皮细胞(HUVEC)与人白血病单核细胞(THP-1)的黏附作用,以及通络药物(通心络超微粉溶液和人参皂苷Rb1)干预的影响。
方法:采用ox-LDL建立血管内皮细胞损伤模型,将细胞分为正常对照组、模型组、通心络组和人参皂苷Rb1组。实验采用MTS比色法检测ox-LDL损伤的HUVEC的生存活性,用活细胞染色方法观察不同组HUVEC与THP-1细胞的黏附率,用酶联免疫吸附测定(ELISA)方法检测HUVEC培养上清中单核细胞趋化因子(MCP-1)、可溶性血管内皮细胞间黏附分子(sVCAM-1)、可溶性内皮细胞间黏附分子(sICAM-1)、E-选择素(E-selectin)的水平,用蛋白免疫印迹法(Western Blot)检测各组HUVEC条件培养基培养的单核细胞趋化因子受体2(CCR2)、极迟抗原4(VLA-4)、巨噬细胞分化抗原-1(Mac-1)的表达。
结果:与正常对照组(100.00±1.31)%比较,模型组HUVEC生存活性降低为正常对照组的(75.57±1.02)%,通心络组和人参皂苷Rb1组HUVEC生存活性明显分别提高了(99.25±1.40) %、(99.48±2.15) %。与正常对照组比较,模型组黏附于HUVEC的THP-1细胞数量明显增多,与模型组比较,通心络组和人参皂苷Rb1组黏附于HUVEC细胞的THP-1细胞数量减少。通心络组和人参皂苷Rb1组HUVEC细胞培养上清中MCP-1、sVCAM-1、sICAM-1、E-selectin的水平和THP-1细胞上相应受体CCR2、VLA-4、Mac-1的表达较模型组降低。上述比较差异均有统计学意义(P<0.05)。
结论:通心络和人参皂苷Rb1能够保护HUVEC,减少ox-LDL损伤的血管内皮细胞趋化、黏附分子的分泌及单核细胞上相应受体的表达,从而抑制单核细胞向受损血管内皮的趋化黏附。
关键词通心络;人参皂苷Rb1;氧化低密度脂蛋白;内皮,血管;单核细胞
作者单位:050017河北省石家庄市,河北医科大学(李红蓉、位庚);泰安市中医医院(孙颖);河北以岭医药研究院国家中医药管理局重点研究室(李辉欣、梁俊清、贾振华)
(Chinese Circulation Journal,2016,31:480.)
氧化低密度脂蛋白 (ox-LDL)等危险因素损伤血管内皮细胞(HUVEC),通过信号传导通路改变内皮细胞分泌活性,介导单核细胞对内皮细胞的黏附进而形成脂质条纹、脂质斑块是动脉粥样硬化(AS)的初始环节。通心络是络病理论指导研制的通络代表方药,具有血管、血液、心脏三重保护作用,人参作为君药有益气通络、保护血管内皮的作用。本研究观察ox-LDL损伤的HUVEC与人白血病单核细胞(THP-1)的黏附作用及通络药物(通心络超微粉溶液和人参皂苷Rb1)干预的影响。
1 材料与方法
材料:HUVEC、THP-1 (购自中国科学院上海细胞库),通心络超微粉(石家庄以岭药业),人参皂苷Rb1标准品(以下简称Rb1,购自北京中科仪友化工技术研究院),DMEM培养基、RPMI-1640培养基、胎牛血清(美国Gibco),胰蛋白酶(美国Amersco),ox-LDL(北京协生生物科技有限责任公司),3-(4,5-二甲基噻唑-2-基)-5-(3-羧酯基)-2-(4-磺苯基)-2H-四唑,内盐(MTS)细胞生存活性检测试剂(美国Promega),Hoechst 33342细胞核染料(美国AAT Bioquest),单核细胞趋化因子(MCP-1) 酶联免疫吸附测定( ELISA)试剂盒(美国abcam),可溶性细胞间黏附分子(sICAM-1)、可溶性血管细胞间黏附分子(sVCAM-1)、E-选择素(E-selectin) ELISA试剂盒(美国R﹠D Systems),兔抗人单核细胞趋化因子受体2(CCR2)、极迟抗原4 (VLA-4)、巨噬细胞分化抗原-1(Mac-1)抗体(美国abcam),BCA 蛋白定量分析试剂盒、细胞核/细胞质蛋白抽提试剂盒(美国Pierce )。多功能酶标仪(美国BioTek),转膜仪(美国Bio-Rad),odyssey扫膜仪(美国Li-Cor)、显微镜(德国ZEISS)。
通心络超微粉溶液的制备:取适量通心络超微粉溶于无血清DMEM培养基,超声促溶1 h,6 500 g离心10 min,收集上清液并用0.22 μm微孔滤器过滤除菌,离心所得沉淀于60 ℃加热烘干并称量,以校正和计算所得上清中药物浓度,于-20℃保存备用,用时稀释至目标浓度。
分组及给药:实验分为4组,正常对照组以无血清培养基培养24 h,模型组以含有ox-LDL (30 μg/ml)的无血清培养基培养24 h,通心络组(150 μg/ml ) 和人参皂苷Rb1组 (120 μg/ml) 的无血清培养基预培养4 h,再加入ox-LDL(30 μg/ml)、通心络(150 μg/ml ) 及人参皂苷Rb1(120 μg/ml ) 继续培养24 h。
各组HUVEC生存活性:将对数生长期的HUVEC以1×105/ml 接种于96孔板,10% FBS、37℃、5% CO2培养箱中静置培养,待细胞生长至90%融合,弃去原培养基。按上述方法处理细胞,每组设4个复孔,参照文献[1]用MTS比色法检测各组HUVEC生存活性。
HUVEC与THP-1黏附率测定:按前述方法将HUVEC接种于玻底96孔板常规培养,并对各组细胞进行相应处理,黏附率检测方法参照文献[2]并进行改进,将正常培养的THP-1细胞用Hoechst 33342 染料进行活细胞核染色15 min,PBS洗去多余染料,用无血清培养基重悬,以5×105/ml 密度加入到处理好的HUVEC中,共培养6 h,PBS洗去未黏附的THP-1细胞,用活细胞成像系统观察发生黏附的THP-1,用Image J图像处理系统计算各视野THP-1细胞数。
酶联免疫吸附测定法检测HUVEC培养上清中MCP-1、sVCAM-1、sICAM-1、E-selectin水平检测:按上述方法处理HUVEC,收集各组细胞培养上清,依参照文献[3]按ELISA试剂盒说明书所示检测HUVEC培养上清中MCP-1、sVCAM-1、sICAM-1、E-selectin的水平。
蛋白免疫印迹方法检测各组THP-1细胞CCR2、Mac-1、VLA-4蛋白的表达:按上述方法将HUVEC接种于6孔板,并对各组细胞进行相应处理,弃去各组细胞培养基,加入无血清培养基培养12 h,然后收集各组细胞培养上清作为条件培养基培养THP-1细胞24 h,收集各组THP-1细胞,用BCA试剂盒测定蛋白浓度,用蛋白免疫印迹方法测定各组蛋白表达情况,实验重复3次。
统计学方法:应用SPSS19.0统计学软件进行统计分析,计量资料以(±s)表示,多组间比较进行方差齐性检验和单因素方差分析,方差齐同,采用LSD方法;方差不齐,用Dunnett T3方法进行方差分析,P<0.05为差异有统计学意义。
2 结果
各组HUVEC生存活性变化的比较:与正常对照组比较(100.00±1.31)%,模型组HUVEC生存活性降低为正常对照组的(75.57±1.02)%,差异有统计学意义(P<0.01);通心络组和人参皂苷Rb1组HUVEC生存活性分别提高(99.25±1.40) %、(99.48±2.15) %,差异有统计学意义(P<0.01);通心络组与人参皂苷Rb1组间比较,差异无统计学意义(P>0.05)。
各组HUVEC与THP-1细胞黏附数量的比较:与正常对照组THP-1黏附数量[(113±31)个]比较,模型组黏附于HUVEC的THP-1数量[(877±152)个]明显增多(P<0.01);与模型组比较,通心络组和人参皂苷Rb1组黏附于HUVEC的THP-1数量减少[(304±27)个、(294±41)个],差异均有统计学意义(P<0.05)。
各组HUVEC培养上清中MCP-1、sICAM-1、sVCAM-1、E-selectin水平的比较(表1):与正常组比较,模型组HUVEC培养上清中MCP-1、sICAM-1、sVCAM-1、E-selectin水平显著升高,差异均有统计学意义(P<0.01);与模型组比较,通心络组和人参皂苷Rb1组HUVEC培养上清中MCP-1水平明显降低,差异均有统计学意义(P<0.01)。
各组THP-1细胞VLA-4、Mac-1、CCR2蛋白表达的比较(图1、表2):与正常对照组比较,经HUVEC条件培养基培养后的THP-1上趋化、黏附分子相应受体VLA-4、Mac-1、CCR2蛋白表达增加(P<0.05);与模型组比较,通心络和人参皂苷Rb1 组VLA-4、Mac-1、CCR2蛋白表达减少,差异均有统计学意义(P<0.05)。
表1 各组HUVEC培养上清中MCP-1、sICAM-1、sVCAM-1 及E-selectin表达水平的比较( n=4,±s)
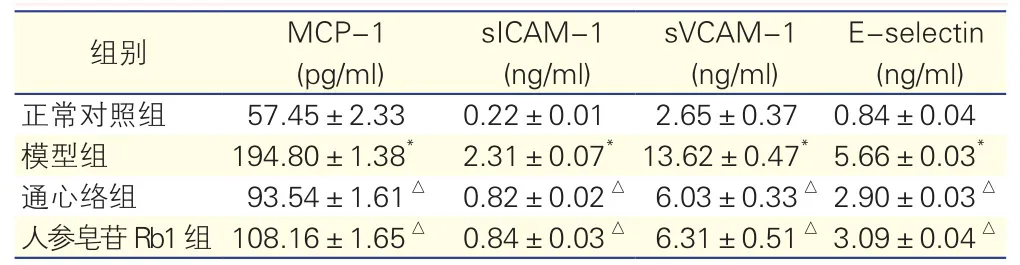
表1 各组HUVEC培养上清中MCP-1、sICAM-1、sVCAM-1 及E-selectin表达水平的比较( n=4,±s)
注:HUVEC:人脐静脉内皮细胞; MCP-1:单核细胞趋化因子;sICAM-1:可溶性细胞间黏附分子1; sVCAM-1:可溶性血管细胞间黏附分子1; E-selectin:E-选择素。与正常对照组比较*P<0.01;与模型组比较△P<0.01
组别 MCP-1 (pg/ml)sICAM-1 (ng/ml)sVCAM-1 (ng/ml)E-selectin (ng/ml)正常对照组 57.45±2.33 0.22±0.01 2.65±0.37 0.84±0.04模型组 194.80±1.38*2.31±0.07*13.62±0.47*5.66±0.03*通心络组 93.54±1.61△0.82±0.02△6.03±0.33△2.90±0.03△人参皂苷Rb1组108.16±1.65△0.84±0.03△6.31±0.51△3.09±0.04△

图1 蛋白免疫印迹法检测THP-1细胞VLA-4、Mac-1、CCR2蛋白表达
表2 THP-1细胞VLA4、Mac-1、CCR2的蛋白表达的比较(n=3,±s)
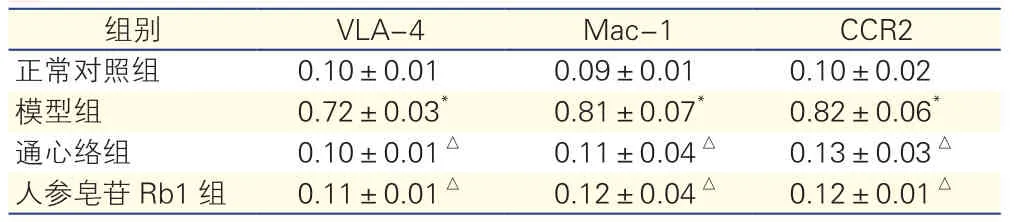
表2 THP-1细胞VLA4、Mac-1、CCR2的蛋白表达的比较(n=3,±s)
注:THP-1:白血病单核细胞。VLA4:极迟抗原4 ;Mac-1;巨噬细胞分化抗原-1;CCR2 :单核细胞趋化因子受体2。与正常对照组比较*P<0.01;与模型组比较△P<0.01
组别 VLA-4 Mac-1 CCR2正常对照组 0.10±0.01 0.09±0.01 0.10±0.02模型组 0.72±0.03* 0.81±0.07* 0.82±0.06*通心络组 0.10±0.01△ 0.11±0.04△ 0.13±0.03△人参皂苷Rb1组 0.11±0.01△ 0.12±0.04△ 0.12±0.01△
3 讨论
动脉粥样硬化以脂质堆积和炎症细胞在动脉壁聚集形成脂质条纹和粥样斑块为特征。体积较小的低密度脂蛋白(LDL)是导致动脉粥样硬化的最主要脂蛋白颗粒,LDL渗入动脉壁便开始了促进动脉粥样硬化的形成过程[4]。ox-LDL导致血管内皮细胞功能障碍,活化的血管内皮细胞表达大量的趋化、黏附分子,促进循环血中单核细胞向血管内皮滚动黏附,在趋化信号的作用下迁移进入血管内皮下层吞噬脂质形成脂质条纹的主要成分——泡沫细胞[5]。本实验中ox-LDL在30 μg/ml时导致HUVEC生存率下降至正常的75%左右,损伤后的HUVEC胞趋化、黏附分子MCP-1、sICAM-1、sVCAM-1、E-selectin表达增高,与既往研究一致[6]。
趋化、黏附分子在动脉粥样硬化的发生发展中起重要作用,E-selectin表达于炎症部位的内皮细胞,可以介导单核细胞在内皮细胞表面最初的滞留和滚动。MCP-1是趋化单核细胞向血管壁滚动的最主要趋化因子,能剂量依赖性的诱导其特异受体CCR2的表达。二者相互作用介导的钙离子内流,对动脉粥样硬化炎症反应过程中单核细胞的迁移和游走及单核细胞的募集极为重要[7]。敲除CCR2或MCP-1基因可阻断血管紧张素Ⅱ诱导的单核/巨噬细胞浸润和聚集并减轻动脉粥样硬化病变[7,8]。ICAM-1/ Mac-1、VCAM-1/VLA-4相互作用介导单核细胞与血管内皮的紧密黏附,并促进单核细胞向内皮下迁移[9]。表达于内皮细胞的ICAM-1、VCAM-1与内膜的泡沫细胞数、动脉粥样硬化病变程度呈显著正相关,血中可溶性ICAM-1、VCAM-1是反应动脉粥样硬化早期变化的指标。用单克隆抗体阻断的方法或应用P-选择素,E-selectin,ICAM-1,VCAM-1,VLA-4基因剔除小鼠进行实验发现,缺乏黏附分子的小鼠给予高脂饮食后诱发的粥样硬化斑块与模型组小鼠相比明显缩小[10]。
本实验采用ox-LDL造成HUVEC损伤,ox-LDL可明显增强HUVEC与THP-1细胞的黏附,促进MCP-1、sICAM-1、sVCAM-1、E-selectin的分泌,经ox-LDL损伤的HUVEC条件培养基对THP-1 CCR2、Mac-1、VLA4蛋白的表达也有上调作用;而通心络和人参皂苷Rb1干预可以抑制ox-LDL损伤的HUVEC 与THP-1细胞的黏附,减少MCP-1、sICAM-1、sVCAM-1、E-selectin的分泌,同时减少HUVEC条件培养基培养的THP-1细胞CCR2、Mac-1、VLA4蛋白的表达。以上结果提示,内皮细胞损伤后可以影响THP-1细胞,而通心络和人参皂苷Rb1作用后可以通过保护HUVEC,减少THP-1细胞的黏附,从而减少巨噬细胞源泡沫细胞,抑制脂质条纹和脂质斑块的形成,起到抗动脉粥样硬化作用。
单核细胞与血管内皮细胞的黏附是内皮细胞功能受损而处于激活状态的表现之一,两种细胞黏附不仅是物理接触,而且涉及单核细胞和血管内皮细胞表面诸多分子之间的相互作用,在相互作用过程中两种细胞的功能均发生相应变化,促进细胞黏附分子的表达,而细胞黏附分子介导的炎症细胞与血管内皮细胞的黏附及损伤作用则被认为是动脉粥样硬化重要的始动环节,可作为炎症活动的指标。此过程涉及多条信号通路的参与,其中血凝集素样氧化低密度脂蛋白受体1(LOX-1)的作用对于ox-LDL损伤HUVEC尤为重要,ox-LDL可浓度依赖性上调LOX-1的表达,通过与内皮细胞表面的LOX-1集合激活内皮,从而影响内皮功能,损伤血管导致动脉粥样硬化的发生发展[11]。对于通心络和人参皂苷Rb1是否是通过上述某条或某几条通路发挥作用,将进行进一步研究。
通心络胶囊是脉络学说指导研制的通络代表方药,具有血管保护、血液保护、心脏保护三重作用,在临床心脑血管疾病防治中发挥重大作用。人参是其君药,有益气通络的作用。既往研究表明,通心络胶囊和人参有保护血管内皮细胞、防治动脉粥样硬化的作用[12]。本研究通过ox-LDL造成HUVEC损伤模型,与单核细胞共培养,进一步验证了通心络及其组方成分人参皂苷Rb1具有保护血管,抑制脉络瘀阻,发挥抗动脉粥样硬化的作用。
参考文献
[1]顾梅,陈娟,汪小乐,等.MTS比色法非小细胞肺癌细胞体外对常用化疗药物的敏感性.中国临床药学杂志,2014,23:150-153.
[2]Cho YS,Kim CH,Ha TS,et al.Ginsenoside Rg2 Inhibits lipopolysaccharide-induced adhesion molecule expression in human umbilical vein endothelial cell.Korean J Physiol Pharmacol,2013,17:133-137.
[3]Wang L,Xu Y,Yu Q,et al.H-RN,a novel antiangiogenic peptide derived from hepatocyte growth factor inhibits inflammation in vitro and in vivo through PI3K/AKT/IKK/NF-kB signal pathway.Biochem Pharmacol,2014,89:255-265.
[4]史旭波,胡大一.动脉粥样硬化性心血管疾病防治中的误区.中国循环杂志,2014,29:158-160.
[5]Goyal T,Mitra S,Khaidakov M,et al.Current concepts of the role of oxidized LDL receptors in atherosclerosis.Curr Atheroscler Rep ,2012,14:150-159.
[6]Li D,Mehta JL.Antisense to LOX-1 inhibits oxidized LDLmediated upregulation of monocyte chemoattractant protein-1 and monocyte adhesion to human coronary artery endothelial cells.Circulation,2000,101:2889-2895.
[7]徐艳,刘喜平,李琴山,等.CCR2 介导 MCP-1 诱导的人内皮细胞凋亡.中国生物化学与分子生物学报,2010,26:356-361.
[8]阮长耿.血细胞的黏附分子.中国实验血液学杂志,2004,12:1-5.
[9]Lee ES,Choi JS,Kim MS ,et al.Ginsenoside metabolite compound K differentially antagonizing tumor necrosis factor-a-induced monocyteendothelial trafficking.Chem Biol Interact,2011,194:13-22.
[10]郝群,梁元姣,张承,等.脱氢表雄酮对血管内皮细胞损伤后单核细胞与内皮细胞相互作用的影响.医学研究生学报,2012,25:571-576.
[11]焦珍珍,方全,黄建凤.氧化型低密度脂蛋白对正常人外周血单核细胞凝集素样氧化低密度脂蛋白受体-1及尿激酶型纤溶酶原激活剂受体蛋白表达的影响.中国循环杂志,2014,29 :288-291.
[12]吴以岭.络病学.北京:中国中医药出版社,2006.198-216.
(编辑:曹洪红)
基础与实验研究
Effect of Dredging Collateral Drug on ox-LDL Injured THP-1 Cells Adhesion to Human Umbilical Vein Endothelial Cells in vitro
LI Hong-rong,WEI Geng,SUN Ying,LI Hui-xin,LIANG Jun-qing,JIA Zhen-hua.
Hebei Medical University,Shijiazhuang (050017),Hebei,China
Abstract
Objective:To observe the effect of oxidative-low density lipoprotein (ox-LDL) injured human leukemia mononuclear cells (THP-1) adhesion to human umbilical vein endothelial cells (HUVECs) in vitro with the intervening function of dredging collateral drug,tongxinluo (TXL) and ginsenoside (Rb1).
Methods:Cell injury was induced by ox-LDL treatment.The cells were divided into 4 groups:①Normal control group,②Injury model group,the cells were cultured by ox-LDL,③TXL group,the cells were cultured with both ox-LDL and TXL,④Rb1 group.HUVEC viability was measured by MTS assay,adherence rate of THP-1 cells to HUVECs was tested by vital cell staining.The contents of monocyte chemoat-tractant protein (MCP-1),soluble vascular cell adhesion molecule (sVCAM-1),soluble inter vascular cell adhesion molecule-1 (sICAM-1) and E-selectin in HUVEC conditioned medium were detected by ELISA; protein expressions of CCR2,VLA4 and Mac-1 in THP-1 cells were examined by Western blot analysis.
Results:Compared with Control group,HUVEC viability was decreased in Injury model group (100 ±1.31) % vs(75.57 ± 1.02) %,while increased in both TXL and Rb1 groups (99.25 ± 1.40) % and (99.48 ± 2.15) %; Injury model group showed elevated adherence rate of THP-1 cells to HUVECs,while the adherence rates were reduced in both TXL and Rb1 groups.Compared with Injury model group,TXL group and Rb1 group showed decreased levels of MCP-1,sVCAM-1,sICAM-1 and E-selectin in HUVEC conditioned medium; decreased protein expressions of CCR2,VLA4 and Mac-1 in THP-1 cells.
Conclusion:TXL and Rb1 could protect HUVECs,reduce ox-LDL injury induced vascular endothelial cell adhesion and decrease relevant receptor expression in monocytes; therefore,inhibit injured monocytes adherence to vascular endothelial cells.
Key wordsTongxinluo; Ginsenoside Rb1; Oxidative-low density lipoprotein; Endothelium,vascular; Monocytes
基金项目:国家重点基础研究发展计划 973计划(2012CB518606)
作者简介:李红蓉硕士主要从事中西医结合心血管病研究Email:hongrongli@126.com通讯作者:李红蓉
中图分类号:R541
文献标识码:A
文章编号:1000-3614(2016)05-0480-04
doi:10.3969/j.issn.1000-3614.2016.05.015
Corresponding Author:LI Hong-rong,Email:hongrongli@126.com
收稿日期:(2015-08-05)
