不同负荷运动后的恢复训练对肥胖雄性小鼠生殖功能的影响
2016-06-07陈德权吕红艳韩俊超曲广才张东军许弟群苏美华衣雪洁1
陈德权,吕红艳,韩俊超,曲广才,张东军,许弟群,苏美华,衣雪洁1,
(1.上海体育学院运动科学学院,上海200438;2.闽南师范大学体育学院,福建漳州363000;3.沈阳体育学院运动人体科学学院,辽宁沈阳110102)
不同负荷运动后的恢复训练对肥胖雄性小鼠生殖功能的影响
陈德权1,2,吕红艳3,韩俊超3,曲广才3,张东军2,许弟群2,苏美华2,衣雪洁1,3
(1.上海体育学院运动科学学院,上海200438;2.闽南师范大学体育学院,福建漳州363000;3.沈阳体育学院运动人体科学学院,辽宁沈阳110102)
肥胖是男性生殖功能低下的危险因素,运动是改善肥胖所致男性生殖功能低下的重要手段,但不同负荷运动及其运动后的恢复训练对肥胖男性生殖功能低下的影响却值得探究。方法:80只雄性C57BL/6J小鼠随机被分为标准饲料对照组(NC)、肥胖对照组(OC)、肥胖中等负荷运动组(OME)、肥胖大负荷运动组(OHE)、标准饲料恢复组(NR)、肥胖恢复组(OR)、肥胖中等负荷运动恢复训练组(OMER)、肥胖大负荷运动恢复训练组(OHER)。OME组和OMER组进行8周,2 h/d,6 d/周的游泳运动。OHE组和OHER组每天进行2次OME组或OMER组的游泳运动。OMER组和OHER组8周运动干预结束后,再进行恢复性游泳训练,1 h/天,6 d/周,4周后结束。末次运动24 h后测量体长、体重、腹腔脂肪重量、生殖腺重量(睾丸、附睾、精囊腺),测定血清黄体生成素(LH)、卵泡刺激素(FSH)、睾酮(T)浓度,显微镜下测定精子浓度和精子活力。结果:肥胖会造成雄性小鼠生殖功能的下降。中等负荷运动和大负荷运动均能显著降低小鼠肥胖程度,且大负荷运动减肥效果更好,但只有中等负荷运动能显著逆转肥胖所致雄性小鼠生殖腺系数、血清性激素水平和精液质量参数的下降。恢复性训练能进一步恢复中等负荷运动后肥胖雄性小鼠的生殖功能,但不能改善大负荷运动后肥胖雄性小鼠生殖功能的低下。结论:中等负荷运动及中等负荷运动后再进行恢复性训练均能显著改善肥胖所致雄性小鼠生殖功能的低下,而大负荷运动和大负荷运动后再进行恢复性训练均不能有效改善肥胖所致雄性小鼠生殖功能的低下。
肥胖;男性生殖功能低下;不同方式运动;恢复性训练
随着我国肥胖人口数量的增加,肥胖男性总数及占世界肥胖人口的比例已居世界首位(4 320万,16.3%)[1],肥胖对男性健康的危害日益引起人们的重视。肥胖不仅是心脑血管系统疾病、Ⅱ型糖尿病等代谢性疾病的重要致病因素,也是男性生殖功能下降的潜在危险。动物和人体研究均已证实,肥胖会降低雄性动物和男性血清卵泡刺激素(FSH)、黄体生成素(LH)、睾酮(T)浓度,升高雌二醇(E2)浓度[2-3],也会降低一次射精量、精子总数、精子浓度、精子活力、正常形态精子数量[2,4],会使精子的顶体反应受损[2,4],最终导致其正常体重的雌性配偶胚胎发育受阻[5]、正常体重女性配偶受孕率及胎儿出生率下降[6]。由此,防治或改善肥胖所致男性生殖功能的低下成为亟待解决的重要健康议题。
运动是减肥和防治肥胖相关代谢性疾病的有效方法,同时研究也发现长期进行运动不仅能逆转肥胖所致肥胖雄性小鼠的精液质量下降[2],也能升高肥胖青年男性的各项精液质量参数[7]。有研究认为长期进行运动会降低肥胖男性青少年血清睾酮(T)浓度、睾酮/皮质醇比值(T/C)[8],也会降低肥胖小鼠精液质量参数[9]。研究结果的不一致除与受试对象及体质差异有关,也与运动负荷/强度大小有关。另外,由于低强度/负荷的恢复性训练能加速大强度/大负荷训练后机体乳酸清除[10],促进内分泌和免疫机能的恢复[11-12],从而加速身体机能的恢复,但是尚无研究证实大负荷训练后进行低强度/负荷的恢复性训练对肥胖男性/雄性生殖功能的影响。因此,本研究首先采用不同负荷的运动干预体质相近的肥胖雄性小鼠,假设不同负荷运动会改善/加重肥胖雄性小鼠生殖功能的低下,然后再利用恢复性训练避免体重的反弹,保持减肥效果,探究恢复性训练对不同负荷运动干预后肥胖雄性小鼠生殖功能的影响,为长期进行中等负荷/大负荷运动以及不同负荷运动后进行恢复性训练改善/加重肥胖男性生殖功能低下提供理论依据。
1 实验材料与方法
1.1 实验动物
4~5周龄刚断乳雄性C57BL/6J小鼠80只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。小鼠饲养环境:温度(22± 5)℃,相对湿度(50±10)%,明暗周期12 h/12 h,每3 d更换一次垫料和水,5只/笼,自由进食饮水。
1.2 方法
1.2.1 动物分组 随机选取20只小鼠作为标准饲料组(ND),其余60只为高脂饲料组(HFD)。ND组进食标准啮齿类动物饲料(6%脂肪),HFD组进食高脂饲料(21%脂肪),饲料配方参照文献[2]。HFD组喂养10周后,剔除肥胖抵抗组小鼠1只,其余小鼠体重均超过标准饲料对照组体重120%,达到肥胖动物模型标准[13]。所有动物喂养10周后,ND组再分为标准饲料对照组(NC,N=10)和标准饲料恢复组(NR,N=10);HFD组再分为肥胖对照组(OC,N=9)、肥胖中等负荷运动组(OME,N=10)、肥胖大负荷运动组(OHE,N=10)、肥胖恢复组(OR,N=10)、肥胖中等负荷运动恢复组(OMER,N=10)、肥胖大负荷运动恢复组(OHER,N=10)。10周建模前后,各组小鼠的进食饲料成分保持不变。每周称量体重一次。动物分组方案见图1。
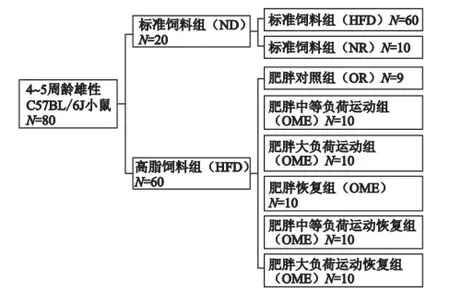
图1 实验动物分组方案
1.2.2 运动方案 运动方式为无负重游泳,水温(34±2)℃。所有运动组小鼠适应性训练2周后进行正式运动训练,6d/w,每周休息1d。运动方案及最终各组小鼠数量见表1。
1.2.3 取材与指标检测 1~4组和5~8组小鼠分别在第18、22周末次运动24 h(禁食12 h)后称体重,腹腔注射10%水合氯醛麻醉后,眼眶取血,分离血清并立即存于-80℃超低温冰箱中待测血清性激素指标。采用酶联免疫吸附法(ELISA)测定血清LH、FSH、T浓度,ELISA试剂盒购自美国R&D公司,全自动酶标仪(北京盛大公司)。
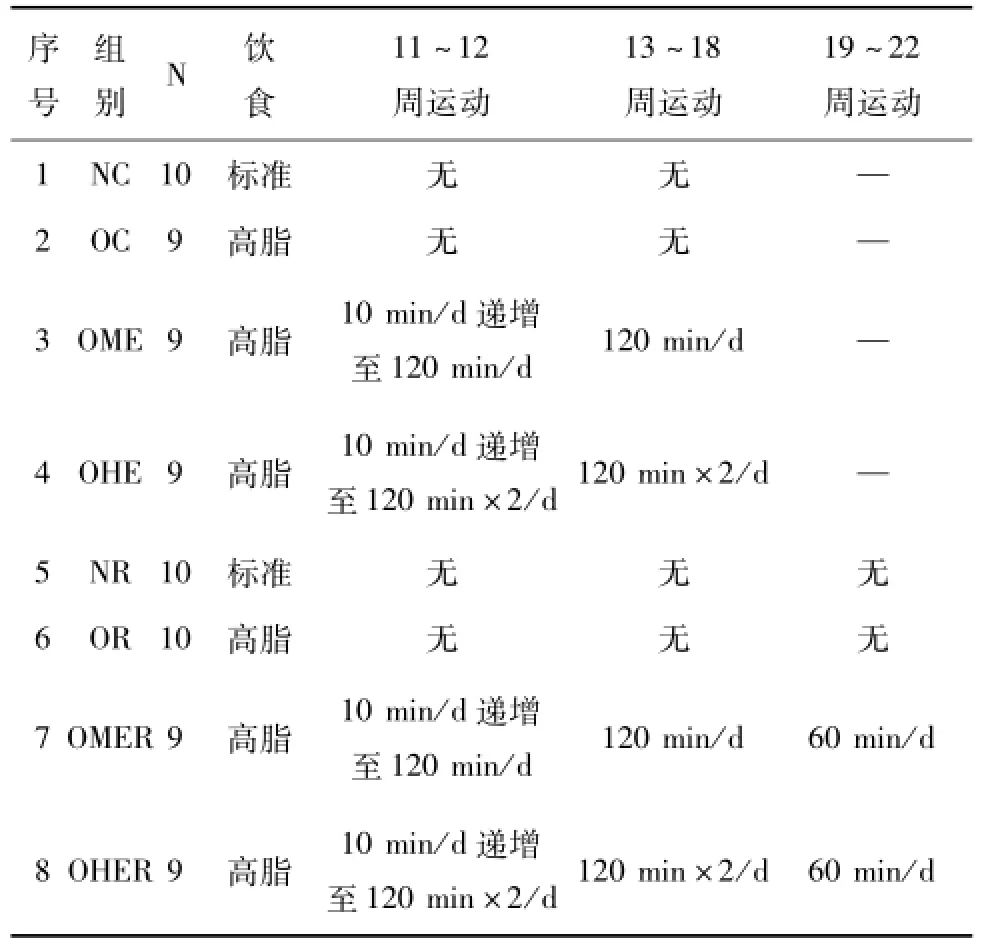
表1 各组小鼠饮食及运动方案
精子活力测定:取血后立即分离左侧附睾,在37℃1 ml生理盐水中将附睾头部和尾部分离,将附睾尾部剪成数段后轻轻挤压,使精子游离出来,迅速于室温18℃~24℃光镜下观察精子活性、并计算各级精子数量,用以计算精子活力。精子活动度的分级标准为:(0)不活动精子;(I)非持续运动精子;(II)持续运动精子。精子活力(%)=(I+II)/(0+I+II)×100%[14]。
称取腹腔脂肪、睾丸、附睾、精囊腺重量。计算Lee’s指数、睾丸系数、附睾系数、精囊腺系数:Lee’s指数=体重1/3(g)×103/体长(cm),睾丸系数=睾丸重量(g)*100/体重(g),附睾系数=附睾重量(g)*100/体重(g),精囊腺系数=精囊腺重量(g)*100/体重(g)。
1.3 统计分析
利用SPSS 18.0软件对实验结果进行统计分析。实验结果以均数±标准差表示。组内数据的假设检验采用单因素方差分析进行,然后再利用Student-Newman-Keuls post hoc进行多重比较;恢复训练前、后数据的比较、OME、OHE组与NC组的比较及OMER、OHER组与NR组的比较均采用独立样本T检验;差异显著水平为P<0.05,差异非常显著水平为P<0.01。
2 结果
2.1 肥胖建模前后小鼠体重的变化
肥胖建模前,ND组小鼠和HFD组小鼠体重没有显著性差异(P>0.05)。到第10周末,HFD组有59只小鼠体重超过ND组小鼠体重20%(P<0.01),肥胖造模成功率高达98.33%。
表2 小鼠肥胖建模前后体重比较

表2 小鼠肥胖建模前后体重比较
注:vs.ND:*P<0.05,**P<0.01。
组别N实验前/g 10周末/g ND 20 20.83±0.56 25.40±0.02 HFD 59 20.74±0.83 36.20±0.87**
2.2 体重、Lee’s指数、腹腔脂肪重量、脂体比的结果分析
图2显示,OC组/OR组体重、Lee’s指数、腹腔脂肪重量均非常显著高于NC组/NR组(P<0.01),表明OC/OR组肥胖造模成功。
运动8周后,OME组体重、Lee’s指数、腹腔脂肪重量均显著性低于OC组(P<0.01,P<0.05,P<0.01);OHE组体重、Lee’s指数、腹腔脂肪重量均非常显著低于OC组(P<0.01),OHE组Lee’s指数、腹腔脂肪重量也均显著低于OME组(P<0.05,P<0.05,P<0.01)。这说明长期进行中等负荷和大负荷的运动均能有效降低肥胖雄性小鼠的体脂,且大负荷运动的效果更好。
4周恢复训练后,NR组仅Lee’s指数显著性低于NC组(P<0.05),说明4周正常饮食没有引起小鼠体重出现非常显著变化;OR组体重显著高于OC组(P<0.05),说明4周高脂饮食引起OR组小鼠体重显著增加。OMER组体重、Lee’s指数、腹腔脂肪重量均非常显著低于OR组(P<0.01),但OMER组仅Lee’s指数显著性低于OME组(P<0.05);OHER组体重、Lee’s指数、腹腔脂肪重量也均非常显著低于OR组(P<0.01),但OHER组与OHE组相比,无显著性差异(P>0.05),这些数据说明恢复训练能维持中等负荷和大负荷运动后的减肥效果,但不能进一步降低两种负荷运动后小鼠的肥胖程度。
2.3 生殖腺重量绝对值及相对系数的结果分析如表3所示,OC组和OR组中仅OR组附睾重量绝对值非常显著高于NR组(P<0.01),但OC组与NC组相比、OR组与NR组相比,睾丸及精囊腺系数均非常显著性降低(P<0.01),同时,OR组附睾系数也显著性低于NR组(P<0.05),这表明肥胖引起雄性小鼠生殖腺形态下降。
8周运动干预后,OME组和OHE组中,仅OME组小鼠睾丸和附睾系数均显著高于OC组(P<0.05)。这说明长期进行中等负荷的运动能逆转生殖腺系数的下降,但长期大负荷的运动则不能缓解肥胖所致生殖腺系数的下降。
4周恢复性训练后,NR组与NC组相比,各指标均无显著性差异(P>0.05),说明4周鼠龄差异不会引起生殖腺形态的显著变化;OR组虽然附睾重和精囊腺中显著高于OC组(P<0.05),但相对系数均无显著性差异(P>0.05),说明4周高脂饮食也没有显著影响生殖腺形态。OMER组睾丸系数、附睾系数和精囊腺系数均显著高于OR组(P<0.05),但OHER组只有睾丸系数显著高于OR组(P<0.05),另外,OMER组与OME组相比、OHER组与OHE组相比,均只有精囊腺系数非常显著升高(P<0.01),但OMER组升高幅度更大,这些数据说明恢复训练对两种负荷运动后肥胖小鼠的生殖腺系数均有缓解作用,但对中等负荷运动后效果更明显。
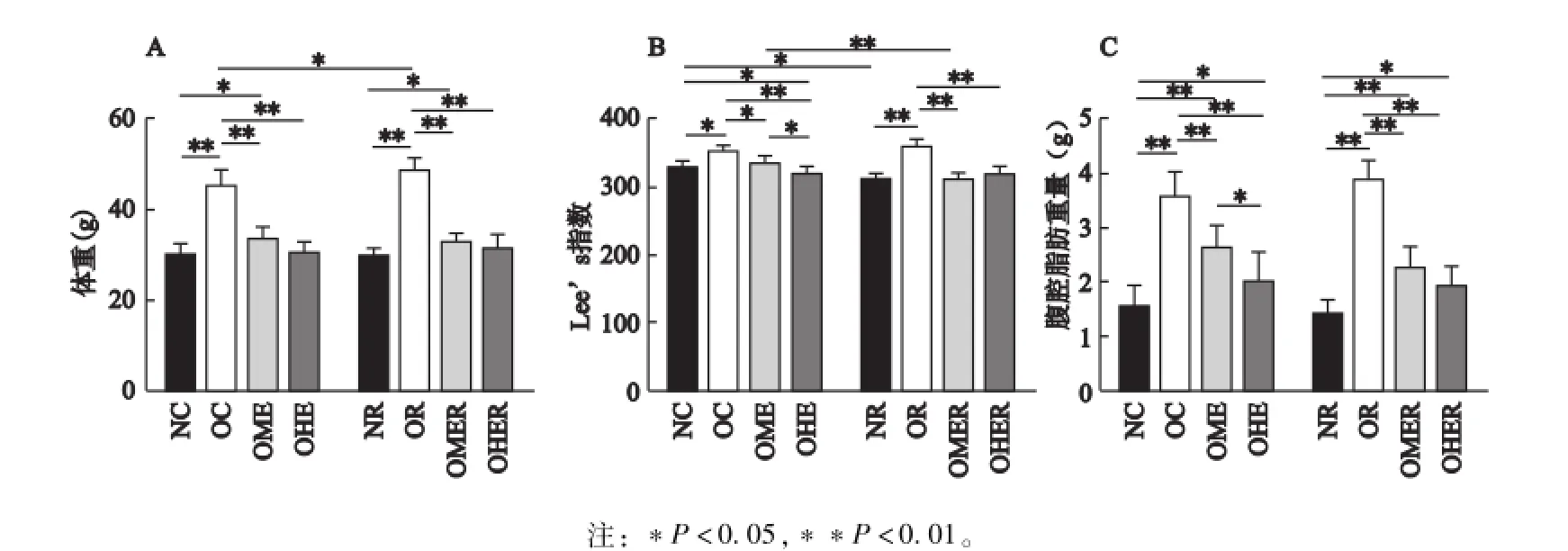
图2 各组小鼠体重、Lee’s指数、腹腔脂肪重量的对比分析
表3 各组小鼠生殖腺重量绝对值及相对系数的对比分析
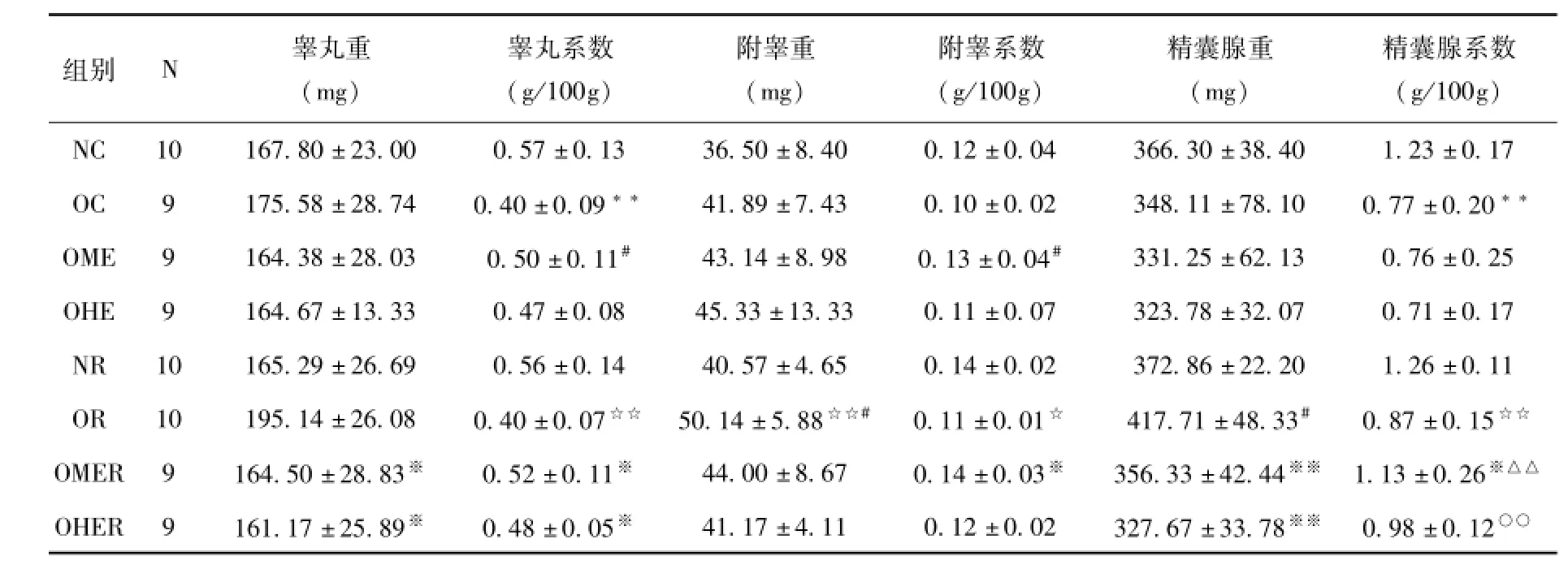
表3 各组小鼠生殖腺重量绝对值及相对系数的对比分析
注:vs.NC:*P<0.05,**P<0.01;vs.OC:#P<0.05,##P<0.01;vs.OME:△P<0.05,△△P<0.01;vs.OHE:○P<0.05,○○P<0.01;vs.NR:☆P<0.05,☆☆P<0.01;vs.OR:※P<0.05,※※P<0.01。
精囊腺系数(g/100g)NC 10 167.80±23.00 0.57±0.13 36.50±8.40 0.12±0.04 366.30±38.40 1.23±0.17 OC 9 175.58±28.74 0.40±0.09**41.89±7.43 0.10±0.02 348.11±78.10 0.77±0.20**OME 9 164.38±28.03 0.50±0.11#43.14±8.98 0.13±0.04#331.25±62.13 0.76±0.25 OHE 9 164.67±13.33 0.47±0.08 45.33±13.33 0.11±0.07 323.78±32.07 0.71±0.17 NR 10 165.29±26.69 0.56±0.14 40.57±4.65 0.14±0.02 372.86±22.20 1.26±0.11 OR 10 195.14±26.08 0.40±0.07☆☆50.14±5.88☆☆#0.11±0.01☆417.71±48.33#0.87±0.15☆☆OMER 9 164.50±28.83※0.52±0.11※44.00±8.67 0.14±0.03※356.33±42.44※※1.13±0.26※△△OHER 9 161.17±25.89※0.48±0.05※41.17±4.11 0.12±0.02 327.67±33.78※※0.98±0.12○○组别N睾丸重(mg)睾丸系数(g/100g)附睾重(mg)附睾系数(g/100g)精囊腺重(mg)
2.4 血清LH、FSH、T浓度结果分析
表4显示,OC组/OR组血清LH、FSH、T浓度均显著性低于NC组/NR组(P<0.01,P<0.05,P<0.05),这说明肥胖造成雄性小鼠血清性激素水平下降。
8周运动干预后,OME组血清LH、FSH、T浓度均显著性高于OC组(P<0.05),OHE组血清LH、FSH、T浓度与OC组相比,仅有下降的趋势(P>0.05),然而,OHE组LH、FSH、T浓度均非常显著低于OME组(P<0.01)。数据表明,中等负荷运动能逆转肥胖所致雄性小鼠血清LH、FSH、T水平的下降,而大负荷运动不仅不能缓解肥胖所致雄性小鼠性激素水平的下降,甚至有加重的趋势。
4周恢复训练后,NR组与NC组相比、OR组与OC组相比,血清性激素水平均无显著性差异(P>0.05),说明4周的正常饲料和高脂饲料对NR组和OR组小鼠血清性激素水平没有显著影响。OMER组血清LH、FSH、T浓度均显著性高于OR组(P<0.01,P<0.05,P<0.05),但OHER组血清T浓度显著低于OR组(P<0.05),同时OHER组血清LH、FSH、T浓度也均显著低于OMER组(P<0.05,P<0.05,P<0.01),另外,OMER组与OME组相比、OHER组与OHE组相比,血清性激素水平均无显著性差异(P>0.05),这些数据说明恢复训练能维持中等负荷运动对肥胖雄性小鼠性激素水平的改善作用,但不能缓解大负荷运动后雄性小鼠的性激素水平。
表4 各组小鼠血清LH、FSH、T浓度对比分析
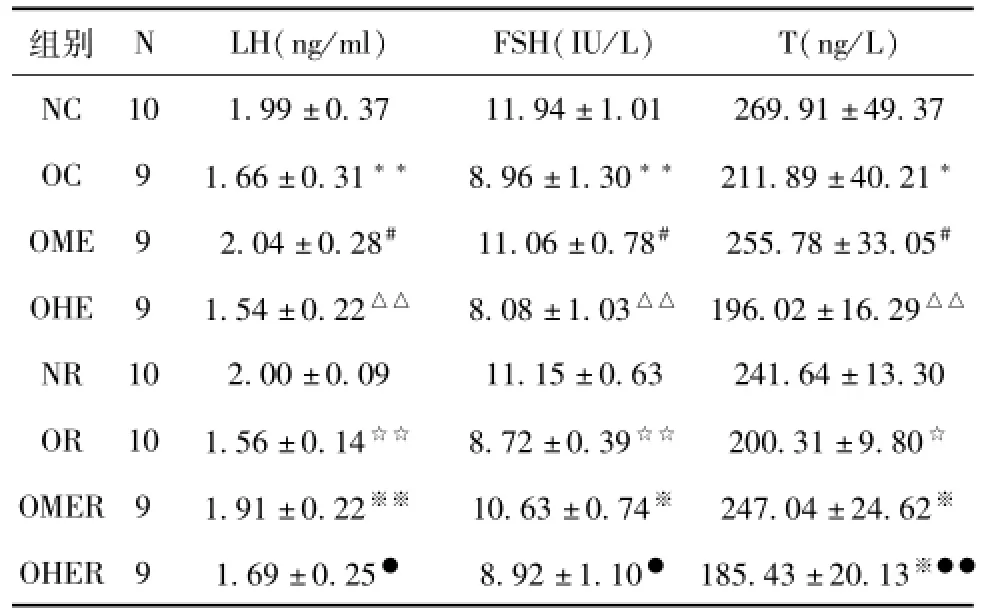
表4 各组小鼠血清LH、FSH、T浓度对比分析
注:vs.NC:*P<0.05,**P<0.01;vs.OC:#P<0.05;vs.OME:△P<0.05,△△P<0.01;vs.NR:☆P<0.05,☆☆P<0.01;vs.OR:※P<0.05,※※P<0.01;vs.OMER:●P<0.05,●●P<0.01。
组别N LH(ng/ml)FSH(IU/L)T(ng/L)NC 10 1.99±0.37 11.94±1.01 269.91±49.37 OC 9 1.66±0.31**8.96±1.30**211.89±40.21*OME 9 2.04±0.28#11.06±0.78#255.78±33.05#OHE 9 1.54±0.22△△8.08±1.03△△196.02±16.29△△NR 10 2.00±0.09 11.15±0.63 241.64±13.30 OR 10 1.56±0.14☆☆8.72±0.39☆☆200.31±9.80☆OMER 9 1.91±0.22※※10.63±0.74※247.04±24.62※OHER 9 1.69±0.25●8.92±1.10●185.43±20.13※●●
2.5 精子浓度、精子活力结果分析
如图3所示,OC组与OC组相比、OR组与NR组相比,小鼠精子浓度和精子活力均非常显著降低(P<0.01),说明肥胖造成雄性小鼠精液质量参数下降。
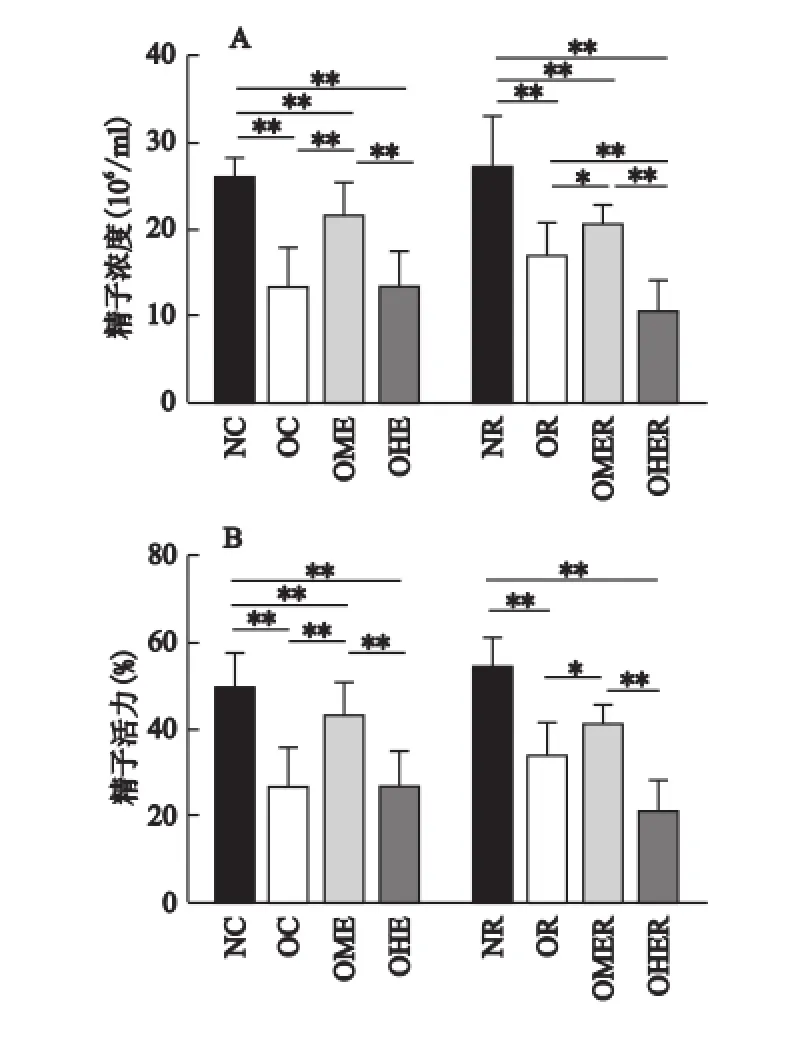
注:*P<0.05,**P<0.01。
8周训练后,OME组精子浓度和精子活力均非常显著高于OC组(P<0.01);OHE组精子活力与OC组相比仅有下降的趋势(P>0.05),但OHE组精子浓度和精子活力均非常显著低于OME组(P<0.01)。这表明中等负荷运动能改善肥胖所致精液质量参数的下降,但大负荷运动不仅没有改善作用,甚至有加重的趋势。
4周恢复训练后,NR组与NC组相比、OR组与OC组相比,精液质量参数均无显著性差异(P>0.05),说明4周的正常饲料和高脂饲料对NR组和OR组小鼠精液质量参数没有明显影响。OMER组精子浓度和精子活力均显著高于OR组(P<0.05),但OHER组精子浓度和精子活力均非常显著低于OMER组(P<0.01),另外,OMER组与OME组相比、OHER组与OHE组相比,精液质量参数均无显著性差异(P>0.05),这些数据说明恢复训练能维持中等负荷运动对肥胖雄性小鼠精液质量参数的改善作用,但不能缓解大负荷运动后肥胖雄性小鼠的精液质量参数。
3 讨论
3.1 不同负荷运动对肥胖雄性小鼠生殖功能的影响
运动是改善Ⅱ型糖尿病、高血压和骨质疏松等多种肥胖相关代谢性疾病的重要干预因素。同时,研究也发现长期进行规律的运动能逆转肥胖所致成年男性精液质量的下降[7]。但是,也有研究发现长期进行大负荷的运动会降低肥胖男孩性激素水平[8],也会引起正常体重男性LH、FSH、T水平和精液质量的下降[15]。运动对男性生殖功能的影响,不仅与运动强度/负荷大小有关,也与受试者体质有关。但不同负荷运动对相近体质的肥胖男性生殖功能的影响却不清楚。由于肥胖所致男性生殖功能的低下,也在肥胖动物实验中也得到验证[2],因此,本研究首先建肥胖动物模型,给刚断乳的雄性小鼠高脂饮食,10周后肥胖组的体重超过了正常组体重的120%,达到了肥胖动物模型的要求[13],在此基础上继续给予高脂饲料喂养,并施加不同负荷运动干预,8周后发现肥胖对照组小鼠生殖腺形态、血清性激素水平以及精液质量参数均出现明显的下降,这样的结果与之前的肥胖致雄性生殖功能低下的动物模型具有一致性[2]。
8周中等负荷和大负荷的运动均能有效降低肥胖雄性小鼠的体脂,且大负荷运动的效果更好。这表明负荷越大的运动,减肥的效果也越好。这与肥胖男孩采用大负荷运动来达到快速减肥的效果具有相似性[8]。同时本研究也发现长期进行中等负荷的运动能逆转肥胖所致雄性小鼠生殖腺系数、性激素水平和精液质量参数的下降,但是大负荷运动不仅不能改善肥胖所致雄性小鼠生殖腺系数、性激素水平和精液质量参数的下降,甚至有加重的趋势。这说明不同运动负荷虽然都有减肥的效果,但是对肥胖所致生殖功能低下的影响却是截然相反的。
中等负荷运动之所以能逆转肥胖所致小鼠生殖功能低下,一方面原因可能是中等负荷运动能降低肥胖小鼠下丘脑部位促炎因子IL-1β、IL-6表达水平[16],从而减弱上述炎症因子通过核因子-κB(NF-κB)信号通路对GnRH神经元的抑制[17],最终逆转肥胖所致LH和FSH激素水平的下降;另外,本课题组前期研究中发现,中等负荷运动可能通过逆转肥胖小鼠睾丸组织睾酮合成关键酶的下降,从而增加睾酮的合成与分泌[18]。再者,也有研究发现中等负荷运动能降低肥胖小鼠睾丸组织中氧化应激、炎症反应程度[19,20]。而肥胖所致睾丸组织中氧化应激和炎症反应程度的增加与睾酮合成酶和调节因子表达的减少、精子畸形率的增加均有密切联系[21,22]。因此,中等负荷运动可能通过上述机制逆转肥胖所致生殖腺系数、血清LH、FSH、T含量和精液质量参数的下降。
大负荷运动之所以不能改善,甚至加重肥胖所致雄性小鼠生殖功能的低下,原因可能也是多方面的。一方面大负荷运动可能引起下丘脑中IL-1β、IL-6、TNF-α表达增加[23],进一步通过NF-κB信号通路抑制GnRH神经元兴奋性,从而影响血清中LH、FSH的水平恢复正常。另一方面,有研究表明大负荷运动能降低大鼠睾丸组织中睾酮合成酶的表达,从而显著降低大鼠血清和睾丸中睾酮浓度[24],也会升高精浆中促炎因子水平,增加精浆中氧化应激水平,降低精浆抗氧化酶活性以及精液质量参数[15],因此,大负荷的运动也可能通过上述机制降低肥胖小鼠血清睾酮浓度和精液质量参数。综上所述,中等负荷运动和大负荷运动都可能主要通过下丘脑和睾丸两个层面对肥胖小鼠的生殖功能进行相反方向的调节,调节的机制可能涉及氧化应激反应、炎症反应等机制,最终对LH、FSH以及睾酮的生物合成、精液质量参数、生殖腺的结构与功能进行相反方向的调节。
3.2 恢复性训练对不同负荷运动后肥胖雄性小鼠生殖功能的影响
恢复性训练作为现代运动训练体系的重要组成部分,已经广泛用于促进运动员大负荷训练后身体机能的恢复。这是由于前期的大量研究已经证实了恢复性训练能加快大负荷训练后机体乳酸的清除[10],从而提高运动成绩。同时,也有研究发现恢复性训练能加快大负荷训练后血液中淋巴细胞和NK细胞的恢复[11],从而促进机体免疫机能的恢复。但是关于恢复性训练对大负荷训练后男性/雄性生殖功能影响的报道却较少,仅Safarinejad M R等研究发现,正常体重男性进行恢复性训练能逆转中等负荷和大负荷跑台运动后性激素水平的下降和大负荷跑台运动后精液质量参数的下降[25],但尚未发现关于恢复性训练对肥胖男性/雄性大负荷运动后生殖功能影响的报道。本研究中发现,4周的恢复训练后中等负荷和大负荷运动组小鼠的体重没有出现明显的波动,提示恢复训练能较好地保持两种负荷运动后的减肥效果。关于恢复性训练对各生殖功能参数的影响,一方面恢复训练对两种负荷运动后肥胖小鼠的生殖腺系数均有缓解作用,且对中等负荷运动后效果更明显,同时恢复训练也能维持中等负荷运动对肥胖雄性小鼠性激素水平和精液质量参数的改善作用,造成这一效果的原因,可能主要与恢复性训练能促进机体核糖体蛋白质的合成[26],有助于免疫机能的恢复[11]、从而有助于性激素的合成与分泌,也有助于精子的生成;另一方面,恢复训练虽然能缓解大负荷运动后生殖腺系数的下降,但不能改善大负荷运动后的性激素水平和精液质量参数。造成这种现象的原因,可能与本研究中恢复训练的时间仅为4周,与Safarinejad M R等[25]采用的36周恢复训练时间差异较大,因此导致大负荷运动后的恢复训练不能有效改善肥胖雄性小鼠生殖功能的低下。
4 结论
1)长期进行中等负荷和大负荷运动均能有效降低肥胖雄性小鼠的体脂,且大负荷运动效果更好。同时,中等负荷运动也能逆转肥胖所致雄性小鼠生殖功能低下,但大负荷运动则不能发挥该作用。
2)4周的恢复训练能有效地避免中、大负荷训练后的体重反弹,保持减肥效果,同时也可有效维持中等负荷运动对肥胖雄性小鼠生殖功能的逆转,但不能缓解大负荷运动后肥胖雄性小鼠生殖功能的低下。
[1]Collaboration N R F.Trends in adult body-mass index in 200 countries from 1975 to2014 a pooled analysis of 1698 population-based measurement studies with 19.2 million participants[J].Lancet,2016,387(10026):1377-1396.
[2]Palmer N O,Bakos H W,Owens JA,et al.Diet and exercise in an obese mouse fed a high-fat diet improve metabolic health and reverse perturbed sperm function[J].Am J Physiol EndocrinolMetab,2012,302(7):E768-780.
[3]Chavarro JE,Toth T L,Wright D L,et al.Body mass index in relation to semen quality,sperm DNA integrity,and serum reproductive hormone levels among men attending an infertility clinic[J].Fertil Steril,2010,93(7):2222-2231.
[4]Samavat J,Natali I,Degl’innocenti S,et al.Acrosome reaction is impaired in spermatozoa of obese men:a preliminary study[J].Fertil Steril,2014,102(5):1274-1281.
[5]Mitchell M,Bakos H W,Lane M.Paternal diet-induced obesity impairs embryo development and implantation in the mouse[J].Fertil Steril,2011,95(4):1349-1353.
[6]Umul M,Kose SA,Bilen E,et al.Effect of increasing paternal body mass index on pregnancy and live birth rates in couples undergoing intracytoplasmic sperm injection[J].Andrologia,2015,47(3):360-364.
[7]Rosety-Rodriguez M,Rosety JM,Fornieles G,et al.Home-based treadmill training improved seminal quality in adults with type2 diabetes[J].Actas Urol Esp,2014,38(9):589-593.
[8]赵大林,高海宁,王宝明,等.短期封闭式综合干预对肥胖男少年体成分、瘦素及睾酮的影响[J].沈阳体育学院学报,2011,30(6):87-89,98.
[9]高珊珊,闫旋飞,高海宁,等.不同负荷运动对雄性肥胖模型小鼠性激素和精子质量的影响[J].中国组织工程研究,2016,20(5):729-735.
[10]Kappenstein J,Engel F,Fernandez-Fernandez J,et al.Effects of active and passive recovery on blood lactate and blood pH after a repeated sprint protocol in children and adults[J].Pediatr Exerc Sci,2015,27(1):77-84.
[11]Meyer T IM,Faude O,Urhausen A,et al.Different effects of two regeneration regimens on immunological parameters in cyclists[J]. Medicine&Science in Sports&Exercise,2004,36(10):1743-1749.
[12]Faude O,Meyer T,Urhausen A,et al.Recovery training in cyclists:ergometric,hormonal and psychometric findings[J].Scand J Med Sci Sports,2009,19(3):433-441.
[13]Chandler P C,Viana JB,Oswald K D,et al.Feeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet[J].Physiol Behav,2005,85(2):221-230.
[14]WHO.WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction[M].Cambridge,UK:Cambridge University Press,1999.
[15]Hajizadeh Maleki B,Tartibian B.Long-term low-to-intensive cycling training:impact on semen parameters and seminal cytokines[J].Clin J Sport Med,2015,25(6):535-540.
[16]Lira F S,Yamashita A S,Rosa JC,et al.Hypothalamic inflammation is reversed by endurance training in anorectic-cachectic rats[J].Nutr Metab(Lond),2011,8(1):60.
[17]Zhang G,Li J,Purkayastha S,et al.Hypothalamic programming of systemic ageing involving IKK-beta,NF-kappaB and GnRH[J]. Nature,2013,497(7448):211-235.
[18]魏伟.运动对不同肥胖状态下大鼠睾丸组织睾酮生物合成的影响[D].沈阳:沈阳体育学院,2014.
[19]Santos M,Rodriguez-Gonzalez G L,Ibanez C,et al.Adult exercise effects on oxidative stress and reproductive programming in male offspring of obese rats[J].Am J Physiol Regul Integr Comp Physiol,2015,308(3):R219-225.
[20]Zhao X,Bian Y,Sun Y,et al.Effects of moderate exercise over different phases on age-related physiological dysfunction in testes of SAMP8 mice[J].Exp Gerontol,2013,48(9):869-880.
[21]Zhao J,Zhai L,Liu Z,et al.Leptin level and oxidative stress contribute to obesity-induced low testosterone in murine testicular tissue[J].Oxid Med Cell Longev,2014,2014:190945.
[22]Yan W J,Mu Y,Yu N,et al.Protective effects of metformin on reproductive function in obese male rats induced by high-fat diet[J]. J Assist Reprod Genet,2015,32(7):1097-1104.
[23]Pereira B C,Da Rocha A L,Pauli JR,et al.Excessive eccentric exercise leads to transitory hypothalamic inflammation,which may contribute to the low body weight gain and food intake in overtrained mice[J].Neuroscience,2015,311:231-242.
[24]Manna I,Jana K,Samanta PK.Effect of intensive exercise-induced testicular gametogenic and steroidogenic disorders in mature male Wistar strain rats a correlative approach to oxidative stress[J].Acta Physiol Scand,2003,178(1):33-40.
[25]Safarinejad M R,Azma K,Kolahi A A.The effects of intensive,long-term treadmill running on reproductive hormones,hypothalamus-pituitary-testis axis,and semen quality:a randomized controlled study[J].J Endocrinol,2009,200(3):259-271.
[26]Figueiredo V C,Roberts L A,Markworth JF,et al.Impact of resistance exercise on ribosome biogenesis is acutely regulated by postexercise recovery strategies[J].Physiol Rep,2016,4(2):e12670.
责任编辑:郭长寿
Effect of Recovery Training on Different Loads of Exercise on Reproductive Function in Obese Male Mice
CHEN Dequan1,2,LYU Hongyan3,HAN Junchao3,QU Guangcai3,ZHANG Dongjun2,XU Diqun2,SU Meihua2,YI Xuejie1,3
(1.School of Kinesiology,Shanghai University of Sport,Shanghai200438,China;2.School of Physical Education,Minnan Normal University,Zhangzhou 363000,Fujian,China;3.School of Kinesiology,Shenyang Sport University,Shenyang 110102,Liaoning,China)
Obesity is a deleterious factor for man’s sub-fertility and exercise is an crucial method for improving the reproductive function of obese males,but the effect of different loads of exercise and the followed recovery training on the reproductive function in obese males is worthy of exploring.Methods:80 male C57BL/6J mice were random ly divided into 8 groups:normal control(NC),obese control(OC),obese moderate-load exercise(OME),obese heavy-load exercise(OHE),normal recovery(NR),obese recovery(OR),obese moderate-load exercise and recovery training(OMER),obese heavy-load exercise and recovery training(OHER)groups.Mice in OME and OMER groups swam 2 hours/day,6 days/week,for8 weeks,and mice in OHE and OHER groups underwent twice the amount of daily exercise intervention as the OME or OMER group.After 8 weeks of exercise,mice in OMER and OHER groupswere further provided with recovery training for4 weeks.24h after the lastboutof exercise,and the body length,body weight,abdominal fat weight,and the gonads(testes,epididymis and seminal vesicle)weight of all mice were determined,luteinizing hormone(LH),follicle stimulating hormone(FSH)and testosterone level in serum were also determined,and semen quality parameters were determined by using a microscope.Results:Obesity was related with reduced reproductive function in male mice.Both moderate and heavy-load exercises were able to reduce the body fat of obese mice,and it was more significant in OHE group,but only moderate-exercise could significantly reverse the decline of gonads/body weight ratio,sex hormones level in serum and semen quality parameters in obese male mice.The recovery training was able to improve reproductive function of obesemale mice in OME group,but it couldn’t improve the reduced reproductive function of mice in OHE group.Conclusions:Both moderate-load exercise and moderate-load exercise followed with recovery training can significantly improve the reproductive function in obese male mice,but neither heavy-load exercise nor heavy-load exercise follow ed with recovery training can effectively improve the reproductive function in obese male mice.
obesity;man’s sub-fertility;different loads of exercise;recovery training
804.21
A
1004-0560(2016)05-0056-07
2016-08-09;
2016-09-17
上海体育学院研究生教育创新基金(yjscx2015019);国家自然科学基金(81273096);福建省教育厅科技项目(JA15311)。
陈德权(1981—),男,讲师,博士研究生,主要研究方向为运动生理生化。
衣雪洁(1966—),女,教授,博士,主要研究方向为运动防治代谢性疾病的基础与应用研究,E-mail:yixuejie8387@163.com。
