槐米中黄酮类成分的微乳薄层色谱分离鉴定*
2016-06-06赵惠茹郭德喜
赵惠茹,郭德喜,李 娜,靖 会,杨 静,杨 阳,侯 进
(1.西安医学院 药学院,陕西 西安 710021;2.宁夏医科大学 药学院,宁夏 银川 750004;3.陕西师范大学 西北濒危药材资源开发国家工程实验室,陕西 西安 710119;4.西安医学院 基础医学部,陕西 西安 710021)
槐米为2015版 《中国药典》 收载的豆科植物槐(SophorajaponicaL.)的干燥花蕾及花。性微寒,味苦。具有抗炎、抗病毒、祛痰、止咳、维生素P样、抑制醛糖还原酶等作用[1-3]。活性成分主要是黄酮类,对其薄层色谱鉴别已有不少报道,常用的吸附剂为硅胶或聚酰胺,展开剂为V(甲醇)∶V(水)=1∶1或V(乙酸乙酯)∶V(甲酸)∶V(水)=8∶1∶1[4-5]。但由于槐米中化学成分类型复杂,其中的黄酮类成分种类繁多,经典的薄层色谱分离效果并不十分理想,而近年来微乳薄层色谱在中药有效成分的分离鉴定方面运用得比较广泛[6-10],但是应用微乳液作为展开剂分离鉴定槐米中黄酮类成分的研究尚未见文献报道。因此该研究以聚酰胺为固定相,微乳液为展开剂,考察微乳液类型、表面活性剂、助表面活性剂、油相、改性剂对槐米中黄酮类成分分离效果的影响,为槐米中黄酮的薄层色谱定性鉴别提供准确简便的方法。
1 实验部分
1.1 试剂与仪器
芦丁对照品:批号为 00081-201007,中国药品生物制品检定所;槐米:陕西省药材公司,由西安医学院杨静教授鉴定为SophorajaponicaL的花蕾;实验所用其它试剂均为分析纯。
四用紫外分析仪:ZF-8,上海嘉鹏科技有限公司;电子天平:FA1004B,上海越平科学仪器有限公司;超声波清洗器:AS3120,Auto Science 公司;薄层色谱用聚酰胺薄膜:台州四青生化材料厂;点样毛细管:华西医科大学仪器厂;薄层层析玻璃缸:上海信谊仪器厂。
1.2 溶液的配制
1.2.1 对照品溶液的制备
精密称取芦丁对照品12.5 mg用适量甲醇溶解并定容至50 mL的容量瓶中,得质量浓度为0.25 mg/mL的芦丁对照品溶液。
1.2.2 供试品溶液的制备
精密称取10 g槐米加无水乙醇100 mL回流提取两次,每次1.5 h,合并提取液回收溶剂,将残渣加100 mL热水超声至溶解,用90 mL石油醚萃取3次,将水层用90 mL正丁醇分3次萃取,合并萃取液,回收正丁醇,取适量用甲醇溶解,微孔滤膜过滤,得供试品溶液1。精密称取10 g槐米加质量分数75%的乙醇100 mL,回流提取两次,每次1.5 h,合并提取液,浓缩,取适量用甲醇稀释,微孔滤膜过滤,得供试品溶液2。
1.3 微乳薄层色谱展开剂的配制
按照m(十二烷基硫酸钠)∶m(正丁醇)∶m(正己烷)=2.7∶6.3∶1.0精密称取各试剂[6],加适量水搅拌溶解,再加水至50 g,超声5 min,静置24 h 备用。
1.4 薄层层析方法
用点样毛细管分别吸取芦丁对照品溶液和供试品溶液1、供试品溶液2各1~2 μL,在聚酰胺薄膜上点样,分别以实验所需的不同组成和结构的微乳液为展开剂,或以硅胶为吸附剂,展开剂为V(甲醇)∶V(水)=1∶1或V(乙酸乙酯)∶V(甲酸)∶V(水)=8∶1∶1,在室温条件下上行展开。展距约8 cm,取出后挥干展开剂,以m(三氯化铝) ∶V(乙醇)= 1%g/mL溶液喷洒薄层板面,晾干后用四用紫外分析仪在365 nm下检识。
2 结果与讨论
2.1 微乳液展开剂的组成及结构
按照“1.3”方法配制实验所用微乳液,其组成及结构见表1,十二烷基硫酸钠为表面活性剂,正丁醇为助表面活性剂。

表1 微乳液的组成及结构
2.2 微乳薄层色谱分离条件的选择
2.2.1 微乳展开剂φ(水)的考察
应用表1中不同组成和结构的微乳液为展开剂,按照“1.4”项进行聚酰胺薄层层析,以斑点数目、斑点清晰度和展开时间为指标,展开效果见表2。
从表2可以看出,随着微乳液φ(水)的增加,展开斑点个数逐渐增多,斑点清晰度由模糊到清晰再变模糊,所用展开时间逐渐缩短。φ(水)= 15%~55%的微乳液展开时间偏长,分离效果欠佳;φ(水)=75%的微乳液展开斑点数目最多,且比较清晰,展开时间适中,分离效果较理想。根据以上结果选择φ(水)=75%的O/W微乳液进行后续的实验。

表2 不同φ(水)的微乳薄层展开效果
2.2.2 微乳液中不同油相的考察
以φ(水)=75%的微乳液-甲酸(体积比9∶1)为展开剂,分别以正己烷、正庚烷、乙酸乙酯、正丁酸乙酯为油相,在聚酰胺薄膜上点样,在紫外灯(365 nm)下检视,以斑点数目、斑点清晰度为指标,考察样品溶液在不同油相的微乳薄层展开剂中的展开效果。结果可见,以正己烷为油相的微乳展开剂分离得到的斑点数目多,斑点圆润清晰,拖尾不明显,Rf值适中,展开效果较其它三种油相好。故选择正己烷为油相的微乳液作展开剂。
2.2.3 微乳液中助表面活性剂种类的考察
以正己烷为油相,以φ(水)=75%的微乳液-甲酸(体积比9∶1)为展开剂。分别以甲醇、乙醇和正丁醇为助表面活性剂,在聚酰胺薄膜上点样,在365 nm下检视,以斑点清晰度和斑点数目为指标,考察样品溶液在不同助表面活性剂组成的微乳展开剂中的薄层展开效果,结果见图1。
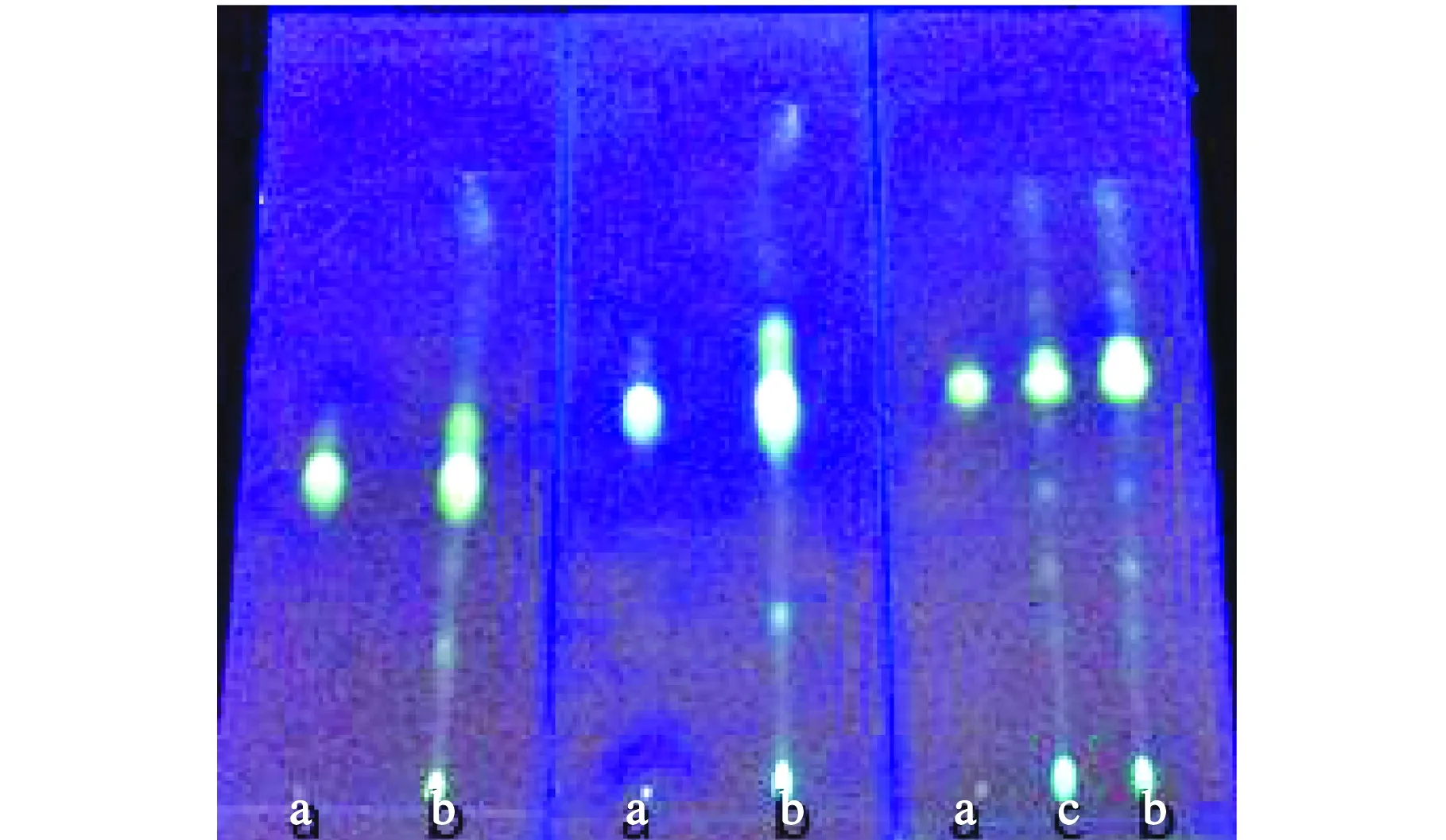
从左向右依次为甲醇,乙醇,正丁醇a-芦丁对照品;b-供试品溶液1;c-供试品溶液2图1 不同助表面活性剂的微乳薄层色谱
由图1可见,与甲醇和乙醇相比,当以正丁醇为助表面活性剂时展开效果好。因此选择以正丁醇为助表面活性剂的微乳液作展开剂。
2.2.4 微乳液中表面活性剂与助表面活性剂质量比的考察
以正己烷为油相,十二烷基硫酸钠(SDS)为表面活性剂,正丁醇为助表面活性剂,以φ(水)=75%的微乳液-甲酸(体积比9∶1)为展开剂。参照文献[3,7]中SDS的用量,在十二烷基硫酸钠和正丁醇总质量不变的情况下,m(SDS)∶m(正丁醇)分别为1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3进行薄层层析,以斑点数目和斑点清晰度为指标,对比样品在不同表面活性剂与助表面活性剂质量比的微乳展开剂中的薄层展开效果。结果见图2。可见,当m(SDS)∶m(正丁醇)=3∶7时,分离得到的斑点数目最多,斑点圆润且各斑点之间分离度大,Rf值适中,分离效果最好。
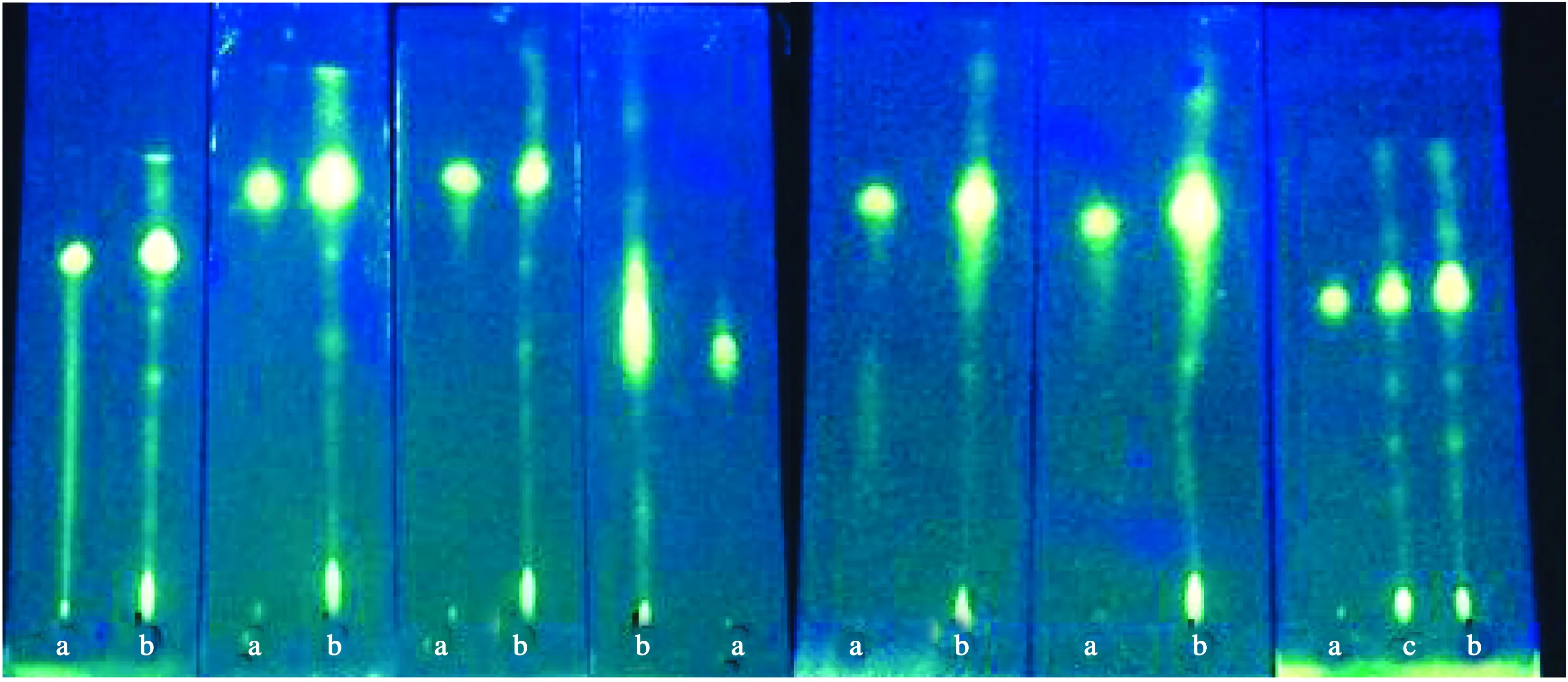
从左向右依次为m(SDS)∶m(正丁醇)=1∶9,2∶8,4∶6,5∶5,6∶4,7∶3,3∶7a-芦丁对照品;b-供试品溶液1;c-供试品溶液2图2 不同表面活性剂与助表面活性剂质量比微乳液薄层色谱图
2.2.5 微乳液中不同改性剂的考察
按照上述优化条件,分别以甲酸、丙酮、V(甲酸)∶V(丙酮)= 1∶1、4∶1为改性剂,用点样毛细管吸取样品溶液和芦丁对照品溶液适量,点样,展开,取出晾干,喷以m(三氯化铝) ∶V(乙醇)= 1%g/mL溶液,晾干后在365 mm下检视,以斑点数目、斑点清晰度为指标。结果表明,用甲酸作改性剂分离得到的斑点数有8个,斑点圆润且斑点之间分离度大,Rf值适中;丙酮作改性剂,分离得到的斑点数目较少且拖尾严重;当加入不同比例的甲酸和丙酮时分离斑点数目较少,Rf值偏大。对比分析可知,用甲酸作改性剂效果最佳。
2.2.6 微乳液中不同量甲酸的考察
在以上优化的微乳配方中加入改性剂甲酸,并使V(微乳液)∶V(甲酸)分别为9∶0、9∶1、9∶2,以此作为展开剂,于聚酰胺薄膜上点样,展距约8 cm,取出晾干,依法显色和检识,以斑点数目、斑点清晰度为指标。薄层色谱结果见图3。由图3可见,当加入甲酸,使V(微乳液)∶V(甲酸)=9∶1时样品分离得到的斑点多,且拖尾现象也有明显的改善,分离效果更好。因此选择φ(水)=75%的微乳液和甲酸体积比9∶1作为展开剂。
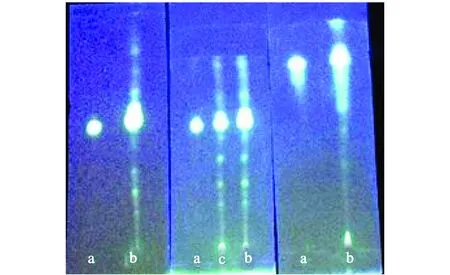
从左向右依次为V(微乳液)∶V(甲酸)= 9∶0,9∶1,9∶2a-芦丁对照品;b-供试品溶液1;c-供试品溶液2图3 不同酸度的微乳液薄层色谱图
2.3 微乳薄层色谱与常规分离方法比较
选择黄酮类化合物常用的2种展开系统V(甲醇)∶V(水)=1∶1和V(乙酸乙酯)∶V(甲酸)∶V(水)=8∶1∶1,与φ(水)=75%的微乳液-甲酸(体积比9∶1)为展开剂,按照1.4项进行聚酰胺薄层层析,结果见图4。
由图4可见,当用φ(水)=75%的微乳液-甲酸(体积比9∶1)作为展开剂时,分离清晰度较高,斑点圆润,无拖尾现象,而用其它2种展开系统时,完全分离的斑点数目很少,可见此微乳展开系统比普通有机溶剂系统在槐米中黄酮类成分的分离鉴定方面具有一定的优越性。
3 结 论
(1) 槐米中的黄酮类化合物可以用聚酰胺为吸附剂,φ(水)=75%的微乳液[m(SDS)∶m(正丁醇)∶m(正己烷)= 2.7∶6.3∶1.0]和改性剂甲酸按体积比9∶1作展开剂进行分离,喷以m(三氯化铝) ∶V(乙醇)= 1%g/mL溶液后在紫外灯(365 nm)下观察,斑点较圆润不拖尾,荧光强度较强,有较好的分离效果。样品在微乳液中展开的效果优于硅胶薄层色谱,可能是由于分配于微乳水相中的是极性大的黄酮苷,分配于微乳油相中的是极性小的黄酮苷元[11]。由于分配、吸附、疏水等效应,使槐米黄酮中结构和性质差别细微的组分均能较好的分离;
(2) 实验曾选用水作为溶剂提取槐米中的黄酮类物质,其它实验条件不变,结果斑点数目较少且Rf较大,各斑点分离界限比较模糊。后分别改用φ(水)=75%乙醇和无水乙醇作为溶剂进行提取,相同条件展开显色,可见无论是无水乙醇还是φ(水)= 75%乙醇提取的样品展开后没有显著差异,斑点数目较多,且Rf较小的组分分离效果也比较理想,分析可能是由于用水作为溶剂时,槐米中一些极性较小的苷元没有被充分提出,而乙醇溶解能力强,溶解范围广,故选择用无水乙醇或φ(水)=75%乙醇来提取样品;
(3) 用优选的微乳液替代了毒性大、污染大、可能会致癌的有机溶剂,主要成分为水,挥发性较小,成本低,对操作人员身体损害小。且实验操作受温度、湿度的影响不大,实验重现性好,检测的灵敏度高。加之微乳液具有比胶束体系更大的增溶量和超低的表面张力[12-13],色谱效率显著提高。
参 考 文 献:
[1] 洪军,胡晓稳,王佩,等.槐米中芦丁的提取及抗氧化活性研究[J].食品研究与开发,2015,36(15):16-18.
[2] 陈宇杰,马丽杰,胡雷,等.槐米对S180荷瘤小鼠的抑瘤作用及机制[J].中药药理与临床,2014,30(5):100-102.
[3] 储金秀,李倩,李光民,等.荞麦中芦丁对免疫性肝损伤小鼠肝脏超微结构的影响[J].华西药学杂志,2015,30(2):190-192.
[4] 张美超,刘廷强,王东明,等.芦丁鼠李糖苷酶水解反应液中鼠李糖的分离纯化[J].大连工业大学学报,2013,32(3):160-163.
[5] 张茹潭,陈军辉,史倩,等.崂山酸枣叶茶中芦丁含量测定及芦丁利用研究[J].时珍国医国药,2014,25(1) :13-15.
[6] 房德敏,高颖,严震,等.微乳薄层色谱在中药成分分析中的应用[J].中草药,2011,42(9):1852-1856.
[7] 郑庆红,周瑞雪,韩利文,等.苦荞黄酮类化合物的提取及微乳薄层色谱鉴别[J].中国药物与临床,2012,12(9):1153-1156.
[8] 李得堂,张丽娟,唐洪梅,等.微乳 TLC 应用于疗筋涂膜剂中分离鉴定的对比研究[J].中成药,2012,34(2):371-374.
[9] 韩松林,李新霞,赵东升,等.新疆2种洋甘菊中5种化合物的微乳薄层色谱鉴别[J].时珍国医国药,2014,25(7):1643-1645.
[10] 赵惠茹,蒋礼杰.微乳薄层色谱定性鉴别蒲公英中黄酮类成分的研究[J].现代中药研究与实践,2014,28(3):20-22.
[11] 刘朝亮,程轩轩.微乳色谱在药物分析中的应用[J].中药材,2010,33(1):143-146.
[12] 周璇,宋粉,钟兆键.微乳液在中药黄酮类成分微乳薄层色谱分析中的应用[J].色谱,2006,24(3):324-326.
[13] 王立萍,李伟,袁勇,等.微乳对田蓟苷增溶作用的研究[J].石河子大学学报(自然科学版),2013,31(6):716-719.
