窄谱中波紫外线通过下调miRNA-25表达促进黑素细胞增殖和黑素生成
2016-06-06李文彬马慧群曾维惠
董 妍,李文彬,郑 雯,王 娟,马慧群,曾维惠
(1.西安交通大学第二附属医院,陕西西安 710004;2. 陕西省中医医院皮肤科,陕西西安 710003)
◇基础研究◇
窄谱中波紫外线通过下调miRNA-25表达促进黑素细胞增殖和黑素生成
董妍1,李文彬2,郑雯1,王娟1,马慧群1,曾维惠1
(1.西安交通大学第二附属医院,陕西西安710004;2. 陕西省中医医院皮肤科,陕西西安710003)
摘要:目的研究窄谱中波紫外线(NB-UVB)对黑素细胞增殖、黑素生成、酪氨酸酶活性及miRNA-25表达的影响,探讨NB-UVB与miRNA-25间的关系以及NB-UVB治疗白癜风的可能作用机制。方法以40 mJ/cm2 NB-UVB作用于体外培养的黑素细胞72 h,观察NB-UVB对细胞增殖、酪氨酸酶活性、黑素生成的影响;NB-UVB作用12 h后,检测miRNA-25表达的变化。分别转染miRNA-25模拟物、miRNA-25抑制剂和miRNA-25突变体,观察细胞增殖、酪氨酸酶活性、黑素生成的变化。使用MTT法检测黑素细胞活性;左旋多巴底物法测定酪氨酸酶活性;NaOH法检测黑素生成,实时荧光定量聚合酶链反应(qRT-PCR)检测miRNA-25表达量。结果40 mJ/cm2剂量的NB-UVB 作用细胞72 h后,黑素细胞增殖、酪氨酸酶活性增大,黑素合成显著增加(P<0.05);NB-UVB作用12 h后,miRNA-25表达量显著低于对照组(P<0.05)。下调miRNA-25表达后,黑素细胞增殖、酪氨酸酶活性、黑素合成增加;过表达miRNA-25后,黑素细胞增殖、酪氨酸酶活性降低,黑素生成减少;过表达miRNA-25后部分抑制了NB-UVB对黑素细胞的作用。结论NB-UVB可能部分通过下调黑素细胞miRNA-25的表达,促进黑素细胞增殖、增加酪氨酸酶活性及黑素生成。
关键词:窄谱中波紫外线;miRNA-25;黑素细胞;黑素生成
白癜风是由于不同原因所致黑素细胞损伤的获得性疾病,表现为皮肤色素缺失[1]。其发病机制目前尚不清楚,患者体液免疫和细胞免疫失常提示其发病可能与自身免疫有关[2]。阻止皮损部位黑素细胞的进一步损伤,促进正常黑素细胞向皮损部位迁移及黑素细胞黑素合成是治疗白癜风的关键环节。
研究发现,窄谱中波紫外线(narrow-band UVB, NB-UVB)可促进黑素细胞黑素的合成和增加酪氨酸酶活性,可有效缓解白癜风症状[3-4],但是其具体机制仍不清楚。微小RNA(microRNA, miRNA)是一类高度保守的内生源性微小非编码RNA,长度为20~25 bp[5-6],通过特异性结合到目的mRNA的3′非翻译区(3′untranslated region, 3′UTR)阻止靶蛋白的表达,广泛参与细胞的分化、增殖、凋亡以及肿瘤的发生和免疫反应等[7-8]。目前关于NB-UVB的作用机制与miRNA关系研究尚少。
我们在研究NB-UVB对黑素细胞酪氨酸酶活性影响时发现,NB-UVB作用黑素细胞后miRNA-25表达降低。本文通过研究NB-UVB和miRNA-25对黑素细胞增殖和黑素合成的影响,探讨NB-UVB治疗白癜风的可能机制及其与miRNA-25的关系。
1材料与方法
1.1材料M254培养基、胎牛血清、L-多巴、黑素细胞生长添加物(HMG)购自Gibco公司;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)、2.5 g/L胰蛋白酶购自Sigma公司;人表皮黑素细胞馈赠于第四军医大学口腔医院。Trizol试剂盒(美国Invitrogen公司);TaqMan miRNA检测试剂盒和High Capacity cDNA逆转录试剂盒(美国Life Technology公司);脂质体2000 LipofectamineTM2000(美国Invitrogen公司);酶标仪(美国Thermo Electron公司);紫外光疗仪器(UVB波长311 nm,德国Waldmann公司)。
1.2方法
1.2.1细胞培养传代待细胞密度约为80%时,用2.5 g/L胰蛋白酶消化,加入5 mL含100 mL/L FBS、100 U/mL青霉素和100 μg/mL链霉素的M254培养基终止消化,反复吹打成单细胞悬液,低速离心去除上清,重新加入培养基将细胞吹打均匀并接种于培养瓶中,于培养箱中培养(50 mL/L CO2,37 ℃)。
1.2.2MTT法检测细胞活性设置实验组、对照组和空白对照组,每组各设6个复孔,将黑素细胞以5 000/200 μL的密度接种于96孔板,每孔200 μL,空白对照组只加入200 μL培养基。于37 ℃、50 mL/L CO2培养箱中培养48 h后,根据文献[9]所示,实验组予以40 mJ/cm2的NB-UVB辐射,对照组不予以辐射。辐射后分别继续培养72 h,于结束前4 h于各孔加入20 μL 5 g/L的MTT,4 h后小心吸净上清,加入150 μL DMSO,避光震荡10 min,酶标仪490 nm波长检测吸光度(A)值。
1.2.3酪氨酸酶活性测定细胞接种于96板,实验组予以40 mJ/cm2的NB-UVB辐射,对照组不予以辐射。刺激后继续培养72 h,弃上清,PBS清洗2次,每孔加入TritonX-100(10 g/L)90 μL后,-80 ℃放置30 min,室温融化,每孔加入L-多巴(1 g/L)100 μL,37 ℃孵育2 h,酶标仪490 nm波长测各孔A值。重复实验3次。
1.2.4黑素含量测定细胞接种于12孔板,实验组予以40 mJ/cm2的NB-UVB辐射,对照组不予以辐射。刺激后细胞继续培养72 h,弃上清,胰酶消化细胞,培养基终止消化并吹打成单细胞悬液,1 000 r/min离心5 min,弃上清,PBS清洗2次,加入1 mol/L含10% DMSO的NaOH,80 ℃水浴2 h后将溶液吸至96孔板,每孔150 μL,酶标仪490 nm波长检测A值。重复实验3次。
1.2.5miRNA转染miRNA-25模拟物、miRNA-25抑制剂和miRNA突变体(阴性对照)均由上海吉玛公司合成。用脂质体2000按照说明书操作将以上核酸转入黑素细胞,6 h后更换培养基进行后续实验。
1.2.6Real-time PCR检测miRNA-25表达分别提取NB-UVB作用后12 h的黑素细胞总RNA,采用High Capacity cDNA逆转录试剂盒按照说明书进行逆转录后,用TaqMan miRNA检测试剂盒进行实时荧光定量PCR检测miRNA-25的表达,U6作为内参。
1.2.7统计学分析数据用均数±标准差表示,统计分析使用SPSS12.0软件。对符合正态分布且方差齐的数据采用Student’t检验或者单因素方差分析,各组间两两比较使用LSD-t检验;方差齐性检验使用Levene检验;若数据不符合正态分布或者方差齐性,使用Mann-WhitneyU检验或者H检验。P<0.05为差异具有统计学意义,其中方差齐性检验P<0.10为差异具有统计学意义。
2结果
2.1NB-UVB对黑素细胞增殖、黑素生成及酪氨酸酶活性的影响使用40 mJ/cm2剂量的NB-UVB作用72 h后,实验组黑素细胞增殖、黑素的生成和酪氨酸酶活性增高,与对照组相比差异具有统计学意义(P<0.05,表1)。
表1窄谱中波紫外线(NB-UVB)对黑素细胞增殖、黑素生成及酪氨酸酶活性的影响
Tab.1Effects of NB-UVB on cell proliferation, melanogenesis and tyrosinase activities in melanocytes

(A, ±s)
2.2NB-UVB对黑素细胞miRNA-25表达的影响使用40 mJ/cm2剂量的NB-UVB作用12 h后,提取总RNA反转录并对miRNA-25进行实时荧光定量。结果显示,实验组miRNA-25表达量降低,与对照组相比差异具有统计学意义(P=0.003,图1)。
2.3miRNA-25对黑素细胞增殖、黑素生成及酪氨酸酶活性的影响将实验分为miRNA-25组、miRNA-25抑制剂组和miRNA阴性对照组,分别转染miRNA-25
模拟物、miRNA-25抑制剂和miRNA-25突变体,并按照说明操作,转染后72 h检测黑素细胞增殖、黑素生成及酪氨酸酶活性。结果显示,与阴性对照相比,miRNA-25组黑素细胞增殖和黑素生成减少,酪氨酸酶活性降低,差异具有统计学意义(P<0.05);与阴性对照相比,miRNA-25抑制剂组黑素细胞增殖、黑素生成、酪氨酸酶活性增加,差异有统计学意义(P<0.05);与miRNA-25组相比,miRNA-25抑制剂组黑素细胞增殖、黑素生成及酪氨酸酶活性明显增加,差异有统计学意义(P<0.05,表2)。
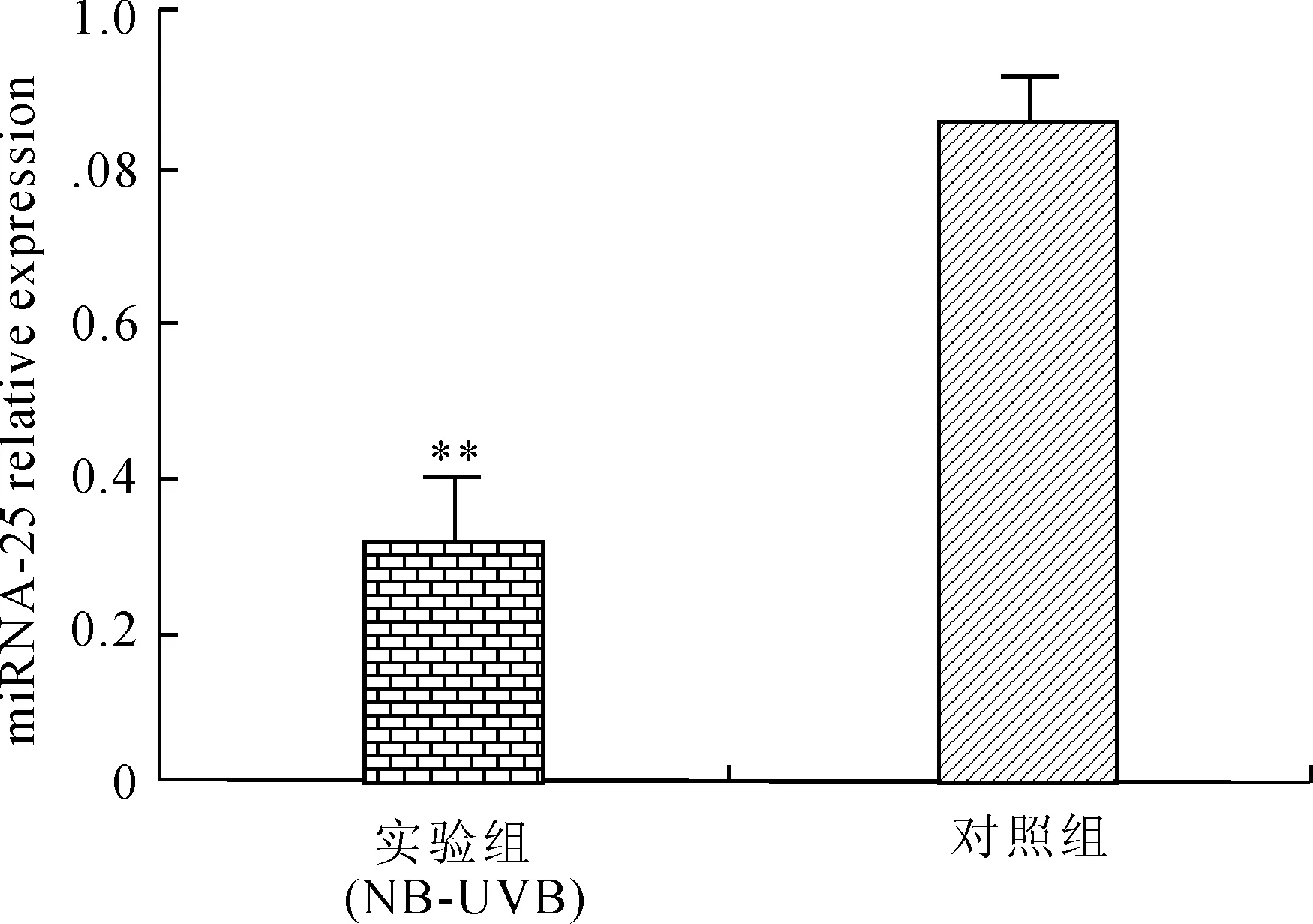
图1NB-UVB对黑素细胞miRNA-25表达的影响
Fig.1 Effects of NB-UVB on the expression of miRNA-25 in melanocytes
以U6作为内参照标准化处理。与对照组比较,**P<0.01。
表2miRNA-25对黑素细胞增殖、黑素生成及酪氨酸酶活性的影响
Tab.2Effects of miRNA-25 on cell proliferation, melanogenesis and tyrosinase activities in melanocytes

(A, ±s)
P1:miRNA-25组与miRNA-25抑制剂组比较;P2:miRNA-25组与miRNA阴性对照组比较;P3:miRNA-25抑制剂组与miRNA阴性对照组比较。
2.4转染miRNA-25部分下调了NB-UVB对黑素细胞的作用将实验分为miRNA-25组、miRNA-25抑制剂组和miRNA阴性对照组,按照转染说明操作,转染后6 h对各组进行40 mJ/cm2剂量的NB-UVB照射,继续培养72 h后检测黑素细胞增殖、黑素生成及酪氨酸酶活性。结果显示,NB-UVB促进了各组黑素细胞增殖、黑素生成,增加了酪氨酸酶活性。其中,miRNA-25抑制剂组促进作用最为明显,与阴性对照组相比差异具有统计学意义(P<0.05);miRNA-25组作用最弱,与阴性对照组相比,除黑素细胞增殖外,其他指标差异均具有统计学意义(表3)。表明miRNA-25部分抑制了NB-UVB对黑素细胞的作用。
3讨论
尽管NB-UVB已广泛用于临床白癜风的治疗,但是其具体治疗机制还不完全清楚。目前研究发现,其机制可能与调节局部免疫、促进黑素细胞增殖及黑素的合成、促进细胞因子分泌有关[10]。本研究通过观察NB-UVB照射后黑素细胞的增殖、黑素生成、酪氨酸酶活性以及miRNA-25的表达情况,探讨特异microRNA对黑素细胞的影响,为探索NB-UVB治疗白癜风的机制提供实验依据。实验结果表明,NB-UVB可以促进黑素细胞增殖及黑素生成,增加酪氨酸酶活性;进一步研究发现,NB-UVB还可以下调miRNA-25的表达。体外转染miRNA-25模拟物后,抑制了黑素细胞增殖、黑素的生成和酪氨酸酶活性,而转染miRNA-25抑制剂后却出现了相反的结果。进一步的实验显示,当过表达miRNA-25后,显著降低了NB-UVB对黑素细胞的作用。以上实验结果提示,对miRNA-25表达的调控可能是NB-UVB治疗白癜风的重要机制之一。
表3miRNA-25下调窄谱中波紫外线(NB-UVB)对黑素细胞的作用
Tab.3miRNA-25 down-regulated the effects of NB-UVB on melanocytes

(A, ±s)
P1:miRNA-25组与miRNA-25抑制剂组比较;P2:miRNA-25组与miRNA阴性对照组比较;P3:miRNA-25抑制剂组与miRNA阴性对照组比较。
黑素细胞的功能失调在白癜风的发病过程中起着至关重要的作用,但是其具体的致病机制目前仍不清楚。我们在研究NB-UVB对黑素细胞的作用时发现,NB-UVB可以抑制miRNA-25的表达,这与JIAN等[11]研究结果一致。但是miRNA-25的具体作用仍不清楚,对此我们观察了miRNA-25在黑素细胞中的作用,发现miRNA-25可以抑制黑素细胞增殖、黑素生成和酪氨酸酶活性,推测其作用可能与NB-UVB治疗白癜风有关。进一步的研究证实了我们的猜想,当下调miRNA-25表达后显著增强了NB-UVB对黑素细胞的作用,而当过表达miRNA-25后部分抑制了NB-UVB的作用,表明NB-UVB对黑素细胞的作用可能部分是通过调节miRNA-25的表达实现的。
小眼畸形相关转录因子(MITF),是黑素合成过程中酪氨酸酶及酪氨酸酶蛋白1基因的重要转录因子,可以调控酪氨酸酶活性及黑素的生成[12];此外,MITF还参与黑素细胞凋亡调控,它通过促进下游抗氧化基因的表达,清除细胞内氧自由基,保护黑素细胞免受破坏[13-14]。研究发现,白癜风皮损区黑素细胞MITF表达降低,而氧化应激是MITF降低的主要原因之一[14-15]。SHI等[13]研究发现,氧化应激不仅可以使白癜风患者黑素细胞MITF的表达降低,同时还可诱导miRNA-25表达升高。进一步研究表明,miRNA-25可以直接结合于MITF mRNA 3′端非翻译区(3′UTR),阻止MITF的表达。除此之外,miRNA-25还可间接破坏角质细胞旁分泌,减少干细胞因子(SCF)和碱性成纤维细胞生长因子(bFGF)对黑素细胞的保护作用,最终导致黑素细胞的退化。近年的研究发现,NB-UVB可能通过消除白癜风患者局部皮损的氧化应激进而缓解病情[16],其作用机制可能是NB-UVB通过调节黑素细胞miRNA-25,间接调控MITF及其下游抗氧化基因的表达,以及促进角质细胞分泌SCF和bFGF,间接发挥作用。
尽管我们观察到NB-UVB及miRNA-25对黑素细胞增殖、黑素生成及酪氨酸酶活性的影响,证明了两者具有相关性,但是其具体调控机制仍然未知,特别是miRNA-25调控黑素细胞的下游直接靶点及NB-UVB与miRNA-25是否直接相关,这些仍需进一步研究。
综上所述,NB-UVB可能通过下调miRNA-25的表达,发挥其对白癜风的治疗作用。同时,本文也为白癜风治疗方法的研究及NB-UVB治疗白癜风的机制提供新的研究方向和思路。
参考文献:
[1] ONGENAE K, VAN GEEL N, DE SCHEPPER S, et al. Effect of vitiligo on self-reported health-related quality of life[J]. Br J Dermatol, 2005, 152(6):1165-1172.
[2] LEE KY, JEON SY, HONG JW, et al. Endothelin-1 enhances the proliferation of normal human melanocytes in a paradoxical manner from the TNF-alpha-inhibited condition, but tacrolimus promotes exclusively the cellular migration without proliferation: a proposed action mechanism for combination therapy of phototherapy and topical tacrolimus in vitiligo treatment[J]. J Eur Acad Dermatol Venereol, 2013, 27(5):609-616.
[3] BRENNER M, HEARING VJ. The protective role of melanin against UV damage in human skin[J]. Photochem Photobiol, 2008, 84(3):539-549.
[4] 董妍,曾维惠,李文彬,等. 他克莫司联合窄谱中波紫外线对黑素细胞黑素合成的影响[J]. 西安交通大学学报(医学版), 2013, 34(2):237-239,252.
[5] BUSHATI N, COHEN SM. microRNA functions[J]. Annu Rev Cell Dev Biol, 2007, 23:175-205.
[6] CARTHEW RW, SONTHEIMER EJ. Origins and mechanisms of miRNAs and siRNAs[J]. Cell, 2009, 136(4):642-655.
[7] LI T, LI D, SHA J, et al. MicroRNA-21 directly targets MARCKS and promotes apoptosis resistance and invasion in prostate cancer cells[J]. Biochem Biophys Res Commun, 2009, 383(3):280-285.
[8] HICKS JA, TRAKOOLJUL N, LIU HC. Discovery of chicken microRNAs associated with lipogenesis and cell proliferation[J]. Physiol Genomics, 2010, 41(2):185-193.
[9] 王奕,王克玉,张向红,等. 窄谱中波紫外线辐射对白癜风黑素细胞生物学特性的影响[J]. 中国麻风皮肤病杂志, 2007, 23(1):6-9.
[10] GRIMES PE. New insights and new therapies in vitiligo[J]. JAMA, 2005, 293(6):730-735.
[11] JIAN Q, AN Q, ZHU D, et al. MicroRNA 340 is involved in UVB-induced dendrite formation through the regulation of RhoA expression in melanocytes[J]. Mol Cell Biol, 2014, 34(18):3407-3420.
[12] KITAMURA R, TSUKAMOTO K, HARADA K, et al. Mechanisms underlying the dysfunction of melanocytes in vitiligo epidermis: role of SCF/KIT protein interactions and the downstream effector, MITF-M[J]. J Pathol, 2004, 202(4):463-475.
[13] SHI Q, ZHANG W, GUO S, et al. Oxidative stress-induced overexpression of miR-25: the mechanism underlying the degeneration of melanocytes in vitiligo[J]. Cell Death Differ, 2015. DOI: 10.1038/cdd.2015
[14] SCHALLREUTER KU, ELWARY SM, GIBBONS NC, et al. Activation/deactivation of acetylcholinesterase by H2O2: more evidence for oxidative stress in vitiligo[J]. Biochem Biophys Res Commun, 2004, 315(2):502-508.
[15] MARESCA V, ROCCELLA M, ROCCELLA F, et al. Increased sensitivity to peroxidative agents as a possible pathogenic factor of melanocyte damage in vitiligo[J]. J Invest Dermatol, 1997, 109(3):310-313.
[16] KARSLI N, AKCALI C, OZGOZTASI O, et al. Role of oxidative stress in the pathogenesis of vitiligo with special emphasis on the antioxidant action of narrowband ultraviolet B phototherapy[J]. J Int Med Res, 2014, 42(3):799-805.
(编辑邱芬)
NB-UVB promotes melanogenesis and cell proliferation through downregulating the expression of miRNA-25 in human melanocytes
DONG Yan1, LI Wen-bin2, ZHENG Wen1, WANG Juan1, MA Hui-qun1, ZENG Wei-hui1
(1. the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004;2. Department of Dermatology, Shaanxi TCM Hospital, Xi’an 710003, China)
ABSTRACT:ObjectiveTo investigate the effect of narrow-band UVB (NB-UVB) on melanocytes proliferation, melanin production, tyrosinase activities and miRNA-25 expression so as to explore the relationship between NB-UVB and miRNA-25 and the possible mechanism of NB-UVB for treatment of vitiligo. MethodsMelanocytes cultured in vitro were treated with 40 mJ/cm2 dose of NB-UVB for 72 h, the effects of NB-UVB on cell proliferation, tyrosinase activity and melanin content were investigated. After NB-UVB stimulation for 12 h, the effect of NB-UVB on miRNA-25 expression in melanocytes was detected. Melanocytes were transfected with miRNA-25 mimics, miRNA-25 inhibitor and miRNA-25 mutant, respectively, the changes of cell proliferation, tyrosinase activitiy and melanin content were observed. Cell viability was detected using MTT method. Tyrosinase activities were measured with levodopa as the substrate. NaOH assay was used for the detection of melanin content. Real-time quantitative polymerase chain reaction (qRT-PCR) was used to detect miRNA-25 expression. ResultsAfter NB-UVB of 40 mJ/cm2 dose was used for the cells cultured for 72 h, the viability of melanocytes, tyrosinase activities, and melanin content were significantly increased (P<0.05). After NB-UVB stimulation for 12 h, miRNA-25 expression was significantly lower than that in the control group (P<0.05). After knockdown of miRNA-25, the cell proliferation of melanocytes, tyrosinase activities and melanin content were increased, whereas overexpression of miRNA-25 decreased the cell proliferation, tyrosinase activities and melanin production. Overexpression of miRNA-25 partially inhibited the effect of NB-UVB on the treatment of melanocytes. ConclusionNB-UVB may promote cell proliferation, increase tyrosinase activities and melanin formation through partially downregulating the expression of miRNA-25 in melanocytes.
KEY WORDS:narrow-band UVB; miRNA-25; melanocyte; melanogenesis
收稿日期:2015-11-27修回日期:2015-12-29
通讯作者:曾维惠. E-mail: zengwh88@126.com
中图分类号:R758.4
文献标志码:A
DOI:10.7652/jdyxb201603020
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160419.1019.004.html(2016-04-19)
