不同采收时间对艾叶挥发油及其挥发性主成分与毒性成分变化的影响*
2016-06-05康利平詹志来南铁贵周爱香郭兰萍
张 元,康利平,詹志来,南铁贵,李 颖,周爱香,郭兰萍
(1.中国中医科学院中药资源中心 道地药材国家重点实验室培育基地 北京 100700;2.北京联合大学生物化学工程学院 北京 100101;3.沈阳药科大学中药学院 沈阳 110016;4.中国中医科学院中药研究所 北京 100700)
不同采收时间对艾叶挥发油及其挥发性主成分与毒性成分变化的影响*
张 元1,2,3,康利平1**,詹志来1,南铁贵1,李 颖1,周爱香4,郭兰萍1
(1.中国中医科学院中药资源中心 道地药材国家重点实验室培育基地 北京 100700;2.北京联合大学生物化学工程学院 北京 100101;3.沈阳药科大学中药学院 沈阳 110016;4.中国中医科学院中药研究所 北京 100700)
目的:利用气相色谱-串联质谱法(GC-MS/MS)分析不同采集时间对艾叶挥发油含量和主要成分及毒性成分变化的影响。方法:以湖北蕲春2014年种植的艾叶为对象,选择端午节前后的1个月左右(5月8日,5月13日,5月20日,5月27日,6月3日,6月9日,6月16日)为采集的时间点,采用水蒸气蒸馏法提取所采集艾叶样本的挥发油,利用GC-MS/MS对其挥发性成分进行分析比对,结合NIST库进行成分的分析鉴定,以峰面积归一化法计算各组分的相对含量。结果:湖北蕲春种植的艾叶在不同时间的挥发油含量和成分均具有一定的差异:挥发油含量在端午节前不断增加,到5月20号左右达到最高点,然后挥发油含量逐渐降低;化合物的种类主要为单萜类、倍半萜及其含氧衍生物及酮、醛、烷、醇及苯系化合物等;其检出和鉴定的化学成分随采集时间的推移逐渐增多,由5月8日的69种逐渐增多为6月16日的82种;以挥发油含量及30种主成分相对含量为指标,艾叶最佳的采集期为端午节前1-2周左右;以挥发油所含侧柏酮等数种毒性成分为指标,最佳的采集期则为端午节之后1-2周左右。结论:不同采集时间对艾叶挥发油的含量及其主要成分表现出一定的时间差异性,该研究结果为艾叶采收时间的确定提供了一定的科学依据。
艾叶 挥发油 气相色谱-质谱 挥发性成分 毒性成分
艾叶为菊科多年生草本植物艾Artemisia argyiLevl. et Vant.的干燥叶,广泛分布于中国东北、华北、华东、西南及西北等地以及周边国家,夏季花未开前采摘[1]。中医临床利用艾叶作为灸材使用已有上千年历史,人们很早就认识到艾灸的临床疗效与灸材质量有密切关系,而艾叶所含挥发性成分与其功效、毒性之间存在一定的量效关系[2]。
有关艾叶毒性的报道古已有之,《图经本草》记载:“近世有单服艾者然亦有毒,其毒发则热气冲上,狂躁不能禁,至攻眼有疮出血者,诚不可妄服也”[7]。目前,已有关于艾叶挥发性成分急性、亚急性毒性、遗传毒性等的研究报道[4-6]。现代研究表明,艾叶挥发性组分是其功效和毒性大小的重要物质组成,而艾叶采集在夏季未花开前采摘的质量与其采收时间有密切关联[3]。
根据传统习俗,端午前后为采集艾叶的最好时间,已有的文献报道从艾叶挥发油的总量上和部分成分累积变化进行了分析,但尚缺乏系统性的主成分种类的分析变动数据,无法精确地说明采收时机的特殊性。因此为了进一步搞清楚艾叶不同时间的采收依据,以及艾叶挥发性组分和毒性成分具体的重要物质基础组成,本文以蕲艾为研究对象,对端
* 科学技术部国家重点基础研究发展计划“973计划”项目(2015CB554506):“基于临床的灸法作用机理研究”子课题——灸材的作用特点及其生物学机制研究。
** 通讯作者:康利平,副研究员,副主任,主要研究方向:中药化学分析及新药开发。午节前后艾叶的挥发油及其主成分的变化及毒性成分进行了系统的测定,目的是对其变化趋势进行分析比较研究,旨在确认艾叶采收的最佳时期,以及采集时间对主成分及毒性组分累积效应有何关联性,同时拟为艾叶的临床合理选择使用提供一定的科学理论依据。
1 材料与方法
1.1 材料、试剂与仪器
实验用艾叶样品均产于湖北省蕲春县鹰岩水库艾叶种植基地,采集时间为2014年端午节(6月2日)前后,共采摘7次,5-7天采摘1次,时间点为2014年5月8日、5月13日、5月20日、5月27日、6月3日、6月9日、6月16日,在采样区内S路径多点整株采样,组成混合样品,避免过大过小的株体。所有样品由康利平副研究员鉴定无误。
气质联用仪为Trace 1300串联TSQ 8000(美国,Thermo公司),石英毛细管柱(TG-5MS GC,30 m ×0.25 mm×0.25 μm,美国Thermo公司),Xcalibur软件(美国Thermo公司)。万分之一电子分析天平(瑞士梅特勒斯公司),无水硫酸钠(北京化工集团公司),水蒸气蒸馏简易装置。
1.2 实验方法
1.2.1 艾叶挥发油的提取和含量计算
将7个不同采集时间的艾叶按时间先后依次编号(见表1),艾叶样本用剪刀剪碎,各精密称取100 g,分别置于5 000 mL圆底烧瓶中,加入2 500 mL蒸馏水,上接挥发油提取器和蛇形回流冷凝管,回流提取6 h,挥发油层分离后用无水硫酸钠干燥、过滤,称重。按以下公式计算:艾叶挥发油含量=艾叶挥发油重量/艾叶重量×100%。
1.2.2 气相色谱-质谱条件
设置程序,程序升温:40℃,保持2.5 min,以5℃·min-1升至200℃,再以10℃·min-1升至240℃,保持5 min,进样口温度250℃,传输线230℃;载气为He,流速为100 mL·min-1;进样量为1 μL,不分流进样。电离方式为EI,70 eV;离子源温度250℃,质量扫描范围35~400 Da;发射电流100 μA,检测电压1.4 kV。质谱检索标准库:NIST数据库,人工图谱解析,鉴定含量较多的成分,采用峰面积归一化法定量[3],测得挥发油中各成分的归一化含量。
1.2.3 样品测定
挥发油供试品溶液的配置:精密量取艾叶挥发油1 μL,溶入999 μL的二氯甲烷中,作为供试品溶液,待测。
2 实验结果
2.1 艾叶挥发油的含量
将不同采集时间的7份艾叶,在相同的提取条件下进行水蒸气蒸馏,得到浅绿色至黄绿色的挥发油,所得挥发油提取率见表1。结果显示,不同采集时间的艾叶挥发油含量存在明显差异,从5月8日至5月20日艾叶中挥发油含量在逐渐增加,到最高值之后至6月16日含量逐渐下降;其中5 月20日挥发油含量最高,达1.286 4%;6月16日含量最低,为0.772 1%。人们一般认为端午(2014年端午节为6月2日)前后为艾叶采集的最佳时间,根据本实验结果,以挥发油含量高低判断,艾叶最佳采集期已经在端阳节前1-2周。
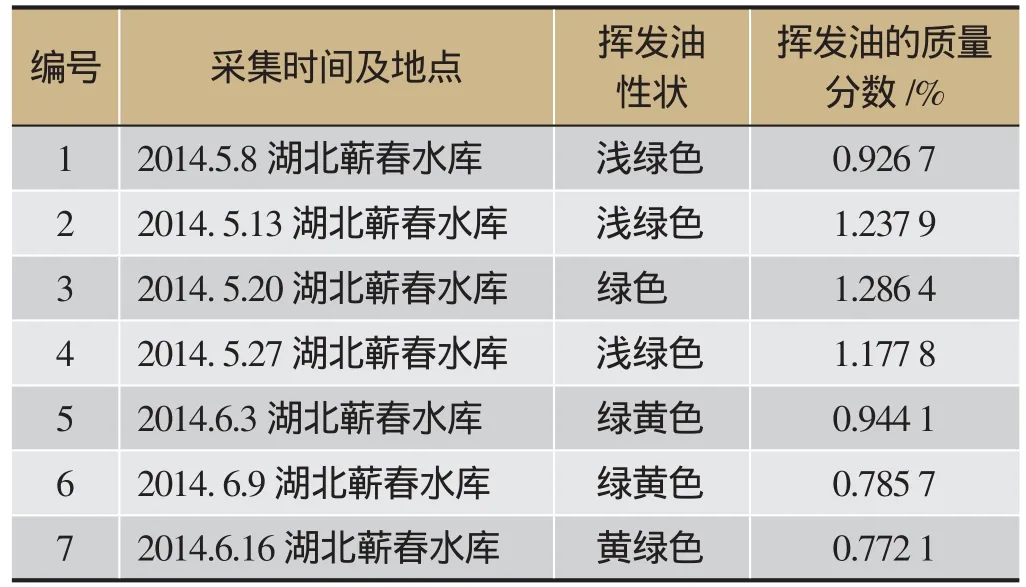
表1 不同采集时间艾叶挥发油含量
2.2 艾叶挥发油的挥发性成分
2.2.1 艾叶挥发油GC-MS分析结果
艾叶挥发油总离子分析图见图1,利用Xcalibur工作站中的NIST标准谱库自动检索各组成分的质谱数据,相似度大于850,且对参考文献[8-13]及有关标准图谱对结果进行核对和确认,湖北蕲春鹰岩水库种植基地5月初所采集艾叶与6月中旬最后一次采集样本的挥发油成分差异较大,按面积归一化法计算GC-MS测定的各组分的相对含量,结果见表2。检测和鉴定出的化合物种类主要为单萜类、倍半萜及其含氧衍生物及醛、酮、烷及苯系化合物等。其中单萜类成分如:萜品烯、水芹烯、茨烯等;倍半萜成分如:石竹烯、蛇麻烯、胡椒稀等;酮类成分如樟脑、侧柏酮等;醇类如松油醇等,以及少量的酯类、酚、醛类、烷烃等。含量较高的为酮类、萜烯类、醇类、醛类等。
艾叶样本经GC-MS测定分析鉴定后,从表2结果,5月8日采集样本共鉴定出的69种成分占色谱总流出峰面积的84.61%,含量最高的为侧柏酮35.41%,其次为(R)-4-甲基1-(1-异丙基)-3-环己烯-1-醇(8.45%)、樟脑8.16%、1-甲基-3-(1-异丙基-苯)(5.97%),桉油精(4.61%)、龙脑(3.14%)等。6月16日采集艾叶挥发油样品鉴定出82种化合物占色谱总流出峰面积的88.46%,含量最高的为龙脑(28.45%),其次是桉油精(9.77%)、樟脑(9.62%)等。其中以龙脑含量的增幅最大,相对含量由5月8日3.14%到6月16日上升为28.45%;桉油精也呈现上升趋势,其相对含量由4.08%变为9.77%,其它上升的成分还有樟脑8.16%升为9.62%,(顺,2-甲基-5-(1-异丙烯基),2-环己烯-1-醇)由1.61%变为2.44%,莰烯由0.11%升为4.91%等。下降的主成分较大的有侧柏酮,由35.41%变为0.6%,(R)-4-甲基1-(1-异丙基),3-环己烯-1-醇由8.45%变为6.25%,1-辛烯-3-醇由2.34变为1.49%等。变化幅度相对不太明显的成分如丁子香酚由0.94%变为0.93%,α-蒎烯由1.12%变为1.41%,香芹酮0.09%变为0.11%等。
两个不同采集时间点检出的挥发性成分种类,随着时间的推移逐渐增加,其检出的种类由69种变为82种,有41种共有成分,采集初期有28种成分在最后采集期未能检测到,如松香芹酮、4-甲基-1-(1-异丙基)-环己烯、松香芹酮等,而最后采集的挥发性成分种类有41种在采集初期未检出,如(-)-桉油烯醇、异龙脑、香芹醇等。
2.2.2 艾叶挥发油主成分结果分析
对不同采收时间的30种艾叶挥发油的主成分进行了分析对比,结果见表3(因5月8与6月16日所采艾叶样本测定的成分已作对比,且与其它时间采集的样本成分有明显的差异,未将之列入表3中进行比较)。从表3可以看出不同采集时间艾叶挥发油成分含量较高的组分有:龙脑、桉油精、樟脑、(R)-4-甲基1-(1-异丙基)-3-环己烯-1-醇、1-甲基-3-1-异丙基-苯、莰烯、松油烯、松油醇、氧化石竹烯、1-辛烯-3-醇、α-蒎烯等,它们构成艾叶挥发油的主要的特征性成分。其中(R)-4-甲基1-(1-异丙基)-3-环己烯-1-醇、莰烯、(1-甲基-3-(1-异丙基-苯)、c-松油烯等成分具有明显的上升趋势;侧柏酮、樟脑则呈现相对波动下降的趋势;氧化石竹烯、1-辛烯-3-醇、异龙脑、(顺,2-甲基-5-(1-异丙烯基),2-环己烯-1-醇)、α-松油醇、(反)-1-甲基-4-(1-异丙基)-2-环己烯-1-醇、1-甲基-4-(1-甲基亚乙基)环己烯等成分的相对含量波动不大,呈现相对平稳的变化趋势。
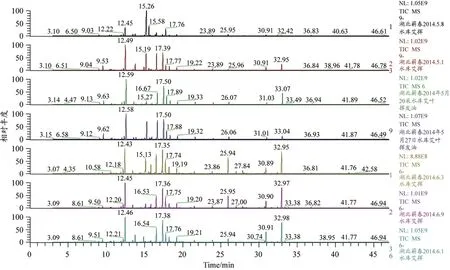
图1 不同采收时间艾叶挥发油成分的总离子流图
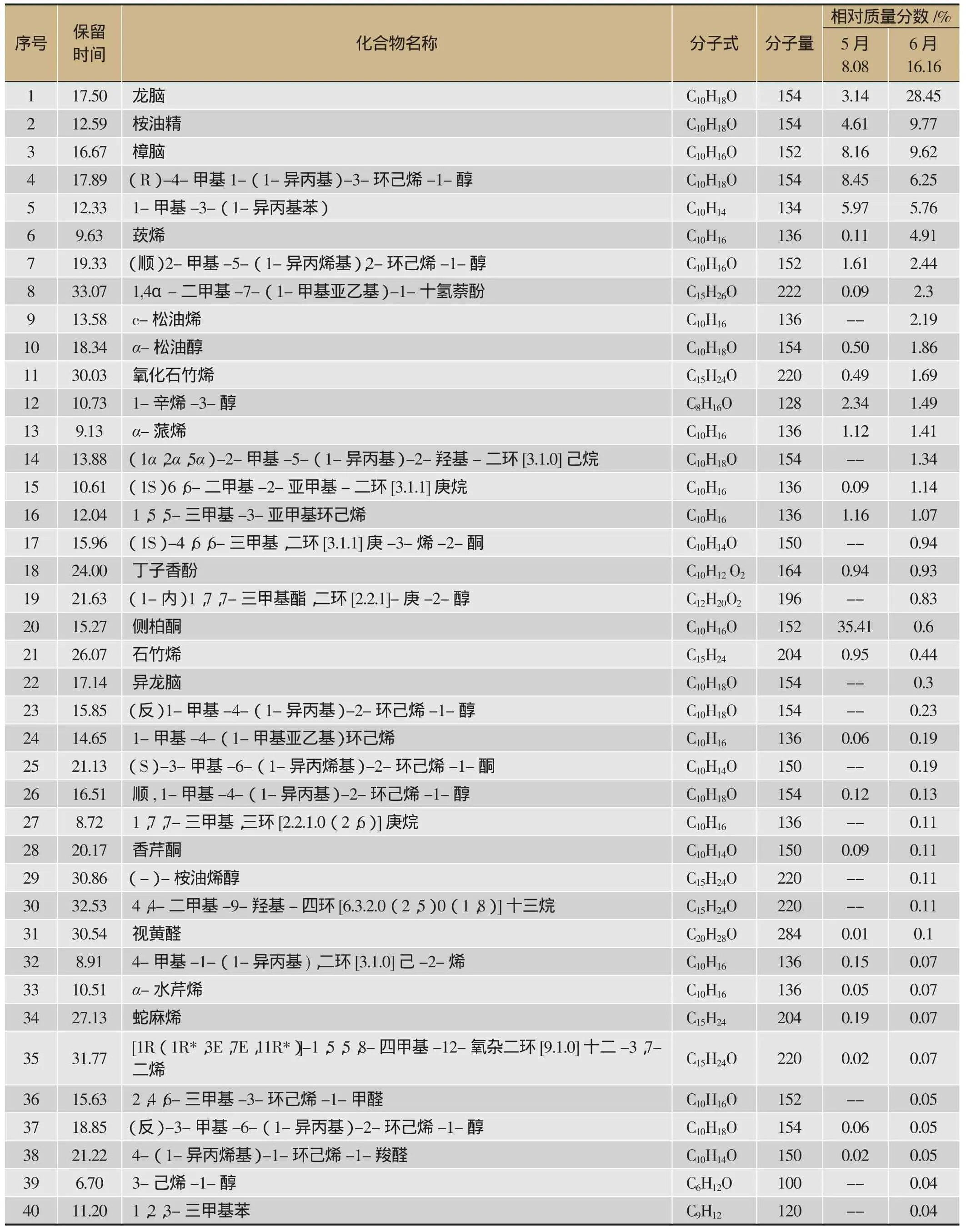
表2 湖北蕲春产艾叶的挥发性成分GC-MS鉴定结果

接上页

接上页
以挥发性主成分龙脑、桉油精、樟脑等30种主成分相对含量为指标,从5月13日、20日、27日至6月3日、9日、16日的30种主成分按相对总流出峰面积的计算其流出峰面积依次为85.86%、88.18%、92.61%、85.34%、85.18%、86.30%。最高的为5月27日的92.61%,其次为5月20日的88.18%。以30种主成分相对含量为指标,最佳的采集期应为5月20日至5月27日,较端阳节提前1-2周左右。结合表1的结果,采集时间对挥发性主成分的影响与挥发油含量的影响结果相当。
以毒性成分含量为指标进行分析,结果显示:侧柏酮和樟脑的含量变化呈现相对下降的趋势,侧柏酮以5月8日检测最高,然后逐渐呈现相对下降的趋势,至6于9日下降为0.7%,6月16日为0.6%;樟脑的含量以5月27日为最高为13.40%,至6月9日为7.39%,6月16日为9.77%;其它含量较低的毒性成分如1-辛烯-3-醇由5月27日最高时的2.08%下降为1.49%,丁子香酚5月20日最高的1.61%下降为0.93%。由此以侧柏酮等数种含量较少毒性成分为指标,最佳的采集期为6月9日和6月16的端午节之后。
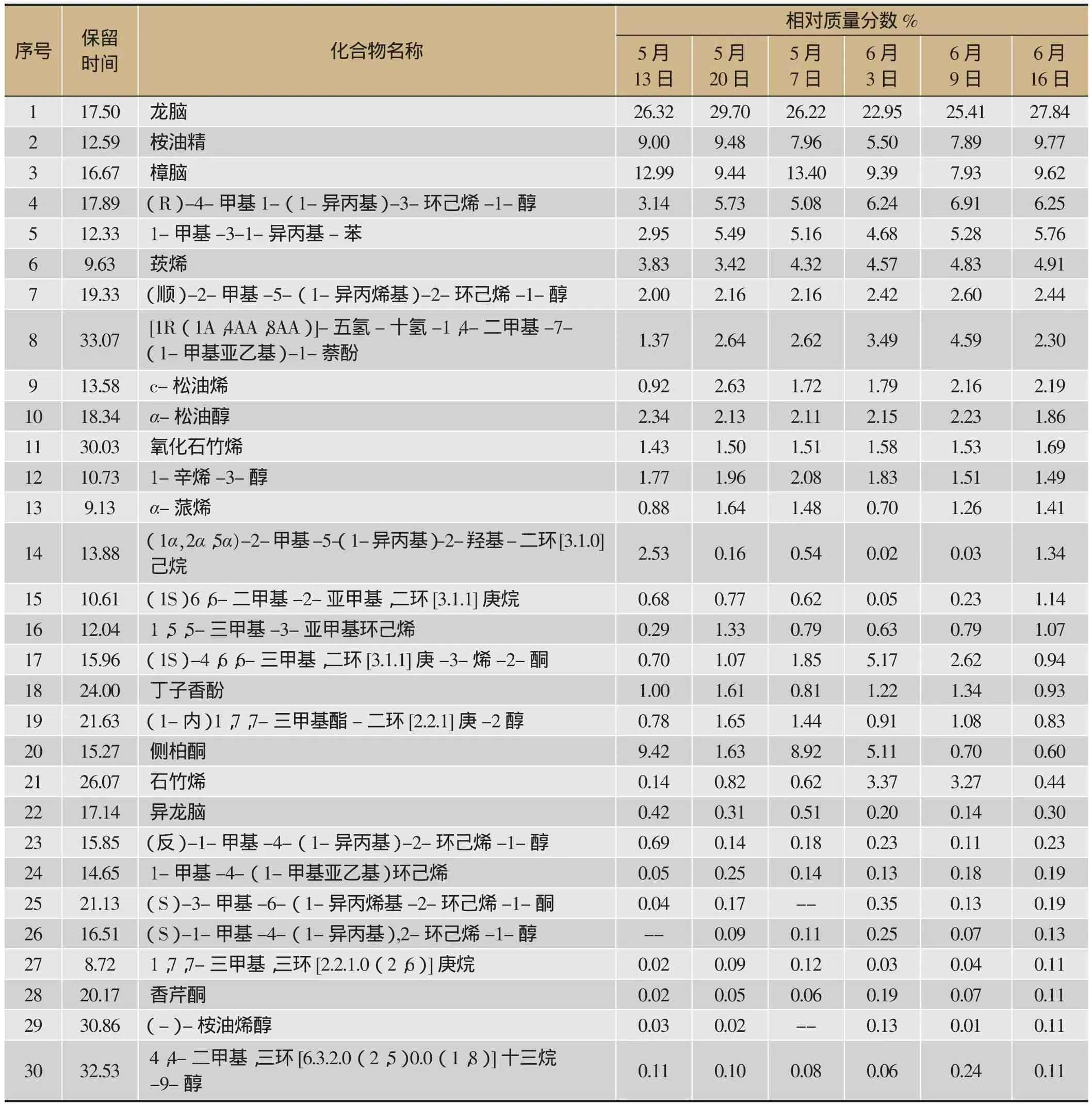
表3 不同采集时间挥发油主成分结果分析
因此,以挥发油含量及30种主成分相对含量为指标,艾叶最佳的采集期为端午节前1-2周左右;以挥发油所含侧柏酮等数种毒性成分为指标,最佳的采集期则为端阳节之后1-2周左右。
3 讨论
根据古文献记载,艾叶样本的采集时间为端午节前后。因此,本研究的艾叶样本在端午节前的5月初开始进行采集,每次采集间隔1周,以保证样本挥发性组分在间隔时间内出现差异;采样方式为大田区域内S路径多点整株采样,避免过大过小的株体,采样后组成混合样品,采样具有一定的代表性。结果显示,采收初期与末期样本的主要成分和含量仍存在明显的不同。这可能由于植物处于不同的生长期,各种生物酶、温度、光照、水分、不同土壤肥力以及大田因素、植株的个体差异等因素影响了生物合成与代谢的累积,使得成分种类和含量不断发生变化。
在不同采集时间,艾叶样本的挥发性成分含量表现出一定差异性,所采集艾叶的挥发油成分大部分是安全的。在不同采集时间点,检测出的挥发性成分种类随着时间的推移逐渐增加,由采集初期的69种变为末次采摘的82种。其次,时间差异性还表现为主成分含量的变化与挥发油含量的变化,其中主成分含量变化以龙脑为最大的增幅,相对含量由初期的3.14%上升为末期的28.45%;桉油精也呈现上升趋势,其相对含量由4.08%变为9.77%,其它上升的成分还有(顺)-2-甲基-5-(1-异丙烯基)-2-环己烯-1-醇由1.61%变为2.44%,莰烯由0.11%升为4.91%等。这些主成分累积表现出一定的时间变化规律,即艾叶样本采集时间的变化规律同挥发性部分主组分含量累积表现呈现正向的相关性;而主成分相对含量同挥发油含量亦呈一定的正向相关性。因此,可将挥发性组分含量及挥发油含量作为艾叶采收的主要参考依据之一。
研究表明,一定剂量的艾叶挥发油对小鼠具有一定的毒副作用和潜在的遗传毒性,并呈剂量反应关系[2-6]。艾叶挥发性成分中的一部分具有一定毒性,但其相对含量远低于文献记载的中毒剂量。侧柏酮是已知的有肝、肾、神经系统毒性的成分,侧柏酮小鼠的毒理学研究显示半致死量LD50为45 mg·kg-1[16]。不同采收时间的樟脑、侧柏酮等具有神经毒性的成分在艾叶挥发油中的含量具有一定差异,侧柏酮含量随采收时间的推移呈下降趋势,且下降幅度较大。樟脑有兴奋、强心、消炎、镇痛、抗菌、止咳、促渗、杀螨等药理作用,并与其他药物间可发生相互作用,且具有较强毒性,表现在对卵巢、睾丸、神经、肝脏、心脏、胎儿、孕妇的明显毒性[14],樟脑的急性毒性数据表明其口服LD50>5g·kg-1(大鼠),小鼠静脉LD503 000 mg·kg-1;樟脑对肾脏泌尿系统的潜在毒性和较小遗传毒性[15]。本研究结果表明:樟脑在整个采收样本中的含量呈现相对稳定,略呈现下降的趋势。因此,两个毒性成分随着采集时间的不同积累量也不同,这可以作为选择艾叶采收时间的参考依据之一。
5月15日后采集的艾叶主要成分如龙脑、桉油精(1-8桉叶素)等主组分的含量,其在整体的主要成分含量中趋于相对稳定。艾叶挥发油所含主成分中相对含量较大的桉油精具有止咳作用,但同时也有导致嗜睡或昏迷或皮肤及附件发生皮炎等毒副作用,桉油精对小鼠的经口半数致死量LD50为3 849.03 mg·kg-1,95%可信限为3 580.9-4 130.5 mg·kg-1,有一定的亚急性毒性反应,根据WTO的外源性化学物质急性毒性分级标准,桉油精属于低毒物质[16]。龙脑在所采样本中的含量均较高,龙脑具有开窍醒脑、消肿止痛的作用;研究表明雄性小鼠灌胃龙脑LD50为1171 g·kg-1BW(95%CI:1126-2133 g·kg-1BW),雌性小鼠LD50为2 100 g·kg-1BW(95%CI: 1 137-2 191 g·kg-1BW),有较高药用安全性[17,18]。龙脑及桉油精的含量在采集的中后期没有明显的时间性变化规律,但其含量变化在整个挥发性组分中已经趋于相对稳定。考量这种平稳变化趋于相对稳定,可把其成分的含量变化归在总的挥发性组分中以含量高低总体考量即可。
其它成分的LD50报道如下:1-甲基-3-(1-异丙基,苯):2 970 mg·kg-1(大鼠,经口),3 272 mg·kg-1(小鼠,经口);c-松油烯:1 680mg·kg-1(大鼠,经口);α-松油醇:5 170 mg·kg-1(大鼠,经口);2 830 mg·kg-1(小鼠经口);2 mg·kg-1(小鼠肌肉);α-蒎烯:3 700 mg·kg-1(大鼠经口);丁子香酚:2 680 mg·kg-1(大鼠经口);氧化石竹烯:5 mg·kg-1(大鼠经口);2 mg·kg-1(兔子经皮);香芹酮:3 710 mg·kg-1(大鼠,经口);(以上数据来源GRAS(FDA,§182.60,2 000)。这些成分中如氧化石竹烯、1-辛烯-3-醇、异龙脑、(顺)-2-甲基-5-(1-异丙烯基-2-环己烯-1-醇、α-松油醇、(反)-1-甲基-4-(1-异丙基)-2-环己烯-1-醇、1-甲基-4-(1-甲基亚乙基)环己烯等成分在挥发性成分中呈现相对平稳的趋势,可将其归在总挥发成分中,以含量高低总体考量。还有其它一些成分如α-蒎烯、香芹酮、丁子香酚等根据其相对分数质量相对占比,虽未表现出明显的时间累积的变化规律,但这些成分在整个挥发性主成分中占比较小,虽有一定的毒性,可以不作为主要考量的因素。
总之,不同采集时间的艾叶样本挥发性组分表现出一定的时间差异性,不同采集时间点检出的挥发性成分种类,随着时间的推移逐渐增加,其次表现为主成分和毒性成分含量的变化。为探索艾叶挥发性成分相对含量与不同采集时间点之间的关系,可以将主成分含量的高低、毒性成分的变化作为主要的参考依据。综上所述,不同采集时间对艾叶样本的挥发性主组分含量的变化及挥发油含量,以及毒性成分含量的降低可以作为艾叶采收的主要依据。本实验的研究结果可为艾叶采收时间的确定提供一定的科学依据。
1 林强,葛喜珍.中药材概论.北京:化工出版社, 2008: 143.
2 兰美兵,余永莉,卢巍,等. 甘肃产艾叶挥发油的化学成分及遗传毒性研究. 中国实验方剂学杂志. 2012, 18(13): 252-255.
3 宋·苏颂撰.胡乃长等辑注,图经本草.福州:福建科技出版社, 1989: 195.
4 蒋涵,侯安继,项志学. 蕲艾挥发油的毒理学研究. 中药药理与临床, 2004, 20(5): 43-44.
5 孙蓉,王会,黄伟,等.艾叶不同组分对小鼠急性毒性实验比较研究.中国药物警戒, 2010, 7(7): 392-396.
6 刘红杰,白杨,洪燕龙,等.不同提取方法制备的艾叶挥发油化学成分分析与急性肝毒性比较.中国中药杂志, 2010, 35(11): 1439-1466.
7 洪宗国, 魏海胜, 张令令,等. 不同采集期艾叶挥发油含量和化学成分的研究. 中南民族大学学报(自然科学版). 2013, 32(2): 32-35.
8 张小俊,赵志鸿,张壮丽,等.HS-SPME-GC-MS测定艾叶挥发性成分方法优化.中国实验方剂学杂志. 2014, 20(21): 66-70,71.
9 梁欢,卢金清,戴艺,等. HS-SPME-GC-MS结合化学计量法对不同产地艾叶药材挥发性成分的比较分析.中国实验方剂学杂志, 2014, 20(18): 85-90.
10 江丹,易筠,杨梅,等.不同品种艾叶挥发油的化学成分分析. 中国医药生物技术, 2009, 4(5): 339-344.
11 李玲,吕磊,董昕,等. 运用GC-MS对三种不同方法提取的艾叶挥发油成分的比较分析.药学实践杂志, 2012, 30(4): 279-282, 286.
12 唐生安,孙亮,翟慧媛,等.艾叶化学成分的研究.天津医科大学学报. 2011, 17(4): 461-463.
13 文福姬,俞庆善,阉民燮.艾叶精油化学成分研究.香料香精化妆品, 2007, 3: 21-23.
14 王川. 1-8桉叶油素的安全性评价.成都:四川农业大学硕士论文, 2013: 1-10.
15 柳芳芳,等.中药和西药致急性药物性肝损伤临床和肝组织病理学特征对比分析.实用肝脏病杂志. 2013, 16(8): 317-319.
16 孙蓉等. 艾叶不同组分多次给药对小鼠肝毒性“量—时—毒”关系研究.中国药物警戒. 2011, 8(7): 397-400.
17 熊振宇,肖复明,徐旭,等.植物药龙脑的药学活性研究.中国中药杂志, 2013, 38(6): 786-790.
18 刘佳,高敏.龙脑的小鼠急性毒性实验研究.中国卫生工程学, 2010, 9(5): 360-361.
Study on Yield, Main Components and Toxic Components of Volatile Oil from Artemisia argyi Levl. et Vant. qvai. Gathered in Different Growing Period
Zhang Yuan1,2,3, Kang Liping1, Zhan Zhilai1, Nan Tiegui1, Li Ying1, Zhou Aixiang4, Guo Lanping1
(1. The State Key Laboratory Breeding Base of Dao-di Herbs Medicine, National of Resource Center for Traditional Chinese Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China; 2. College of Biochemical Engineering of Beijing Union University, Beijing 100101, China; 3. Shenyang Pharmaceutical University, Shenyang 110016, China; 4. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China)
This study was aimed to compare and analyze the content, yield and main chemical and toxic components of volatile oil fromArtemisia argyiLevl. et Vant. qvai. gathered in seven different collection times, which were May 8, May 13, May 20, May 27, June 3, June 9, June 16 in 2014. The volatile oil was extractedby steam distillation, and the volatile components were analyzed by GC-MS/MS and NIST library station. The relative content of each component was calculated by peak area normalization method. The results showed that the chemical components of oil yield from seven different growing periods had some differences. The volatile oil content increased before the Dragon Boat Festival, to around the highest point on May 20, and then it gradually reduced. The type of components included the monoterpenes, sesquiterpenes, oxygenated derivatives and so on. The detection and identification of the chemical compositions gradually increased from 69 to 82 kinds with time in May 8 to June 16, respectively. The best collection time was one to two weeks before the Dragon Boat Festival, which contented volatile oil and relative contents of 30 species main components as indexes. The best collection time was one to two weeks after the Dragon Boat Festival, which contented several kinds of toxic components of the volatile oil as index. It was concluded that the chemical components of oil yield from seven different growing periods showed a certain amount of time differences. This study provided some scientific basis for the determination of the recovery time fromArtemisia argyiLevl. et Vant. qvai.
Artemisia argyiLevl. et Vant. qvai., volatile oil, GC-MS/MS, volatile principal component, toxic component
10.11842/wst.2016.03.013
R282.4
A
(责任编辑:马雅静 张志华,责任译审:王 晶)
2016-02-14
修回日期:2016-03-04
