花生籽仁黄酮含量遗传模式分析
2016-06-05侯名语胡晓辉刘立峰
侯名语,胡晓辉,陈 静,刘立峰*
(1.华北作物种质资源教育部重点实验室/河北省作物种质资源实验室/ 河北农业大学农学院,河北 保定 071001; 2.山东省花生研究所,山东 青岛 266100)
花生籽仁黄酮含量遗传模式分析
侯名语1,胡晓辉2,陈 静2,刘立峰1*
(1.华北作物种质资源教育部重点实验室/河北省作物种质资源实验室/ 河北农业大学农学院,河北 保定 071001; 2.山东省花生研究所,山东 青岛 266100)
黄酮是花生种子中重要的功能性成份,明确花生籽仁黄酮含量的遗传模式,为培育高黄酮花生品种奠定基础。本研究以花育22号和P76为亲本构建的重组自交系群体为材料,鉴定其种子黄酮含量,结果表明,亲本花育22号及P76的黄酮含量分别为19 μg RTE/g FW、70 μg RTE/g FW,群体花生种子黄酮含量在4~181 μg RTE/g FW之间。采用植物数量性状分离分析软件分析其遗传模式,结果表明花生种子黄酮含量受四对主基因控制,主基因遗传力为98.48%,具有加性效应,加性效应值在-46.7535~234.6343之间,基因之间具有互作效应,三对基因间的互作可提高花生籽仁黄酮含量。
花生;黄酮;遗传模式
花生又名“长生果”,具有重要的医药功用价值,所含的主要功能性成份是黄酮类化合物。黄酮由植物体的苯丙烷代谢途径合成,起始于苯丙氨酸,经查尔酮合成酶后进入黄酮合成途径,由多基因控制[1],所以,花生种子的黄酮含量为复杂数量性状。
对复杂数量性状进行遗传模式分析,有利于计划性和方向性育种。张宁等运用植物数量性状主基因+多基因混合遗传模型分析甜瓜果实糖含量相关性状的遗传特性[2],明确了主基因在糖含量遗传中的重要作用,得出适宜早代选择的结论,为甜瓜含糖量育种奠定了基础。陈小荣等利用主基因+多基因混合遗传模型分析水稻株高、茎粗、单穗质量,千粒质量的遗传特性,明确了育种选择该目标性状时需要考虑构建遗传群体的亲本及种植季节[3-5]。李侠等对大豆脂肪酸进行了遗传分析,五种脂肪酸的遗传主要受主基因控制[6]。林婷婷等对不结球白菜中维生素C含量进行遗传分析,表明其受1对加性主基因+加性-显性多基因控制,并受环境影响[7]。应用遗传模型分析花生的农艺性状和品质性状,表明主茎高、侧枝长、分枝数和结果枝数4个农艺性状均受2对主基因+多基因控制[8],蛋白质受多基因加性遗传控制[9];脂肪由两对加性-显性-上位性主基因+加性-显性多基因共同控制[10-11];花生的油酸和亚油酸性状分别由2对主基因控制,同时存在基因互作及多基因效应[11-12]。可见,应用遗传模型分析植物数量性状,具有重要的遗传理论意义和育种实际意义。有关花生种子黄酮含量遗传分析的研究未见报道。
本研究利用栽培花生 RIL 群体,采用 SEA.DH 软件分析花生籽仁黄酮含量的遗传模式,以期为花生籽仁高黄酮育种提供理论参考。
1 材料方法
1.1 试验材料
母本花育22号与父本P76杂交的98个RIL(重组自交系,recombinant inbred lines)家系(F11代)于2013年5月10日种植于山东省花生研究所莱西试验田,管理方式同大田。9月按生育期收获,每家系收获3个单株,自然晾干后4℃保存备用。
1.2 花生黄酮含量测定
总黄酮含量(total flavonoid content,TFC)测定方法参照 Chukwumah 等[13]方法,每单株取20粒果壳内部褐色的成熟花生种子,高速万能粉碎机粉碎,过 20 目筛,石油醚萃取脱脂反复3次。80%甲醇提取黄酮,25kHz 超声辅助提取。氯化铝显色法测定反应物 510nm 处的吸光度值。标准品为芦丁(RT:rutin),购自上海千叶生物科技公司。TFC 结果以每克花生籽仁重(FW:fresh weight)中含有 RT 的 μg 当量值表示,即μg RTE/g FW。
1.3 数据分析
采用Excel整理数据,南京农业大学开发的 SEA.DH 软件进行遗传分析[14]。
2 结果与分析
2.1 花生RIL群体黄酮含量分布
RIL群体及亲本黄酮含量分布见表1和附图。花育22号和P76两亲本间TFC相差51μg RTE/g FW,在其RIL群体中,超亲现象严重,含量超过亲本P76的家系占36.73%;低于亲本花育22 号的家系占28.57%。偏度值为1.01>1,正偏差数值较大,向右拖尾,即高于亲本的家系多。峰度值为0.11<1,比正态分布峰陡峭。表明通过TFC差异较大的两品种杂交可以培育出丰富的高TFC基因型,通过杂交育种,分析遗传模式,选育高TFC品系是可行的。
2.2 花生种子黄酮含量遗传分析
利用SEA.DH软件中21类遗传模型分析花育22号与P76杂交的RIL群体TFC,求出各种遗传模型的极大似然函数值(max likelihood value,MLV)和AIC (Akaike's information criterion)值。根据估计分布与真实分布的适合性程度进行推断,选择AIC值最小的模型为最适模型,其中,4MG-EEEA模型的AIC值最小,为995.4945,4MG-AI、3MG-CEA、4MG-EEA三模型的AIC值与之非常相近,分别为996.5369、997.224和999.3463,故 4MG-EEEA、4MG-AI、3MG-CEA和 4MG-EEA 模型均作为备选模型作适合性测验。
根据参数U1、U2、U3、nW的概率值P检测,适合性检验结果(表2)表明,4MG-AI 适合性参数的概率P值比其余3模型高,P(Dn)(>0.05)差异不显著,说明理论分布符合实际分布,4MG-AI(加性-加性×加性上位性)模型为花生黄酮含量的遗传模式,即花生种子黄酮含量由 4 对主基因控制,具有加性效应,基因之间具有上位性,互作效应。

表1 花育22号×P76 RIL群体及亲本黄酮含量表现 (μg RT/g FW)Table 1 TFC of Huayu22×P76 RIL population and its parents
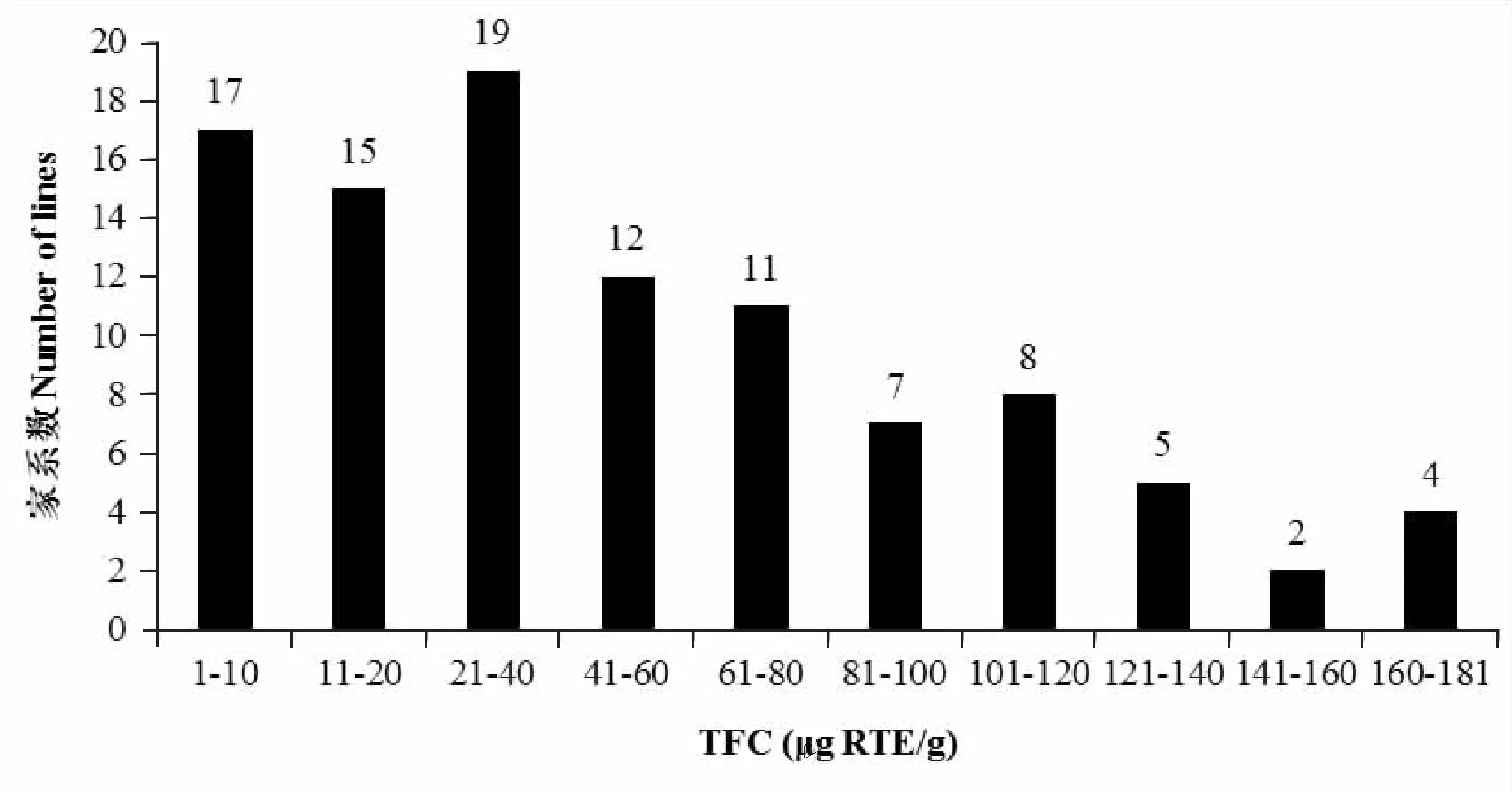
附图 RIL群体的TFC次数分布图Fig. Frequency distribution of TFC in RIL population
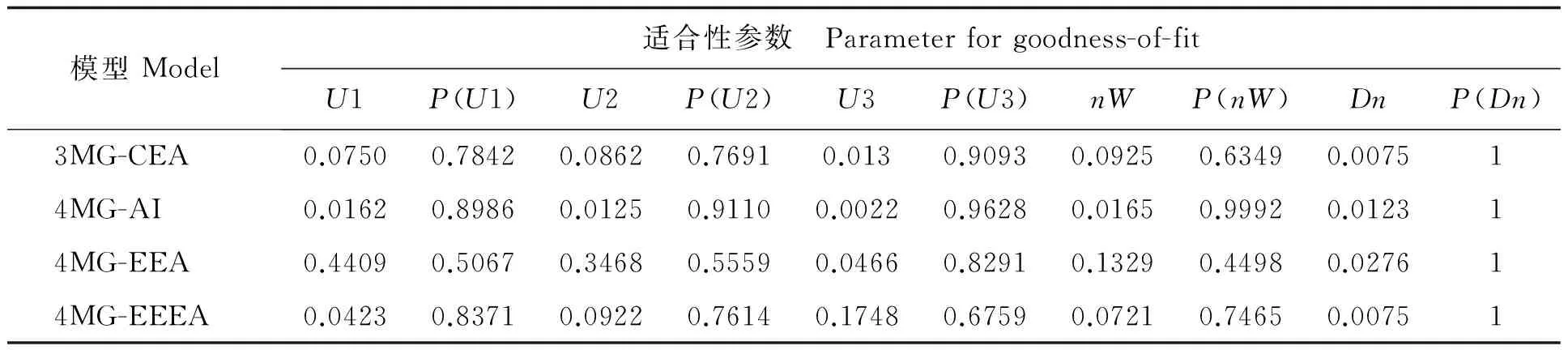
表2 备选遗传模型的适合性测验Table 2 Fitness test for the genetic models
花生种子黄酮含量由4对主基因控制,第一对和第二对主基因的加性效应值最大,da=234.6343,db=128.6069,且两对主基因间互作效应值最大,iab=100.1963;第三对主基因的加性效应值为负值,dc=-46.7535, 其与第一对主基因(a,加性效应值最大)及第四对主基因(d,加性效应值最小)的互作效应值均为负值;加性效应值最小的主基因(d)与第二对主基因(b)互作也会降低种子TFC。主基因遗传力为98.48%,花生种子黄酮含量主要依靠4对主基因遗传(表3)。
3 讨 论
黄酮为植物的次生代谢物,是植物在进化过程中适应外界环境胁迫合成的,其生物合成经历很多步骤,受多个结构基因和转录因子协调控制表达,其中一些基因会发生有利于黄酮形成的变异,且能稳定遗传到下一代,研究其遗传机制和模式,可以定向培育高黄酮含量的品种。在黄酮含量丰富的葡萄、番茄和大豆中,及在黄酮含量甚微的大田禾谷作物玉米和小麦中均定位到了黄酮 QTLs(数量性状位点)[15-21]。在番茄中,多项研究结果表明果实黄酮含量是受主效基因控制的, Ballester等利用野生番茄(Solanumchmielewskii)基因渗入系,将高黄酮QTL定位到第5染色体,根据测序结果,确定QTL为CHI1(CHI:chalcone-flavonone isomerase,查尔酮异构酶)基因[17]。Hanson 等利用另一番茄野生种质(Solanumhabrochaites)基因渗入系,也将黄酮QTL定位到第5染色体CHI[21]。Medal等利用RIL群体定位花生种子总黄酮QTL,检测到5个TFC QTLs,贡献率在25%~67%之间,存在主效QTL,其中,两个加性效应为正,有互作效应[22]。本研究利用植物数量性状遗传分析软件也分析到主效基因,主基因间具有互作效应,由于本实验只是一年一点的结果,未检测受环境影响的微效基因,但可推断花生种子黄酮含量遗传存在主效基因,有利于高黄酮花生基因型的选育,基因的类别及变异类型有待深入研究。
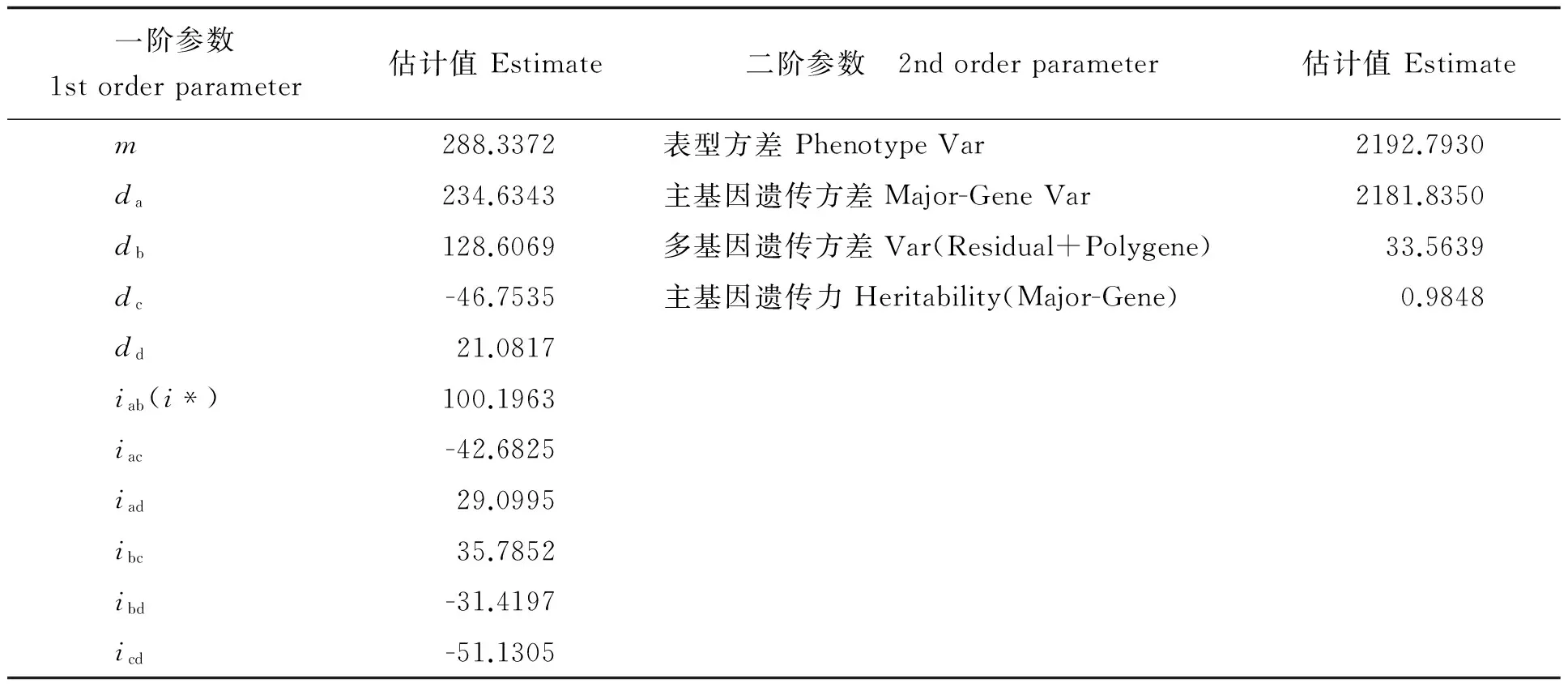
表3 种子TFC性状遗传参数估计值Table 3 Estimates of genetic parameters for TFC of seeds
[1] Lopes R M,da Silveria Angostini-Costa T,Gimenes M A,et al.Chemical composition and biological activities ofArachisspecies [J].Journal of Agriculture and Food Chemistry,2011,59:4321-4330.
[2] 张宁,张显,张勇,等.甜瓜远缘群体果实糖含量相关性状遗传分析[J].植物遗传资源学报,2014,15(5):932-939.
[3] Chen X R,Chen Z B,He H H,et al.Genetic analysis on plant height in rice in different growing seasons [J].Agricultural Science & Technology,2010,11(11-12):114-118.
[4] 陈小荣,陈志彬,贺浩华,等.不同种植季节下水稻茎杆粗度遗传分析[J].江西农业大学学报,2011,33(2):205-210.
[5] 陈小荣,陈志彬,贺浩华,等.水稻单穗质量和千粒质量的遗传分析[J].华南农业大学学报,2012,33(1):5-10.
[6] 李侠,常玮,韩英鹏,等.大豆种子脂肪酸含量的遗传分析[J].大豆科学,2009,28(3):403-408.
[7] 林婷婷,王建军,王立,等.不结球白菜维生素C含量主基因+多基因遗传分析[J].作物学报,2014,40(10):1733-1739.
[8] 江建华,王嵩,汪清,等.花生4个主要农艺性状的遗传分析[J].花生学报,2015,44(3):7-13.
[9] 刘华,张新友,崔党群,等.花生蛋白质和脂肪含量的主基因+多基因遗传分析[J].江苏农业科学,2011,39(2):127-130.
[10] 禹山林,杨庆利,潘丽娟,等.花生种子含油量的遗传分析[J].植物遗传资源学报,2009,10(3):453-456.
[11] Zhang X Y,Zhu S J,Han S Y,et al.Inheritance of fat and fatty acid compositions in peanut (ArachishypogaeaL.) [J].Agricultural Science & Technology,2011,12(7):943-946,974.
[12] 黄冰艳,张新友,苗利娟,等.花生油酸和亚油酸含量的遗传模式分析[J].中国农业科学,2012,45(4):617-624.
[13] Chukwumah Y,Walker L T,Verghese M.Peanut skin color:a biomarker for total polyphenolic content and antioxidative capacities of peanut cultivars [J].International Journal of Molecular Science,2009,10:4941-4952.
[14] 刘兵.植物数量性状分离分析Windows软件包SEA的研制[D].南京:南京农业大学,2013.
[15] Savoi S,Wong D C J,Arapitsas P,et al.Transcriptome and metabolite profiling reveals that prolonged drought modulates the phenylpropanoid and terpenoid pathway in white grapes (VitisviniferaL.) [J].BMC Plant Biology,2016,16:67,DOI:10.1186/s12870-016-0760-1.
[16] Malacarne G,Coller E,Czemmel S,et al.The grapevine VvibZIPC22 transcription factor is involved in the regulation of flavonoid biosynthesis [J].Journal of Experimental Botany,2016,67(11):3509-3522.
[17] Ballester A-R,Tikunov Y,Molthoff J,et al.Identification of loci affecting accumulation of secondary metabolites in tomato fruit of aSolanumlycopersicum×Solanumchmielewskiiintrogression line Population [J].Front Plant Sci,2016,7:1428.doi:10.3389/fpls.2016.01428.
[18] Li M W,Munoz N B,Wong C F,et al.QTLs regulating the contents of antioxidants,phenolics,and flavonoids in soybean seeds share a common genomic region [J].Front Plant Sci,2016,7:854.
[19] Hill C B,Taylor J D,Edwards J,et al.Detection of QTL for metabolic and agronomic traits in wheat with adjustments for variation at genetic loci that affect plant phenology [J].Plant Science,2015,233:143-154.
[20] Wen W W,Liu H J,Zhou Y,et al.Combining quantitative genetics approaches with regulatory network analysis to dissect the complex metabolism of the maize kernel [J].Plant Physiology,2016,170:136-146.
[21] Hanson P,Schafleitner R,Huang S M,et al.Characterization and mapping of a QTL derived fromSolanumhabrochaitesassociated with elevated rutin content (quercetin-3-rutinoside) in tomato [J].Euphytica,2014,200:441-454.
[22] Mondal S,Phadke R R,Badigannavar A M.Genetic variability for total phenolics,flavonoids and antioxidant activity of testaless seeds of a peanut recombinant inbred line population and identification of their controlling QTLs [J].Euphytica,2015,204:311-321.
Inheritance Analysis of Flavonoid Content in Peanut Seed
HOU Ming-yü1,HU Xiao-hui2,CHEN Jing2,LIU Li-feng1*
(1.NorthChinaKeyLab.forCropGermplasmResources,EducationMinistry/KeyLab.ofCropGermplasmResourcesLab.ofHebei/AgronomyCollegeofHebeiAgriculturalUniversity,Baoding071001,China;2.ShandongPeanutResearchInstitute,Qingdao266100,China)
Flavonoids are important functional components in peanut seed.In order to breed the varieties with high flavonoid,genetic mode of flavonoid content in peanut seed were analyzed.In this study,the recombinant inbred lines population derived from two cultivars was tested,and their flavonoid contents were evaluated.The results showed that the flavonoid contents of recombinant inbred lines were from 4 μg RTE/g FW to 181 μg RTE/g FW,and the flavonoid contents in the parents Huayu22 and P76 were 19 μg RTE/g FW and 70 μg RTE/g FW respectively.The genetic model was analyzed by using the plant quantitative trait analysis software.Flavonoid content of peanut seed was controlled by 4 major genes together with additive and interactive effect.The heritability of major genes was 98.48%,and additive effect values were from -46.7535 to 234.6343.Interaction of three pairs of genes can improve the content of flavonoids.
peanut; flavonoid; genetic mode
10.14001/j.issn.1002-4093.2016.04.005
2016-10-21
国家现代农业产业技术体系建设专项 (CARS-14);河北省科技支撑计划 (16226301D)
侯名语(1976-),女,河北徐水人,华北作物种质资源教育部重点实验室实验师,硕士,主要从事花生种质资源研究与利用。E-mail:houmy@hebau.edu.cn
*通讯作者:刘立峰(1968-),博士,教授,主要从事花生遗传育种研究。E-mail:lifengliucau@126.com
S565.2;Q348
A
