花生iso-ARah3基因克隆及多克隆抗体制备
2016-06-05姜焕焕郝翠翠迟晓元陈明娜潘丽娟祁佩时禹山林
姜焕焕,郝翠翠,迟晓元,王 冕,陈 娜, 陈明娜,潘丽娟,祁佩时,王 通,禹山林
(1.山东省花生研究所,山东 青岛 266100; 2.哈尔滨工业大学市政环境工程学院, 黑龙江 哈尔滨 150001; 3.青岛科技大学化工学院,山东 青岛 266042)
花生iso-ARah3基因克隆及多克隆抗体制备
姜焕焕1,2,郝翠翠3,迟晓元1,王 冕1,陈 娜1, 陈明娜1,潘丽娟1,祁佩时2,王 通1*,禹山林*
(1.山东省花生研究所,山东 青岛 266100; 2.哈尔滨工业大学市政环境工程学院, 黑龙江 哈尔滨 150001; 3.青岛科技大学化工学院,山东 青岛 266042)
类花生致敏原3(iso-ARah3)是花生致敏原3的同系物,其表达活性与干旱及黄曲霉侵染相关。本研究通过RT-PCR技术从花生种子cDNA文库中克隆获得iso-ARah3的开放阅读框(ORF),全长1533bp,编码510个氨基酸,N端预测有20个氨基酸的信号肽序列。通过序列比对发现,该克隆序列有1处缺失突变,其N端210个氨基酸序列与胰蛋白酶抑制因子的同源性较高,达83.60%。通过构建原核表达载体pET28a-isoARah3,转化进大肠杆菌BL21,经IPTG诱导表达,利用SDS-PAGE检测表明,融合蛋白His-isoARah3获得高效表达,分子量约54kD。His-isoARah3经纯化和富集,对新西兰兔进行4次免疫,纯化获得的iso-ARah3多克隆抗血清,通过间接ELISA检测,表明获得了效价比(1∶512000)很好的抗体。通过对融合蛋白的诱导前和纯化后样品进行Western Blot分析,结果显示仅在纯化样品相应位置(54kD)有明显信号,表明所制备的抗体具有很高灵敏度和特异性。本研究结果为深入研究花生iso-ARah3基因的功能奠定了基础。
花生;黄曲霉毒素;序列分析;原核表达;多克隆抗体
黄曲霉毒素是由真菌类的黄曲霉和寄生曲霉代谢产生的一类真菌毒素,普遍存在于土壤、作物种子及其各种制品中,花生是受黄曲霉侵染和危害最严重的作物之一,已成为全球花生产业发展的主要限制因素之一[1-3]。目前,国内外学者普遍认为解决花生黄曲霉毒素污染问题经济有效的可行途径是通过基因工程手段培育抗性品种[4]。随着基因组学和蛋白质组学技术的发展,挖掘抗性相关基因和标记蛋白,进而研究花生抗黄曲霉机制,成为培育抗黄曲霉品种的关键。各国学者通过蛋白质组学技术鉴定出了植物种子内含高丰度的贮藏蛋白,其中许多被鉴定为与抗黄曲霉毒素相关,这些蛋白含量的多少与抗性品种的抗性大小相关[5-7]。花生致敏原3(ARah3)是一个分子量为60kD,具有IgE结合功能的蛋白质,具有致敏原性[8]。类花生致敏原3(iso-ARah3)是ARah3的同系物,属于11S 球蛋白家族,均属于花生贮藏蛋白质家族[9]。其首次发现是Liang等[10]通过双向电泳技术从不同花生品种中分离、鉴定出来的,并推测其可能在花生种子抗黄曲霉侵染中起到一定作用。2010年Wang等[11]人通过蛋白质组学技术比较干旱及黄曲霉胁迫下抗—感黄曲霉花生品种种子蛋白质表达差异,也同样发现类花生致敏原3(iso-ARah3)在蛋白质及mRNA水平的表达受干旱和黄曲霉胁迫诱导显著上调。这说明抗性品种中iso-ARah3基因响应黄曲霉胁迫,具有一定的抗黄曲霉功能。2011年王通[12]对正常生长、干旱胁迫和干旱及黄曲霉共同胁迫下抗性品种YJ-1和感黄曲霉品种粤油7号种子进行蛋白质组学研究,鉴定出12个差异表达蛋白质点,其中包括贮藏蛋白iso-ARah3,其在蛋白质表达和mRNA转录水平均受干旱和黄曲霉菌诱导上调表达,另外通过高密度基因芯片技术进一步验证了该基因的表达受黄曲霉菌侵染诱导。这进一步可以推测iso-ARah3基因表达活性与干旱及黄曲霉侵染相关。通过基因工程培育抗性品种前提是要对蛋白的结构和功能特性进行了解,目前只在基因芯片和蛋白质组学技术角度鉴定出iso-ARah3基因与花生抗黄曲霉毒素相关,有关该基因的功能研究也仅限于其致敏性,其与抗黄曲霉毒素相关的结构和功能还未有相关报道,因此本研究对iso-ARah3基因进行序列分析,体外原核表达及抗体的制备,为深入研究其与黄曲霉毒素相关性的机制,培育抗性品种奠定基础。
1 材料与方法
1.1 实验材料及试剂
花生(ArachishypogaeaL.)材料为本实验室保存的品种花育23。大肠杆菌DH5a、BL21、氨苄青霉素、卡那霉素等购自生工生物工程(上海)股份有限公司。
rTaq DNA聚合酶,BamHⅠ、NotⅠ内切酶,pMD18-T Vector购自TaKaRa公司;质粒提取试剂盒和胶回收试剂盒购自OMEGA公司;其余常用试剂为国产分析纯。
1.2 总RNA的提取及cDNA的合成
取100 mg花生种子于预冷的研钵中加液氮迅速研磨成粉末状,参照TaKaRa公司RNA抽提试剂盒说明书提取总RNA,最后用50μL DEPC水溶解RNA。以总RNA为模板,利用PrimeScriptTMRT reagent试剂盒反转录合成cDNA第1链,-80℃保存,备用。
1.3iso-ARah3基因的克隆
根据已有的iso-ARah3基因序列,通过软件Primer5设计用于扩增的引物,命名为iso-F(iso-F:GGATCCATGGCCAAGCTTCTTGCGCTT)酶切位点为BamH I和iso-R(iso-R:GCGGCCGCAGCCACCTCCCTCATAGACTGA)酶切位点为NotI。PCR扩增iso-ARah3基因的全长ORF片段。PCR程序为94℃ 5min;94℃ 30s,55℃ 45s,72℃ 1min40s,32个循环;72℃ 10 min。参考pMD18-T克隆试剂盒(TaKaRa)中的连接反应步骤将iso-ARah3基因PCR胶回收产物与pMD18-T载体连接,然后转化到大肠杆菌DH5a中。经过蓝白斑筛选和菌液PCR进行阳性克隆筛选,并送往上海生物有限工程公司进行测序。
1.4iso-ARah3基因序列生物信息学分析
将测序结果利用软件DNAMAN比对。通过在线软件(http://expasy.org/tools/pi_tool.html),对iso-ARah3的氨基酸成分和含量,以及蛋白质的理论分子量等基本生物学性质进行预测。软件DNAMAN、SignalP和iPSORT预测花生iso-ARah3基因N端信号肽序列。NCBI链接的CDD[13]对其蛋白质二级结构及功能区域进行预测。在线网络工具NCBI分析其氨基酸序列同源性,软件MEG5构建系统发育树,分析其进化关系。
1.5iso-ARah3基因原核表达载体的构建
将iso-ARah3基因克隆到大肠杆菌克隆载体pET28a(+)中。分别将凝胶电泳验证提取成功的pMD18-isoARah3质粒和大肠杆菌pET28a(+)质粒以BamH I和NotI进行双酶切,对目的片段进行切胶、回收,4℃连接过夜,42℃热击转化到大肠杆菌BL21(DE3)感受态细胞中。以扩增引物进行菌液PCR,BamH I和NotI进行双酶切,验证筛选的阳性克隆。
1.6 iso-ARah3重组蛋白的诱导表达及SDS-PAGE检测
以浓度为0.4mmol/L异丙基硫代半乳糖(IPTG)为诱导剂,条件为37℃,120 r/min,诱导12 h后离心收集菌体,用裂解液(含50 mmol/L(pH 8.0)Tris Base,2 mmol EDTA,100 mmol NaCl)重悬菌体,进行超声波破碎,超声条件为功率200 W,超声3 s后,暂停5 s,此为一个循环。每200mL培养基超声循环次数为99次,超声完毕后,8000 r/min、4℃、离心15 min,分别收集上清和菌体沉淀。蛋白样品与上样缓冲液以2:1比例混匀后经SDS-PAGE电泳。电泳条件为5%浓缩胶,80 V,15 min;10%分离胶,150V,60min。考马斯亮蓝G-250染色1 h左右,用双蒸水清洗两次,然后用脱色液(5%甲醇、7.5%乙酸)进行脱色。在胶片观察灯下观察目的条带出现的位置,判断iso-ARah3融合蛋白是否可溶。
1.7 iso-ARah3重组蛋白的纯化及SDS-PAGE检测
将获得的Iso-ARah3融合蛋白用Ni-NTA 亲和层析柱纯化,纯化过程:(1)用10倍柱床体积的Binding buffer(PBS,8 mol/L尿素,15mmol/L咪唑,300 mmol/L NaCl,0.5%Triton X-100,pH8.0)清洗平衡柱子,流速60mL/h;(2)样品(溶解液上清)上柱,流速45mL/h,收集穿透液;(3)10倍柱床体积的Binding buffer清洗柱子,流速60mL/h;(4)Elute Buffer洗脱(PBS,8mol/L尿素,500mmol/L咪唑,pH8.0),流速45mL/h,收集洗脱液;(5)将纯化后的蛋白置于透析袋中,在PBS缓冲液(pH=8.0)中缓慢透析3次,每次2 h。收集透析后的样品进行SDS-PAGE分析。SDS-PAGE电泳条件同1.6。
1.8 多克隆抗体的制备及检测
选取实验室饲养4个月大的健康新西兰大白兔2只,初次免疫的抗原为弗氏完全佐剂和蛋白抗原的混合物,免疫剂量为0.5mg每只。21 d后进行第二次免疫,分别在第35 d和第49 d进行第三、四次免疫,免疫所用抗原和剂量与第二次免疫相同。分别对第三次和第四次免疫生长7 d后的兔子进行耳静脉采血,利用ELISA试剂盒进行抗血清效价的检测,酶标仪测定效价值。最终抗血清效价符合抗体制备要求,颈动脉采全血,利用ELISA试剂盒对抗体的效价进行检测,Western Blot验证抗体的特异性。
2 结果与分析
2.1iso-ARah3基因的克隆
以花生种子的cDNA为模板,PCR扩增iso-ARah3基因,连接T载体后,转化入大肠杆菌DHa5中。阳性克隆筛选结果(图1)显示,在1500 bp处出现特异性目的条带,表明成功克隆了该基因。
2.2iso-ARah3基因序列及编码蛋白的生物信息学分析
生物信息学分析表明,测序所得的序列为完整的开放读码框,大小为1533bp,编码510个氨基酸。蛋白质理论分子量约58399.4,为酸性氨基酸。带有负电荷氨基酸(天冬氨酸+谷氨酸)71个,带有正电荷氨基酸(赖氨酸+亮氨酸)56个。该蛋白质富含谷氨酸、谷氨酰胺、精氨酸,含量分别达9.2%、8.8%、8.6%;其次丝氨酸和苏氨酸含量高达7.1%和3.1%。编码的蛋白质二级结构包含有8个α-螺旋和22个β-折叠(图2),含有2个Cpuin-1的相对保守的结构区域,属于Cupin蛋白超家族(图3)。在N端有20个氨基酸的信号肽,其序列为MAKLLALSLCFCVLVLGASS。
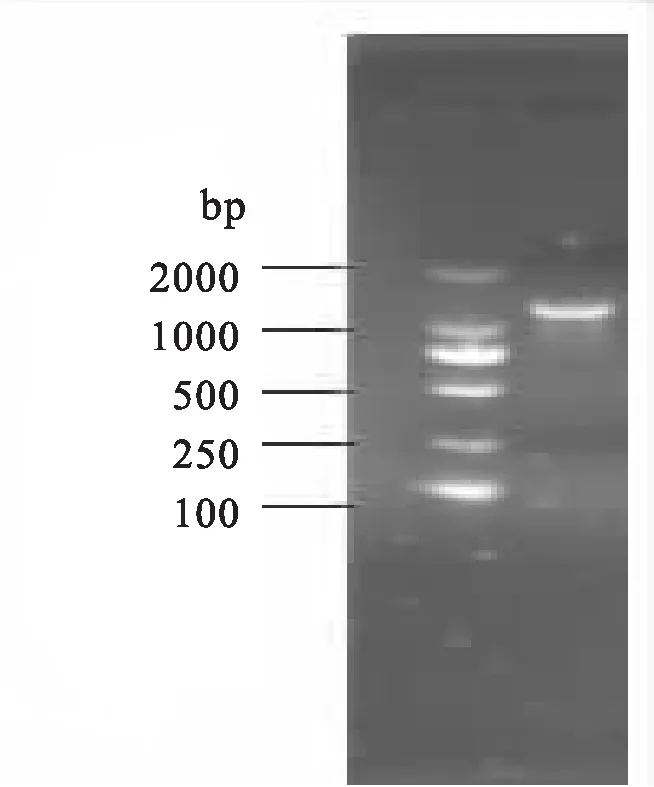
图1 iso-ARah3基因PCR产物的琼脂糖凝胶电泳分析Fig.1 Electrophoresis profile of iso-ARah3 gene by PCR
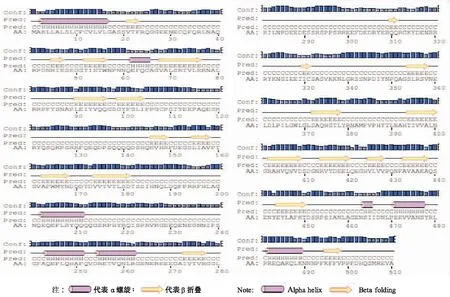
图2 iso-ARah3蛋白质的二级结构图Fig.2 Predicted protein secondary knot of iso-ARah3

图3 iso-ARah3蛋白质的保守结构域分析Fig.3 Predicted domain sites of iso-ARah3
通过DNAMAN对该基因的碱基序列与GeneBank上公布的iso-ARah3基因序列(登录号为ABI17154.1)对比(图4),发现克隆到的目的序列有1处缺失突变。其N端210个氨基酸序列与胰蛋白酶抑制因子(登录号为AF487543)的同源性较高,达到83.60%,表明该基因很可能具有胰蛋白酶抑制因子的活性。根据推测的氨基酸序列构建系统发育树(图5),结果表明,Iso-ARah3与花生中其他致敏蛋白质相似性很高,其中与ARah3(登录号AF93541)及ARah4(登录号AF086821)的同源性分别高达96%和72%。
2.3 重组蛋白表达载体的验证
利用PCR检测pET28a-ARah3重组质粒,电泳结果(图6a)显示在1533 bp处出现了目的条带。利用内切酶BamH I和NotI双酶切重组质粒,在同样的位置处出现了目的条带(图6b)。重组质粒再次测序,序列与所克隆序列经比对完全吻合,进一步说明iso-ARah3基因的原核表达载体构建成功。
2.4 SDS-PAGE分析
IPTG诱导含pET28a-iso-ARah3重组质粒的大肠杆菌12h,超声破碎、离心后,分别收集上清和菌体沉淀,对样品上清和沉淀进行SDS-PAGE分析,以不含iso-ARah3基因的大肠杆菌pET-28a(+)作为对照菌株。电泳结果显示在54kD出现明显的新生条带(图7a),大小与分子生物信息学预测的结果基本相符,表明融合蛋白在诱导12h后成功得到了表达,并且蛋白主要存在于沉淀中,超声后的上清中含量很少,表明蛋白主要为包涵体形式。融合蛋白经过镍琼脂糖亲和层析法进行纯化后,SDS-PAGE电泳结果显示在相应位置(54kD)出现了明显单一条带,表明融合蛋白成功得到了纯化(图7b)。为下一步蛋白功能的研究奠定了基础。

图4 iso-ARah3基因的氨基酸序列比对分析Fig.4 Alignment and analysis of amino acid sequences of iso-ARah3
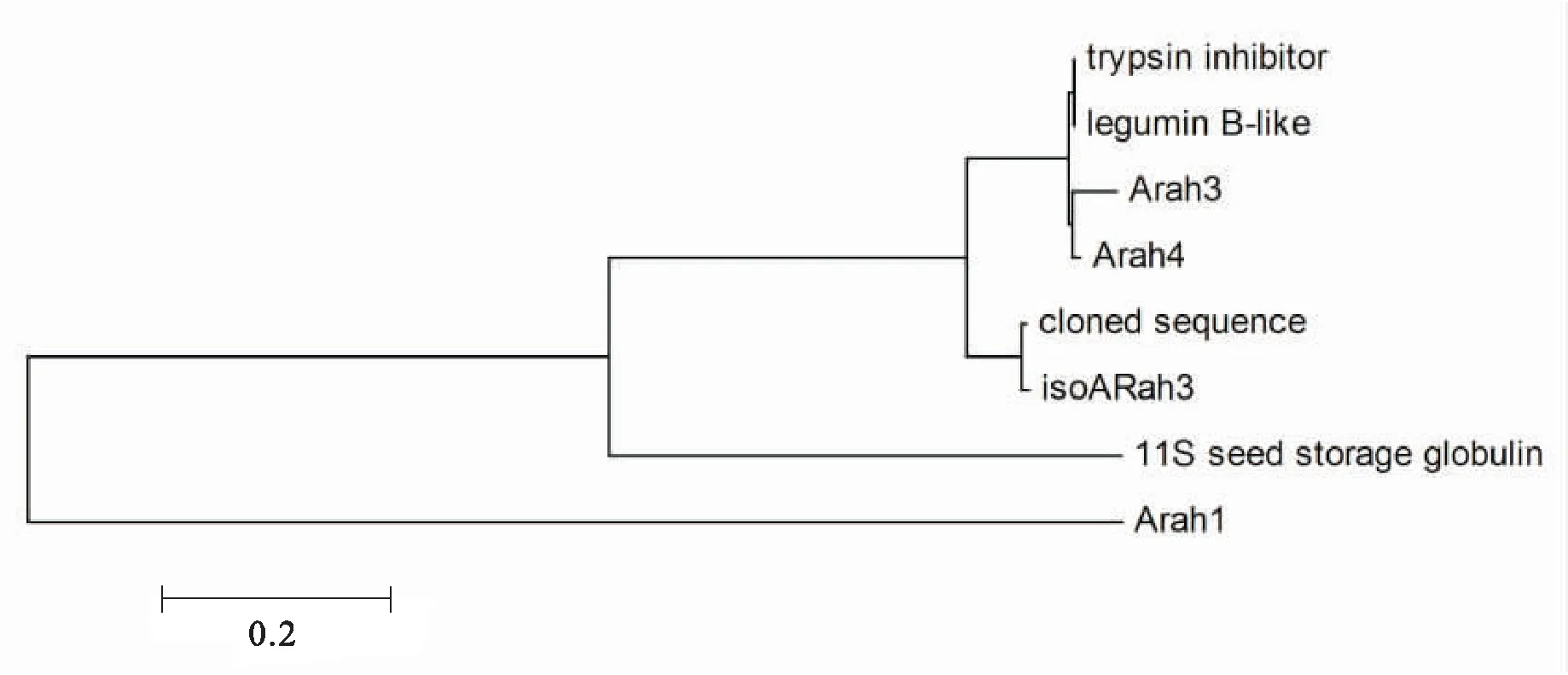
图5 iso-ARah3与花生其他种子贮藏蛋白质的系统发育树Fig.5 Multiple alignment of the iso-ARah3 amino acid sequences and other storage protein

图6 pET28a-isoARah3原核表达载体菌液PCR及质粒酶切鉴定Fig.6 PCR and plasmid enzyme identification of pET28a-isoARah3 prokaryotic expression vector注:(a)pET28a-isoARah3菌液PCR,M:DL2000Marker,1~6:菌液PCR;(b)pET28a-isoARah3双酶切鉴定,M:DL2000 DNA marker,1:pET28a-isoARah3质粒双酶切(BamH I/Not I),2:pET28a-isoARah3质粒。Note:(a)Liquid PCR of PET28-isoARah3,M:DL2000 Marker; 1~10:Liquid PCR; (b):Double enzyme digestion identification of pET28a-isoARah3,M:DL2000 DNA marker,1:Double digestion of pET28a-isoARah3 plasmid by BamH I and Not I,2:pET28a-isoARah3 plasmid.
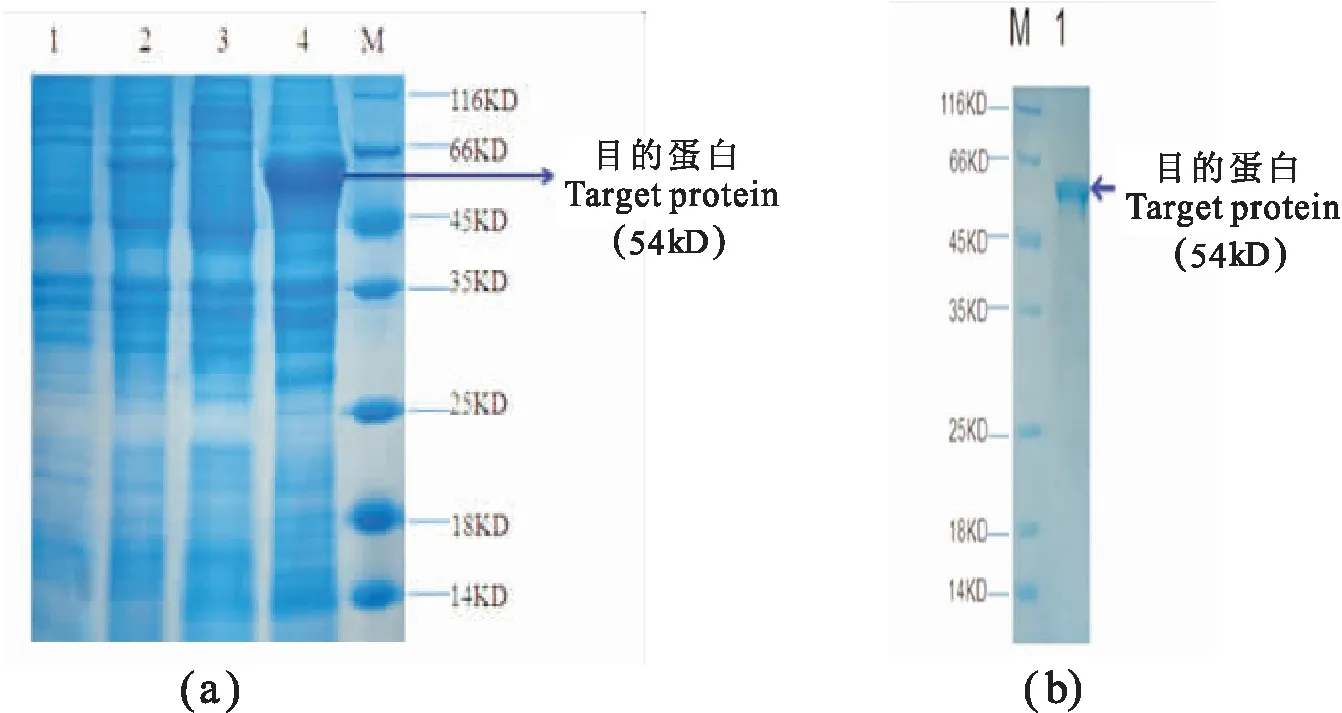
图7 Iso-ARah3融合蛋白表达定位与纯化的SDS-PAGE分析Fig.7 SDS-PAGE analysis of the expressed location and purification product of recombinant Iso-ARah3注:(a)Iso-ARah3原核诱导表达SDS-PAGE电泳图,1:未经诱导的pET28a-isoARah3,2:经IPTG诱导12h后的样品,3:超声波破碎后的上清液,4:超声波破碎后的沉淀,M:蛋白marker;(b)纯化后pET28a-isoARah3的SDS-PAGE电泳图,M:蛋白Marker,1:纯化后的融合蛋白。Note:(a) SDS-PAGE electrophoresis of Iso-ARah3 prokaryotic induced expression,1:Recombinant protein without inducing,2:Recombinant protein induction by IPTG after12 h,3:The supernatant after ultrasonic disruption,4:The precipitation after ultrasonic disruption,M:Protein marker; (b) SDS-PAGE electrophoresis of the recombinant Iso-ARah3,M:Protein marker,1:The purified fusion protein.
2.5 多克隆抗体的制备及检测
对新西兰兔进行4次免疫并分别对四次的血清进行间接ELISA检测及酶标仪检测。结果显示,三免后抗血清效价:A:16K,B:16K;四免后抗血清效价:A:512K,B:512K;终放后抗血清在稀释了512千倍时,抗体还可以产生可观察到的免疫反应,经酶标仪检测其效价:A:512K,B:512K(图8)。证明血清里抗体浓度高,特异性强,可以用于后续的蛋白印迹实验。
分别对诱导前和纯化后的融合蛋白进行Western Blot分析,结果显示诱导前样品在相应位置(54kD)无信号,纯化后样品在相应位置(54kD)有明显信号,所获免疫血清与诱导表达后的目的蛋白专一结合显色(图9)。证明所获抗体确实是含iso-ARah3基因的抗体。
通过ChemiDocTM XRS+ system软件进行灰度分析(图10)。结果表明融合蛋白的纯度为84.5%,证明符合制备抗体的纯度。
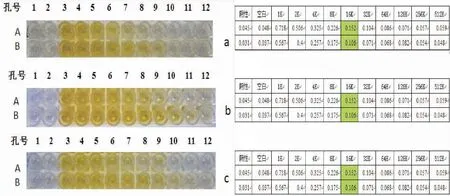
图8 血清ELISA效价检测及酶标仪测得数据图Fig.8 The detection of antibody by ELISA and enzyme standard instrument注:a:三免血清ELISA及酶标仪检测结果,b:四免血清ELISA及酶标仪检测结果,c:终放血后血清ELISA及酶标仪检测结果。Note:a:ELISA and enzyme standard instrument results of the third rabbit serum; b:ELISA and enzyme standard instrument results of the fourth rabbit serum; c:ELISA and enzyme standard instrument results of the final rabbit serum.

图9 pET28a-isoARah3融合蛋白的Western Blot检测Fig.9 Western Blot analysis of recombinant iso-ARah3注:1:纯化后样品,2:诱导前样品。Note:1:Samples after purified,2:Samples before induction.
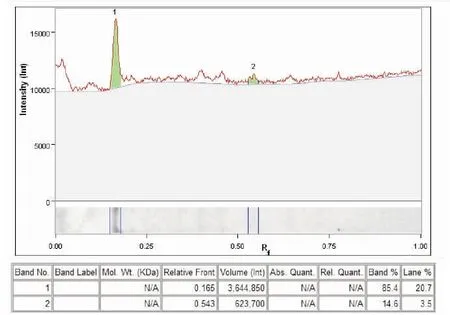
图10 抗体灰度分析Fig.10 Gray analysis of antibody
3 讨 论
国内外学者普遍认为解决花生黄曲霉毒素污染的有效途径是通过基因工程手段培育抗性品种。因此从复杂的抗性相关基因中筛选出重要基因就成了关键问题。类花生致敏原3(iso-ARah3)是花生主要致敏蛋白质III(ARh3)的一个亚型,通过基因组学及蛋白质组学方法鉴定其表达活性与干旱及黄曲霉侵染相关。目前,有关该基因的结构及功能研究都是与其致敏性相关。Kang等[14]克隆的iso-ARah3基因由510个氨基酸组成,具有低致敏性。钟海峰等[15]采用Touchdown PCR技术从花生cDNA文库中克隆了两个片段长度为512bp的iso-ARah3同源基因,也鉴定出其具有低致敏性。本研究首次从该基因与花生抗黄曲霉角度出发,成功克隆了由510个氨基酸组成的iso-ARah3基因,与GenBank公布的序列比对,有1处碱基缺失,这处碱基是ARah3序列上的一个IgE结合位点,而IgE结合位点的多少决定了过敏原性的高低,因此推测iso-ARah3基因的过敏原性比ARah3低,这与Kang等的研究结果一致[14]。序列分析表明,丝氨酸和苏氨酸比例高达7.1%和3.1%,推测其可能与蛋白质磷酸化修饰有关,对维持蛋白质活性具有重要作用。信号肽与蛋白质的折叠和定位有一定关系,通过多种软件预测该基因的信号肽,发现iso-ARah3基因N端具有20个氨基酸的信号肽,且发生剪切性很小,这为后期引物设计和蛋白纯化提供了理论依据。该基因编码的蛋白质有8个α-螺旋和22个β-折叠及2个Cpuin-1的相对保守结构域组成,蛋白质的空间结构与其功能相关,因此功能区域的预测对了解其功能及作用机制具有重要意义。
花生是主要的食物过敏源之一,已经报道的花生致敏蛋白有20多种,其中ARah1,ARah2和ARah3是主要的致敏蛋白,可以被50%以上的过敏者识别[16]。大多数花生致敏蛋白属于花生贮藏蛋白质家族,不仅具有致敏性,还与花生的抗性相关[17]。iso-ARah3是ARah3的一个亚型,是近年来新发现的一个致敏原因子。本研究克隆的iso-ARah3基因N端210个氨基酸序列与胰蛋白酶抑制因子(登录号为AF487543)的同源性较高,达到83.60%,这表明该基因很可能具有胰蛋白酶抑制因子的活性。而且该基因编码的蛋白质与花生中其他贮藏蛋白具有同源性,与ARah3和ARah4的同源性分别达到96%和72%。前人研究表明,花生中的致敏蛋白ARah2、ARah3及ARah4具有胰蛋白酶抑制剂的活性[18-19],进一步说明,作为同源致敏蛋白的iso-ARah3也具有胰蛋白酶抑制剂的活性。胰蛋白酶抑制剂是一类参与植物防御机制的贮藏蛋白,主要存在于植物的种子中[20]。目前,在许多作物中都成功克隆了胰蛋白酶抑制因子基因,并鉴定其具有抑制黄曲霉的功能[21-23]。梁炫强等[24]通过对花生粗体蛋白的研究,表明胰蛋白酶抑制剂具有体外抑制黄曲霉孢子生成的功能。Chen等[25]通过对玉米的研究,鉴定出14kD的胰蛋白酶抑制剂(TI),通过对纯化的TI蛋白和黄曲霉菌及其他真菌共同培养,证明其具有抑制黄曲霉真菌生长的功能。因此进一步推测iso-ARah3基因与花生抗黄曲霉毒素侵染相关。但要了解该基因的功能,还需要在蛋白质水平上进行深入研究。
通过原核表达载体的构建进行蛋白体外表达,具有操作简便、蛋白表达量高、节省时间等优点。因此本实验选用具有6个组氨酸标签的pET28a(+)为载体,将iso-ARah3基因进行体外融合蛋白的表达,成功获得了54kD纯化蛋白,这比生物信息学预测的结果(58kD)小,可能是由于在表达前通过引物的设计已经把基因N端信号肽序列切除,而预测蛋白分子量大小是以完整的氨基酸序列进行的,所以其表达的蛋白最终会比预测的略小。纯化的蛋白免疫新西兰兔,得到了效价高、灵敏度和特异性好的多克隆抗体,该抗体可以识别iso-ARah3融合蛋白,且具有较高的纯度。多克隆抗体的成功制备为进一步研究花生iso-ARah3基因的内源表达和蛋白功能奠定了基础。
4 结 论
本研究成功克隆了花生iso-ARah3基因。序列分析表明其具有510个氨基酸, N端210个氨基酸序列与胰蛋白酶抑制因子的同源性较高,达83.60%。iso-ARah3蛋白与花生其他种子贮藏蛋白质具有同源性。成功获得并纯化了该基因的重组蛋白。经过免疫新西兰兔,获得了效价高达1∶512000的多克隆抗体,Western Blot显示所制备的抗体具有特异性,纯度为84.5%。这为今后iso-ARah3基因的内源表达调控和功能的研究搭建了一个很好的平台。
[1] 罗自生,秦雨,徐艳群,等.黄曲霉毒素的生物合成、代谢和毒性研究进展[J].食品科学,2015,36(3):250-257.
[2] Payne G A,Brown M P.Genetics and physiology of aflatoxin biosynthesis [J].Annual Review of Phytopathology,1998,36(4):329-62.
[3] 胡东青,庞国兴,张治宇,等.出口花生黄曲霉毒素污染的预防与控制[J].花生学报,2011,40(1):36-38.
[4] Eapen S,George L.Agrobacterium tumefaciens mediated gene transfer in peanut (ArachishypogaeaL.) [J].Plant cell reports,1994,13(10):582-586.
[5] Chen Z Y,Brown R L,Rajasekaran K,et al.Identification of a maize kernel pathogenesis-related protein and evidence for its involvement in resistance toAspergillusflavusinfection and aflatoxin production [J].Phytopathology,2006,96(1):87-95.
[6] Baker R L,Brown R L,Chen Z Y,et al.A maize lectin-like protein with antifungal activity againstAspergillusflavus[J].Journal of Food Protection,2009,72(1):120-127.
[7] Oberschall A,Deak M,Torok K,et al.A novel aldose/aldehyde reductase protects transgenic plants against lipid peroxidation under chemical and drought stresses [J].The Plant Journal,2000,24(4):437-446.
[8] Rabjohn P,Helm E M,Stanley J S,et al.Molecular cloning and epitope analysis of the peanut allergen Arah3 [J].The Journal of clinical investigation,1999,103(4):535-542.
[9] 王通,梁炫强,李玲.花生致敏原的研究进展[J].中国油料作物学报,2007,29(3):353-358.
[10] Liang X Q,Luo M,Holbrook C C,et al.Storage protein profiles in Spanish and Runner market type peanuts and potential markers [J].Bmc Plant Biology,2006,6(5):1-9.
[11] Wang T,Zhang E H,Chen X P,et al.Identification of seed proteins associated with resistance to pre-harvested aflatoxin contamination in peanut (ArachishypogaeaL.) [J].Bmc Plant Biology,2010,10(1):1-11.
[12] 王通.花生抗黄曲霉相关基因的表达分析及AhGLP家庭基因的功能研究[D].华南师范大学,2011.
[13] Marchlerbauer A,Lu S,Anderson J B,et al.CDD:a Conserved Domain Database for the functional annotation of proteins [J].Nucleic Acids Research,2011,39 (Database issue):D225-D229.
[14] Kang I H,Gallo M.Cloning and characterization of a novel peanut allergen Arah3 isoform displaying potentially decreased allergenicity [J].Plant science,2007,172(2):345-353.
[15] 钟海峰,马三梅,王永飞,等.花生过敏原iso-Arah3的克隆、表达和免疫学鉴定[J].植物生理学报,2009(10):958-962.
[16] Koppelman S J,Vlooswijk R A A,Knippels L M J,et al.Quantification of major peanut allergens Arah1 and Arah2 in the peanut varieties Runner,Spanish,Virginia,and Valencia,bred in different parts of the world [J].Allergy,2001,56(2):132-137.
[17] Breiteneder H,Ebner C.Molecular and biochemical classification of plant-derived food allergens [J].Journal of Allergy and Clinical Immunology,2000,106(1):27-36.
[18] Maleki S J,Viquez O,Jacks T,et al.The major peanut allergen,Arah2,functions as a trypsin inhibitor,and roasting enhances this function [J].Journal of Allergy and Clinical Immunology,2003,112(1):190-195.
[19] Dodo H W,Viquez O M,Maleki S J,et al.cDNA clone of a putative peanut (ArachishypogaeaL.) trypsin inhibitor has homology with peanut allergens Arah3 and Arah4[J].Journal of agricultural and food chemistry,2004,52(5):1404-1409.
[20] Liao H,Ren W,Kang Z,et al.A trypsin inhibitor fromCassiaobtusifoliaseeds:isolation,characterization and activity againstPierisrapae[J].Biotechnology letters,2007,29(4):653-658.
[21] Tripathi V R,Kumar S,Garg S K.A study on trypsin,AspergillusflavusandBacillussp.protease inhibitory activity inCassiatora(L.)synSennatora(L.) Roxb.seed extract[J].Bmc Complementary & Alternative Medicine,2011,11(1):1-8.
[22] Benjakul S,Visessanguan W,Thummaratwasik P.Isolation and characterization of trypsin inhibitors from some Thai legume seeds[J].Journal of Food Biochemistry,2000,24(2):107-127.
[23] Yeh K W,Chen J C,Lin M I,et al.Functional activity of sporamin from sweet potato (IpomoeabatatasLam.):a tuber storage protein with trypsin inhibitory activity[J].Plant molecular biology,1997,33(3):565-570.
[24] 梁炫强,潘瑞炽.花生种子胰蛋白酶抑制剂与抗黄曲霉侵染的关系[J].作物学报,2003,29(2):295-299.
[25] Chen Z Y,Brown R L,Lax A R,et al.Resistance toAspergillusflavusin corn kernels is associated with a 14-kDa protein[J].Phytopathology,1998,88(4):276-281.
Gene Cloning of Peanutiso-ARah3 and Preparation of Its Polyclonal Antibody
JIANG Huan-huan1,2,HAO Cui-cui3,CHI Xiao-yuan1,WANG Mian1,CHEN Na1, CHEN Ming-na1,PAN Li-juan1,QI Pei-shi2,WANG Tong1,YU Shan-lin1
(1.ShandongPeanutResearchInstitute,Qingdao266100,China; 2.SchoolofMunicipalandEnvironmentalEngineering,HarbinInstituteofTechnology,Harbin150001,China;3.CollegeofChemicalEngineering,QingdaoUniv.ofScienceandTechnology,Qingdao266042,China)
Iso-ARah3 is a homologue of the peanut Allergen III (ARah3).And its expression in peanut seeds was induced significantly by the invasion ofAspergillusflavus.In this study,the full-length sequence ofiso-ARah3 gene was cloned through RT-PCR technology from cDNA library of peanut seeds.And the open reading frame (ORF) ofiso-ARah3 with 1533bp encoded 510 amino acids.The N-terminal of this protein had a signal peptide sequence (MAKLLALSLCFCVLVLGASS).And alignment analysis showed that the cloned sequence with a deletion mutation was highly homologous as 83.6% to the trypsin inhibitor of peanut.The recombinant plasmid pET28a-isoARah3 was constructed,and the fusion protein His-isoARah3 was super-expressed inE.coliBL21 under induction of IPTG.SDS-PAGE analysis showed that the fusion protein was approximately 54kD.Then the fusion protein was purified and used as antigen to inject rabbits for four times.The prepared polyclonal antiserum was obtained and purified.And indirect ELISA analysis showed that the anti-isoARah3 polyclonal antibodies have good sensitivity and high specificity with a titer of 1:512000.Furthermore,the polyclonal antibody was used to test the expression of fusion protein inE.coliBL21 through Western Blot,and detected a specific band at 54kD.It suggested that anti-isoARah3 polyclonal antibodies have high specificity and sensitivity.Our results are useful for further functional studies of peanutiso-ARah3.
peanut;Aspergillusflavus; sequence analysis; prokaryotic expression; polyclonal antibody
10.14001/j.issn.1002-4093.2016.04.002
2016-09-06
2014年国家“万人计划”青年拔尖人才;国家花生产业技术体系项目(CARS-14);山东省自然科学基金项目(ZR2014YL011;ZR2014YL012);国家自然科学基金项目(31200211);山东省农业科学院青年科研基金项目(2016YQN14)
姜焕焕(1989-),女,黑龙江肇源人,在读博士,主要从事花生遗传育种及PGPR与植物互作关系研究。
*通讯作者:王通,博士,主要从事花生抗黄曲霉机制及遗传育种研究。E-mail:wtwtp@126.com
S565.2; Q785
A
禹山林,研究员,主要从事花生遗传育种研究。E-mail:yshanlin1956@163.com
