HOXD10基因转染对人胃癌耐药SGC7901/VCR细胞增殖、凋亡及侵袭能力的影响
2016-06-05杨锡贵杨香山
陈 玲,陈 凯,杨锡贵,姜 超,杨香山
1. 山东省医学科学院附属医院内三科,山东 济南 250031; 2. 昆明医科大学第三附属医院胸外科一病区; 3. 山东省医学科学院附属医院病理科
HOXD10基因转染对人胃癌耐药SGC7901/VCR细胞增殖、凋亡及侵袭能力的影响
陈 玲1,陈 凯2,杨锡贵1,姜 超1,杨香山3
1. 山东省医学科学院附属医院内三科,山东 济南 250031; 2. 昆明医科大学第三附属医院胸外科一病区; 3. 山东省医学科学院附属医院病理科
目的 研究HOXD10基因转染人胃癌耐药细胞系SGC7901/VCR后表达情况及对细胞增殖、凋亡、侵袭能力的影响。方法将HOXD10基因表达质粒(pcDNA3.1-EGFP-HOXD10)转染至SGC7901/VCR中,利用Real-time PCR和Western blotting检测HOXD10基因转染后表达效果;MTT方法、平板单克隆实验、流式细胞术、Transwell方法分别检测HOXD10基因转染对细胞增殖、单克隆形成、细胞周期、凋亡、侵袭能力的影响;并用Western blotting检测HOXD10基因转染对肿瘤侵袭性相关因子MMP-2蛋白表达的影响。结果 HOXD10基因转染至人胃癌SGC7901/VCR细胞后其基因和蛋白表达水平均显著上升(P<0.05),能够抑制SGC7901/VCR细胞增殖、单克隆形成、细胞周期,并提高顺铂作用下细胞凋亡率(P<0.05),同时显著抑制细胞侵袭能力和MMP-2蛋白的表达(P<0.05)。结论 HOXD10基因转染人胃癌耐药细胞系SGC7901/VCR后能够高表达,进而抑制细胞增殖、单克隆形成、细胞周期和侵袭能力并提高顺铂下细胞凋亡率,而其抑制细胞侵袭能力可能与MMP-2表达减少有关。
HOXD10;基因转染;细胞增殖;细胞凋亡;细胞侵袭;MMP-2
胃癌作为全球高发的恶性肿瘤之一,在我国肿瘤死亡原因中占第二位,且因其早期诊断率较低,不易被诊治[1]。Bernards等[2]研究发现胃癌肿瘤易发生转移侵袭,转移性患者的发病率从1990年的24%显著提高到2011年的44%,且和其他类型肿瘤一样,胃癌也易存在原发性耐药性。近来对胃癌的研究有了较大进步,但针对晚期和伴有转移性、耐药性的胃癌研究仍不理想[3]。人胃癌耐药细胞系SGC7901/VCR具有强侵袭能力和耐药能力,是研究人胃癌特性细胞功能的最佳细胞系[4]。HOXD10基因是Ⅰ类同源异形盒基因(Homobox genes)家族中的一种特殊的转录调节因子,具有控制胚胎细胞发育、组织细胞增殖、分化的生理作用,并具有抑癌基因的作用[5]。最新研究[6]表明HOXD10表达水平在乳腺癌、子宫肿瘤、肾癌、胃癌等恶性肿瘤中均表达减少,并在上皮来源恶性肿瘤侵袭转移中发挥作用。但目前关于HOXD10在人胃癌肿瘤发生、发展中发挥作用及对细胞功能的影响尚未见研究。因此,本研究通过将HOXD10基因转染至人胃癌耐药细胞系SGC7901/VCR中,探讨HOXD10基因在胃癌细胞增殖、凋亡及侵袭中发挥的作用。
1 材料与方法
1.1 试剂和材料人胃癌耐药细胞系SGC7901/VCR购自北京中科院细胞库;RPMI 1640细胞培养基、EDTA胰酶、胎牛血清购自美国Gibico公司;pcDNA3.1-EGFP空载质粒及人源HOXD10基因重组pcDNA3.1-EGFP-HOXD10表达质粒购自中国医学科学院肿瘤研究所及本实验室自行构建;LipofectamineTM2000购自上海Invitrogen公司;Real-time PCR试剂盒购自大连Takara公司;Transwell Permeable Supports购自美国Corning公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、顺铂购自美国Sigma公司;细胞周期检测试剂盒、Annexin-V/PI细胞凋亡检测试剂盒均购自北京鼎国生物公司;兔抗人HOXD10、基质金属蛋白酶-2(MMP-2)、肌动蛋白(β-actin)一抗购自美国Santa Cruz公司;HRP标记山羊抗兔IgG二抗购自北京中杉金桥公司。
1.2 方法
1.2.1 HOXD10基因转染细胞及培养:取对数生长期的人胃癌细胞耐药系SGC7901/VCR细胞以1×105个/ml重悬于含10%胎牛血清的RPMI 1640细胞培养基中后,种植于6孔细胞板中,放入含5%CO2的细胞培养箱中培养。待细胞贴壁生长融合率达80%~90%时,开始HOXD10基因转染。先将50 μl Opti-MEM稀释混匀4 μg重组pcDNA3.1-EGFP-HOXD10表达质粒及pcDNA3.1-EGFP空载质粒,再用50 μl Opti-MEM将2 μl的LipofectamineTM2000稀释混匀,分别室温孵育5 min后将其混匀再孵育20 min,均匀加入到SGC7901/VCR细胞中共培养转染6 h后更换新的培养基。同时加入1.0 g/L的G418进行阳性筛选,同时用未转染的SGC7901/VCR作对照。当细胞大部分死亡时,换用0.5 g/L的G418筛选。挑取阳性克隆细胞进行扩大培养,分别获得HOXD10基因转染细胞和空载转染细胞。
1.2.2 HOXD10基因转染检测:重组pcDNA3.1-EGFP-HOXD10表达质粒转染SGC7901/VCR细胞并筛选后继续培养48 h,在倒置荧光显微镜下观察各组的细胞形态和绿色荧光表达情况。同时消化离心收集各转染组及转染前后细胞,加入1 ml RNAiso Plus提取液匀浆提取总RNA,并利用反转试剂盒逆转录获得cDNA第一链为模板。根据人HOXD10基因和内参β-actin基因设计引物为HOXD10:上游5′-TTCACCGCTCTTTGTTTG-3′,下游5′-AGTTACCCTGCATTACGA-3′;β-actin:上游5′-CTGGGACGACATGGAGAAA-3′,下游5′-AGGAAGGCTGGAAGAGTGC-3′。利用Bio-Rad公司的IQ5TMReal-time PCR系统进行实时荧光PCR检测pcDNA3.1-EGFP-HOXD10表达质粒转染前后各组SGC7901/VCR细胞中HOXD10基因的表达情况。PCR的反应条件为:95 ℃ 60 s,95 ℃ 10 s,58 ℃ 20 s,70 ℃ 10 s,40个循环。各组重复检测3次,以2-△△Ct方法计算基因相对表达。同时在细胞转染48 h后,消化收集各组细胞,RAPI强裂解液裂解细胞提取细胞中总蛋白,利用BCA试剂盒测定蛋白浓度后,各组上样30 μg总蛋白进行10%的SDS-PAGE电泳2 h后,半干法转PVDF膜,封闭后孵育多克隆兔抗人HOXD10和β-actin一抗,4 ℃过夜后利用TBST洗涤3次后孵育山羊抗兔HRP标记二抗(1∶5 000)2 h,后TBST洗涤后ECL化学发光显影,曝光拍照,用Quantity One软件分析各组细胞中HOXD10蛋白的相对表达量。
1.2.3 MTT方法检测细胞增殖:分别收集HOXD10基因转染前后的SGC7901/VCR细胞,设置未转染对照组、EGFP空载组和HOXD10转染组。利用各组培养基稀释细胞浓度为104个/ml,接种于96孔板中,分别先后培养12、24、36、48、60、72 h后,每孔加入20 μl的MTT溶液(浓度为5 mg/ml),37 ℃培养箱中继续培养4 h后,吸弃培养基,每孔加入二甲基亚砜(DMSO)150 μl,振荡10 min后,置于酶标仪测定492 nm处各孔的A值。每组设置6个重复孔,各进行3个重复实验。
1.2.4 平板实验检测细胞单克隆形成能力:分别取未转染对照组、EGFP空载组和HOXD10基因转染组SGC7901/VCR细胞,消化后收集用培养基重悬成单细胞悬液。在细胞培养板中分别加入各组含500个细胞的单细胞悬液,在37 ℃含5% CO2培养箱中继续培养7 d,每组设置3个重复,用4%多聚甲醛固定30 min,1%的结晶紫染色30 min后PBS洗涤2次。在显微镜下拍照计数单克隆数,各组单克隆形成率(%)=各组单克隆数/接种细胞总数×100%。
1.2.5 流式细胞术检测细胞周期和顺铂作用下凋亡率:收集各组对数生长期SGC7901/VCR细胞进行同步化后接种于6孔板中,调整每孔细胞浓度为5×104个/ml细胞,置于37 ℃,5% CO2细胞培养箱中培养24 h。各组细胞消化离心后收集弃上清,并用70%预冷乙醇在4 ℃固定12 h以上后,离心弃上清洗去乙醇,用500 μl PBS重悬细胞加入PI和RNaseA(50 μg/ml)孵育后室温避光经流式细胞仪检测各组HUVEC细胞周期并计算各组细胞周期细胞百分比。同时收集各组细胞,参照文献[7]更换含0.6 mg/L顺铂、10%胎牛血清的RPMI 1640新培养基继续24 h,后分别加入5 μl的FITC标记Annexin V及10 μl PI细胞凋亡检测试剂,经流式细胞仪检测各组细胞凋亡率。
1.2.6 Transwell检测细胞侵袭能力:收集HOXD10基因转染前后各组SGC7901/VCR细胞,用培养基调整细胞浓度为5×105个/ml。分别在各组Transwell板的上室膜上涂抹均匀的1 mg/ml的Matrigel胶50 μl,置于37 ℃培养箱中30 min使形成基底膜结构后,将各组细胞各取100 μl加入到Transwell上室中,在下室中加入含20%胎牛血清的1640培养基600 μl,每组设置3个重复,置于37 ℃、5% CO2培养箱中继续培养48 h。培养好后用4%多聚甲醛固定小室滤膜,并擦除上表面细胞,用结晶紫染色10 min后PBS洗涤2遍,在显微镜下观察各组细胞滤膜上穿过膜侵袭的细胞,拍照并计数各组SGC7901/VCR细胞侵袭率。侵袭率(%)=各组平均侵袭细胞数/未处理组侵袭细胞数×100%。
1.2.7 Western blotting检测细胞MMP-2蛋白表达情况:HOXD10基因转染SGC7901/VCR细胞后,收集正常未转染组、EGFP空载组、HOXD10基因转染组细胞,PBS洗涤1次后按照相同的方法提取各组细胞中总蛋白并测定蛋白浓度。每组上样30 μg总蛋白后进行10%的SDS-PAGE电泳2 h,半干法转膜封闭后分别孵育细胞基质金属蛋白酶-2(MMP-2)、肌动蛋白(β-actin)抗体(1∶1 000)4 ℃过夜,TBST洗涤后二抗(1∶5 000)孵育2 h,ECL显影,曝光拍照。用Quantity One软件分析目的条带相对吸光值,并用内参β-actin进行校正。
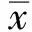
2 结果
2.1 HOXD10基因转染SGC7901/VCR细胞后表达情况通过将构建的重组pcDNA3.1-EGFP-HOXD10表达质粒用脂质体可以顺利转染到SGC7901/VCR细胞中,在荧光显微镜下观察细胞形态和发荧光变化。未转染对照组中细胞结构完整不发荧光,而转染pcDNA3.1-EGFP空载组和pcDNA3.1-EGFP-HOXD10基因转染组中,大部分细胞均发出绿色荧光,说明SGC7901/VCR细胞中有绿色荧光蛋白EGFP表达,重组质粒转染成功(见图1)。为进一步检测HOXD10基因转染SGC7901/VCR细胞后的表达情况,分别利用Real-time PCR和Western blotting方法检测HOXD10基因和蛋白的表达情况。Real-time PCR检测发现,与未转染组相比,EGFP空载组中HOXD10基因表达未见明显变化,而HOXD10基因转染组中HOXD10基因表达显著提高约12倍(P<0.05);Western blotting检测发现,与未转染组相比,EGFP空载组中HOXD10蛋白表达无明显变化,而HOXD10基因转染组中HOXD10蛋白表达上升约5倍(P<0.05,见图2)。
2.2 HOXD10基因转染对SGC7901/VCR细胞增殖的影响利用MTT方法检测HOXD10基因转染SGC7901/VCR细胞后不同时间点的生长曲线以判断其对细胞增殖的影响。与未转染对照组相比,EGFP空载组中细胞在不同时间点的吸光值变化不明显(P>0.05);而HOXD10基因转染组中细胞在48、60、72 h时的吸光值(分别为0.51±0.03、0.59±0.04、0.63±0.04)均显著低于未转染对照组(分别为0.65±0.04、0.77±0.03、0.88±0.04),差异有统计学意义(P<0.05,见图3)。

图1 HOXD10基因转染SGC7901/VCR细胞后形态及荧光变化(20×) A:未转染对照组;B:EGFP空载组;C:HOXD10基因转染组

注:与未转染对照组相比,*P<0.05。

注:与未转染对照组相比,*P<0.05。
2.3 HOXD10基因转染对SGC7901/VCR细胞单克隆形成的影响利用平板实验检测HOXD10基因转染对SGC7901/VCR细胞单克隆形成的影响。未转染对照组和EGFP空载组中细胞单克隆形成数差别不大,而HOXD10基因转染组中细胞单克隆形成数显著降低。经统计发现,未转染对照组、EGFP空载组中细胞单克隆形成率分别为(45.50±4.50)%、(42.00±5.50)%,相比未见明显变化(P>0.05);而HOXD10基因转染组中细胞单克隆形成率为(19.50±4.60)%,显著低于未转染对照组,差异有统计学意义(P<0.05,见图4)。
2.4 HOXD10基因转染对SGC7901/VCR细胞周期的影响流式细胞术检测HOXD10基因转染后对SGC7901/VCR细胞周期的影响。与未转染对照组细胞中G0/G1期(55.65±3.10)%和S+G2/M期(31.24±2.53)%相比,HOXD10基因转染组中细胞G0/G1期百分比显著升高(P<0.05);而S+G2/M期百分比显著下降(P<0.05)。而EGFP空载组中细胞G0/G1期和S+G2/M期百分比值与未转染对照组相比,差异无统计学意义(P>0.05,见图5)。

注:与未转染对照组相比,*P<0.05。

注:与未转染对照组相比,*P<0.05。
2.5 HOXD10基因转染对顺铂作用下SGC7901/VCR细胞凋亡的影响利用流式细胞术检测HOXD10基因转染对顺铂作用下耐药SGC7901/VCR细胞凋亡的影响。在0.6 mg/L顺铂作用下,未转染对照组和EGFP空载组中SGC7901/VCR细胞凋亡较少,验证了SGC7901/VCR细胞的耐药性,而HOXD10基因转染组中细胞凋亡则显著增加。与未转染对照组细胞凋亡率(15.50±3.25)%相比,EGFP空载组细胞凋亡率变化不显著,为(18.35±4.55)%(P>0.05),而HOXD10基因转染组中细胞凋亡率显著增加,为(46.48±4.64)%(P<0.05,见图6)。

注:与未转染对照组相比,*P<0.05。
2.6 HOXD10基因转染对SGC7901/VCR细胞侵袭的影响利用Transwell实验可以检测HOXD10基因转染对SGC7901/VCR细胞侵袭的影响。与未转染对照组相比,EGFP空载组中细胞的侵袭数未见明显变化,而HOXD10基因转染组中细胞侵袭数显著减少。与未转染对照组侵袭率(99.55±1.25)%相比,HOXD10基因转染组中细胞侵袭率显著下降至(38.46±4.65)%(P<0.05,见图7)。
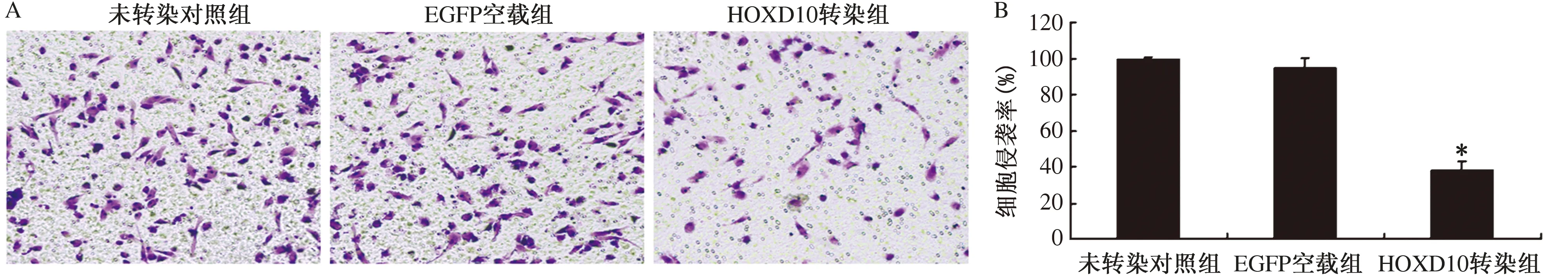
注:与未转染对照组相比,*P<0.05。
2.7 HOXD10基因转染对SGC7901/VCR细胞中MMP-2表达的影响利用Western blotting方法检测HOXD10基因转染对SGC7901/VCR细胞中肿瘤侵袭性相关因子MMP-2蛋白的表达。与未转染对照组(0.82±0.04)相比,EGFP空载组中MMP-2蛋白表达(0.78±0.04)未见明显变化,而HOXD10基因转染组中MMP-2蛋白表达则显著降低,为0.26±0.05(P<0.05,见图8)。

注:与未转染对照组相比,*P<0.05。
3 讨论
HOXD10是人类同源盒基因(Homeobox,HOX)家族中的一员,HOX基因是一类特殊的转录调节因子,其编码蛋白能够与特异性DNA结合后调节胚胎发育和细胞生长分化,而近来研究表明其异常表达与肿瘤的发生、发展有关[7]。目前,在多种肿瘤中均可检测到HOX家族相关基因的异常表达如结肠癌、肾癌、乳腺癌、骨肉癌等[8]。HOX家族基因与乳腺癌等多种恶性肿瘤的预后及发展密切相关,参与其细胞增殖、分化、凋亡信号通路等[9]。HOXD10作为同源盒家族中一种,与肿瘤的关系研究尚处于初步阶段,在对乳腺癌、食管癌、人脑星形细胞瘤等肿瘤研究中发现HOXD10蛋白表达水平低于其在正常组织中水平,其可能作为抑癌基因表达[10]。同时已有研究表明不同肿瘤细胞中HOXD10表达水平与其分化程度和侵袭转移能力相关[11]。任辉等[12]研究也发现HOXD10在正常胃黏膜组织中呈强阳性表达,而在淋巴结转移阳性的胃癌组织中表达极弱或不表达。胃癌作为消化道中最为常见的恶性肿瘤,在我国恶性肿瘤发病率中占首位,尽管目前对胃癌研究已有较大进展,但因其强侵袭能力和转移能力,仍未有较满意的诊断和治疗途径[13]。而胃癌的发生发展涉及到多因素包括抑癌基因的表达异常、细胞增殖、细胞周期的调控异常、基因启动子的转录异常等方面[14]。HOXD10基因作为可能的抑癌基因,与胃癌发生发展的关系,特别是对胃癌的生物学行为影响尚未见研究,因此,本研究利用真核质粒转染的方法,将HOXD10基因转染至人胃癌耐药细胞系SGC7901/VCR中,使HOXD10基因高表达,进而检测其对SGC7901/VCR细胞增殖、凋亡、侵袭等生物功能的影响。
本研究中将HOXD10基因转染至SGC7901/VCR细胞后,利用Real-time PCR和Western blotting方法分别检测HOXD10转染前后基因和蛋白的表达变化,结果表明转染后HOXD10基因和蛋白表达水平分别显著上升约12倍和5倍,说明HOXD10基因在正常人胃癌耐药细胞系SGC7901/VCR中表达较低,而通过基因转染后能够在SGC7901/VCR中高表达。利用MTT方法检测HOXD10基因转染后在不同时间点对SGC7901/VCR细胞生长的抑制效果,结果发现与未转染组和EGFP空载组相比,HOXD10基因转染组细胞生长较缓慢且在48~72 h时间段生长曲线显著降低。平板单克隆实验能够检测单个细胞的增殖能力,本研究中HOXD10基因转染SGC7901/VCR细胞后,细胞单克隆形成率也显著下降,充分说明HOXD10基因过表达能够抑制人胃癌耐药细胞系SGC7901/VCR细胞增殖。
细胞的增殖水平及能力主要受到细胞周期时相的调节,细胞周期是细胞活动的基本过程,包括DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)和细胞分裂暂停期(G0期)[15]。本研究利用流式细胞术检测HOXD10基因转染至SGC7901/VCR细胞后发现细胞周期能够阻滞于G0/G1期,而反映细胞增殖状态的S+G2/M期百分率也显著下降,与上述检测发现HOXD10基因转染后过表达抑制SGC7901/VCR细胞增殖结果是一致的。HOXD10作为转录调控因子,能够调节细胞发育分化,因此,HOXD10基因转染后抑制SGC7901/VCR细胞生长和增殖的机制可能是HOXD10过表达调控相关转录信号影响细胞G0期向G1期细胞分化的能力。同时利用流式细胞术检测HOXD10基因转染后在顺铂作用下的细胞凋亡情况。人胃癌耐药细胞系SGC7901/VCR对一般化疗药物具有耐药性[16],检测也发现在0.6 mg/L顺铂作用下,未转染对照组和EGFP空载组细胞凋亡率均较低,而当HOXD10基因转染后SGC7901/VCR细胞凋亡率显著上升,说明HOXD10过表达能够促进人胃癌耐药SGC7901/VCR对化疗药物的敏感性,进而诱导细胞凋亡。
人胃癌耐药细胞系SGC7901/VCR因具有强耐药性,比一般胃癌SGC7901细胞具有更强的侵袭和迁移能力[17]。本研究中利用Transwell方法检测HOXD10基因转染后对SGC7901/VCR细胞侵袭能力的影响,结果发现HOXD10基因转染组中细胞的侵袭率显著下降,说明HOXD10高表达能够抑制SGC7901/VCR细胞的侵袭能力。为了揭示HOXD10高表达抑制SGC7901/VCR细胞侵袭的机制,利用Western blotting检测了HOXD10基因转染前后细胞中侵袭性相关因子MMP-2的表达情况。在肿瘤细胞侵袭转移中,基质金属蛋白酶(MMPs)发挥关键性作用,MMPs能够降解细胞基质外各种蛋白成分,从而破坏肿瘤细胞侵袭的组织学屏障,促进肿瘤细胞向周围组织的侵袭迁移[18]。而在MMPs家族中,MMP-2被认为是肿瘤细胞中影响侵袭性生长的最佳预测因子[19]。本研究中Western blotting检测发现HOXD10基因转染SGC7901/VCR后细胞侵袭能力下降同时MMP-2蛋白表达水平也随之显著下降,说明HOXD10高表达抑制SGC7901/VCR细胞侵袭能力可能通过抑制MMP-2蛋白表达发挥作用。
综上所述,本研究利用HOXD10基因转染人胃癌耐药细胞系SGC7901/VCR,诱导HOXD10高表达,发现能够显著抑制SGC7901/VCR的细胞增殖、诱导细胞凋亡,并通过抑制MMP-2蛋白表达降低细胞侵袭能力。通过本研究证明HOXD10在胃癌发生、发展的病理机制中发挥重要作用,并可为胃癌的治疗和诊断提供理论依据和新方向。
[1]Lian C, Yang J, Wang XT, et al. Reversion of multidrug resistance of human gastric cancer SGC7901/DDP cells by E2F-1 gene silencing [J]. Chin J Oncol, 2014, 36(3): 171-176. 廉超, 杨杰, 王晓通, 等. E2F-1基因沉默对人胃癌耐药细胞株SGC7901/顺铂多药耐药性的逆转[J]. 中华肿瘤杂志, 2014, 36(3): 171-176.
[2] Bernards N, Creemers GJ, Nieuwenhuijzen GA, et al. No improvement in median survival for patients with metastatic gastric cancer despite increased use of chemotherapy [J]. Ann Oncol, 2013, 24(12): 3056-3060.
[3] Cardoso R, Coburn N, Seevaratnam R, et al. A systematic review and meta-analysis of the utility of EUS for preoperative staging for gastric cancer [J]. Gastric Cancer, 2012, 15(1): 19-26.
[4] Zhang KG, Qin CY, Wang HQ, et al. The effect of TRAIL on the expression of multidrug resistant genes MDR1, LRP and GST-π in drug-resistant gastric cancer cell SGC7901/VCR [J]. Hepatogastroenterology, 2011, 59(120): 2672-2676.
[5] Grier DG, Thompson A, Kwasniewska A, et al. The pathophysiology of HOX genes and their role in cancer [J]. J Pathol, 2005, 205(2): 154-171.
[6] Ansari KI, Hussain I, Kasiri S, et al. HOXC10 is overexpressed in breast cancer and transcriptionally regulated by estrogen via involvement of histone methylases MLL3 and MLL4 [J]. J Mol Endocrinol, 2012, 48(1): 61-75.
[7] Pan HM, Fei HX, Du JP, et al. Construction of a cisplatin-induced human gastric cancer drug-resistant cell line [J]. World Chinese Journal of Digestology, 2007, 15(18): 2009-2013. 潘洪明, 费洪新, 杜静平, 等. 人胃癌顺铂耐药细胞系的建立过程[J]. 世界华人消化杂志, 2007, 15(18): 2009-2013.
[8] Li XC, Xiong JG, Cheng ZW, et al. Association between XPG polymorphisms and risk of gastric cancer [J]. Chin J Gastroenterol Hepatol, 2014, 23(3): 259-262. 李湘楚, 熊建光, 程正位, 等. XPG基因多态性与胃癌发病风险研究[J]. 胃肠病学和肝病学杂志, 2014, 23(3): 259-262.
[9] Pilato B, Pinto R, De Summa S, et al. HOX gene methylation status analysis in patients with hereditary breast cancer [J]. J Hum Genet, 2013, 58(1): 51-53.
[10]Hou XW, Wang YJ, Wang M, et al. Clinicopathological significance of homobox gene HOXD10 mRNA expression in human breast cancer [J]. China Oncology, 2007, 17(6): 448-452. 侯晓玮, 王雅杰, 王梅, 等. 同源异型盒基因HOXD10在乳腺癌组织中的表达及其临床病理意义[J]. 中国癌症杂志, 2007, 17(6): 448-452.
[11] Sun L, Yan W, Wang Y, et al. MicroRNA-10b induces glioma cell invasion by modulating MMP-14 and uPAR expression via HOXD10 [J]. Brain Res, 2011, 1389(3): 9-18.
[12] Ren H, Ren SN, Jin HY, et al. Homologous alien HOXD10 box genes expression and gastric cancer metastasis correlation analysis [J]. Chin J Gen Surg, 2013, 28(1): 63-64. 任辉, 任圣男, 金洪永, 等. 同源异型盒基因HOXD10的表达与胃癌转移相关性分析[J]. 中华普通外科杂志, 2013, 28(1): 63-64.
[13] Liu ZX, Wang JJ, Wang XX, et al. Expression and clinical significance of 15-hydroxyprostaglandin dehydrogenase and cyclooxygenase-2 in gastric cancer [J]. Chin J Gastroenterol Hepatol, 2013, 22(4): 337-340. 刘震雄, 王景杰, 王旭霞, 等. 胃癌组织中15-PGDH与COX-2的表达特征及其临床意义[J]. 胃肠病学和肝病学杂志, 2013, 22(4): 337-340.
[14] Nong YC, Lai MY, Su T, et al. GOLPH3 gene overexpression promotes proliferation of gastric cancer cells [J]. World Chinese Journal of Digestology, 2014, 22(12): 1669-1675. 农云翠, 赖铭裕, 苏婷, 等. 高尔基体磷蛋白3基因过表达对胃癌细胞增殖的影响[J]. 世界华人消化杂志, 2014, 22(12): 1669-1675.
[15] Hallett RM, Huang C, Motazedian A, et al. Treatment-induced cell cycle kinetics dictate tumor response to chemotherapy [J]. Oncotarget, 2015, 6(9): 7040-7052.
[16] Yang YX, Xiao ZQ, Chen ZC, et al. Proteome analysis of multidrug resistance in vincristine-resistant human gastric cancer cell line SGC7901/VCR [J]. Proteomics, 2006, 6(6): 2009-2021.
[17] Zhang Y, Lu Q, Cai X. MicroRNA-106a induces multidrug resistance in gastric cancer by targeting RUNX3 [J]. FEBS Letters, 2013, 587(18): 3069-3075.
[18] Merdad A, Karim S, Schulten HJ, et al. Expression of matrix metalloproteinases (MMPs) in primary human breast cancer: MMP-9 as a potential biomarker for cancer invasion and metastasis [J]. Anticancer Res, 2014, 34(3): 1355-1366.
[19] Zhang HY, Zheng XZ, Wang XH, et al. S100A4 mediated cell invasion and metastasis of esophageal squamous cell carcinoma via the regulation of MMP-2 and E-cadherin activity [J]. Mo Bio Rep, 2012, 39(1): 199-208.
(责任编辑:马 军)
Influence of HOXD10 gene transfection on cell proliferate, apoptosis and invasion of human gastric cancer resistance SGC7901/VCR
CHEN Ling1, CHEN Kai2, YANG Xigui1, JIANG Chao1, YANG Xiangshan3
1. Department of the Third Internal Medicine, Affiliated Hospital of Shandong Academy of Medical Sciences, Ji’nan 250031; 2. Department of Thoracic Surgery, the Third Affiliated Hospital of Kunming Medical University; 3. Department of Pathology, Affiliated Hospital of Shandong Academy of Medical Sciences, China
Objective To investigate the expression of HOXD10 gene after transfecting human gastric cancer cell line SGC7901/VCR and its effect on cell proliferation, apoptosis and invasion. Methods HOXD10 expression plasmid (pcDNA3.1-EGFP-HOXD10) was trasfected into SGC7901/VCR, then HOXD10 gene and protein expression effect were tested by Real-time PCR and Western blotting. The effect of HOXD10 gene transfection on cell proliferation, monoclonal formation, cell cycle, apoptosis treated with cisplatin, cell incasion of the SGC7901/VCR were determined by MTT assay, tablet monoclonal experiments, flow cytometry and Transwell assay, respectively. And the expression of tumor invasion related factor matrix metalloproteinase-2 (MMP-2) was detected by Western blotting after HOXD10 gene transfected.Results The levels of HOXD10 gene and protein expression were significantly increased after HOXD10 gene transfected into SGC7901/VCR cell (P<0.05); which could inhibit the cell proliferation, monoclonal formation, cell cycle of SGC7901/VCR, and enhance the apoptosis rate after treated with cisplatin (P<0.05); and inhibit the cell invasion and MMP-2 protein expression (P<0.05).Conclusion HOXD10 could be highly expressed after the HOXD10 gene transfected into human gastric cancer resistant cell line SGC7901/VCR, inhibit the cell proliferation, monoclonal formation, cell cycle and invasion ability and improve the rate of apoptosis in casplatin, which inbibit the invasion of SGC7901/VCR cells related to the decrease of MMP-2 expression.
HOXD10; Gene transfection; Cell proliferation; Apoptosis; Cell invasion; MMP-2
陈玲,主治医师,研究方向:胃癌基础医学及临床治疗。E-mail:chenling_712@163.com
杨香山,副主任医师,研究方向:恶性肿瘤侵袭及转移分子机制研究。E-mail:yangxsh@126.com
10.3969/j.issn.1006-5709.2016.01.003
R735.2
A
1006-5709(2016)01-0009-07
2015-06-10
