Ca2+对希瓦氏菌MR-1胞外多糖的影响*
2016-06-05唐连凤周丽华孙丽华宋少云
唐连凤, 周丽华, 孙丽华, 宋少云
(1. 广东工业大学轻工化工学院, 广东 广州 510006;2. 中山大学生命科学学院,广东 广州 510275)
Ca2+对希瓦氏菌MR-1胞外多糖的影响*
唐连凤1, 周丽华1, 孙丽华1, 宋少云2
(1. 广东工业大学轻工化工学院, 广东 广州 510006;2. 中山大学生命科学学院,广东 广州 510275)
希瓦氏菌是一类革兰氏阴性土壤铁还原菌,具有胞外电子传递能力,其胞外聚合物的组成是直接影响其电子传递效应的重要因素之一。胞外多糖(EPS)是胞外聚合物的重要组成成分,该文以ShewanellaoneidensisMR-1为对象,采用苯酚-硫酸法结合光谱法、色谱法及质谱法等系统地研究了含不同浓度(0、0.7、1.4、2.1和5.0 mmol/L)CaCl2培养基对MR-1胞外多糖的影响。结果表明,不同浓度Ca2+影响下的MR-1多糖的分泌量各不相同,其中Ca2+浓度为2.1 mmol/L时,MR-1分泌多糖质量浓度最高,为0.3 g/mL,是无Ca2+影响的EPS分泌量的5倍;而Ca2+浓度为1.4 mmol/L 时,EPS为0.08 g/mL,与无Ca2+影响时EPS分泌量相近;Ca2+对MR-1分泌的EPS结构没有显著性影响,获得的EPS均为由α-D-吡喃甘露糖通过 1,3-苷键形成的多糖。研究结果为深入研究希瓦氏菌胞外聚合物提供数据参考。
ShewanellaoneidensisMR-1;钙离子;胞外多糖;甘露糖
ShewanellaoneidensisMR-1是一种革兰氏阴性兼性厌氧土壤铁还原菌,广泛存在于淡水沉积物、海湾沉积物等环境。因MR-1能利用多种物质作为电子受体进行胞外电子传递而常应用于有机污染物的降解 、重金属的还原解毒、及微生物燃料电池(MFC)等研究中[1-3],但外界环境的变化能对MR-1性能产生重要的影响。Liu等[4]通过对比0与5 mmol/L CaCl2对微生物对U(Ⅵ)还原性能的影响发现,虽然Ca2+可增加钠铀矿的溶解速度和提高U(Ⅵ),的生物利用度,但Ca2+的存在大大降低了MR-1对水溶液中U(Ⅵ)的还原能力。2012年,Bailey等[5]报道表面活性剂如月桂醇磺酸钠、十二烷基磺酸钠、椰油酰胺丙基甜菜碱等及多硫化钙在一定浓度范围内可抑制或刺激MR-1的生长,从而影响MR-1在土壤修复中的作用。同年,Fitzgeald等[3]则研究发现,在MR-1培养基中加入一定浓度的CaCl2,则能有效提高基于MR-1的MFC的功率输出。当在以乳酸钠做碳源的培养基中加入1.4 mmol/L CaCl2后,MFC的电流密度增加 >80% (0.95~1.76 μA/cm2),并发现当CaCl2浓度增加至2.080 mmol/L时,最大输出功率能从157增大到330 μW。
Ca2+作为生物体内的第二信使,其通过细胞内外形成的浓度差异,而具有穿梭于细胞内外传递信息的能力,可广泛参与细胞生命活动,如调控细胞的分裂周期、运输和运动等。Ca2+对微生物各种功能的影响,最终主要体现在微生物生物膜及其胞外聚合物的变化上[6]。其中,胞外多聚物由微生物生长过程中的代谢产物以及细胞自溶物组成, 主要成分为多糖和蛋白质,此外还含少量核酸、脂类、腐殖质、糖醛酸等。 对于土壤铁还原菌而言,胞外多聚物则是微生物与电子受体相互作用的“屏障与媒介”, 研究土壤铁还原菌胞外电子传递机理也主要从胞外多聚物着手[7]。本文鉴于各文献报道Ca2+对MR-1功能的影响,开展研究不同Ca2+浓度对MR-1胞外多聚物的重要组成成分之一胞外多糖(EPS)的影响,从而从EPS分子水平角度描述MR-1对Ca2+的响应,为更深入研究土壤铁还原菌胞外电子传递机理提供数据参考。
1 材料与方法
1.1 样品与试剂
ShewanellaoneidensisMR-1 (MR-1) 来源于广东省生态环境与土壤研究所;细菌学蛋白胨,酵母提取粉,广东环凯微生物科技有限公司;氯化钙,φ=50%戊二醛,乙酸乙酯,乙酸异戊酯,冰醋酸,麝香草粉均来源于天津大茂化学试剂,分析纯;氯化钠,氯化钾,无水乙醇,正丁醇,丙酮,氯仿均来源于天津致远化学试剂,分析纯;甲醇,天津彩云飞化工,分析纯;葡萄糖,甘露糖,上海伯奥生物科技,分析纯;三氟乙酸(TFA)来源于Sigma-Aldrich,蛋白测序级;GF254硅胶板,青岛海洋化工。实验过程中使用的水均来自ELGA LabWater实验室纯水系统(英国埃尔格公司)。
1.2 实验过程与方法
1.2.1 不同CaCl2浓度环境下希瓦氏菌的培养 配制500 mL LB(蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L)培养基,分装到5个容量为150 mL的锥形瓶中,每瓶 90 mL,用报纸包扎封口,再分别配制浓度为0.7,1.4,2.1和5 mmol/L的氯化钙溶液,装于蓝口瓶中,于121 ℃,0.1 MPa条件下灭菌30 min。待灭菌完并冷却至室温后,于超净台中接种细菌:0 mmol/L组中加入8 mL超纯无菌水到LB培养基中,其余4组则分别加入8 mL相应浓度的无菌CaCl2溶液,最后分别加入2 mL菌种,30 ℃,160 r/min条件下恒温培养24 h。
1.2.2 胞外多糖的提取、分离与纯化 胞外粗多糖的提取分离参照文献[8]中的方法,具体如下:收集每组MR-1细菌的发酵液,离心15 min(12 000 r/min),取上清液。在上清液中分别加入等体积的饱和KCl和φ=95%乙醇,-20 ℃下沉淀过夜后离心收集其沉淀,φ=95%乙醇洗涤2次后真空干燥即得多糖粗提物,蒸馏水透析48 h后用丙酮沉淀,真空干燥。Sevage法[9]纯化去除粗多糖中的蛋白质,乙醇沉淀后真空干燥即得胞外多糖。
1.2.3 胞外多糖定量及结构分析 利用UV2540型紫外-可见分光光度计(日本岛津公司)分析提取多糖的纯度;采用苯酚-硫酸法(分光光度法)对提取的多糖进行定量分析;将干燥的胞外多糖样品与KBr粉末混合后压片,进行红外光谱分析(Nicolet 6700型红外光谱仪,美国Thermofisher公司);将30 mg 胞外多糖溶解于0.5 mL纯度为φ=99.98%的D2O中,进行1H NMR和13C NMR测定(AVANCE Ⅲ HD 400型超导核磁共振仪,德国 Bruker公司); 将胞外多糖溶于蒸馏水中,与2,5-二羟基苯甲酸(DHB)和1-羟基异喹啉(1-HIQ)形成的基质混合,取0.5 μL 混合液滴加在样品台上,进行基质辅助激光解吸/电离飞行时间质谱分析(MALDI TOF-MS, Ultraflex Ⅲ TOF/TOF,德国Bruker公司)。胞外多糖单糖组分的薄层色谱分析过程如下:取适量胞外多糖溶于2 mL浓度为2 mol/L的TFA中,加入到水解管中,氮气封口后110 ℃ 水解6 h。将水解后的样品蒸干,并反复加入甲醇旋蒸,以去除残留的TFA。用蒸馏水将水解后的糖转移至干净的EP管中备用。取适量葡萄糖和甘露糖溶于适量蒸馏水中。将水解的糖样和标准单糖点样于GF254硅胶板上,V(乙酸乙酯)∶V(甲醇)∶V(冰醋酸)∶V(水)=12∶3∶3∶2为展开剂,麝香草酚溶液显色后,105 ℃干燥。
1.2.4 细菌表面形态观察 将培养24 h后的五组MR-1细菌分别于3 000 r/min,4 ℃条件下离心15 min,去除上清液,用φ=2.5%的戊二醛在4 ℃条件下固定3 h,然后用0.2 mol/L的pH=7.2的PBS洗涤3次,每次20 min;接着用φ=30%,50%,70%,90%梯度的乙醇各洗涤一次,每次10 min;然后用无水乙醇洗涤两次,每次10 min,最后用乙酸异戊酯洗涤2次,每次10 min,然后自然条件下干燥。样品喷金处理后进行电镜扫描测定(S3400N型扫描电子显微镜,日本Hitachi公司)。
2 结果与讨论
2.1 Ca2+对MR-1胞外多糖表达量的影响分析
细菌胞外聚合物除含胞外多糖外,还含大量蛋白及少量核酸,采用丙酮沉淀法与Sevage法对提取的粗多糖进行了进一步处理。提取的胞外多糖的紫外-可见光光谱图上,在波长260和280 nm处已无明显核酸与蛋白质吸收峰,而波长206 nm 处则有强的多糖吸收峰。由此可知,已基本去除EPS中可能含有的核酸和蛋白质。多糖含量测定采用苯酚-硫酸法。图1(a)为葡萄糖含量标准曲线,其回归方程为y=0.002 4x+0.044 0,线性相关系数为0.997 9。图1(b)为不同Ca2+浓度影响下MR-1胞外多糖的含量,通过重复3批次细菌培养,每一组测定3次所得。由图可知,随着培养基中Ca2+浓度的增加,MR-1所表达的EPS量并没有成规律的变化。其中,Ca2+浓度为2.1 mmol/L时,MR-1分泌多糖的质量浓度最高,为0.30 g/mL,而当Ca2+浓度逐渐增加至5.0 mmol/L及以上时,则EPS的量下降。特别值得注意的是,在Ca2+浓度为0.7~2.1 mmol/L的影响范围内,EPS的量先降低再升高。其中,当Ca2+浓度为1.4 mmol/L 时,EPS的质量浓度最低,为0.08 g/mL,与无Ca2+影响下的EPS质量浓度相差不多。Ca2+对不同细菌不同形态下产生的胞外多糖的影响有所不同。当细菌形成生物膜时,由于Ca2+能与EPS中带负电荷的基团相互作用而结合,从而有助于细菌胞外多糖的交联稳定,促进生物膜结构的完善[10]。在一定浓度范围内Ca2+能大大增加生物膜的干质量[11]或影响如叶缘焦枯菌[12]和铜绿假单胞菌[13]等形成的生物膜的厚度。Ca2+对生物膜中最重要的组成部分胞外多聚物的分泌量没有显著影响[12],但仍可检测到胞外蛋白质和EPS量的变化,并可增加铜绿假单胞菌中胞外多糖海藻酸的量[13]。当细菌浮游培养时,Ca2+对不同细菌的胞外多糖含量产生较大影响。对于地衣芽孢杆菌KS-17[14]及海洋细菌Hahellachejuensis[15 ]等细菌,CaCl2在低浓度范围< 20mmol/L内,能增加细菌EPS的产量,但>20mmol/L时,将会大大降低EPS的量。在酸性环境下,Ca2+的加入,还可提高如根瘤菌的存活率,影响其EPS的量[16]。Ca2+对菌的存活率的提高,被认为是通过影响细菌细胞膜上的EPS和脂多糖的合成过程,并对其起到直接保护作用而实现的。在pH为5.5及5mmol/LCa2+浓度下,苜蓿根瘤菌Sinorhizobiummeliloti存活率最好,所产生的EPS最高[16 ]。本研究的目标物MR-1为浮游培养,其胞外多糖的量同样也受到CaCl2的影响。在2.1mmol/LCa2+浓度下可获最高EPS量,继续增加CaCl2则EPS量会得到抑制。但CaCl2浓度在1.4mmol/L时,则表现为Ca2+对其他微生物形成生物膜时对EPS一样的效果,对MR-1的EPS表达量没有显著的影响。在本实验条件下,将不同浓度CaCl2影响下的MR-1应用到MFC中,获得与文献[3]相同的研究结果:在1.4mmol/LCaCl2影响下的MR-1可使MFC的电流密度获得最大增幅,在2.1mmol/LCaCl2影响下的MR-1可使MFC给出最大输出功率。土壤铁还原菌胞外聚合物被证明具有氧化还原活性, 可参与胞外电子传递。胞外聚合物的组成可直接影响土壤铁还原菌在MFC的作用。在胞外聚合物中含较为丰富的胞外蛋白,而胞外多糖含量则相对低[17]。MR-1在1.4和2.1mmol/LCaCl2影响下所表现的MFC电性能特点,可能主要与其表达的关键蛋白质差异有关,本文作者课题组正在进行相关研究。此外,通过电镜扫描观察5个不同浓度Ca2+影响下的MR-1的形态,如图2 所示。由图可知,1.4mmol/LCaCl2下的MR-1细菌外表褶皱程度(图2c)与 无CaCl2时的相似,而2.1mmol/LCaCl2下的MR-1细菌外表褶皱及变形程度最大。Garrison-Schilling等[6]曾研究发现,在Ca2+影响下,创伤弧菌生长过程中表型变化分为三个阶段,最开始菌体呈光滑、不透明的黏液状,随着菌体表面的荚膜多糖和皱纹胞外多糖的合成,菌体表型变得透明并逐渐出现褶皱。上述形态的变化与Ca2+加入量可加速创伤弧菌的荚膜多糖和皱纹胞外多糖的分泌有关。也有其他细菌表面出现褶皱是由于细菌的EPS分泌过多所致的相关报道[18-19]。由此我们推测,本研究中细菌形态的变化与其分泌的EPS量有关。
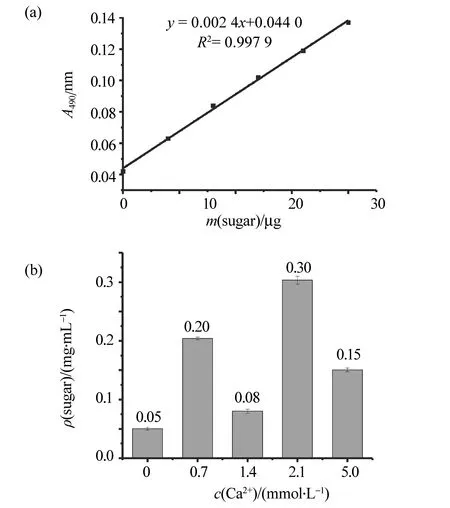
图1 葡萄糖含量标准曲线 (a) 和不同Ca2+浓度下的MR-1胞外多糖含量(b)Fig.1 (a) Standard curve of glucose sugar content and (b) dependence of the exopolysaccharide content of MR-1 on the concentration of Ca2+
2.3 Ca2+对MR-1多糖结构影响及多糖结构分析
Appanna等[20]认为,Ca2+参与了细菌的EPS的合成过程,与锰离子一样,可影响到RhizobiummelilotiJJ-1产生的EPS的单糖组成,而Dilworth等[21]在研究Ca2+和酸性条件对SinorhizobiumrnelilotiWSM419的EPS的影响时认为,Ca2+不影响产生的EPS的取代结构。我们采用质谱、薄层色谱、红外光谱、核磁共振等对5组不同浓度Ca2+影响下的MR-1产生的EPS结构进行了分析。图3(a)为0和1.4 mmol/L Ca2+影响下EPS的MALDI-TOF-MS图。5个不同浓度Ca2+组影响的EPS具有相似的MALDI-TOF-MS图,典型图见图3(a)。图3(a)下图中附有m/z1 985~2 471范围质谱峰的扩展图。由图可知,图中出现的系列峰每相邻两峰之间的m/z值均相差162,与一个己糖残基的质量相符,m/z1 985~2 471范围质谱峰归属见表1。由以上结果可知,所提取的EPS具有相同相对分子质量的糖基单元——己糖,且每条糖链的端基由-OH与-H组成。这5组EPS所得MALDI-TOF-MS图呈现的峰型相同,只是在各个峰强度及最大能检测到的m/z值有所差别,可测的m/z范围均在4 500以下,其中最大m/z值是4 253(聚合度n为26)。
将EPS水解后进行了薄层色谱的测定,以确定上述推测糖基单元己糖具体的类型,典型图见图3(b)。图中1、2、3和4号分别为0 mmol/L Ca2+影响下EPS水解产物、1.4 mmol/L Ca2+影响下EPS水解产物、标样甘露糖和葡萄糖在GF254硅胶板上,以乙酸乙酯/甲醇/冰醋酸/水为展开剂,以麝香草酚为显色剂后的谱图。由图可知,两个EPS的水解产物均只有显现一个斑点,两个斑点的比移值相同,且与标样甘露糖的比移值接近。由此可推测,在Ca2+影响下的EPS的单糖组成仍相同,为甘露糖。由质谱和色谱图结果可知,对于MR-1在培养过程中加入Ca2+,虽Ca2+可能参与了EPS的合成过程,但并不影响其单糖组成类型。

表1 图3(a)中m/z 1 984~2 470范围内离子峰的归属
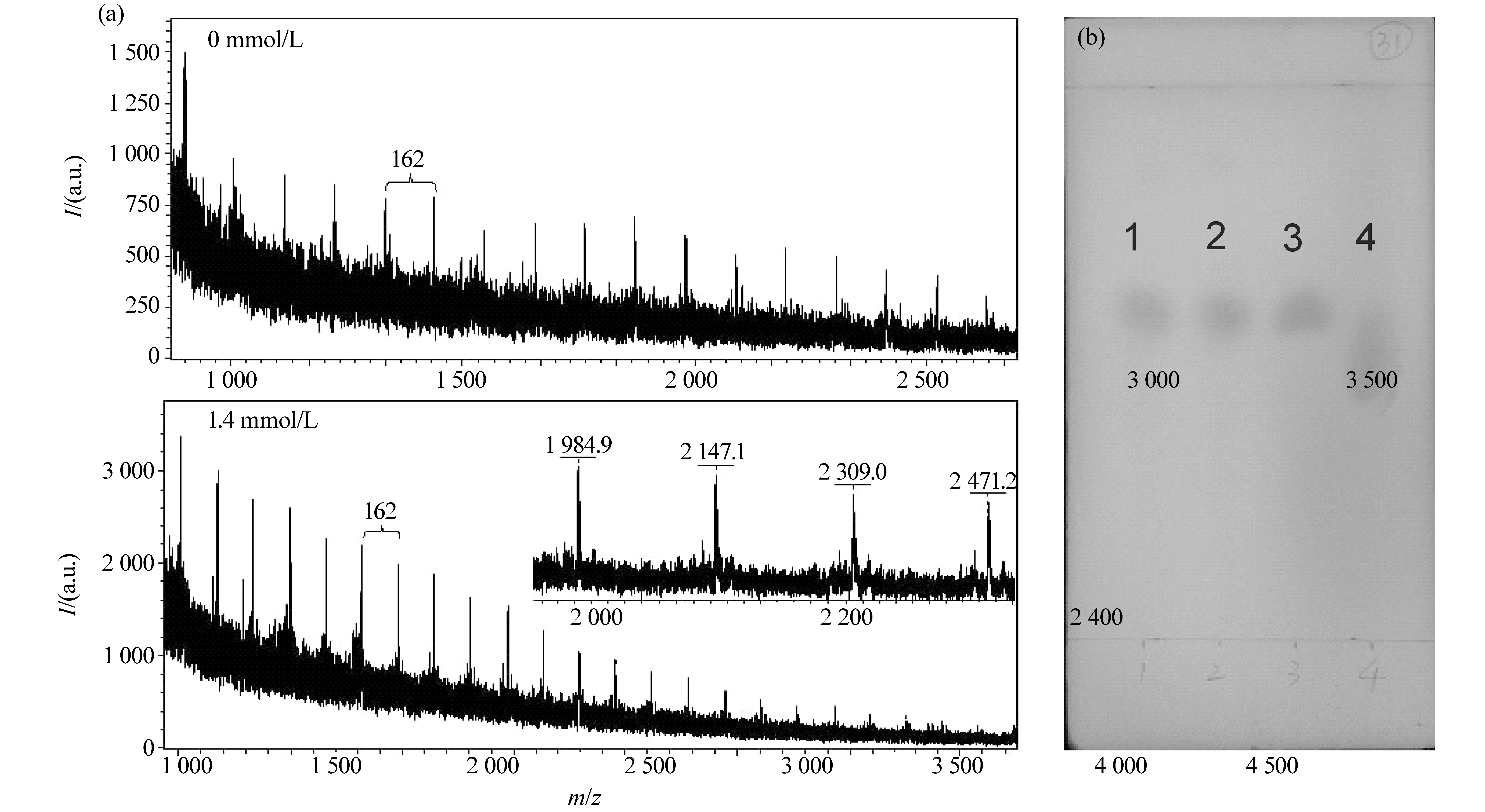
图3 0和1.4 mmol/L Ca2+ 影响下EPS的MALDI-TOF-MS图(a)与EPS水解产物的薄层色谱图(b)Fig.3 (a) MALDI-TOF mass spectra of EPS and (b) TLC of hydrolysate of EPS affected by 0 and 1.4 mmol/L of Ca2+(b)中,1与2分别为c(Ca2+)为0和1.4 mmol/L影响下EPS水解物;3为标样甘露糖苷;4为葡萄糖


图4 EPS的的红外谱图Fig.4 Infrared spectra of exopolysaccharides
对EPS的糖环构型和异头构型可由核磁共振谱图进一步确认。 图5 为1.4 mmol/L Ca2+影响下EPS的1H NMR (a)和13C NMR (b)图,其它4组ESP相应谱图峰型相似,未列出。在1H NMR图中,异头氢区域分布有5个主要的信号峰,由低场到高场化学位移依次为5.22、5.06、5.04、5.02和4.97,均大于4.91,符合含α-甘露糖结构的多糖氢谱特征[24]。在13C NMR图中,异头碳区域分布有3个主要信号峰,由低场到高场依次是102.21、100.60和98.24,分别可归属为[Manp(1→]的端头碳信号、[→2)Manp(1→]的端头碳信号与[→3,6)Manp(1→]的端头碳信号。 在碳谱中,异头碳δ90~102为α构型,δ102~112为β构型[25],碳谱谱峰符合含α-甘露糖结构特征,与红外谱峰推测一致。此外,谱图中除了异头碳外,其他碳信号均小于80,也为吡喃糖的C3和C5的化学位移特征[26]。60~80的非异头碳区是糖环上碳原子的信号,其中,70~74是未发生取代的C-2和C-4的化学位移信号,61.15是未发生取代的C-6的化学位移信号,77.96~78.76是C-2或C-3位置发生取代的信号峰,73.36 是未发生取代的C-5的信号峰。由此可推测,所研究的EPS均为主要由甘露糖以1→3糖苷键相连形成的多聚甘露糖。
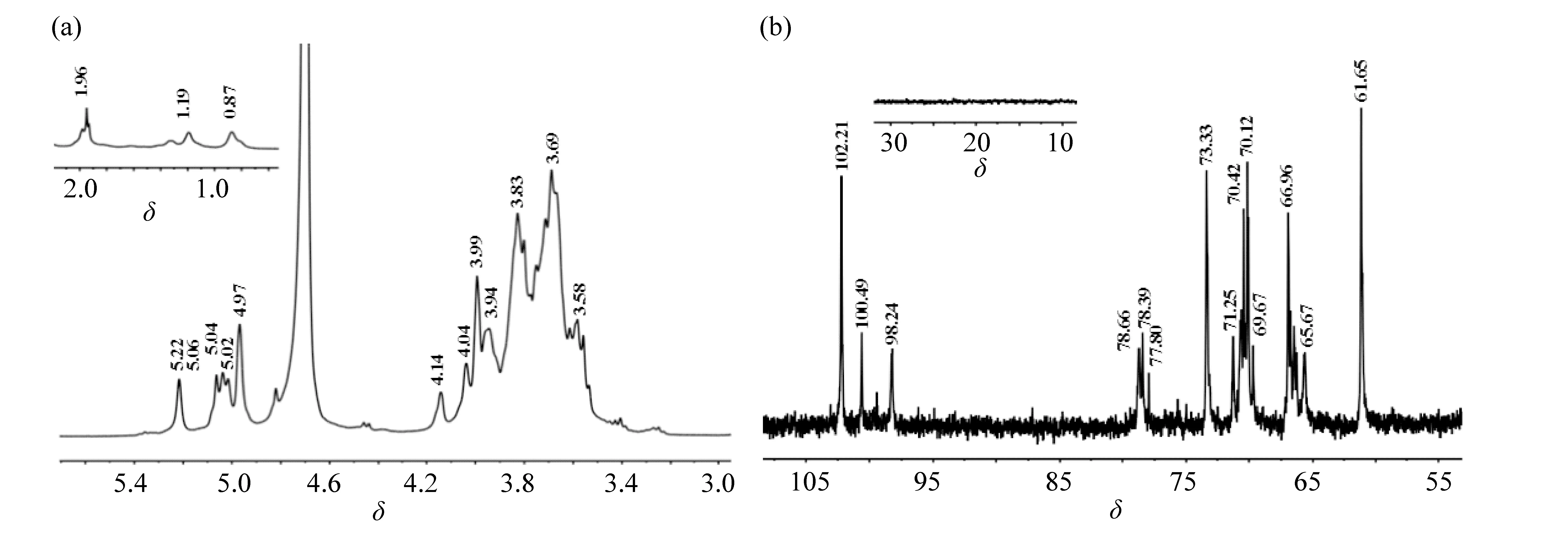
图5 1.4 mmol/L Ca2+影响下EPS的1H NMR (a)和13C NMR (b)Fig.5 1H NMR和13C NMR spectra of EPS affected by 1.4 mmol/L of Ca2+
3 结 论
培养基中不同浓度存在的Ca2+可对希瓦氏菌ShewanellaoneidensisMR-1 的胞外多糖的量产生影响。当Ca2+浓度为2.1 mmol/L 时可促进MR-1产生更多的EPS,但随着Ca2+浓度逐渐增加至5.0 mmol/L及以上时,则EPS的量下降。而当Ca2+浓度为1.4 mmol/L 时, MR-1产生的EPS的量则与无Ca2+影响下的EPS量相当。培养基中不同浓度存在的Ca2+对EPS的结构没有显著性影响,虽获得的EPS虽在相对分子质量范围上有一定的差别,但均为由α-D-吡喃甘露糖通过 1,3-苷键形成的多糖。
[1]XIAOX,XUCC,WUYM,etal.BiodecolorizationofNaphtholGreenBdyebyShewanellaoneidensisMR-1 under anaerobic conditions[J]. Bioresource Technology, 2012,110:86-90.
[2] JIANG S, KIM M G, KIM S J, et al. Bacterial formation of extracellular U(Ⅵ) nanowires[J]. Chem Commun, 2011, 47(28): 8076-8078.
[3] FITZGERALD L A, PETERSEN E R, GROSS B J, et al. Aggrandizing power output fromShewanellaoneidensisMR-1 microbial fuel cells using calcium chloride[J]. Biosensors and Bioelectronics, 2012, 31(1): 492-498.
[4] LIU C, JEON B H, ZACHARA J M, et al. Influence of calcium on microbial reduction of solid phase uranium(Ⅵ) [J]. Biotechnology and Bioengineering, 2007, 97 (6): 1415-1422.
[5] BAILEY K L, TILTON F, JANSIK D P, et al. Growth inhibition and stimulation ofShewanellaoneidensisMR-1 by surfactants and calcium polysulfide[J]. Ecotoxicology and Environmental Safety, 2012,80:195-202.
[6] GARRISON-SCHILLING K L, GRAU B L, MCCARTER K S, et al. Calcium promotes exopolysaccharide phase variation and biofilm formation of the resulting phase variants in the human pathogenVibriovulnificus[J]. Environmental Microbiology, 2011, 13(3): 643-654.
[7] 马摇晨, 周顺桂, 庄莉,等.微生物胞外呼吸电子传递机制研究进展[J].生态学报, 2011,31(7):2008-2018.
[8] SUDHEER K S, MUKHERJEE A, CHANDRASEKARAN N. Interaction of colloidal silver nanoparticles (SNPs) with exopolysaccharides (EPS) and its adsorption isotherms and kinetics[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011, 381(1/2/3): 99-105.
[9] LI X, ZHAO R, ZHOU H L, et al. Deproteinization of polysaccharide from the stigma maydis by sevag method[J]. Advanced Materials Research, 2011, 340: 416-420.
[10] YUAN S,SUN M,SHENG G, et al. Identification of key constituents and structure of the extracellular polymeric substances excreted byBacillusmegateriumTF10 for their flocculation capacity[J]. Environmental Science &Technology, 2011, 45(3) : 1152-1157.
[11] 张燕,胡学伟,江孟,等. Ca2+对生物膜形态结构及其组分的影响[J]. 环境工程学报, 2015(4): 1547-1552.
[12] CRUZ L F, COBINE P A, FUENTE L D L. Calcium increasesXylellafastidiosasurface attachment, biofilm formation, and twitching motility[J]. Applied and Environmental Microbiology, 2012, 78(5): 1321-1331.
[13] SARKISOVA S, PATRAUCHAN M A, BERGLUND D, et al. Calcium-induced virulence factors associated with the extracellular matrix of mucoidPseudomonasaeruginosabiofilms[J]. Journal of Bacteriology, 2005, 187(13): 4327-4337.
[14] SONG Y R, JEONG D Y, BAIK S H. Optimal production of exopolysaccharide byBacilluslicheniformisKS-17 isolated from Kimchi[J]. Food Sci Biotechnol , 2013,22(2): 417-423.
[15] KO S H, LEE H S, PARK S H, et al. Optimal conditions for the production of exopolysaccharide by marine microorganismHahellachejuensis[J]. Biotechnol Bioproc E, 2000, 5(3): 181-185.
[16] DELAVECHIA C, HAMPP E, FABRA A, et al. Influence of pH and calcium on the growth, polysaccharide production and symbiotic association ofSinorhizobiummelilotiSEMIA 116 with alfalfa roots[J]. Biol Fertil Soils, 2003, 38(2):110-114.
[17] DURMAZ B, SANIN F D. Effect of carbon to nitrogen ratio on the composition of microbial extracellular polymers in activated sludge[J]. Water Science and Technology,2001,44(10) : 221-229.
[18] ZOGAJ X, BOKRANZ W, NIMTZ M, et al. Production of cellulose and curli fimbriae by members of the family Enterobacteriaceae isolated from the human gastrointestinal tract[J]. Infection and Immunity, 2003, 71(7): 4151-4158.
[19] AGUILAR C, VLAMAKIS H, LOSICK R, et al. Thinking aboutBacillussubtilisas a multicellular organism Claudio Aguilar1, Hera Vlamakis1, Richard Losick2 and Roberto Kolter1[J]. Current Opinion in Microbiology, 2007, 10(6): 638-643.
[20] APPANNA V. Alteration of exopolysaccharide composition inRhizobiummelilotiJJ-1 exposed to manganese[J]. Microbiol Lett, 1988,50:141-144.
[21] DILWORTH M J, RYNNE F G, CASTELLI J M, et al. Survival and exopolysaccharide production inSinorhizobiumrnelilotiWSM419 are affected by calcium and low pH[J]. Microbiology,1999,145(7):1585-1593.
[22] SUN Y, WANG S, LI T, et al. Purification, structure and immunobiological activity of a new water-soluble polysaccharide from the mycelium ofPolyporusalbicans(Imaz.) Teng[J]. Bioresource Technology, 2008, 99(4): 900-904.
[23] LIM J M, JOO J H, KIM H O, et al. Structural analysis and molecular characterization of exopolysaccharides produced by submerged mycelial culture ofCollybiamaculataTG-1[J]. Carbohydrate Polymers, 2005, 61(3): 296-303.
[24] LIZICAROVA I, MATULIVA M, CAPEK P. Human pathogenCandidadubliniensis: A cell wall mannan with a high content of β-1,2- linked mannose residues[J]. Carbohydrate Polymers, 2007, 70(1): 89-100.
[25] MONDAL S, CHAKRABORTY I, ROUT D, et al. Isolation and structural elucidation of a water-soluble polysaccharide (PS-I) of a wild edible mushroom,Termitomycesstriatus[J]. Carbohydrate Research, 2006, 341(7): 878-886.
[26] FABER E J, van HAASTER D J, KAMERLING J P, et al. Characterization of the exopolysaccharide produced byStreptococcusthermophilus8S containing an open chain nononic acid[J]. European Journal of Biochemistry, 2002, 269(22): 5590-5598.
Effect of Ca2+on the extracellular polysaccharide ofShewanellaoneidensisMR-1
TANGLianfeng1,ZHOULihua1,SUNLihua1,SONGShaoyun2
(1. School of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China;2.School of Life Sciences,Sun Yat-sen University,Guangzhou 510275,China)
Shewanella is a gram-negative soil iron reducing bacteria, which has extracellular electron transfer ability. The composition of the extracellular polymer is one of the important factors that can directly influence the electron transfer effect. Extracellular polysaccharide (EPS) is an important component of extracellular polymers. The effect of different concentrations of CaCl2(0, 0.7,1.4, 2.1 and 5.0 mmol/L) on the EPS ofShewanellaoneidensisMR-1 was herein studied by phenol sulfuric acid method combined with spectrophotometry, chromatography and mass spectrometry. The results showed that the amount of EPS would vary with the Ca2+concentration. Maximum EPS production of 0.3 g /mL was obtained in the culture medium with 2.1 mmol/L of Ca2+concentration, which was 5 times greater than that obtained without Ca2+. The amount of EPS obtained with 1.4 mmol/L Ca2+concentration was 0.08 g/mL, which was nearly the same to that obtained without Ca2+. The concentration of Ca2+in the medium did not significantly influence the structure of EPS produced by MR-1. EPS had a repeating unit with a [→3)-α-D-Manp(1→]backbonechain.TheresultsofthisstudyprovidereferencedataforthefurtherstudyofShewanellaextracellular polymers.
ShewanellaoneidensisMR-1; exopolysaccharides; Ca2+; mannose
10.13471/j.cnki.acta.snus.2016.06.019
2016-03-16
国家自然科学基金资助项目(41301264);广东省自然科学基金资助项目(S2011010004991)
唐连凤(1989年生),女;研究方向:微生物代谢组学及质谱应用研究;通讯作者:周丽华;E-mail:qhzhoulh@gdut.edu.cn
Q539
A
0529-6579(2016)06-0125-07
