山东葫芦科蔬菜上病毒病种类检测及黄瓜花叶病毒分离物的亚组鉴定
2016-06-03孙晓辉王树森高利利刘永光竺晓平
孙晓辉,王树森,高利利,乔 宁,刘永光,赵 静,竺晓平
(1.山东农业大学 植物保护学院,山东省蔬菜病虫生物学重点实验室,山东 泰安 271018;2.山东省诸城市农业农村综合办公室,山东 诸城 262200;3.潍坊科技学院 蔬菜花卉研究所,山东 寿光 262700 )
山东葫芦科蔬菜上病毒病种类检测及黄瓜花叶病毒分离物的亚组鉴定
孙晓辉1,王树森2,高利利1,乔宁3,刘永光3,赵静3,竺晓平1
(1.山东农业大学 植物保护学院,山东省蔬菜病虫生物学重点实验室,山东 泰安271018;2.山东省诸城市农业农村综合办公室,山东 诸城262200;3.潍坊科技学院 蔬菜花卉研究所,山东 寿光262700 )
摘要:为了检测和鉴定山东地区葫芦科蔬菜上病毒病种类,从山东诸地11个蔬菜种植区采集了867个葫芦科蔬菜疑似感病样品。利用黄瓜花叶病毒、黄瓜绿斑驳花叶病毒、西瓜花叶病毒、烟草花叶病毒、小西葫芦黄花叶病毒、南瓜花叶病毒、甜瓜黄斑病毒、瓜类褪绿黄化病毒、李属坏死环斑病毒及甜瓜坏死斑点病毒等特异性引物对疑似感病样品分别进行RT-PCR检测,各病毒检出率分别为34.8%,10.4%,20.0%,41.7%,27.0%,7.8%,2.6%,1.7%,0,0.9%。表明除PNRSV外,其他9种病毒在山东各地均有发生,且CMV和TMV发病率较高,2种或2种以上病毒复合侵染也很普遍。同时为明确山东地区CMV分离物的株系分化状况,选取11个地区有代表性的CMV阳性样品,测定其外壳蛋白(Coat protein,CP)和RNA3核苷酸序列并进行序列比对和进化分析,结果显示侵染山东地区葫芦科蔬菜的CMV分离物均属于IB亚组,与韩国分离物As(AF013291)相似性最高,未发现其他株系。
关键词:瓜类病毒病;黄瓜花叶病毒;RT-PCR;亚组
病毒病的蔓延流行严重制约着黄瓜、西葫芦和西瓜等葫芦科蔬菜的生产,葫芦科蔬菜病毒病种类有黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、烟草花叶病毒(Tobaccomosaicvirus,TMV)、黄瓜绿斑驳花叶病毒(Cucumbergreenmottlemosaicvirus,CGMMV)、西瓜花叶病毒(Watermelonmosaicvirus,WMV)、小西葫芦黄花叶病毒(Zucchiniyellowmosaicvirus,ZYMV)、南瓜花叶病毒(Squashmosaicvirus,SqMV)、番木瓜环斑病毒(Papayaringspotvirus,PRSV)、南瓜蚜传黄化病毒(Cucurbitaphid-borneyellowsvirus,CABYV)、李属坏死环斑病毒(Prunusnecroticringspotilarvirus,PNRSV)、甜瓜坏死斑点病毒(Melonnecroticspotvirus,MNSV)等38个确定种9个暂定种和1种类病毒确定种[1],在我国主要有PRSV[2]、CABYV[3]、SqMV[4]、CMV[5]、WMV[6]、ZYMV[7]、TMV[8]、CGMMV[9]、MNSV[10]等。山东省作为主要的设施蔬菜产区,葫芦科蔬菜上病毒病的发生比较严重,据有关学者的报道[5-12]表明,病毒的种类也较多[5-12],但多年来缺少针对葫芦科蔬菜病毒病的系统及全面的检测和鉴定。
本试验通过分子检测手段对山东葫芦科蔬菜上的病毒病病原种类及其主次关系进行了全面检测和鉴定,并针对近年来在山东蔬菜产区发病较为普遍的CMV,通过序列测定确定了其亚组归属,以期为葫芦科蔬菜上抗病品种的选育及病毒病的防治提供科学依据。
1材料和方法
1.1试验材料
1.1.1感病样品采集2014年7-8月,从山东的泰安、淄博、潍坊、临沂、聊城、菏泽、青岛、烟台、威海、日照、济宁11个地级市的南瓜、丝瓜、黄瓜、西瓜、西葫芦产区共采集到867个葫芦科蔬菜疑似感病样品,其中设施蔬菜567株,种苗300株。将采集到的样品保存在-80 ℃冰箱,用于后续试验。
1.1.2菌株、载体和生化试剂大肠杆菌DH5α菌株由山东省蔬菜病虫生物学实验室留存;Recombinant RNase Inhibitor、Reverse Transcriptase M-MLV(RNase H-)、T4DNA连接酶及克隆载体pMD18-T购自宝生物工程(大连)(TaKaRa Biotechnology,Dalian)有限公司;快捷型琼脂糖凝胶DNA回收试剂盒Ⅱ(离心柱型)购自北京百泰克生物技术(Bio Teke Corporation)有限公司;TRIzol 试剂、TaqDNA聚合酶、dNTPs及DNA分子量标准Trans 2K plus均购自北京全式金生物技术(Trans Gen Biotech)有限公司;其他常用生化试剂均为进口或国产分析纯。
1.2试验方法
1.2.1山东葫芦科蔬菜病毒病种类检测本试验用引物序列见表1。RNA提取采用TRIzol法,而后利用CMV、CGMMV、TMV、ZYMV、WMV、CCYV、PNRSV和MYSV等特异性引物对葫芦科疑似感病样品分别进行RT-PCR检测,反应程序为:预变性94 ℃ 3 min;变性94 ℃ 30 s,退火(退火温度)30 s,延伸72 ℃ 1 min,共32个循环;终延伸72 ℃ 10 min。
取25 μL PCR扩增产物与4 μL 6×Loading Buffer混合于1%的琼脂糖凝胶上检测并拍照记录试验结果。从各县区阳性样品中,选择1~2个切取目的条带利用凝胶回收试剂盒回收,回收产物纯化后与pMD18-T Vector连接转化大肠杆菌DH5α,用含氨苄青霉素(Amp)的培养基进行筛选。阳性克隆经菌液PCR验证后委托上海铂尚生物科技有限公司进行测序。
1.2.2CMV序列分析及株系鉴定从山东11个地区感病样品中分别选取具有代表性的分离物的CMV CP和RNA3 阳性克隆送铂尚生物技术(上海)有限公司测序。所得序列在NCBI上利用Blast 进行检索,利用DNAStar软件中的MegAlign将所得序列与GenBank中已登录的亚组IA、亚组IB和亚组II的代表序列进行同源性比对。利用软件Mega 5.05的Clustal W法进行多序列比对分析以及邻接法(Neighbor-Joining,NJ)构建系统进化树,系统进化树中各分支置信度(Bootstrap)进行1 000次重复分析。
2结果与分析
2.1病毒检出率和复合病毒检出率
在山东采集的567个设施样本中检测到CMV、CGMMV、TMV、ZYMV、WMV、SqMV、CCYV、MYSV和MNSV 9种病毒的存在,所有检测到的病毒均经测序验证为该种病毒,没有检测到PNRSV病毒的存在,各病毒的样本检出率见图1,其中从图1中可以看出TMV和CMV的病毒检出率最高,ZYMV和WMV其次,CCYV、MYSV和MNSV的病毒检出率相对较低,300株种苗带毒率为14.7%。另外,在采集到的设施样本中发现病毒的综合复合侵染率为37.4%,2种病毒的复合侵染率为18.2%,3种病毒的复合侵染率为11.3%,4种病毒的复合侵染率为3.5%,5种病毒的复合侵染率为4.4%,未测到更多种病毒的复合侵染。
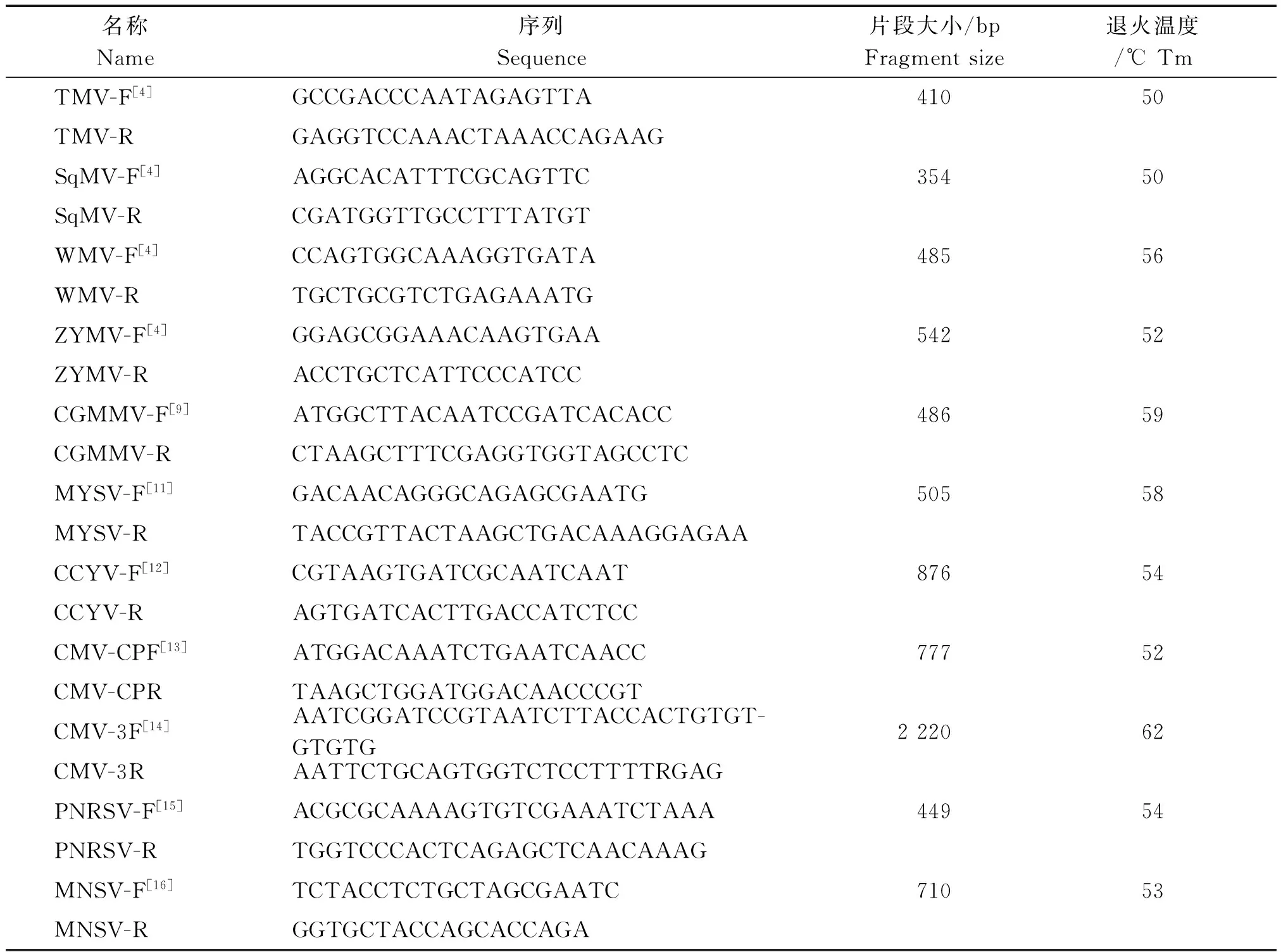
表1 用于病毒检测的引物序列
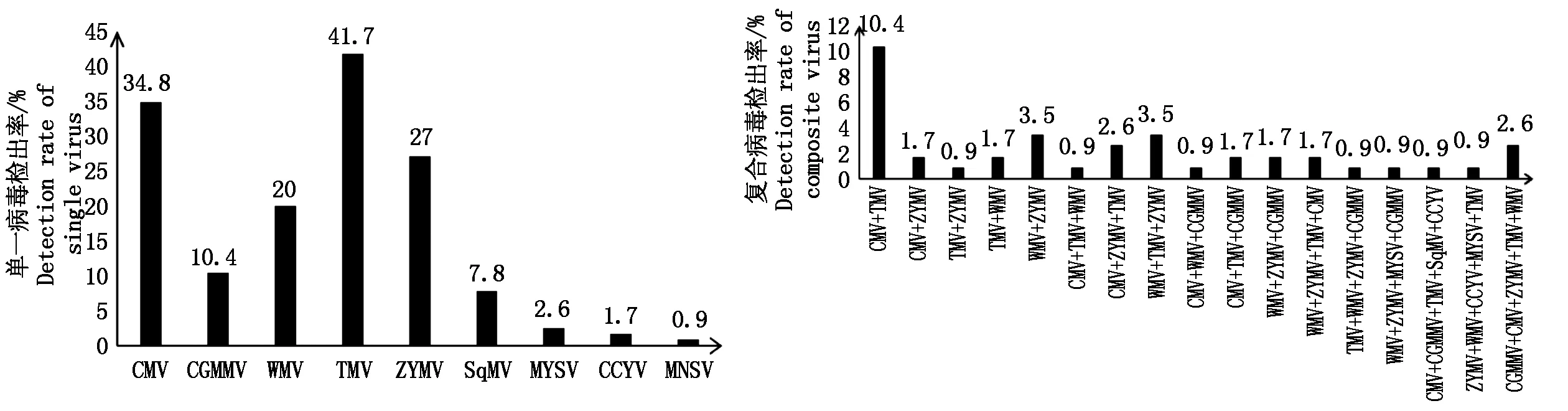
图1 单一病毒检出率和复合病毒检出率
2.2CMV PCR扩增结果及亚组鉴定
2.2.1以待测葫芦科样品提取的RNA为模板,利用特异性引物CMV-CPF/R和CMV3F/R进行RT-PCR扩增,取5 μL扩增产物利用1.2%琼脂糖凝胶进行电泳检测分析。结果如图2,分别出现777 bp左右的条带(分别包含CP全基因组片段及其上下游侧翼序列)和2.3 kb左右的条带(分别包含RNA3全基因组片段及其上下游侧翼序列)。

A.特异性引物CMV-CPF/CMV-CPR扩增结果:1~11.葫芦科样品;M.Trans 2K Plus DNA Marker;CK.阴性对照;

分离物Isolatesname地点Loca.tion登录号AccessionNo.寄主植物Hostplant片段Protein分离物Isolatesname地点Loca.tion登录号AccessionNo.寄主植物Hostplant片段ProteinSD-HZ菏泽KP710840西瓜CPBY16湖北KF564789芋头CPSD-JN济宁KP710854南瓜CPCah1浙江FJ268746美人蕉CPSD-LC聊城KP710841丝瓜CPCMV-Cu伊朗EF620777黄瓜CPSD-LY临沂KP710842丝瓜CPHB24郑州KC019301不确定CPSD-QD青岛KP710843南瓜CPSFQT1-2新疆HQ283393番茄CP、RNA3SD-RZ日照KP710844南瓜CPNt9台湾D28780不确定CP、RNA3SD-TA泰安KP710845西葫芦CPO日本D00385不确定CP、RNA3SD-WH威海KP710847南瓜CPXb福建AF268598香蕉CP、RNA3SD-WF潍坊KP710846南瓜CPLS美国AF127976不确定CP、RNA3SD-YT烟台KP710848南瓜CPLY澳大利AF198103不确定CP、RNA3SD-ZB淄博KP710849南瓜CPAs韩国AF013291不确定CP、RNA3QDR青岛KP710852南瓜RNA3ER美国U15730豇豆CP、RNA3WHR威海KP710851南瓜RNA3Ns匈牙利AJ511990叶烟CP、RNA3TAR泰安KP710853南瓜RNA3Legume日本D16405豇豆CP、RNA3ZBR淄博KP710850南瓜RNA3Fny美国D10538不确定RNA3Barcelona西班牙AM183116番茄CPtrk7匈牙利L15336不确定RNA3S美国AF063610不确定CPTfn意大利Y16926番茄RNA3SDTA泰安FJ403473辣椒CPp1-1西班牙AM183116番茄RNA3Lucknow印度EF153734番茄CPPhy浙江DQ412732不确定RNA3AMA荷兰AJ131625观赏作物CPI17F法国Y18137不确定RNA3
2.2.2CMV山东分离物序列分析利用MegAlign方法,对选取的CP和RNA3核苷酸序列进行相似性比较分析(表2)。
CP核苷酸序列比对结果显示,本研究获得的11个样品的CP核苷酸序列相似性为97.2%~99.9%;与CMV亚组Ⅱ株系分离物相似性较低,为77.0%~78.5%;与CMV亚组IA株系分离物的相似性较高,为92.4%~94.5%;与CMV亚组IB株系分离物的相似性最高,为93.3%~97.6%,其中与CMV亚组IB株系韩国(Korea)分离物As(AF013291)的相似性最高。RNA3核苷酸序列比对结果显示:获得的4个RNA3全序列相似性为94.4%~99.3%;与CMV亚组Ⅱ株系分离物相似性较低,为67.4%~69.8%,与CMV亚组IA株系分离物的相似性为86%~91.2%,与CMV亚组IB分离物的相似性最高,为89%~93.8%,其中与CMV亚组IB的韩国(Korea)分离物As(AF013291)的相似性最高。
为了更好地分析其进化历程和亲缘关系,选取世界各地有代表性的CMV分离物的CP和RNA3核苷酸序列构建系统进化树(图3)。从构建的2个系统进化树可以看出,山东CMV各分离物的CP和RNA3核苷酸序列与韩国(Korea)分离物As(AF013291)亲缘关系最近,与同源性比对结果相一致,同属于CMV IB亚组。
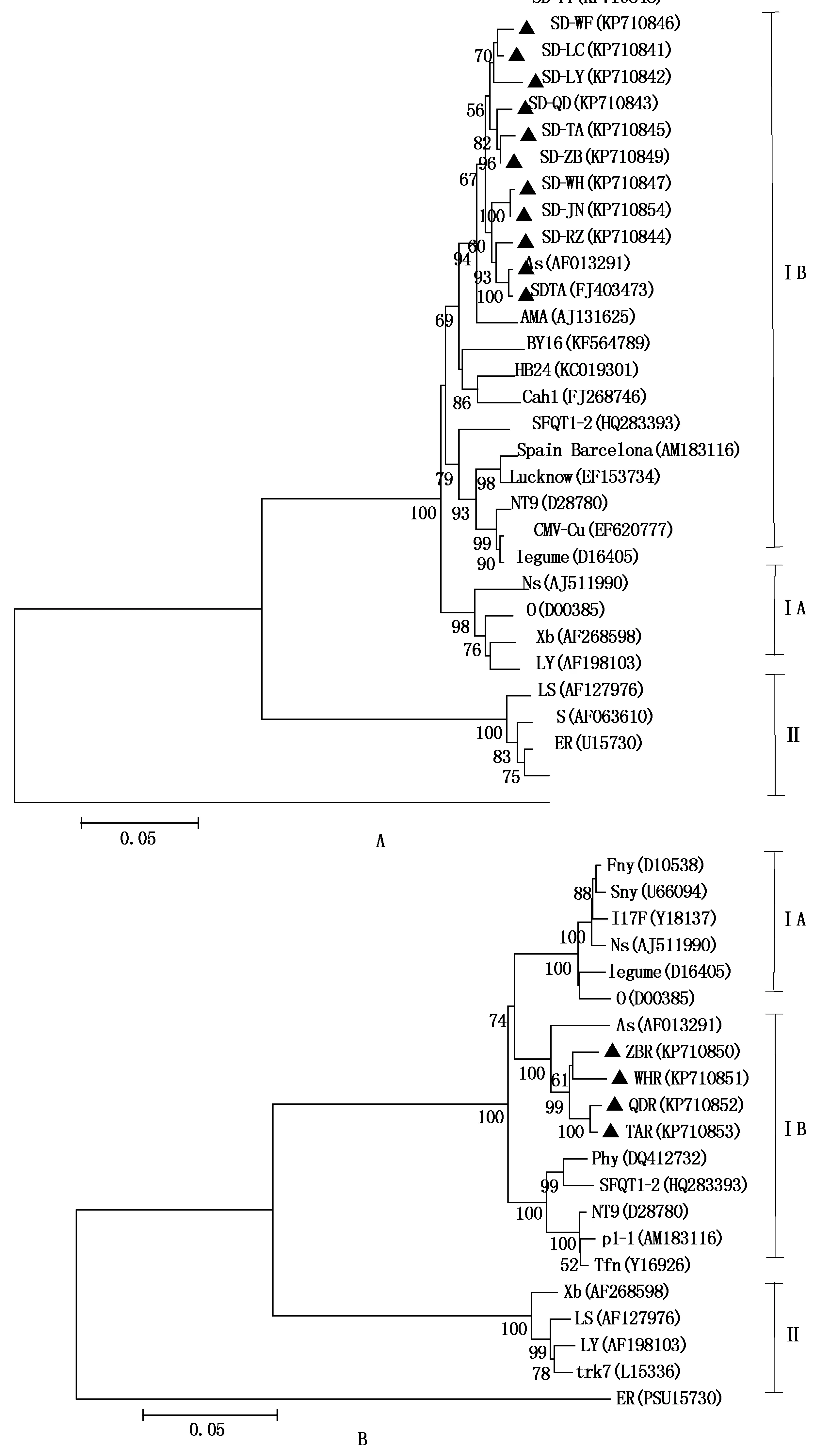
A.基于CP基因的系统进化树;B.基于RNA3的系统进化树。
3结论与讨论
山东是蔬菜生产主要地区,病毒病较为严重种类也较多。目前,山东虽然有CMV[5]、WMV[6]、ZYMV[7]、TMV[8]、CGMMV[9]、MNSV[10]的相关报道,但缺少全面而系统的检测,病毒种类、主次关系及复合侵染情况不明确,缺少重要病毒的株系分化鉴定。
本试验利用多对针对不同瓜类病毒的特异性引物对山东11个地区采集到的葫芦科蔬菜样品进行RT-PCR检测,检测到的病毒种类及发病严重程度由大到小排序如下:TMV、CMV、ZYMV、WMV、CGMMV、SqMV、MYSV、CCYV、MNSV,并且复合侵染情况较重,检出的病毒复合组合中除了CMV与MYSV、WMV与SqMV和CCYV、ZYMV与CCYV、SqMV与MYSV、CCYV与MYSV和MNSV与所测病毒均未发现复合侵染外,其他的组合均存在复合侵染的情况,并且这些组合中CMV和TMV的复合侵染率最高。这可能与山东地区葫芦科作物的大面积种植、栽培模式的多样化以及广泛的传毒媒介有关。CMV是迄今已知病毒中寄主范围最广泛、分布最广、危害最严重也是目前研究最多最具经济重要性的一种植物病毒[13]。在我国,葫芦科蔬菜上的CMV在南京[17]、广州[18]、浙江[19]、新疆[20]等多地均有发现。
黄瓜花叶病毒是一种RNA病毒具有很强变异性和适应性,在世界各地分布广泛,能够侵染1 000多种植物,因而其株系分化十分复杂[18,21-22]。不同地区和不同寄主植物上CMV分离物的生物学性状和分子生物学特性存在明显差异[23],导致育种难度加大。CMV分为不同的株系,Pita等[24]根据寄主范围、症状反应、血清学以及CP序列差异将CMV分为亚组Ⅰ和亚组Ⅱ,不同亚组株系在致病性、寄主范围等方面有一定差异,如亚组Ⅰ常引起坏死、蕨叶等较为严重的症状。Palukaitis等[25-26]基于基因组RNA3的5′端的非编码区序列将亚组Ⅰ进一步分为亚组ⅠA和亚组ⅠB。序列分析是划分CMV株系的最主要的技术与方法,应用也越来越广泛[13,27]。它从分子水平揭示了CMV分离物不同亚组之间的差异。我国CMV分离物也存在着株系分化,我国绝大多数地区CMV分离物都隶属于CMV亚组Ⅰ[28-33],徐平东等[13]首次测定了我国分离物亚组Ⅱ的CP基因序列,从分子水平证实了在我国存在CMV的2个亚组。
本研究在山东的西瓜、南瓜、丝瓜、西葫芦等葫芦科作物上获得的11个样品的CP、RNA3经分子比对和进化分析发现这些样品均归属于CMV亚组ⅠB。与除了福建以外的我国其他序列均处于一个大分支上,且序列与葫芦科寄主无明显的相关性。由于山东葫芦科蔬菜上CMV亚组的单一性,可以针对这一亚组培育抗病品种来控制病毒病的发生,为葫芦科蔬菜的防控提供了科学依据。
参考文献:
[1]Fauquet M C,Mayo M A.Abbreviations for plant virus names[J].Arch Virol,1999,144:1249-1273.
[2]张雨良,黄启星,郭安平,等.海南番木瓜PRSV和PLDMV病毒发生情况及分子鉴定[J].热带作物学报,2013,34(12):2436-2441.
[3]尚巧霞,向海英,韩成贵,等.南瓜蚜传黄化病毒湖北和云南分离物的部分序列分析[J].植物病理学报,2008,38(1):64-68.
[4]王威麟,张昊,于祥泉,等.侵染西瓜的5种病毒ZYMV、WMV、TMV、SqMV和CMV的多重RT-PCR检测体系的建立与检测应用[J].植物病理学报,2010,40(1):27-32.
[5]崔连民,张福进,朱常香,等.黄瓜花叶病毒山东分离物外壳蛋白基因的克隆及序列分析[J].山东农业科学,2005(4):3-6.
[6]刘金亮,王凤婷,魏毅,等.侵染南瓜的西瓜花叶病毒和黄瓜花叶病毒CP基因的克隆和序列分析[J].中国农学通报,2010,26(16):262-266.
[7]刘金亮,邵云华,张广民,等.小西葫芦黄花叶病毒山东南瓜分离物的分子特性[J].植物病理学报,2009,39(5):544-548.
[8]刘金亮,王凤婷,魏毅,等.烟草花叶病毒南瓜分离物CP基因的克隆、序列分析及其原核表达[J].华北农学报,2010,25(5):6-10.
[9]王云,辛志梅,赵黎明,等.侵染丝瓜的黄瓜绿斑驳花叶病毒山东分离物分子鉴定[J].山东农业科学,2014,46(8):10-14.
[10]乔宁,魏家鹏,李美芹,等.两种甜瓜病毒寿光分离物的分子检测与鉴定[J].植物保护,2015,41(5):130-133.
[11]乔宁,王兴翠,田素波,等.黄瓜上甜瓜黄斑病毒寿光分离物的初步鉴定及序列分析[J].中国蔬菜,2015(7):25-28.
[12]刘珊珊,彭斌,吴会杰,等.海南省和河南省发生甜瓜褪绿黄化病的分子鉴定[J].果树学报,2013,30(2):291-293.
[13]徐平东,周仲驹,林奇英,等.黄瓜花叶病毒亚组Ⅰ和Ⅱ分离物外壳蛋白基因的序列分析与比较[J].病毒学报,1999,15(2):72-79.
[14]陈集双,吴鹏.黄瓜花叶病毒小青菜分离物RNA3全长序列分析[J].辽宁师范大学学报:自然科学版,2007,30(2):210-212.
[15]Scott S W,Zimmerman M T,Xin G,et al.The coat proteins and putative movement proteins of isolates ofPrunusnecroticringspotvirusfrom different host specises and geographic origins areextensively conserved[J].Eur J Plant Pathol,1998,104:155-161.
[16]温少华.甜瓜坏死斑点病毒(MNSV)中国分离物全基因组序列的克隆和分析[D].武汉:华中农业大学,2009.
[17]Gallitelli D.The ecology ofCucumbermosaicvirusand sustainable agriculture[J].Virus Research,2000,71(1/2):9-21.
[18]程宁辉,杨金水,濮祖芹,等.宁沪杭地区黄瓜花叶病毒(CMV)株系群划分的初步研究[J].病毒学报,1997,13(2):84-88.
[19]赵芹,李华平,谢大森,等.侵染节瓜的3种病毒多重PCR检测体系的建立[J].园艺学报,2011,38(11):2215-2222.
[20]陈洁云,陈集双,柴立红,等.两种葫芦科病毒的分子检测和致病性研究[J].植物病理学报,2003,33(5):449-455.
[21]Lin H X,Rubio L,Smythe A,et al.Genetic diversity and biological variation among California isolates ofCucumberviosaicvirus[J].The Journal of General Virology,2003,84:249-258.
[22]田兆丰,于嘉林,刘伟成,等.黄瓜花叶病毒(CMV)亚组Ⅰ、Ⅱ分离物生物学特性比较研究[J].华北农学报,2009,24(5):201-205.
[23]姚明华,王飞,叶志彪.侵染辣椒的黄瓜花叶病毒分离物的亚组鉴定及株系分析[J].华中农业大学学报,2009,28(4):472-475.
[24]Pita J S,Roossinck M J.Mapping viral functional domains for genetic diversity in plants[J].Journal of Virology,2013,87(2):790-797.
[25]Palukaitis P,Roossinck M J,Shintaku M.Mapping functional domains inCucumbermosaicvirusand its satellite RNAs[J].Can J Plant Patholog,1991,13(2):155-162.
[26]Wahyuni W S,Dietzgen R G,Hanada K,et al.Serological and biological variation between and within subgroup Ⅰ and Ⅱ strains ofCucumbermosaicvirus[J].Plant Pathology,1992,41(3):282-297.
[27]徐平东,谢联辉.黄瓜花叶病毒亚组研究进展[J].福建农业大学学报,1998,27(1):83-92.
[28]李志勇,夏惠娟,李兴红,等.北京、宁夏甜椒上分离的黄瓜花叶病毒CP基因序列分析及亚组鉴定[J].河北农业大学学报,2005,28(4):89-92.
[29]席德慧,林宏辉,向本春.黄瓜花叶病毒2个分离物的亚组鉴定及株系分化研究[J].植物病理学报,2006,36(3):232-237.
[30]金大伟,罗朝鹏,杨军,等.烟草黄瓜花叶病毒湖北分离物全基因组序列分析及亚组鉴定[J].烟草科技,2014,318(1):80-84.
[31]刘勇,莫笑晗,余清,等.云南、福建、湖南烟区烟草花叶病主要病毒种类检测及黄瓜花叶病毒亚组鉴定[J].植物病理学报,2006,36(4):310-313.
[32]黎微,孔宝华,陈海如,等.云南主要地区辣椒分离的黄瓜花叶病毒的亚组鉴定[J].云南农业大学学报,2008,23(2):167-172.
[33]吴畏,孙淼,孙现超,等.重庆地区马铃薯上黄瓜花叶病毒的检测及亚组鉴定[J].西南大学学报:自然科学版,2014,36(7):29-32.
Detection of Viruses Infecting Cucurbit Vegetables in Shandong and Identification of Subgroup of theCucumbermosaicvirusIsolates
SUN Xiaohui1,WANG Shusen2,GAO Lili1,QIAO Ning3,LIU Yongguang3,ZHAO Jing3,ZHU Xiaoping1
(1.College of Plant Protection,Shandong Agricultural University,Shandong Provincial Key Laboratory for Biology of Vegetable Diseases and Insect Pests,Taian271018,China;2.Zhucheng Intergrated Office of Agriculture and Countryside,Zhucheng262200,China;3.Institute of Vegetables and Flowers,Weifang University of Science and Technology,Shouguang262700,China)
Abstract:In order to detect and identify the viral causing agent that infecting cucurbit vegetable plants in Shandong,867 cucurbit plant samples of suspected viral diseases from 11 vegetable planting areas in Shandong were collected during July to August,2014.9 primer pairs specific to Cucumber mosaic virus(CMV),Cucumber green mottle mosaic virus(CGMMV),Watermelon mosaic virus(WMV),Tobacco mosaic virus(TMV),Zucchini yellow mosaic virus(ZYMV), Squash mosaic virus(SqMV),Melon yellow spot virus(MYSV),Cucurbit chlorotic yellows virus(CCYV),Prunus necrotic ringspot ilarvirus(PNRSV)and Melon necrotic spot virus(MNSV)were used respectively to perform PCR detection.The results showed that viruses carried rate was 34.8%,10.4%,20.0%,41.7%,27.0%,7.8%,2.6%,1.7%,0 and 0.9% respectively.The natural infection of these viral diseases except PNRSV in Shandong was confirmed,and the incidence of CMV and TMV were higher than others.Two or more than two viruses mixed infections were also very common in field.At the same time,those CMV positive samples from 11 regions were selected for subgroup classification.Coat protein(CP)gene and the whole RNA3 nucleotide sequences were determined.Sequence alignment and phylogenetic analyses were performed.The results showed that the CMV isolates of cucurbit vegetables in Shandong area were all members of CMV subgroup IB with the highest similarity to a South Korea isolate As(AF013291),no other strains were found.
Key words:Cucurbit viral disease;Cucumber mosaic virus;RT-PCR;Subgroup
doi:10.7668/hbnxb.2016.02.034
中图分类号:S432.4+1
文献标识码:A
文章编号:1000-7091(2016)02-0211-07
作者简介:孙晓辉(1989-),男,山东威海人,在读硕士,主要从事植物病理学研究。通讯作者:竺晓平(1966-),男,江苏六合人,教授,博士,主要从事植物病理学研究。
基金项目:国家公益性(农业)行业科研专项资助项目(201303028);山东省科技发展计划资助项目(2014GNC111008);山东省自然科学基金项目(ZR2015CQ022)
收稿日期:2016-02-19
