烟草钾转运体NtKT12的克隆及表达分析
2016-06-03鲁黎明李立芹
李 姣,许 力,鲁黎明,李立芹
(四川农业大学 农学院,四川 成都 611130)
烟草钾转运体NtKT12的克隆及表达分析
李姣,许力,鲁黎明,李立芹
(四川农业大学 农学院,四川 成都611130)
摘要:克隆烟草钾转运体基因,预测其结构,并分析其进化关系和功能,为研究烟草钾吸收机制奠定基础。采用RT-PCR方法从烟草品种K326中克隆到了一个钾转运体的同源基因,该序列全长为2 532 bp,蛋白编码844个氨基酸,预测分子量为93.1 kDa,等电点为7.2。同源性分析结果显示,该基因与绒毛烟草钾转运体12、林烟草钾转运体12等具有较高的同源性,故命名为NtKT12。生物信息学分析表明,NtKT12具有12个跨膜区。组织表达分析发现该基因在根中的表达量最高。低钾胁迫试验表明,该基因在处理6,24 h后表达量明显高于对照。研究结果为解析NtKT12 在烟草钾营养中的功能奠定一定的理论基础。
关键词:烟草;NtKT12基因;克隆;序列分析;表达
钾是大多数活细胞中必不可少的阳离子,它在植物细胞内的含量很高,能达到植物干质量的2%~10%[1]。钾在植物的生长发育及生理生化代谢过程中发挥着重要作用,例如促进植物光合作用和同化产物的转运,参与调节一些酶的活性,增强植物抗非生物逆境胁迫的能力,提高作物产量和品质等[2-3]。
K+在植物体内的功能与其跨膜转运相关,通常认为钾在植物体内有2种跨膜转运机制:钾离子通道和钾离子转运体[4]。 钾转运体在介导K+在植物体内的运输,催化钾的吸收以及维持植物体内K+的平衡方面有重要作用[5]。KUP/HAK/KT家族是植物体内最大的钾转运体家族,它几乎在植物所有组织中均可表达[6]。已有研究表明,KUP/HAK/KT家族通过介导K+的跨膜转运及吸收来维持植物体内K+的动态平衡[7]。
烟草是我国重要的经济作物,钾对烟草生理生化、品质和抗逆性具有重要的作用,是评判烟叶品质的重要标准,被称为“品质元素”[8]。对钾素的吸收利用关系到烟株的生长发育,已有研究表明,当外界钾浓度较低时,烟株根系生长明显受到抑制[9]。钾转运体对于低钾环境下钾的吸收利用十分重要,目前烟草中已克隆的钾转运体基因主要有NrHAK1[10]、NtHAK1[11]、NtPOT10(TPK1)[12]和NsHAK11[13]。谭颖等[14]利用共转化法将NtHAK1基因导入烟草品种K326,结果发现NtHAK1超量表达显著提高了转基因植株的富钾能力。郭兆奎等[15]将AtKUP1基因导入烟草后发现,转基因植株叶片中钾含量相比对照提高了约45%。Horie等[16]将OsHAK5在烟草 BY2 细胞中表达后发现,在低钾条件下,该基因提高了细胞的钾吸收能力。季静和车文利等[17-18]分别将HAK基因转入玉米和棉花植株后发现,转基因植株中的钾含量明显高于对照。这些研究都表明在植物中高效表达钾转运体基因,可以提高它们对K+的吸收和转运能力。
本研究从烟草K326 中克隆到一个KUP/HAK/KT转运体(NtKT12)的cDNA,利用生物信息学对NtKT12编码蛋白进行相关分析,同时,运用荧光定量PCR分析了其在根、茎、叶、花及低钾胁迫下基因的表达水平,旨在为今后NtKT12的功能研究奠定基础。
1材料和方法
1.1试验材料及试剂
植物材料为烟草K326。首先挑选籽粒饱满、大小一致的烟草种子用20%的次氯酸钠溶液消毒30 min,然后用无菌水反复清洗6~7次后,播种于MS培养基上,每个培养基上播种50粒左右,放置在16 h光/8 h暗,25 ℃的光照培养箱中培养15 d后,挑取长势一致的幼苗转移到低钾培养基上,处理相应时间(6,12,24,48 h)后进行整株取样。低钾培养基是将MS培养基中的KNO3去掉,并且将KH2PO4替换为NH4H2PO4,其余成分相同。
大肠杆菌感受态和DNA凝胶纯化回收试剂盒购自天根公司,TRIzol试剂、载体PMD19-T、高保真Pfu酶、cDNA 合成试剂盒、SYBR Green Master mix等试剂购自TaKaRa。
1.2试验方法
1.2.1烟草NtKT12基因的克隆参考GenBank 收录绒毛烟草NtKT12序列,采用Primer5.0 软件设计引物NtKT12F和NtKT12R(表1)。扩增反应程序为:95 ℃ 预变性5 min;95 ℃ 变性 30 s,55 ℃ 退火 30 s,72 ℃ 延伸 1.5 min,35 个循环。 目的片段纯化后与pMD19-T载体16 ℃连接过夜,连接产物转化大肠杆菌DH5α 感受态,随后在涂有氨苄青霉素的LB 平板上进行筛选,采用菌落PCR 检测阳性克隆。检测后随机选取3个独立的阳性克隆送生物技术公司进行测序。
1.2.2烟草NtKT12基因生物信息学分析利用ExPASy ProtParam tool分析NtKT12编码蛋白的理化性质;采用DNAMAN 软件分析其编码蛋白的疏水性,并构建系统进化树;运用TMHMM 2.0进行跨膜区的预测分析;利用NCBI在线分析NtKT12的保守功能域;运用在线工具PSORT预测NtKT12的亚细胞定位;运用IBCP和SWISS-MODEL在线预测NtKT12的二级、三级结构。
1.2.3烟草NtKT12基因的表达分析根据基因序列,采用Primer Premier 5.0设计Real time PCR引物NtKT12qF和NtKT12qR(表1),采用烟草的18SrRNA为内参进行表达差异研究。PCR扩增程序为:95 ℃ 5 min;95 ℃ 30 s,72 ℃ 1 min 30 s,40个循环;72 ℃ 10 min。所有的样品都设置3个重复,反应结束后,基因相对表达水平用2-ΔΔCt方法进行计算。
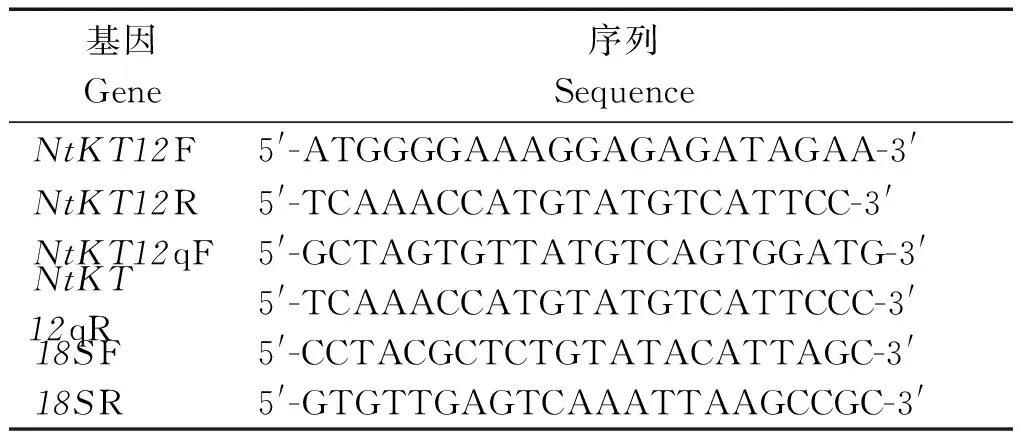
表1 引物序列
2结果与分析
2.1基因克隆
以烟草叶片总RNA反转录合成的cDNA为模板进行PCR扩增,电泳结果显示在2 500 bp左右的位置上有清晰的条带(图1)。该条带纯化后与pMD19-T 载体在16 ℃进行连接,运用菌落PCR方法鉴定阳性克隆,随机挑选3个阳性克隆送生物公司进行测序。
2.2NtKT12基因和蛋白序列分析
2.2.1NtKT12的理化性质及疏水性分析NtKT12编码蛋白的理化性质分析结果表明,该基因序列全长为2 532 bp,编码844个氨基酸,NtKT12编码蛋白预测的分子量为93.1 kDa,理论等电点PI为7.2,总平均疏水性为0.349,不稳定系数是35.95,说明该蛋白是一个稳定性蛋白。
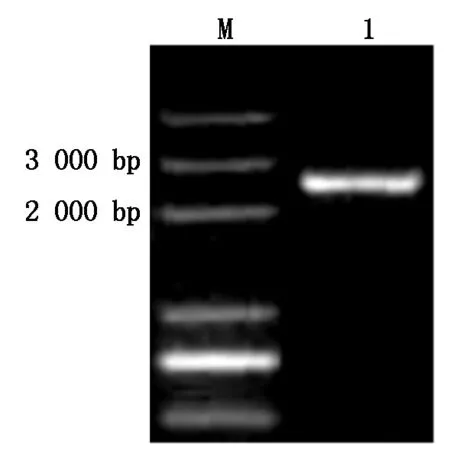
M.Marker;1.目的基因。
利用DNAMAN软件进行的疏水性分析结果(图2)表明,该蛋白含有294个疏水性氨基酸,可能为疏水性蛋白。
2.2.2NtKT12的二级、三级结构预测利用IBCP(http://npsa-pbil.ibcp.fr)的在线工具SOPMA,对NtKT12的二级结构进行预测发现,α-螺旋约占44.60%,无规则卷曲约占27.28%,延伸链占21.12%,β-转角占7.00%,其中α-螺旋为主要结构(图3-A)。运用SWISS-MODEL对NtKT12的三级结构进行了预测(图3-B),并将结果与二级结构预测及跨膜结构预测比照,结果较为统一。
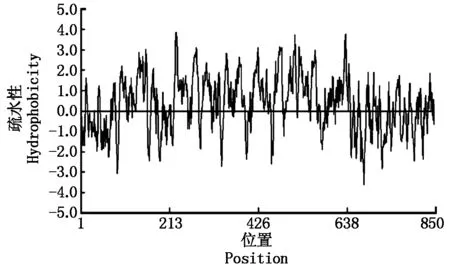
图2 NtKT12疏水区预测
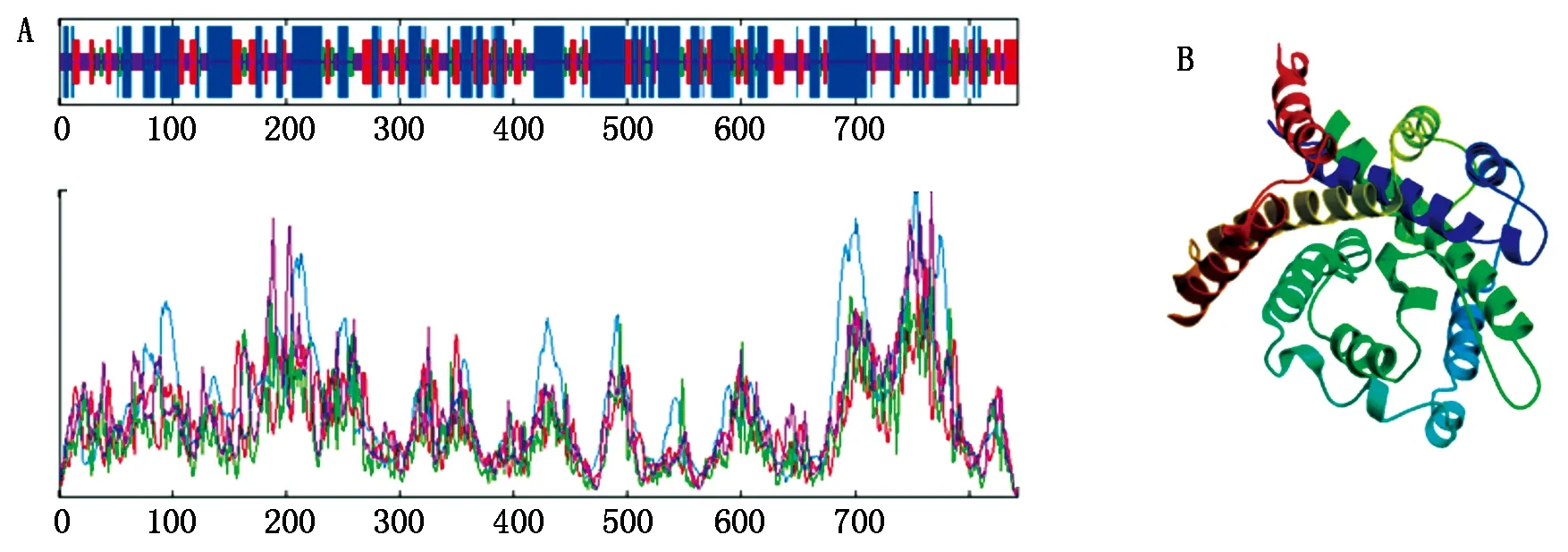
A.二级结构预测;B.三级结构预测。
2.2.3NtKT12蛋白跨膜区域预测NtKT12编码蛋白的跨膜区分析结果表明,该蛋白含有12个跨膜区(图4),且在第2,3个跨膜区之间有一个较长的胞质质环。跨膜螺旋的位置分别为第106~128氨基酸,第143~165氨基酸,第234~256氨基酸,第269~291氨基酸,第298~320氨基酸,第349~371氨基酸,第378~400氨基酸,第420~442氨基酸,第470~492氨基酸,第502~524氨基酸,第529~551氨基酸,第561~580氨基酸。根据跨膜区分析结果推测NtKT12是一个膜蛋白。
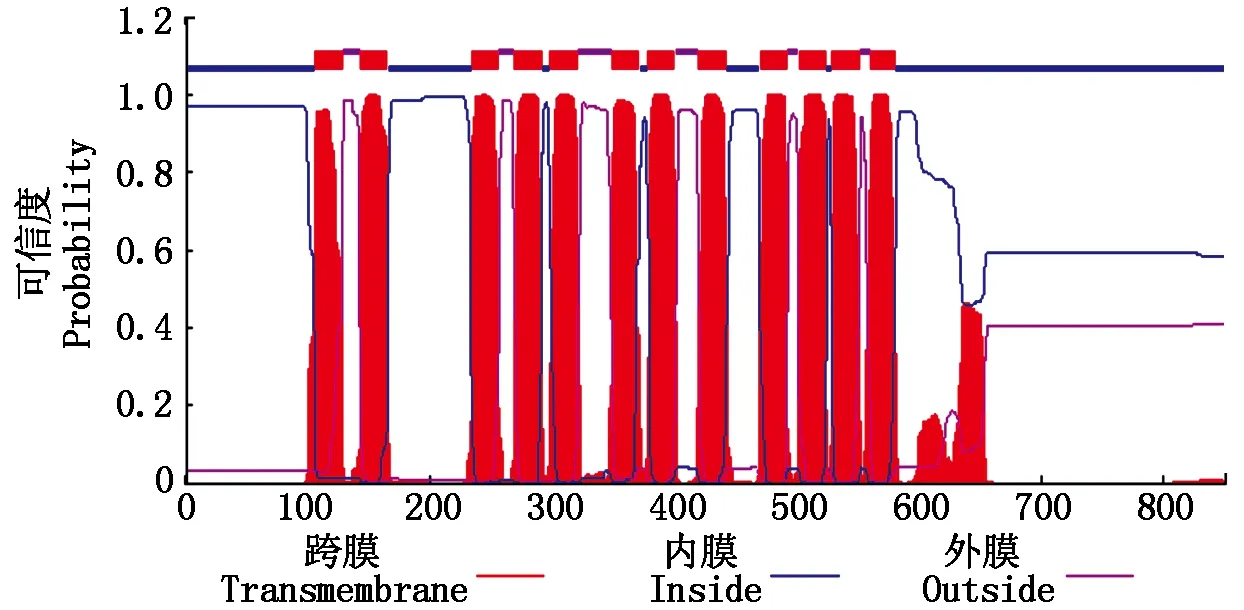
图4 NtKT12蛋白跨膜区预测
2.2.4NtKT12同源性分析把NtKT12序列在NCBI 数据库中进行Blast比对,按照相似性程度高低选择20个基因序列(包括NtKT12)构建系统进化树,结果表明(图5),NtKT12 与绒毛烟草钾转运体12-1、林烟草钾转运体12、马铃薯钾转运体12-1等具有较高的核苷酸序列同源性(99%,99%,92%),与粟米钾转运体23同源性最低,为73%。
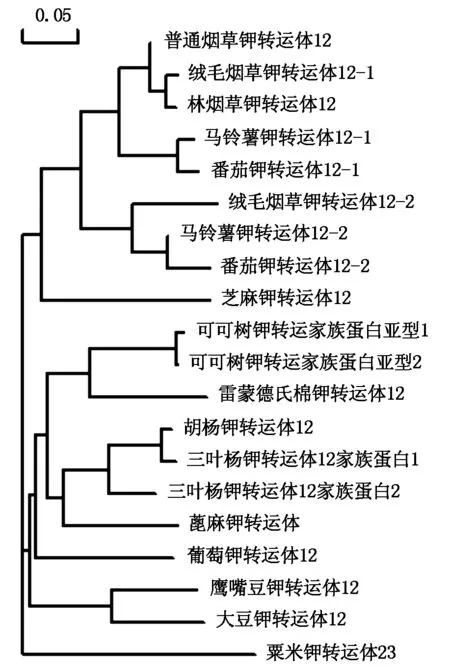
图5 NtKT12的系统进化分析
2.2.5编码蛋白的功能保守域及亚细胞定位分析利用 NCBI 数据库的 CDD 软件对NtKT12蛋白功能保守域进行了分析,结果表明(图6),该蛋白是钾转运体超级家族(K-trans superfamily)的一员,并且该蛋白具有KUP/KT/HAK钾转运体家族的专用典型结构“K-trans”结构域(Pfam02705)。利用PSORT(http://psort.hgc.jp/form.html)在线预测NtKT12的亚细胞定位,结果显示,在质膜上面占0.8,在叶绿体类囊体膜上面占0.4,在高尔基体上面占0.4,在内质网(膜)上面占0.3,预测NtKT12可能定位在质膜上。
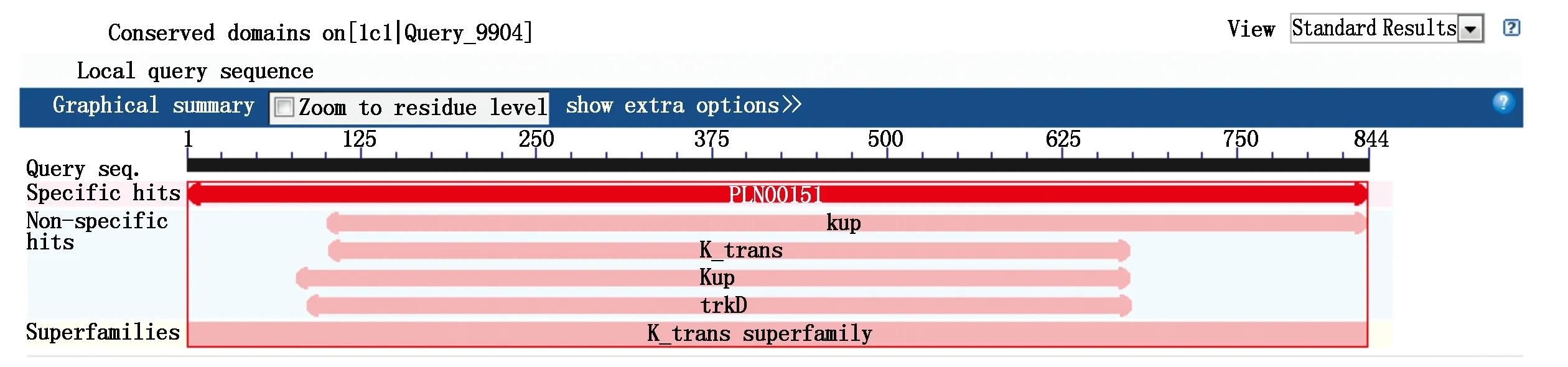
图6 NtKT12功能保守域分析
2.3NtKT12的组织表达分析
以烟草K326的根、茎、叶、花cDNA 为模板进行Real time PCR反应,分析NtKT12在各个部位的表达量,由图7可知,NtKT12的表达量由高到低依次为根>叶>茎>花,其在根中的表达量分别是叶、茎、花中表达量的4.2,52.2,177.3倍,这说明NtKT12基因主要在烟草植株的根中表达,并且其表达存在组织特异性。

图7 NtKT12在不同组织中的相对表达量分析
2.4低钾胁迫下NtKT12的表达分析
采用Real time PCR 对NtKT12在低钾处理后的表达量进行了分析。由图8可知,该基因在低钾处理1~6 h内表达量上调,6 h时达到最大,为对照(0 h)的18.2倍;随后表达量下降,12 h时表达量低于对照,而24 h时表达量再次上升,为对照的3.9倍;24 h后表达量下降,48 h表达量低至对照的57%。因此,低钾处理后,NtKT12的表达量是先上调后降低。
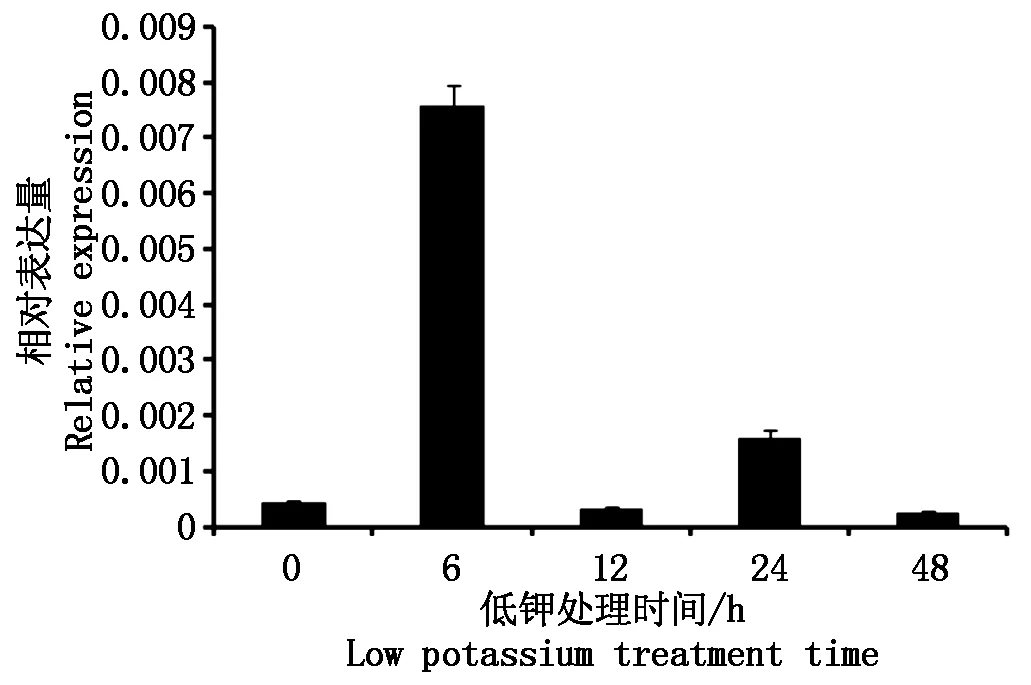
图8 NtKT12在低钾处理下的相对表达量
3讨论
本研究中,我们首先克隆烟草K326NtKT12基因全长cDNA的序列,跨膜预测分析表明,该蛋白具有12个跨膜区域(TMS),且在第2个和第3个TMS之间有一个较长的胞质质环[19],这是KUP/HAK/KT家族钾转运体蛋白的共同特征之一。亚细胞定位预测结果表明NtKT12可能定位在质膜上,这对于下一步基因功能研究具有重要指导意义。朱晓玲等[20]的研究表明,大豆GmKT12亚细胞定位于质膜、内质网、细胞核或细胞骨架上;Gupta 等[21]发现,拟南芥AtKUP/HAK/KT12定位于叶绿体膜上;Hyun等[22]发现,番茄SlHAK12定位在叶绿体类囊体膜上。同一家族的钾转运体在不同植物内亚细胞定位不同,可能是由于不同的植物能量与营养需求不同所致,也说明了KUP/HAK/KT钾转运体家族的复杂性及功能丰富性[23]。
KUP/HAK/KT家族几乎在植物的各个组织、器官中均有分布,但其在不同的器官及发育组织中的表达量不同。 Guo等[10]的研究结果表明,NrHAK1在黄花烟草根中的表达量显著高于叶和花中的表达量,推测其可能参与根部钾离子的吸收。蔺万煌等[24]的研究发现,PaHAK1主要在商陆根中表达,其功能可能与根对K+的高亲和吸收有关。本研究利用Real time PCR分析NtKT12在烟草K326根、茎、叶、花组织中的表达水平,结果显示,NtKT12在烟草根中的表达量明显高于其在叶、茎和花中的表达量,这与前人的研究结果一致[10,24],说明NtKT12可能在根中发挥功能。
大多数植株通过高亲和性钾转运体来应对低钾胁迫,维持其在低钾环境下的生长发育。研究表明,许多KUP/HAK/KT家族基因表达量受低钾条件诱导,其可能参与低钾条件下植物细胞内K+的吸收及采集[25]。低钾胁迫条件下,拟南芥AtHAK5 的表达量会迅速上调并可维持5 d 的高表达水平[26];小麦TaHAK1的表达水平在缺钾处理后24 h达到最高[27];大豆GmKT12在缺钾处理后的2 h内表达量迅速上调[20]。本研究发现,低钾处理1~6 h,NtKT12的表达量明显升高,而后表达水平降低,这与宋毓峰等[13]研究结果基本一致。
已有研究表明,外界缺钾时,钾转运体作为重要的信号组分将会诱导植物产生活性氧(ROS)、乙烯和生长素等以抵御非生物胁迫[28]。其中拟南芥AtHAK5 在K+营养不足时会激活乙烯信号途径并调控 ROS 的积累,ROS既可以反馈调控AtHAK5的表达以响应根中K+的不足,同时也会刺激根毛伸长从而增强根对 K+的吸收[29]。但NtKT12是否参与这一信号途径还需要进一步的试验验证。后续工作可构建NtKT12 基因的过量表达和RNAi载体进行转基因研究,也可利用电压钳技术研究NtKT12通道电流,进一步明确NtKT12在烟草钾营养方面的功能。
参考文献:
[1]Coskun D,Britto D T,LI Mingyuan,et al.Capacity and plasticity of Potassium channels and high-affinity transporters in roots of barley andArabidopsis[J].Plant Physiology,2013,162(1):496-511.
[2]Troufflard S,Mullen W,Larson T R,et al.Potassium deficiency induces the biosynthesis of oxylipins and glucosinolates inArabidopsisthaliana[J].BMC Plant Biology,2010,10:172.
[3]R mheld V,Kirkby E A.Research on Potassium in agriculture:needs and prospects[J].Plant and Soil,2010,335(1/2):155-180.
[4]Hosoo Y,Kimura Y,Nanatani K,et al.Molecular cloning and expression analysis of a gene encoding KUP/HAK/KT-type Potassium uptake transporter fromCryptomeriajaponica[J].Trees,2014,28(5):1527-1537.
[5]Ashley M K,Grant M,Grabov A.Plant responses to Potassium deficiencies:a role for Potassium transport proteins[J].Journal of Experimental Botany,2006,57(2):425-436.
[6]Gierth M,Mäser P.Potassium transporters in plants-involvement in K+acquisition,redistribution and homeostasis[J].FEBS Letters,2007,581(12):2348-2356.
[7]Osakabe Y,Arinaga N,Umezawa T,et al.Osmotic stress responses and plant growth controlled by Potassium transporters inArabidopsis[J].The Plant Cell,2013,25(2):609-624.
[8]闫慧峰,石屹,李乃会,等.烟草钾素营养研究进展[J].中国农业科技导报,2013,15(1):123-129.
[9]何伟,杨中义,张发明,等.低钾胁迫下不同烤烟品种根系生长和根毛形态的差异[J].中国烟草学报,2010,16(3):43-48.
[10]Guo Zhaokui,Yang Qian,Wan Xiuqing,et al.Functional characterization of a Potassium transporter geneNrHAK1 inNicotianarustica[J].Journal of Zhejiang University-Science B,2008,9(12):944-952.
[11]鲁黎明,杨铁钊.烟草钾转运体基因NtHAK1的克隆及表达模式分析[J].核农学报,2011,25(3):469-476.
[12]鲁黎明.烟草钾转运体基因TPK1的电子克隆及生物信息学分析[J].中国农业科学,2011,44(1):28-35.
[13]宋毓峰,董连红,靳义荣,等.林烟草KUP/HAK/KT钾转运体基因NsHAK11的亚细胞定位与表达[J].中国农业科学,2014,47(6):1058-1071.
[14]谭颖,秦利军,赵丹,等.共转化法获得HAK1基因高表达烟草提高植株钾吸收能力[J].植物生理学报,2013,49(7):689-699.
[15]郭兆奎,杨谦,姚泉洪,等.转拟南芥AtKup1基因高含钾量烟草获得[J].中国生物工程杂志,2005,25(12):24-28.
[16]Horie T,Sugawara M,Okada T,et al.Rice sodium-insensitive Potassium transporter,OsHAK5,confers increased salt tolerance in tobacco BY2 cells[J].Journal of Bioscience and Bioengineering,2011,111(3):346-356.
[17]季静,汪婷婷,王罡,等.HAK基因对玉米的遗传转化及其耐盐性研究[J].天津大学学报,2013,46(7):659-665.
[18]车文利,张书玲,吴立柱,等.转AlHAK1基因棉花耐盐能力分析[J].中国农业科技导报,2015,17(1):49-56.
[19]Sato Y,Nanatani K,Hamamoto S,et al.Defining membrane spanning domains and crucial membrane-localized acidic amino acid residues for K+transport of a Kup/HAK/KT-typeEscherichiacoliPotassium transporter[J].Journal of Biochemistry,2014,155(5):315-323.
[20]朱晓玲,陈海峰,王程,等.大豆钾转运体基因GmKT12的克隆和信息学分析[J].作物学报,2013,39(9):1701-1709.
[21]Gupta M,Qiu Xuhua,Wang Lei,et al.Kt/HAK/KUPPotassium transporters gene family and their whole-life cycle expression profile in rice(Oryzasativa)[J].Molecular Genetics and Genomics,2008,280(5):437-452.
[22]Hyun T K,Rim Y,Kim E,et al.Genome-wide and molecular evolution analyses of the Kt/HAK/KUP family in tomato(SolanumlycopersicumL.)[J].Genes & Genomics,2014,36(3):365-374.
[23]刘贯山,王元英,孙玉合,等.高等植物钾转运蛋白[J].生物技术通报,2006(5):13-18.
[24]蔺万煌,马立英,苏益,等.商陆高亲和性K+转运体基因PaHAK1的克隆与表达分析[J].植物生理学报,2011,47(1):91-96.
[25]Ma T L,Wu W H,Wang Y.Transcriptome analysis of rice root responses to potassium deficiency[J].BMC Plant Biology,2012,12:161.
[26]Gierth M,Maser P,Schroeder J I.The Potassium transporter AtHAK5 functions in K+deprivation-induced high-affinity K+uptake and AKT1 K+channel contribution to K+uptake kinetics inArabidopsisroots[J].Plant Physiology,2005,137(3):1105-1114.
[27]秦余香,田延臣,王军,等.小麦耐盐相关基因TaHAK1的克隆与表达分析[J].麦类作物学报,2011,31(6):1014-1019.
[28]Alemán F,Nieves-cordones M,Martínez V,et al.Root K(+)acquisition in plants:theArabidopsisthalianamodel[J].Plant & Cell Physiology,2011,52(9):1603-1612.
[29]张彦桃,王欣,祁智,等.拟南芥高亲和性钾转运体AtHAK5参与植物根对盐胁迫及ABA的反应[J].华北农学报,2014,29(6):214-219.
Cloning and Expression Analysis of a Potassium TransporterNtKT12 inNicotianatabacum
LI Jiao,XU Li,LU Liming,LI Liqin
(College of Agronomy,Sichuan Agricultural University,Chengdu611130,China)
Abstract:Cloned the tobacco potassium transporter gene and predicted its structure,and analyzed their evolutionary relationships and functions,to lay the foundation for the study of tobacco potassium absorption mechanism.In this study,a homologous gene of a potassium transporter was cloned by RT-PCR from K326.Sequences analysis showed this gene contained 2 532 bp and coded 844 amino acid residues,and the calculated molecular mass was 93.1 kDa with the theoretical isoelectric point(pI)was 7.2.Homology analysis suggested that the gene had a high homology with the potassium transporter 12 of the Nicotiana tomentosiformis and Nicotiana sylvestris,so it was named as NtKT12.Protein structure and function analysis showed that NtKT12 has 12 transmembrane domains.Expression patterns showed that the expression level was the highest in the roots.Expression patterns under low potassium treatment suggested NtKT12 expression level was significantly higher after 6,24 h than the control.These results provided some basis for potassium function analysis of NtKT12.
Key words:Tobacco;NtKT12;Cloning;Sequence analysis;Expression
doi:10.7668/hbnxb.2016.02.012
中图分类号:Q78;S572.03
文献标识码:A
文章编号:1000-7091(2016)02-0065-06
作者简介:李姣(1989-),女,河南临颍人,在读硕士,主要从事烟草生物技术研究。通讯作者:李立芹(1974-),女,山东东阿人,副教授,博士,硕士生导师,主要从事植物分子生物学研究。
基金项目:国家自然科学基金项目(31070244);植物生理学与生物化学国家重点实验室开放课题基金项目(SKLPPBKF1506)
收稿日期:2016-02-18
