金纹细蛾细胞色素CYP6家族基因的克隆及表达
2016-06-03郭长宁王冠华于建光
田 甜,李 鑫,郭长宁,侯 茜,王冠华,于建光
(西北农林科技大学 植物保护学院,陕西 杨凌 712100)
金纹细蛾细胞色素CYP6家族基因的克隆及表达
田甜,李鑫,郭长宁,侯茜,王冠华,于建光
(西北农林科技大学 植物保护学院,陕西 杨凌 712100)
[摘要]【目的】 克隆并鉴定金纹细蛾(Phyllonorycter ringoniella)细胞色素CYP6家族基因,并观察氯氟氰菊酯药剂处理后mRNA相对表达量的变化,为金纹细蛾细胞色素CYP6家族基因全长cDNA的获得,以及防止或延缓金纹细蛾抗药性的产生提供理论依据。【方法】 以GenBank上公布的CYP6家族基因编码区序列为基础设计并合成简并引物;利用RT-PCR扩增获得序列后在NCBI上进行Blastx对比,根据P450基因命名法进行命名并向GenBank提交序列获得登录号;利用点滴法和qRT-PCR技术,将金纹细蛾3龄幼虫在氯氟氰菊酯(LC50=12.88 mg/L)条件下处理24 h后,观察其体内细胞色素P450基因的相对表达量。【结果】 成功扩增出3个长度分别为415,412和421 bp的cDNA片段。同源性分析表明,3条基因序列与CYP6AN5、CYP6B5和CYP6ab氨基酸相似性分别达61%,59%和71%,可将其初步均归类为CYP6家族,并分别命名为phCYP6AN5、phCYP6B5和phCYP6ab,将序列信息提交至GenBank,获得GenBank登录号分别为KJ559411、KJ559412和KJ559413。药剂处理对3种基因发生了不同的诱导或抑制作用,phCYP6AN5基因在受到药剂处理后相对表达量显著上升,而phCYP6B5和phCYP6ab在受到药剂处理后相对表达量显著下降。【结论】 成功获得3条金纹细蛾细胞色素CYP6家族基因片段;诱导剂的诱导作用存在一定程度的特异性,对某种或几种P450酶有效应的化合物并不一定诱导其他类型的P450。
[关键词]金纹细蛾;细胞色素P450;序列分析;基因表达
P450为一基因超家族,由多个基因家族组成,每个基因家族又包含若干个基因亚家族。随着分子生物学技术的发展,昆虫P450基因不断被分离、克隆并体外表达,其结构、功能、表达的调控及与昆虫抗药性关系的研究也不断深入[1]。细胞色素P450是昆虫体内参与各类杀虫剂及其他外源性和内源性化合物代谢的主要解毒酶系——多功能氧化酶系的末端氧化酶,其可与底物结合,从NADPH传递电子到NAD-PH细胞色素P450还原酶[2]。
金纹细蛾(Phyllonorycterringoniella)是苹果树上一种常见的潜叶性害虫,是东亚特有种。自20世纪70年代以来,金纹细蛾的危害在我国日渐严重,已成为果园的主要害虫之一。目前,国内外关于金纹细蛾的研究主要集中在田间发生规律、越冬蛹保存及其寄生蜂等方面[3-4],而有关其分子生物学方面的研究却鲜有报道。
细胞色素P450与昆虫的抗药性关系密切[5-6],但目前有关细胞色素P450基因的克隆及其解毒作用的研究主要集中于家蝇、果蝇、棉铃虫上[7]。本研究利用RT-PCR技术克隆了金纹细蛾细胞色素P450基因片段,并通过qRT-PCR技术检测了细胞色素P450基因在氯氟氰菊酯胁迫处理后的表达,为金纹细蛾细胞色素P450基因全长的获得,以及防止或延缓金纹细蛾抗药性的产生提供理论依据。
1材料与方法
1.1供试虫源
供试虫源来自西北农林科技大学应用昆虫学重点实验室温室。金纹细蛾虫疤叶采自陕西洛川果园,解剖虫疤叶,将得到的蛹置于4 ℃冰箱保存。翌年4月,将蛹接种到苹果树上,在西北农林科技大学应用昆虫学重点实验室温室内进行饲养。饲养温度为(25±2) ℃,光周期为16L/8D,相对湿度为(70±10)%。7月收集健康虫源进行试验。
抗药试验虫源处理参照毛细管点滴法[8]。首先在双筒解剖镜下挑取正在取食活动的3龄幼虫带叶供试。将氯氟氰菊酯用丙酮稀释后,用毛细管点滴器点滴处理幼虫腹部后半部分的背面,并在点滴前先揭去这部分的外叶膜,以丙酮点滴处理为对照。毛细管点滴器容积为0.050~0.067 μL,每处理30头,3个重复。处理后将试虫放人培养皿内保湿,并置于恒温室((25±2) ℃)中,24 h后镜检死亡率。
1.2主要试剂
上海生工生物公司的UNIQ-10柱式Trizol 总RNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒;Thermo公司的RevertAid First Stand cDNA Synthesis Kit;康为世纪的DM 2000 DNA Marker、琼脂糖、2×ES Master mixTaq酶、UltraSYBR Mixture。本试验所用的PCR引物均由上海生工生物公司合成。
1.3P450基因克隆及mRNA表达水平检测
1.3.1引物设计本试验所用到的引物均使用Primer 5.0软件设计,引物序列见表1。phA、phB和phC为根据P450基因保守序列设计的3对简并引物,预期cDNA扩增产物长度为400 bp左右。phCYP6AN5-R和phCYP6AN5-F、phCYP6B5-R和phCYP6B5-F、phCYP6ab-R和phCYP6ab-F、β-actin-R 和β-actin-F为基因特异性引物,分别用于qRT-PCR分析。
1.3.2总RNA 的提取及反转录1)灭菌和无菌处理。将试验器具用1/1 000 DEPC水浸泡24 h,在120 ℃、0.1 MPa下高温灭菌20 min,之后置于烘箱内60 ℃处理至干燥备用。
2)总RNA的提取。取30头3龄中期金纹细蛾幼虫快速放入经液氮预冷的研钵中并快速向研钵中加入液氮。先缓缓研磨,待液氮挥发殆尽时加速研磨,如此反复2~3次,直至样品完全变成白色粉末。将白色粉末用小勺小心移至盛有500 μL Trizol试剂的1.5 mL无菌离心管中,轻微振荡混匀后室温放置10 min。之后12 000 r/min、 4 ℃离心10 min。将上清液用移液枪移至另一新的1.5 mL离心管中,加入0.2 mL 氯仿,剧烈振荡30 s,室温放置3 min,12 000 r/min、4 ℃离心10 min。将上清液用移液枪移至另一新的1.5 mL离心管中,加入1/2倍上清液体积的无水乙醇,轻微颠倒混匀。同时将吸附柱放入收集管中,用移液枪将溶液全部加至吸附柱中,静置2 min,12 000 r/min 室温离心3 min,倒掉收集管中的废液。将吸附柱放回收集管中,加入500 μL RPE Solution,静置2 min,10 000 r/min 室温离心30 s,倒掉收集管中废液。重复该步骤一次。将吸附柱放回收集管中,10 000 r/min 室温空离心2 min,去除残余的乙醇。将吸附柱放入另一干净的1.5 mL 离心管中,在吸附膜中央悬空加入30 μL DEPC-treated ddH2O,静置5 min,12 000 r/min 室温离心2 min,将所得到的RNA溶液置于-70 ℃保存,用于后续试验。
3)第1链合成。在冰浴的无核酸酶的PCR管中加入2 μg总RNA,2 μL Oligo (dT)15,2 μL(2.5 mmol/L)dNTP,再加RNA-free ddH2O至14.5 μL,将上述溶液于PCR仪中70 ℃温浴5 min后迅速在冰上冷却2 min。然后12 000 r/min 室温离心1 min,按顺序加入以下组分:4 μL 5×Firstand Buffer(含DTT),0.5 μL Rnasin,1 μL(200 U)TIANScript M-MLV,用移液枪轻轻混匀。然后于PCR仪中42 ℃温浴50 min,之后加热至95 ℃终止反应。加入RNA-free ddH2O将反应体系稀释至50 μL,所得cDNA模板于-20 ℃保存待用。

表 1 本研究中所用引物
1.3.3RT-PCR的扩增PCR反应体系(25 μL):12.5 μL 2×ES Master mixTaq酶,1 μL上游引物(10 μmol/L),1 μL 下游引物(10 μmol/L),1 μL cDNA模板,9.5 μL RNase-free water。PCR反应条件:94 ℃预变性1 min;94 ℃ 30 s,45 ℃ 30 s,72 ℃ 1 min,30个循环;最后72 ℃延伸5 min。PCR 产物检测:均用1.5%的琼脂糖凝胶进行电泳检测。电泳条件:100 V,40 min。电泳结束后用EB染色并照相观察。
1.3.4基因克隆与测序基因克隆采用上海生工生物公司的克隆试剂盒。将已纯化的3对引物的PCR产物分别连接到pUCm-T载体后转入感受态细胞。根据蓝白斑筛选原理,选择白色菌落,用LB液体培养后选择其菌液抽提质粒DNA。3组产物每组挑取5个单克隆送至上海生工生物公司进行测序,测序结果经NCBI数据库中的Blastx比对,进行序列鉴定。
1.3.5实时定量PCR扩增和定量方法qRT-PCR反应体系为(25 μL):12.5 μL 2×UltraSYBR Mixture,1 μL cDNA,上、下游引物各1 μL,9.5 μL RNase-free water。反应条件:95 ℃ 3 min;95 ℃ 20 s,56 ℃ 20 s,72 ℃ 20 s,50个循环;熔解步骤:65 ℃开始收集信号,每10 s升高0.5 ℃,到95 ℃结束。定量方法采用比较CT相对定量法[9]。该方法在假设目标基因片段和持家基因片段扩增效率一致的情况下,cDNA表达量为2-ΔΔCT(ΔCT=CT目标基因-CT持家基因,ΔΔCT=ΔCT样品-ΔCT参照物)。本研究采用组成性表达延伸因子β-actin作为内参基因。
1.4数据分析
本试验通过BIO-RAD IQ5荧光定量读取数据,采用比较CT相对定量法[9]作为基因表达的相对指标进行数据分析,数据统计分析采用SPSS 17.0 软件中单因素方差分析,进行Duncan多重比较,通过OriginProPorable 8.5软件绘图。
2结果与分析
2.1金纹细蛾CYP6AN5、CYP6B5和CYP6ab基因的克隆及序列分析
2.1.1总RNA的提取与检测以金纹细蛾幼虫提取的总RNA检测结果(图1)显示,经NanoDrop 2000微量紫外分光光度计测得A260/A280均在 1.8~2.0,表明RNA纯度较高,可用于后续试验。
2.1.2RT-PCR扩增检测以金纹细蛾总RNA反转录得到的cDNA为模板,用简并引物进行扩增后经凝胶电泳检测,3条序列长度分别为415,412和421 bp(图2),与预期结果相符。

图 1金纹细蛾总RNA提取结果
1,2.提取的总RNA;M.DNA Marker DL2000
Fig.1Total RNA fromPhyllonorycterringoniella
1,2.Extraction of total RNA;M.DNA Marker DL2000
图 2RT-PCR扩增产物凝胶电泳结果
1~3.不同引物的PCR扩增产物;M.DNA Marker DL2000
Fig.2Agarose gel electrophoresis of RT-PCR products
1-3.Amplified fragments of different primers;
M.DNA Marker DL2000
2.1.3序列鉴定与分析测序所得的3条序列片段经NCBI数据库的Blastx比对,结果见表2。表2结果显示:所克隆的基因片段全部属于P450基因超家族,按照P450基因的命名法则[10],可将其初步均归类为CYP6家族,并分别命名为phCYP6AN5、phCYP6B5和phCYP6ab,将序列信息提交至GenBank,获得GenBank登录号分别为KJ559411、KJ559412和KJ559413。

表 2 所得3条金纹细蛾P450序列的最佳匹配
表3中9条氨基酸序列与所得的3条氨基酸序列进行的同源性比对结果如图3所示。

表 3 不同物种9个P450基因片段的最佳匹配
由图3可知,这12条序列上游均含有对应引物的AGFETSST(残基1-8)区域,下游均含有对应引物的P(F/L)GEGPR(残基135-141)区域,氨基酸序列中部还含有P450蛋白的特征区域ExxR(残基69-72)和PERF(残基116-119)。

图 3金纹细蛾CYP6氨基酸序列与其他物种氨基酸序列比对结果
上游均含有对应引物的AGFETSST(残基1-8)区域,下游均含有对应引物的P(F/L)GEGPR(残基135-141)区域,
氨基酸序列中部还含有P450蛋白的特征区域ExxR(残基69-72)和PERF(残基116-119)。Ⅰ~Ⅲ和A1~A9代表的序列同表2和表3
Fig.3Comparison of acid sequences betweenPhyllonorycterringoniellaand other species
Upstream contains the corresponding primer AGFETSST (residues 1-8),downstream contains corresponding primer P(F/L)
GEGPR(residues 135-141),central amino acid sequence contains P450 protein characteristic regions ExxR (residues 69-72) and
PERF (residues 116-119).The suquenle of Ⅰ-Ⅲ and A1-A9 are the same with table 2 and 3
2.2药剂处理后金纹细蛾细胞色素P450基因表达的变化
2.2.1PCR产物熔解曲线及荧光定量PCR扩增效率的一致性研究采用荧光染料SYBR GreenⅠ作为实时定量PCR检测的荧光化学物质,由于它可以与任何双链DNA(如引物二聚体或非特异目标产物)结合,易产生假阳性信号[11]。因此,必须利用熔解曲线观察产物的生成情况,确认检测基因所用引物的特异性。本试验中所比较的3个P450基因和1个持家基因(β-actin)的熔解曲线都只有1个峰,表明其扩增产物只有1个。用cDNA系列稀释液测定这4个基因的荧光定量PCR扩增标准曲线,检测目标基因与持家基因扩增效率的一致性,结果见图4。从图4可以看出,各标准曲线的斜率一致,表明这3个P450基因的扩增效率是一致的,因此可以采用比较CT相对定量法(即2-ΔΔCT法)进行基因表达量的比较。
2.2.2细胞色素P450基因相对表达量的比较金纹细蛾3龄幼虫在氯氟氰菊酯LC50=12.88 mg/L条件下处理24 h后,其体内细胞色素P450基因的相对表达量如图5所示。由图5可见,细胞色素P450基因在未受到药剂处理和受到药剂处理条件下均有表达。phCYP6AN5基因在受到药剂处理后相对表达量显著上升,说明该药剂在LC50=12.88 mg/L条件下处理24 h后对phCYP6AN5基因起到一定诱导作用,而phCYP6B5和phCYP6ab在受到药剂处理后的相对表达量显著下降,说明该药剂处理24 h后,对这2个基因产生了抑制作用,并且前者大于后者。
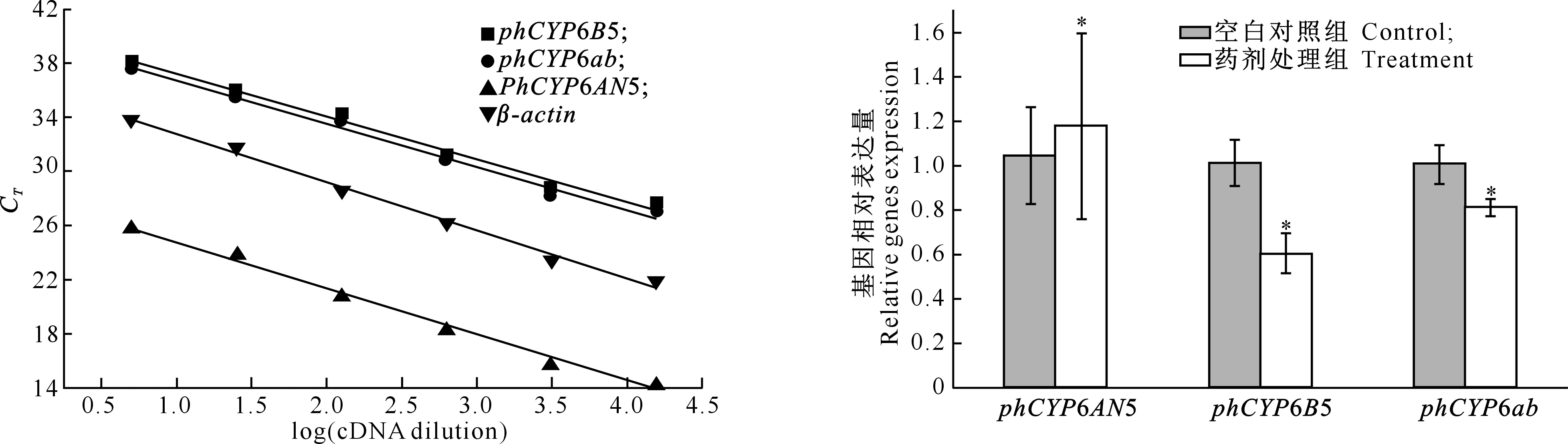
图 4金纹细蛾phCYP6AN5、phCYP6B5和phCYP6ab和
β-actin基因实时定量PCR扩增标准曲线
Fig.4Standard curves ofphCYP6AN5,phCYP6B5,and
phCYP6abofPhyllonorycterringoniellaand
β-actinby real-time PCR amplification
图 5金纹细蛾3龄幼虫细胞色素P450基因的
相对表达情况
*表示与空白对照组相比差异显著(P<0.05)
Fig.5Relative expression of cytochrome P450 genes of
Phyllonorycterringoniella3rd larvae exposed
Compared with blank control,* indicates significant
difference(P<0.05)
3讨论
本研究利用RT-PCT技术克隆得到3条金纹细蛾细胞色素P450 CYP6家族基因序列,同源性分析表明,3条基因序列与CYP6AN5、CYP6B5和CYP6ab氨基酸相似性分别为61%,59%和71%。
从第一个昆虫CYP6家族基因CYP6A1被分离鉴定,迄今为止,已有大量研究证明CYP6家族与昆虫的抗性密切相关。而这一特性与CYP6家族成员的作用底物密不可分。例如,家蝇(Muscadomestica) CYP6A1的诱导物为苯巴比妥和胡椒基丁醚[2];CYP6A2和CYP6D1的作用底物为苯巴比妥和吡虫啉[12];CYP6A8和CYP6A9的诱导底物为巴比妥[13];黑凤蝶(Papilioprotenor) CYP6B1和CYP6B3的诱导物为花椒毒素[14];棉铃虫(Helicoverpaarmigera) CYP6B2的诱导物则为薄荷油[15]。不同种类的诱导底物使得这些CYP6家族成员可以介导多种外源有害化合物的代谢。于是,对昆虫抗性的重视也使得CYP6家族成为过去几十年昆虫P450s研究的重点。本研究对金纹细蛾细胞色素CYP6家族基因进行克隆与分析,从而为后续对其抗性研究提供依据。
诱导剂的诱导作用存在一定程度的特异性,对某种或几种P450酶有效应的化合物并不一定诱导其他类型的P450。例如,家蝇CYP6A1 mRNA和CYP6D1编码的蛋白P450LPR均可被苯巴比妥(PB)和增效醚(pbo)诱导,但均不被萘、环戊二烯类(如狄氏剂或艾氏剂)、DDT诱导,而乙醇仅能诱导CYP6A1[16]。在黑凤碟(Papiliopolyxenes)中,CYP6B1只能被线性呋喃香豆素所诱导,而CYP6B3也可以被角型的呋喃香豆素诱导[17]。另外,同一诱导剂也可能同时对多种酶产生诱导,表现出诱导效应的重叠性。例如北美黑尾凤碟(Paliopolyxene)CYP6B1基因mRNA的诱导剂黄原毒素(xanthotoxin)[17],也可诱导P450LPR[16]。
本研究通过qRT-PCR技术研究发现,在LC50=12.88 mg/L的氯氟氰菊酯诱导处理24 h后,金纹细蛾体内不同细胞色素P450基因的相对表达量不同,可能是因为氯氟氰菊酯某种成分与这3种细胞色素P450基因的某些作用位点发生了结合,抑制或促进了相关基因的表达。至于细胞色素P450基因之间的具体功能和调控模式,以及在不同种类药剂或者同一种药剂不同质量浓度处理后是否具有同样的表达趋势,还需要进一步的探讨和研究。
[参考文献]
[1]程鹏,曹银光,公茂庆.细胞色素P450介导的昆虫抗药性研究进展 [J].中国病原生物学杂志,2009,4(1):62-65.
Cheng P,Cao Y G,Gong M Q.The progress of cytochrome P450 mediated insecticide resistance [J].Journal of Pathogen Biology,2009,4(1):62-65.(in Chinese)
[2]Feyerisen R.Insect P450 enzymes [J].Ann Rev Entomol,1999,44:507-533.
[3]孟芳,李鑫,张金钰,等.金纹细蛾及其优势寄生蜂主要行为的研究 [J].西北农林科技大学学报:自然科学版,2010,38(5):90-100.
Meng F,Li X,Zhang J Y,et al.Behaviors of the asiatic apple leaf-miner,LithocolletisringoniellaMats.and its dominant parasitic wasps [J].Journal of Northwest A&F University:Nat Sci Ed,2010,38(5):90-100.(in Chinese)
[4]马丽,刘玉玉,赵微微,等.陕西洛川苹果树冠金纹细蛾幼虫空间结构分析 [J].西北农林科技大学学报:自然科学版,2009,37(3):169-174.
Ma L,Liu Y Y,Zhao W W,et al.Spatial distribution pattern of larvae ofLithocolletisringoniellain the crown of apple trees [J].Journal of Northwest A&F University:Nat Sci Ed,2009,37(3):169-174.(in Chinese)
[5]陈秋霞,黄炯烈.昆虫细胞色素P450的诱导和抗药性 [J].热带医学杂志,2001,1(1):67-71.
Chen Q X,Huang J L.Induction and resistance of insect cytochrome P450 [J].Journal of Tropical Medicine,2001,1(1):67-71.(in Chinese)
[6]邱星辉,何凤琴,李梅.昆虫细胞色素P450研究的一些新进展 [J].生命的化学,2003,23(4):279-281.
Qiu X H,He F Q,Li M.Cytochrome P450 mediated insect resistance [J].Chemistry of Life,2003,23(4):279-281.(in Chinese)
[7]Shen B C,Zhao D X,Qiao C L,et al.Cloning of CYP9G2 from the diamondback moth,Plutellaxylostella(Lepidopera:Yponomeutidae) [J].DNA Sequence,2004,15(3):228-233.
[8]王强, 赵学平,吴长兴.柑桔潜叶蛾对两种拟除虫菊酯类杀虫剂的抗性测定 [J].浙江农业学报,1996,8(5):290-293.
Wang Q,Zhao X P,Wu C X.On resistance of citrus leafminer,Phyllocnistiscitrellastainton,to two pyrethroids and screening of new insecticides for its control [J].Acta Agriculturae Zhejiangensis,1996,8(5):290-293.(in Chinese)
[9]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J].Methods,2001,25(4):402-408.
[10]Nelson D R.The P450 superfamily:Update on new sequences,gene mapping,aaccession numbers,early trivial names of enzymes,and nomenclature [J].DNA and Cell Biology,1993,12:1-51.
[11]岳丽娜,杨亦桦,武淑文.棉铃虫P450基因CYP6AE12和CYP9A18的克隆与mRNA表达水平 [J].昆虫学报,2007,50(3):234-240.
Yue L N,Yang Y H,Wu S W.Cloning and mRNA expression levels of cytochrome P450 genes CYP6AE12 and CYP9A18 in the cotton bollworm,Helicoverpaarmigera(Hübner) [J].Acta Entomologica Sinica,2007,50(3):234-240.(in Chinese)
[12]Dunkov B C,Guzov V M,Mocelin G,et al.The drosophila cytochrome P450 gene CYP6A2:Structure,localization,heterologous expression,and induction by phénobarbita [J].DNA and Cell Biology,2011(16):1345-1356.
[13]Helviga C,Tijet N,Feyereisen R,et al.DrosophilamelanogasterCYP6A8,an insect P450 that catalyzes lauric acid (w-1)-hydroxylation [J].Biochemical and Biophysical Research Communications,2004,325:1495-1502.
[14]Wauthier V,Verbeeck R K,Calderon P B.The effect of ageing on cytochrome P450 enzymes:Consequences for drug biotrans-formation in the elderly [J].Curr Med Chem,2007,14:745-757.
[15]Feyereisen R.Insect CYP genes and P450 enzymes [J].Insect Biochem Molec Biol,2012:236-316.
[16]Scott J G.Cytochrome P450 monooxygenase-mediated resistance to insecticides [J].J Pestic Sci,1996,21:241-245.
[17]Prapaipong H,Berenbaum M R,Schuler M A.Transcriptional regulation of thePapiliopolyxenesCYP6B1 gene [J].Nucl Acid Res,1994,22:3201-3217.
Cloning and expression of cytochrome CYP6 gene fromPhyllonorycterringoniella
TIAN Tian,LI Xin,GUO Chang-ning,HOU Qian,WANG Guan-hua,YU Jian-guang
(CollegeofPlantProtection,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 This study cloned and identified cytochrome CYP6 gene from Phyllonorycter ringoniella,and observed the change of mRNA relative expression after cyhalothrin treatment to provide information for obtaining full length cDNA of CYP6 gene and preventing or delaying its drug resistance.【Method】 Degenerate primers were designed and synthesized based on the available coding region of CYP6 family genes in GenBank database.Blastx comparison on NCBI was conducted after getting the fragments by RT-PCR method,and they were named according to P450 gene nomenclature before being submitted to GenBank for registration number.At last,the relative expression of cytochrome P450 genes was quantified after the 3rd instars of Phyllonorycter ringoniella were disposed in cyhalothrin(LC50=12.88 mg/L)for 24 hours by spot method and qRT-PCR.【Result】 Three cDNA fragments with lengths of 415,412,and 421 bp were successfully obtained,and the similarities of amino acids were 61%,59% and 71%,respectively by homology analysis.They were named phCYP6AN5,phCYP6B5 and phCYP6ab and preliminarily grouped to CYP6 family.The login numbers of KJ559411,KJ559412 and KJ559413 were obtained from GenBank.The expression of phCYP6AN5 after treatment increased,while that of phCYP6B5 and phCYP6ab decreased.【Conclusion】 This study successfully constructed three cytochrome CYP6 family genes and they had specificity to inducing agents.The compounds that were effective to P450 enzyme may not necessarily work for other types of P450.
Key words:Phyllonorycter ringoniella;cytochrome P450;sequence analysis;gene expression
[文章编号]1671-9387(2016)01-0111-07
[中图分类号]Q785
[文献标志码]A
[通信作者]李鑫(1957-),男,陕西岐山人,副教授,博士,硕士生导师,主要从事果树害虫管理与农业标准化研究。
[作者简介]田甜(1988-),女,天津蓟县人,在读硕士,主要从事果树害虫分子生物学研究。
[基金项目]陕西省农业攻关项目(2008K01-04);世界银行资助项目(Y/SHYL/XY/050)
[收稿日期]2014-05-23
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.017
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.034.html
E-mail:tian14720962@hotmail.com
E-mail:Lixin57@hotmail.com
