NAFLD发病中基因FXR对PPAR-α影响的实验研究
2016-06-01邱睿睿周永健聂玉强杜艳蕾李瑜元
邱睿睿,周永健,聂玉强,杜艳蕾,李瑜元
广州医科大学附属市一医院,广东 广州 510180
论著·肝脏疾病
NAFLD发病中基因FXR对PPAR-α影响的实验研究
邱睿睿,周永健,聂玉强,杜艳蕾,李瑜元
广州医科大学附属市一医院,广东 广州 510180
目的 观察法尼基衍生物X受体(FXR)在非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的发病过程中对过氧化物酶体增殖物活化受体-α(PPAR-α)表达的影响。方法 将正常小鼠与FXR基因敲除小鼠分成4组,分别喂高脂饲料及普通饲料,检测各组小鼠血清ALT、TC、TG,观察肝脏脂肪变性情况,检测肝脏PPAR-α mRNA及蛋白表达情况。结果 模型组血清指标均较实验组显著升高(P<0.05),肝脏HE染色见肝脏内有大量脂肪滴,部分可见炎症细胞聚集,PPAR-α mRNA及蛋白表达水平均明显升高(P<0.05)。结论 FXR基因功能缺陷可能通过上调PPAR-α的表达并改变其在脂质代谢中的功能而引起NAFLD的发生。
非酒精性脂肪性肝病;法尼基衍生物X受体;过氧化物酶体增殖物活化受体-α
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确的损肝因素所致的脂肪性肝病[1-2]。而近年来,越来越多的研究[3]证明NAFLD的发病机制与代谢性核受体有着密不可分的关系。
核受体是一组调节复杂基因网络活性的细胞内转录因子,在真核细胞的发育、分化、能量代谢平衡等方面发挥了重要作用。与肝脏脂质代谢密切相关的孤儿核受体主要包括PPARs(过氧化物酶体增殖物活化受体家族)、FXR(法尼基衍生物X受体)、LXR(肝X受体)、RXR(类视黄醇X受体)。其中,胆汁酸是FXR的内源性配体,主要通过CYP7A1、Ntcp、Bsep等重要的靶基因对胆汁酸的合成与转运进行调节[4],还可以通过抑制PCSK9的活动从而减少血浆中胆固醇的浓度[5],对于血脂代谢的调节也具有一定的作用。既往在NAFLD患者中曾发现FXR的表达显著降低[6],激活FXR以后可以改善高脂血症、2型糖尿病及脂肪性肝炎[7]。
PPARs主要功能是调控体内脂质代谢。肝内PPAR-α的主要作用是促进肝内脂肪酸β氧化,通过诱导脂酰辅酶A合成酶、肉碱棕榈酰转移酶1等减少肝脏甘油三酯的沉积[8]。既往有研究发现NAFLD患者肝脏PPAR-α mRNA表达降低[9]。在PPAR-α基因敲除的小鼠体内可检测到血脂代谢紊乱,从而导致了NAFLD发生[10]。但是也有研究发现在野生型小鼠中胰岛素抵抗的表现较PPAR-α基因敲除小鼠明显[11],且在高龄的NAFLD大鼠中检测到PPAR-α的表达较正常大鼠明显升高[12]。
在胆汁淤积孕鼠的肝脏中发现,FXR表达明显升高但PPAR-α的表达却下降[13]。而在新鲜的人类皮脂腺中,能够检测到PPAR-α的表达却检测不到FXR的表达[14],说明在一些肝脏疾病或脂质代谢相关疾病中FXR与PPAR-α的表达可能具有相关性,但是二者在NAFLD的发病中是否有着相互关系则还有待研究,因此本实验将检测FXR在NAFLD的发病过程中是否会对PPAR-α的表达产生影响,以了解上述两种因素是否具有相关性,为今后的临床诊治工作提供参考。
1 材料与方法
1.1 实验材料 2个月龄FXR基因敲除C57/BL小鼠由上海中医药大学提供(引自美国国家卫生研究所),饲养于广州医科大学实验动物中心。正常2个月龄野生型C57/BL小鼠及高脂饲料(按质量构成比由普通级饲料82.5%,猪油10%,蔗糖5%,胆固醇2%,胆盐0.3%,丙硫氧嘧啶0.2%配制而成)[15]购自广东省医学实验动物中心。组织RNA提取试剂盒(TaKaRa RNA Extraction Kit)、逆转录试剂盒(PrimeScript RT Master Mix)、实时荧光定量试剂盒(SYBR Premix Ex Taq Ⅱ)均购自大连宝生物工程TaKaRa有限公司。组织蛋白提取试剂盒购自上海碧云天生物技术有限公司,PPAR-α一抗购自美国SANTA CRUZ生物有限公司,二抗购自武汉博士德生物工程有限公司,内参抗体GAPDH购自杭州贤至生物科技有限公司。
1.2 动物饲养与分组 正常2个月龄野生型C57/BL小鼠16只(对照组8只、实验组8只)和2个月龄FXR基因敲除C57/BL小鼠16只(模型组8只、观察组8只),其中实验组及模型组予高脂饲料喂养,对照组及观察组予普通饲料喂养,共8周。
1.3 观察项目 检测各组小鼠血清丙氨酸氨基转移酶(ALT)、甘油三酯(TG)、总胆固醇(TC)水平;肝脏组织HE染色观察肝细胞形态;提取肝脏细胞总RNA、蛋白等。
1.4 肝脏HE染色 取肝脏组织按照实验要求处理后经过固定、冲洗、脱水、透明、浸蜡、包埋、切片、烘干、脱蜡、HE染色、封片后,光镜下阅片。
1.5 PPAR-α mRNA表达检测 取10 mg肝脏组织,按照TaKaRa说明书进行mRNA提取、逆转录等步骤进行实验操作,然后取2 μl cDNA为模版,根据SYBR法进行PCR扩增。参考相关文献[16],使用Primer 5.0软件设计引物,扩增条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环44次,采用2-△△CT法分析目的基因的相对表达量。相关引物序列如表1所示。

表1 小鼠PPAR-α目的基因RT-PCR引物序列及扩增长度Tab 1 PPAR-α RT-PCR primer sequence in mice
1.6 PPAR-α蛋白表达量检测 按照碧云天公司蛋白提取试剂盒说明书进行核蛋白提取,根据说明书配制分离胶和浓缩胶,经过电泳、转膜、孵育等操作后在暗房进行显影曝光,并对各组样本蛋白表达量进行分析比较。
1.7 统计学处理 采用SPSS 17.0统计软件进行分析,多组间比较用One way-ANOVA分析,组间比较使用Student-Newman-Keulsq检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体质量及血清生化指标比较 模型组较观察组小鼠体质量明显增加,实验组与对照组比较,体质量明显减少(P<0.05),而模型组与实验组体质量差异无统计学意义(P>0.05)。血清生化指标方面,模型组与实验组相比较,血清ALT、TG、TC等指标及肝脏指数均明显升高(P<0.05);实验组与对照相比较,血清ALT、TC等指标及肝脏指数也明显升高(P<0.05,见表2)。
2.2 肝脏HE染色结果 对照组小鼠肝脏细胞边缘规则,界限清晰,光镜下肝细胞浆内未见脂肪滴,核仁无偏移(见图1A、2A);实验组小鼠肝脏增大,边缘稍钝,细胞浆内有较多脂滴,提示小鼠脂肪肝模型成功建立(见图1B、2B);模型组小鼠肝脏肉眼可见边缘圆钝,呈金黄色改变,镜下见大量脂肪滴聚集,伴有肝细胞肿胀、增大,部分可见淋巴细胞聚集,提示肝脏存在炎症改变(见图1C、2C);观察组小鼠肝脏体积较模型组减小,呈深红色,边缘稍锐利,镜下见少量脂肪滴,肝细胞排列较整齐,无炎症细胞聚集(见图1D、2D)。
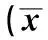
表2 各组小鼠体质量及血清生化指标比较 ±s)Tab 2 The comparison of weigh and serum indexes in different groups of mice ±s)
注:与对照组比较,*P<0.05;与实验组比较,**P<0.05。

图1 各组小鼠肝脏肉眼外观图 A:对照组;B:实验组;C:模型组;D:观察组Fig 1 Liver histology in different groups of mice A: control group; B: experiment group; C: model group; D: observation group

图2 各组小鼠肝脏HE染色病理切片(40×) A:对照组;B:实验组;C:模型组;D:观察组Fig 2 HE staining of mice livers biopsy (40×) A: control group; B: experiment group; C: model group; D: observation group
2.3 各组小鼠PPAR-α mRNA相对表达水平 与对照组(1.521±1.162)相比,实验组PPAR-α mRNA表达降低(0.819±0.485),差异有统计学意义(P<0.05)。与实验组相比,模型组PPAR-α mRNA表达水平(2.687±1.907)明显升高(P<0.05),观察组肝脏组织表达水平(1.827±1.446)也较对照组表达水平升高,提示在FXR基因敲除小鼠中PPAR-α表达升高。
2.4 各组小鼠PPAR-α蛋白表达水平 实验组小鼠PPAR-α蛋白表达(0.505±0.276)较对照组(0.566±0.153)减少(P<0.05)。与实验组相比,模型组PPAR-α蛋白表达水平(0.696±0.027)明显升高(P<0.05),而观察组蛋白水平(0.646±0.008)则较模型组下降,但仍高于对照组(P<0.05,见图3、图4)。

注:A:对照组;B:实验组;C:模型组;D:观察组。图3 内参蛋白;图4 PPAR-α蛋白Fig 3 GAPDH; Fig 4 PPAR-α
2.5 扩增产物特异性 图5、图6是PPAR-α、β-actin扩增曲线图,呈S型曲线;图7、图8可见PPAR-α、β-actin融解曲线呈单一峰,说明扩增产物特异性好。

图5 小鼠PPAR-α扩增曲线;图6 小鼠β-actin扩增曲线Fig 5 Amplification curve of PPAR-α; Fig 6 Amplification curve of β-actin

图7 小鼠PPAR-α融解曲线Fig 7 Melting curve of PPRA-α

图8 小鼠β-actin融解曲线Fig 8 Melting curve of β-actin
3 讨论
NAFLD作为慢性肝病的一种,除了有由于肝细胞变性引起肝功能受损的表现以外,通常还可伴随有高脂血症、高血压、体质量超重、血糖异常等代谢综合征的表现。既往不少NAFLD动物模型实验中都发现使用高脂饲料造成的NAFLD动物模型其体质量都会较正常饲料喂养的动物显著增加,然而在我们的实验中,实验结束时,我们却发现高脂饲料喂养的动物体质量均较正常饲料喂养的动物体质量有所减轻,但是肝脏指数却明显增加,病理切片显示肝细胞脂肪沉积,血清ALT、TG、TC均升高,提示NAFLD动物模型成功建立。本研究中选用的高脂饲料中含有丙硫氧嘧啶,虽然能抑制体内脂肪分解,促进内脏脂质沉积,但由于其口感偏苦,使小鼠进食量减少,食物热量摄入减少而出现体质量较普通饲料喂养的小鼠减轻。
本研究采用RT-PCR和Western blotting检测各组小鼠肝脏中PPAR-α mRNA及蛋白的表达情况。结果表明,与对照组相比,实验组小鼠肝脏PPAR-α mRNA及蛋白均明显减少,但是在FXR基因敲除小鼠中却发现其肝脏PPAR-α mRNA和蛋白的表达均较对照组及实验组明显升高,提示FXR基因功能缺陷可能对PPAR-α的表达产生双向影响,使PPAR-α在NAFLD中的表达升高,但血清ALT、TC却比正常NAFLD小鼠明显升高,且基因敲除小鼠的肝脏脂肪变性及炎症反应均较野生型小鼠严重,我们猜测可能是因为PPAR-α在调控脂质代谢的通路中受到FXR功能缺陷的影响,影响其下游表达,使其出现一个类似负反馈表现的表达升高,但不能对肝脏脂肪变性起到保护作用,反而促进了NAFLD的疾病进展。也有可能是FXR通过其他方面如表观遗传学方面影响PPAR-α基因的功能,上调PPAR-α表达等[17]。至于是哪个环节受到影响则需要行下一步的基因功能验证来确定。
综上所述,由于FXR基因功能缺陷对PPAR-α的表达具有双向影响,FXR的表达与PPAR-α的表达可能具有负相关关系,因此,通过改善FXR功能以后再给予PPAR-α相关激动剂对于NAFLD的治疗可能会有更佳的效果。
[1]Liu F. Advances in diagnosis and treatment of non-alcoholic fatty liver disease [J]. China Modern Medicine,2011,18(21): 20-21. 刘芳. 非酒精性脂肪肝的诊治新进展[J]. 中国当代医药,2011,18(21): 20-21.
[2]Byrne CD. Dorothy Hodgkin Lecture 2012:non-alcoholic fatty liver disease,insulin resistance and ectopic fat: a new problem in diabetes management [J]. Diabet Med,2012,29(9): 1098-1107.
[3]Adorini L,Pruzenski M,Shapiro D. Farnesoid X receptor targeting to treat nonalcoholic steatohepatitis [J]. J Drug Discov Today,2012,17(17-18): 988-997.
[4]Zhang MY,Li B,Xia XM. Relationship between nuclear receptor FXR and bile acid metabolism in related disorders [J]. The Journal of Practical Medicine,2010,26(24): 4611-4613. 张孟瑜,李波,夏先明. 核受体FXR与胆汁酸代谢及相关疾病的关系[J]. 实用医学杂志,2010,26(24): 4611-4613.
[5]Langhi C,Le May C,Kourimate S,et al. Activation of the farnesoid X receptor represses PCSK9 expression in human hepatocytes [J]. FEBS Lett,2008,582(6): 949-955.
[6]Yang ZX,Shen W,Sun H. Effects of nuclear receptor FXR on the regulation of liver lipid metabolism in patients with non-alcoholic fatty liver disease [J]. Hepatol Int,2010,4(4): 741-748.
[7]Cariou B. The farnesoid X receptor (FXR) as a new target in non-alcoholic steatohepatitis [J]. Diabetes Mateb,2008,34(6 Pt 2): 685-691.
[8]Rodríguez-Vilarrupla A,Lavina B,García-Calderó H,et al. PPARα activation improve endothelial dysfunction and reduces fibrosis and portal pressure in cirrhotic rats [J]. J Hepatol,2012,56(5): 1033-1039.
[9]Abdelmegeed MA,Yoo SH,Henderson LE,et al. PPARalpha expression protects male mice from high fat-induced nonalcoholic fatty liver [J]. J Nutr,2011,141(4): 603-610.
[10]Lee SS,Pineau T,Drago J,et al. Targeted disruption of the alpha isoform of the peroxisome proliferator-activated receptor gene in mice results in abolishment of the pleiotropic effects of peroxisome proliferators [J]. Mol Cell Biol,1995,15(6): 3012-3022.
[11]Cha DR,Han JY,Su DM,et al. Peroxisome proliferator-activated receptor-alpha deficiency protects aged mice from insulin resistance induced by high-fat diet [J]. Am J Nephrol,2007,27(5): 479-482.
[12]Yeon JE,Choi KM,Baik SH,et al. Reduced expression of peroxisome proliferator-activated receptor-alpha may have an important role in the development of non-alcoholic fatty liver disease [J]. J Gastroenterol Hepatol,2004,19(7): 799-804.
[13]Shi QY,Lin YG,Zhou X,et al. Expression of FXR mRNA,PPAR alpha mRNA and bile acid metabolism related genes in intrahepatic cholestasis of pregnant rats [J]. Chin J Hepatol,2010,18(12): 927-930. 时青云,林宇庚,周新,等. 胆汁酸代谢主要调节核受体和相关基因在胆汁淤积孕鼠肝脏中的表达[J]. 中华肝脏病杂志,2010,18(12): 927-930.
[14]Downie MM,Sanders DA,Maier LM,et al. Peroxisome proliferator-activated receptor and farnesoid X receptor ligands differentially regulate sebaceous differentiation in human sebaceous gland organ cultures in vitro [J]. Br J Dermatol,2004,151(4): 766-775.
[15]Zeng CH,Zeng P,Deng YH,et al. The effects of curcumin derivatives on experimental steatohepatitis [J]. Chin J Hepatol,2011,19(6): 454-459. 曾春华,曾萍,邓艳红,等. 姜黄素衍生物对实验性非酒精性脂肪性肝炎的治疗作用[J]. 中华肝脏病杂志,2011,19(6): 454-459.
[16]Li Y,Ling WH. Effect of diet with high fats and cholesterol on PPARα gene expression and body cholesterol level in mice [J]. Chinese Journal of Pathophysiology,2006,22(7): 1311-1315. 李燕,凌文华. 高脂高胆固醇膳食对小鼠PPARα基因表达及机体胆固醇水平的影响[J]. 中国病理生理杂志,2006,22(7): 1311-1315.
[17]Tang D,Zhou YJ,Li YY,et al. The effects of curcumin on the demethylation of peroxisome proliferator-activated receptor-α of steatosis cells [J]. Guangdong Medical Journal,2014,35(2): 175-179. 唐丹,周永健,李瑜元,等. 姜黄素对脂肪变性肝细胞过氧化物酶体增殖物活化受体-α的去甲基化作用[J].广东医学,2014,35(2): 175-179.
(责任编辑:王全楚)
Experimental study of gene FXR for PPAR-α effects in the pathogenesis of NAFLD
QIU Ruirui,ZHOU Yongjian,NIE Yuqiang,DU Yanlei,LI Yuyuan
Guangzhou First People’s Hospital,Guangzhou Medical University,Guangzhou 510180,China
Objective To investigate whether FXR is correlated with the change of PPAR-α expression in non-alcoholic fatty liver disease (NAFLD).Methods Normal mice and FXR deficiency mice were divided into four groups (control group,experiment group,model group,observation group),which were fed with chow diet or high-fat diet for 8 weeks. Then biochemical assays were used to access the serum ALT,TG,TC. Livers FXR expression and PPAR-α expression were also detected.Results Serum biochemical assays were higher in model group,as well as PPAR-α mRNA and protein expression in livers compared with experiment group (P<0.05). Moreover,HE staining showed lots of fatty droplets and lymphocyte in livers in model group,which indicated liver dysfunction and NASH-like changes.Conclusion During NAFLD development,FXR maybe have a negative correlation with PPAR-α which regulates downstream genes.
Non-alcoholic fatty liver disease; Farnesoid X receptor; Peroxisome proliferator activated receptor-α

广州市卫生局重大疾病综合防治(2014Y2-000139);广州市医药卫生科技重点项目(2009-ZDi-03)
邱睿睿,硕士,研究方向:非酒精性脂肪性肝病。E-mail:815531221@qq.com
周永健,博士,主任医师,硕士生导师,研究方向:非酒精性脂肪肝。E-mail: zhouyongjian1968@163.com
10.3969/j.issn.1006-5709.2016.02.011
R575
A
1006-5709(2016)02-0159-05
2015-04-16
