miR-504在原发性肝细胞癌中的表达及其临床意义
2016-06-01许晓梅韩建雄
童 霞 许晓梅 叶 颖 韩建雄
成都市第五人民医院消化内科(611130)
miR-504在原发性肝细胞癌中的表达及其临床意义
童霞*许晓梅叶颖韩建雄
成都市第五人民医院消化内科(611130)
背景:microRNA表达失调与肿瘤的形成相关。miR-504在多种肿瘤中表达,但在肝癌中的表达目前尚未见相关报道。目的:探讨miR-504在原发性肝细胞癌(HCC)和肝癌细胞株中的表达及其与预后的关系。方法:收集85例HCC患者手术标本,常规培养5株肝癌细胞株和永生化肝细胞株。以CCK8法检测miR-504表达对HepG2细胞增殖的影响,实时荧光定量PCR法检测miR-504表达,分析miR-504表达与HCC患者临床病理特征和预后的关系。结果:与正常肝细胞相比,5种肝癌细胞中miR-504表达显著降低(P<0.05)。上调miR-504表达明显抑制HepG2细胞增殖,而下调miR-504表达则促进细胞增殖。HCC患者miR-504表达显著低于相应癌旁组织,且与肿瘤分化程度(P=0.002)、TNM分期(P=0.021)、甲胎蛋白(P=0.012)和门静脉癌栓(P=0.003)密切相关,但与患者的性别、年龄、肿瘤大小、肿瘤数量无关。miR-504低表达者的生存时间较高表达者明显缩短(P<0.05)。结论:miR-504在HCC中表达下调,其表达与患者的临床预后相关,提示miR-504可作为判断HCC患者预后的独立预测因子。
关键词癌,肝细胞;miR-504;细胞增殖;预后
Expression and Clinical Significance of miR-504 in Primary Hepatocellular Carcinoma
TONGXia,XUXiaomei,YEYing,HANJianxiong.
DepartmentofGastroenterology,ChengduFifthPeople’sHospital,Chengdu(611130)
Background: Dysregulation of microRNA expression is involved in the carcinogenesis of many tumors, expression of miR-504 has been observed in many tumors, but its expression in primary hepatocellular carcinoma (HCC) has not been reported. Aims: To explore the expression and clinical significance of miR-504 in HCC tissues and cells. Methods: Tumor and para-cancerous tissue in 85 HCC patients were collected. Five liver cancer cell lines and immortalized liver cell line were conventionally cultured. Effect of miR-504 expression on HepG2 cells proliferation was determined by CCK8 assay. The expression of miR-504 was determined by real time fluorescent quantitative PCR. Relationships between expression of miR-504 and clinicopathological features and prognosis of HCC patients were analyzed. Results: Compared with normal liver cells, expression of miR-504 was significantly downregulated in five liver cancer cells (P<0.05). Up-regulation of miR-504 inhibited proliferation of HepG2 cells, and down-regulation of miR-504 promoted proliferation of HepG2 cells. miR-504 expression in tumor tissue was significantly decreased than that in corresponding para-cancerous tissue. Expression of miR-504 was correlated with tumor differentiation (P=0.002), TNM stage (P=0.021), alpha fetoprotein (P=0.012) and portal vein tumor thrombus (P=0.003), but not with gender, age, tumor size and tumor number. Survival in HCC patients with lower miR-504 expression was significantly shorter than that in patients with high expression (P<0.05). Conclusions: Expression of miR-504 is downregulated in HCC, and is correlated with the prognosis of patients, suggesting that miR-504 can be used as an independent predictor for prognosis of HCC patients.
Key wordsCarcinoma, Hepatocellular;miR-504;Cell Proliferation;Prognosis
原发性肝细胞癌(hepatocellular carcinoma, HCC)是全球死亡率居前列的恶性肿瘤,亦是我国常见的恶性肿瘤。HCC的发生、发展是包括原癌基因激活或(和)抑癌基因失活在内的多阶段多步骤过程。越来越多的研究表明,除HCC内蛋白编码基因的变异,miRNAs表达失调亦会促进HCC的发生[1-3]。miRNAs是一类长约19~25个核苷酸的小分子非编码RNA,进化上具有保守性,能以不完全方式与mRNA分子的3’UTR区结合,在转录和转录后水平上抑制靶基因表达,在细胞生长、增殖、发育和凋亡过程中发挥重要作用,与多种肿瘤的发生、发展相关[4-5]。Kikkawa等[6]发现,miRNA-504(miR-504)通过靶向CDK6抑制下咽部鳞状细胞癌的增殖;Hu等[7]发现miR-504表达与p53呈负相关,是肿瘤形成中的重要miRNAs;Zhao等[8]发现miR-504通过下调核呼吸因子1表达,导致鼻咽癌放射抵抗。然而,miR-504在HCC中的表达及其意义目前尚未见相关报道。本研究通过检测HCC细胞和组织中miR-504表达,旨在分析其临床意义,从而为miR-504用于HCC的诊断、治疗提供理论依据。
材料与方法
一、资料来源
收集2009年1年—2011年1月成都市第五人民医院肝胆外科行手术切除的85例HCC患者的肿瘤和癌旁组织标本,诊断均由术后病理学确诊。所有患者均签署知情同意书,临床资料完整。术前均未行放化疗、介入治疗等抗肿瘤治疗。所有患者均接受一般情况、临床症状和影像学检查的随访,随访方式为电话、门诊和住院随访。随访起点为病理确诊日期,末次随访时间为2015年7月31日,至末次随访时,存活病例47例,死亡38例,无失访病例。本研究方案经我院伦理委员会批准。
二、细胞培养
永生化正常肝细胞株L02和5株肝癌细胞株(HepG2、MHCC97H、MHCC97L、PLC、MHCC-LM3)均购自中国科学院上海细胞生物学研究所。使用含10% FBS的RPMI-1640细胞培养液培养L02细胞株;5株肝癌细胞株用含10% FBS的高糖DMEM培养液培养。细胞置于37 ℃ 5% CO2培养箱中进行培养。
三、细胞增殖的检测
采用LipofectamineTM2000(Invitrogen公司)将miR-504 mimics和inhibitor以及阴性对照转染HepG2细胞,以CCK8法(上海碧云天生物技术公司)检测细胞增殖的变化。
四、实时荧光定量PCR
提取组织和细胞中的总RNA,逆转录成cDNA。实时荧光定量PCR采用2×SYBR Green PCR Master Mix[宝生物工程 (大连) 有限公司],取适量cDNA作为模板,引物浓度0.4 μmol/L,15 μL体系进行扩增,每个样本设置3个平行复孔。由上海吉玛制药技术有限公司合成用于特异扩增的miRNAs引物,直接使用目标miRNAs的成熟序列,参照Sanger miRBase数据库。以U6 snRNA作为内参,上实时定量PCR反应仪。miR-504引物上游:5’-AGA CCC TGG TCT GCA CTC TAT C-3’,下游:5’-GCG AGC ACA GAA TTA ATA CGA C-3’;U6引物上游:5’-GCA AGG ATG ACA CGC AAA T-3’,下游:5’-GCG AGC ACA GAA TTA ATA CGA C-3’。实验重复3次,采用2-△△Ct法计算基因表达。
五、统计学分析
采用SPSS 13.0统计软件。计量资料的比较采用t检验或方差分析,计数资料的比较采用χ2检验,生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
结果
一、miR-504在肝癌细胞株中的表达
与永生化肝细胞株L02相比,miR-504在5株肝癌细胞株中的表达明显降低(P<0.05)(图1)。
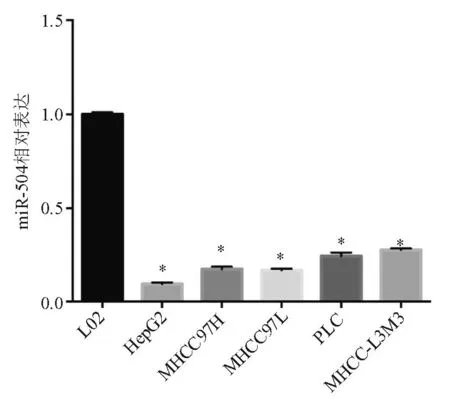
*P<0.05
图1miR-504在永生化肝细胞株L02和不同肝癌细胞株中的表达
二、HepG2细胞增殖
转染miR-504 mimics后,miR-504表达上调了17.89倍,细胞增殖速度减慢;转染miR-504 inhibitor后,miR-504表达下调了80.81%,细胞增殖加快(图2),组间细胞增殖差异有统计学意义(P<0.01)。
三、miR-504表达与HCC预后的关系
与癌旁组织相比,HCC组织中miR-504表达明显降低(1.00±0.09对6.74±1.02,P<0.05)。
根据miR-504表达情况,将HCC患者分为miR-504高表达组 (2-△△Ct>1) 和低表达组 (2-△△Ct≤1)。
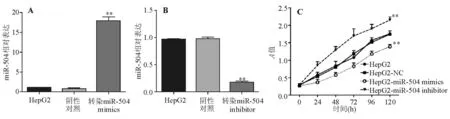
**P<0.01
miR-504表达与肿瘤分化程度(P=0.002)、TNM分期(P=0.021)、甲胎蛋白(P=0.012)和门静脉癌栓(P=0.003)相关,而与患者的性别、年龄、HBV、肿瘤大小、肝硬化、肿瘤数量无关(表1)。
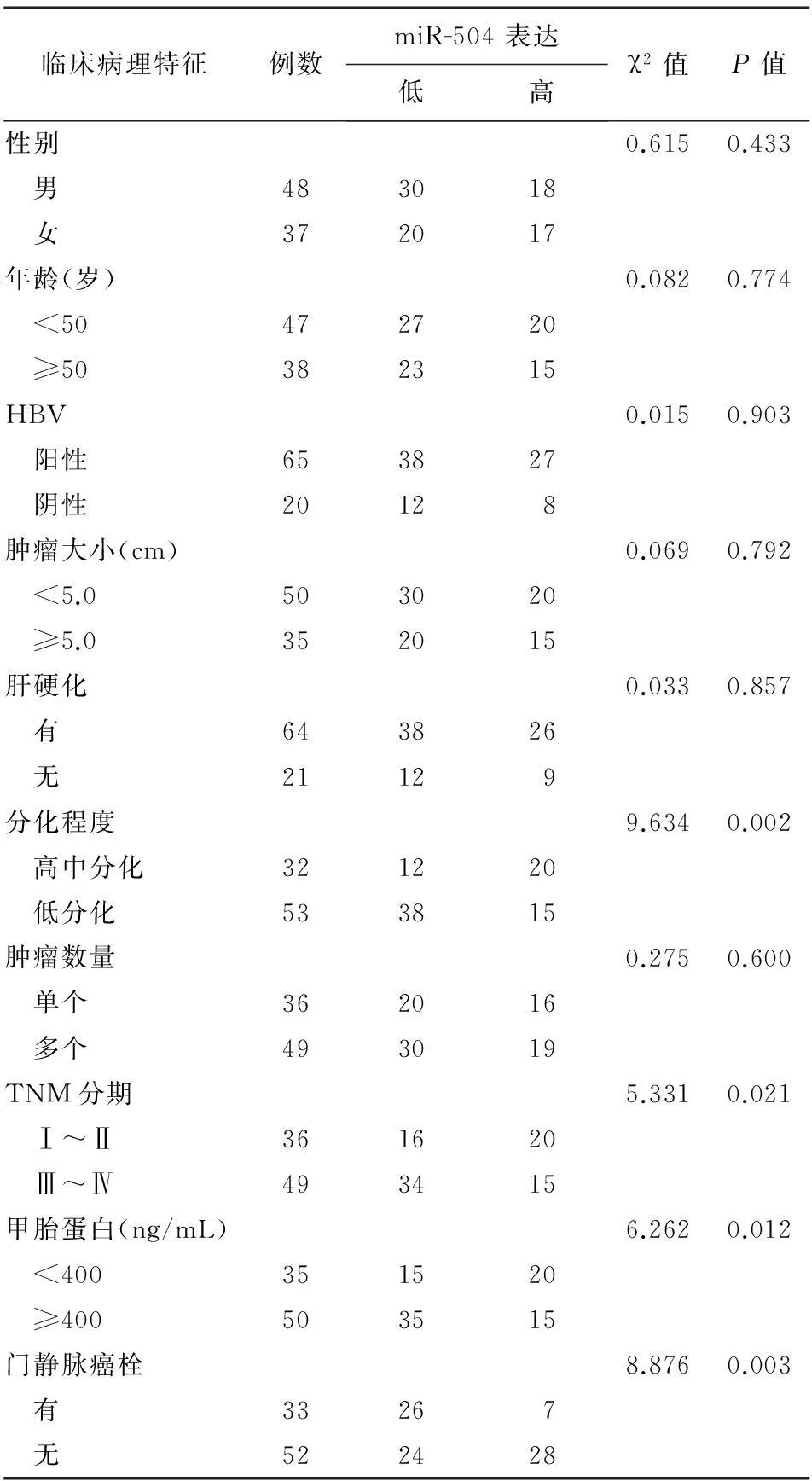
表1 miR-504表达与HCC患者临床病理特征的相关性(n)
四、miR-504表达对患者生存时间的影响
Kaplan-Meier分析显示,miR-504高表达者的生存时间较低表达者明显延长(χ2=27.246,P<0.001)(图3)。
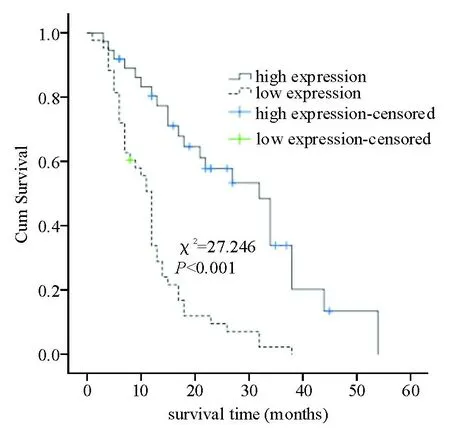
图3miR-504表达与HCC患者生存时间的关系(Kaplan-Meier法)
讨论
HCC病情进展极快,且具有发病隐匿的特点,多数患者诊断为HCC时已出现了肝内或肝外转移,从而丧失了接受根治性手术的机会;少部分患者由于早期发现、早期诊断并接受及时治疗而获得了较长的生存时间[9]。因此,HCC的及时诊断是决定患者治疗效果和生存时间的重要因素。目前已有多种分子标记物用于HCC的诊断,但存在敏感性低、特异性不足的问题,因此寻找敏感性好、特异性高的肿瘤标记物是目前肝癌研究领域中迫切需要解决的问题。
miRNAs与人体的生理活动和疾病发生紧密相关,可作为癌基因或抑癌基因调控肿瘤的发生和发展[10]。由于miRNAs在不同肿瘤中具有明显差异的表达模式,因此有望将其作为肿瘤诊断标记物或评估预后[11]。目前研究发现多种miRNAs参与调节HCC增殖、凋亡、分化、转移等多种生物学过程,与HCC的发生、发展密切相关,这些异常表达的miRNAs包括miR-1、miR-21、miR-221、miR-222、miR-224、miR-301、let-7a、miR-139a、miR-143、miR-195、miR-26、miR-29和miR-199a/b-3p等[12]。研究报道miR-504可靶向抑制抑癌基因p53[13-14],提示其具有促癌作用;此外,结缔组织生长因子(CTGF)可明显下调miR-504表达,miR-504通过靶向作用于转录因子FOXP1促进口腔鳞状细胞癌的细胞迁移和侵袭[15];但miR-504可靶向下调细胞周期蛋白依赖性激酶CDK6,抑制下咽部鳞状细胞癌增殖[6]。上述研究结果差异可能是由于miR-504表达的时序性和组织特异性所致。
然而,miR-504在肝癌中的作用及其机制目前国内外尚未见相关报道。本研究发现miR-504在HCC细胞中的表达显著下降。上调miR-504表达可明显降低细胞增殖能力,下调表达的作用则相反。为进一步验证miR-504在HCC中的表达和临床意义,对85例HCC患者肿瘤组织和癌旁组织中miR-504表达进行检测,结果显示肿瘤组织中miR-504表达显著下调,且与肿瘤分化程度、TNM分期、甲胎蛋白和门静脉癌栓密切相关,但与性别、年龄、HBV、肿瘤大小、肝硬化和肿瘤数量无关;miR-504低表达者的生存时间较高表达者明显缩短。说明miR-504表达在正常肝脏中发挥重要作用,并与HCC患者预后相关。然而,关于miR-504在HCC中的生物学功能及其具体作用机制有待进一步研究。
参考文献
1 Lyra-González I, Flores-Fong LE, González-García I, et al. MicroRNAs dysregulation in hepatocellular carcinoma: Insights in genomic medicine[J]. World J Hepatol, 2015, 7 (11): 1530-1540.
2 Song Y, Wang F, Huang Q, et al. MicroRNAs contribute to hepatocellular carcinoma[J]. Mini Rev Med Chem, 2015, 15 (6): 459-466.
3 Xie KL, Zhang YG, Liu J, et al. MicroRNAs associated with HBV infection and HBV-related HCC[J]. Theranostics, 2014, 4 (12): 1176-1192.
4 Notari M, Pulecio J, Raya. Update on the pathogenic implications and clinical potential of microRNAs in cardiac disease[J]. Biomed Res Int, 2015, 2015: 105620.
5 Orellana EA, Kasinski AL. MicroRNAs in cancer: A historical perspective on the path from discovery to therapy[J]. Cancers (Basel), 2015, 7 (3): 1388-1405.
6 Kikkawa N, Kinoshita T, Nohata N, et al. microRNA-504 inhibits cancer cell proliferation via targeting CDK6 in hypopharyngeal squamous cell carcinoma[J]. Int J Oncol, 2014, 44 (6): 2085-2092.
7 Hu W, Chan CS, Wu R, et al. Negative regulation of tumor suppressor p53 by microRNA miR-504[J]. Mol Cell, 2010, 38 (5): 689-699.
8 Zhao L, Tang M, Hu Z, et al. miR-504 mediated down-regulation of nuclear respiratory factor 1 leads to radio-resistance in nasopharyngeal carcinoma[J]. Oncotarget, 2015, 6 (18): 15995-16018.
9 Attwa MH, El-Etreby SA. Guide for diagnosis and treatment of hepatocellular carcinoma[J]. World J Hepatol, 2015, 7 (12): 1632-1651.
10Ohtsuka M, Ling H, Doki Y, et al. MicroRNA processing and human cancer[J]. J Clin Med, 2015, 4 (8): 1651-1667.
11Hollis M, Nair K, Vyas A, et al. MicroRNAs potential utility in colon cancer: Early detection, prognosis, and chemosensitivity[J]. World J Gastroenterol, 2015, 21 (27): 8284-8292.
12Callegari E, Gramantieri L, Domenicali M, et al. MicroRNAs in liver cancer: a model for investigating pathogenesis and novel therapeutic approaches[J]. Cell Death Differ, 2015, 22 (1): 46-57.
13Soutto M, Chen Z, Saleh MA, et al. TFF1 activates p53 through down-regulation of miR-504 in gastric cancer[J]. Oncotarget, 2014, 5 (14): 5663-5673.
14Kumar M, Lu Z, Takwi AA, et al. Negative regulation of the tumor suppressor p53 gene by microRNAs[J]. Oncogene, 2011, 30 (7): 843-853.
15Yang MH, Lin BR, Chang CH, et al. Connective tissue growth factor modulates oral squamous cell carcinoma invasion by activating a miR-504/FOXP1 signalling[J]. Oncogene, 2012, 31 (19): 2401-2411.
(2015-08-26收稿;2015-09-19修回)
DOI:10.3969/j.issn.1008-7125.2016.04.003
*Email: 2892615414@qq.com
