miR-181b在结肠炎相关结肠癌发生过程中的表达*
2016-06-01贺龙梅赵新华马怡茗汪红英
贺龙梅 赵新华 马怡茗 汪红英
国家癌症中心/中国医学科学院 北京协和医学院肿瘤医院分子肿瘤学国家重点实验室(100021)
miR-181b在结肠炎相关结肠癌发生过程中的表达*
贺龙梅赵新华马怡茗汪红英#
国家癌症中心/中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室(100021)
背景:miR-181b与多种肿瘤的形成相关,但其在结肠炎相关结肠癌中的表达情况尚不明确。目的:探索miR-181b在结肠炎相关结肠癌发生过程中的变化,并初步筛选其下游可能的靶基因。方法:联合使用氧化偶氮甲烷(AOM)和葡聚糖硫酸钠(DSS)制备结肠炎相关结肠癌小鼠模型。以实时荧光定量PCR(qPCR)检测不同时期小鼠结肠组织miR-181b表达。利用全基因组表达谱芯片结合miRNA靶基因预测软件TargetScan、PicTar和miRDB初步预测miR-181b的下游靶基因,并以qPCR法检测结肠炎相关结肠癌小鼠中靶基因的表达。结果:miR-181b表达在结肠炎相关结肠癌形成过程中逐渐升高,但单独使用AOM或DSS均不会改变miR-181b水平。结合全基因组表达谱芯片和miRNA靶基因预测软件初步筛选出miR-181b可能的下游靶基因为Ipmk、E2f5、Klf6、Prkcd、Bai3和Hic2,qPCR法显示Ipmk、Prkcd、Bai3、Hic2表达明显低于对照组。结论:miR-181b表达随结肠炎相关结肠癌的发展而升高,该变化与单纯慢性炎症无关。
关键词miR-181b;结肠肿瘤;结肠炎
Expression of miR-181b in Colitis-associated Colon Carcinogenesis
HELongmei,ZHAOXinhua,MAYiming,WANGHongying.
StateKeyLaboratoryofMolecularOncology,NationalCancerCenter/CancerHospital,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing(100021)
Correspondence to: WANG Hongying, Email: hongyingwang@cicams.ac.cn
Background: miR-181b is related to the progression of many tumors, however, its expression in colitis-associated colon cancer is not clear. Aims: To investigate miR-181b expression and its potential target genes in the process of colitis-associated colon carcinogenesis. Methods: Colitis-associated colon cancer model was established by combined administration of azoxymethane (AOM) and dextran sulfate sodium (DSS) in mice. The expression of miR-181b in colon tissue at different time points was measured by real time fluorescent quantitative PCR (qPCR). Target genes of miR-181b were screened preliminarily by genome microarray combined with miRNA target gene prediction softwares TargetScan, PicTar and miRDB. Expressions of target genes in colitis-associated colon cancer mice were detected by qPCR. Results: The expression of miR-181b was gradually elevated during the development of colitis-associated colon cancer. However, AOM or DSS alone did not change expression of miR-181b. Genome microarray combined with miRNA target gene prediction softwares showed that Ipmk, E2f5, Klf6, Prkcd, Bai3, Hic2 might be the target genes of miR-181b. qPCR showed that expressions of Ipmk, Prkcd, Bai3, Hic2 were significantly decreased in colitis-associated colon cancer than in control group. Conclusions: Expression of miR-181b in colon is upregulated with the development of colitis-associated colon cancer, but is irrelevant with simple chronic inflammation.
Key wordsmiR-181b;Colonic Neoplasms;Colitis
结肠癌的发病率和死亡率均位列世界前五名。炎症性肠病(IBD)主要包括溃疡性结肠炎(UC)和克罗恩病(CD),是导致结肠癌的原因之一[1]。结肠炎相关结肠癌是结肠炎患者的重要死亡原因[2]。结肠炎相关结肠癌的临床研究受诸多因素限制,如患者病理标本收集相对困难,难以长期跟踪获取同一患者不同时期的标本。因此,动物模型成为研究结肠炎相关结肠癌发生、发展动态过程的重要途径。目前比较成熟的结肠炎相关结肠癌动物模型为氧化偶氮甲烷(azoxymethane, AOM)-葡聚糖硫酸钠(dextran sulfate sodium, DSS)模型,可在短期内建立慢性结肠炎相关的癌变模型[3]。
miRNAs为一种内源性非编码的小RNA,与靶基因mRNA特异性结合后,在转录或转录后水平调节基因表达,在机体的生理病理过程中起有重要作用[4-5]。miRNA-181b(miR-181b)在多种恶性肿瘤中异常表达,且其在不同肿瘤中的作用不同。miR-181b通过靶向肿瘤抑制基因TIMP3来促进肝癌的发展[6];miR-181b通过靶向Bcl2提高胃癌细胞的耐药性[7];在胶质瘤中则作为肿瘤抑制基因诱导细胞凋亡,抑制细胞增殖和侵袭[8-9]。miR-181b表达在结肠癌细胞株和临床标本中均显著升高[10-11],且参与NF-κB介导的血管性炎症[12]。但miR-181b是否参与炎症相关肿瘤的发生未见报道。本研究通过制备小鼠结肠炎相关结肠癌模型,旨在探讨miR-181b在结肠炎相关结肠癌发生、发展中的表达变化,并初步筛选下游可能的靶基因。
材料与方法
一、实验材料
1. 实验动物:SPF级雄性C57BL/6小鼠46只,鼠龄6~8周,体质量18~20 g,购自中国医学科学院医学实验动物研究所,饲养于无特定病原体环境中。实验过程符合动物伦理学要求。
2. 主要试剂:AOM购自Sigma公司,DSS购自MP Biomedicals公司,Trizol试剂购自Invitrogen公司,microRNA逆转录试剂盒购自日本TaKaRa公司,内参U6的引物购自广州复能基因有限公司,SYBR Green荧光定量PCR试剂购自ABI公司,全基因组表达谱芯片购自Agilent公司。mRNA逆转录试剂盒购自Thermo公司。
二、实验方法
1. 结肠炎相关结肠癌模型的建立[13]:将小鼠随机分成对照组、AD组、DSS组和AOM组,对照组不作任何处理;AD组第1天(D1)单剂量腹腔注射AOM 12.5 mg/kg,1周后将正常饮用水换为含有2.5% DSS的饮用水,连续5 d,第12天恢复正常饮用水持续16 d,21 d作为一个DSS周期,共给予3个周期;DSS组仅给予3个周期DSS;AOM组仅给予单剂量AOM腹腔注射。各组动物饲养71 d后断颈处死取结肠组织备用。
2. 动物标本采集:在每个DSS周期结束时(第29、50、71天)分别处死AD组和对照组小鼠,每组5~7只,分别命名为AD1、AD2、AD3组和对照组。实验结束时处死小鼠,取相应结肠组织,-80 ℃冰箱保存。上端结肠部分命名为ADn-A/Cn-A,下端结肠部分命名为ADn-D/Cn-D。
3. 荧光定量PCR(qPCR)检测miR-181b表达:将总RNA逆转录成cDNA,用SYBR Green荧光定量PCR检测miR-181b表达,引物序列:AAC ATT CAT TGC TGT CGG TG,具体步骤按试剂盒说明书操作。
4. miR-181b下游靶基因的筛选:①全基因组表达谱芯片检测:按照说明书操作,用检测合格的纯化RNA行芯片实验,扫描芯片获取图像,Feature Extraction将图像转化为数值,再用GeneSpring软件分析数据。
②靶基因的预测:联合应用miRNA靶基因预测软件Targetscan、PicTar和miRDB,取分析结果交集的100个基因作为备选集。然后利用全基因组表达谱芯片数据,分析备选集中100个可能的靶基因在结肠炎相关结肠癌发生过程中的变化趋势,选取AD3组中表达较对照组下调大于1.5倍的基因。
5. qPCR法验证下游靶基因表达:按Trizol试剂说明书提取结肠组织中的总RNA,检测其浓度和纯度。目的基因引物由生工生物工程(上海)股份有限公司合成(表1),qPCR法检测各基因表达,具体步骤按试剂盒说明书操作。

表1 PCR引物序列
三、统计学分析
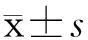
结果
一、miR-181b表达
AD3组多数小鼠(6/7)肉眼可见结肠腺瘤,且肿瘤集中于结肠中下部(直肠端);而其他各组包括AD1、AD2、DSS和AOM组均未发现肿瘤。HE染色示AD3组小鼠结肠黏膜出现腺瘤样特征(图1)。
A:对照组;B:AD3组
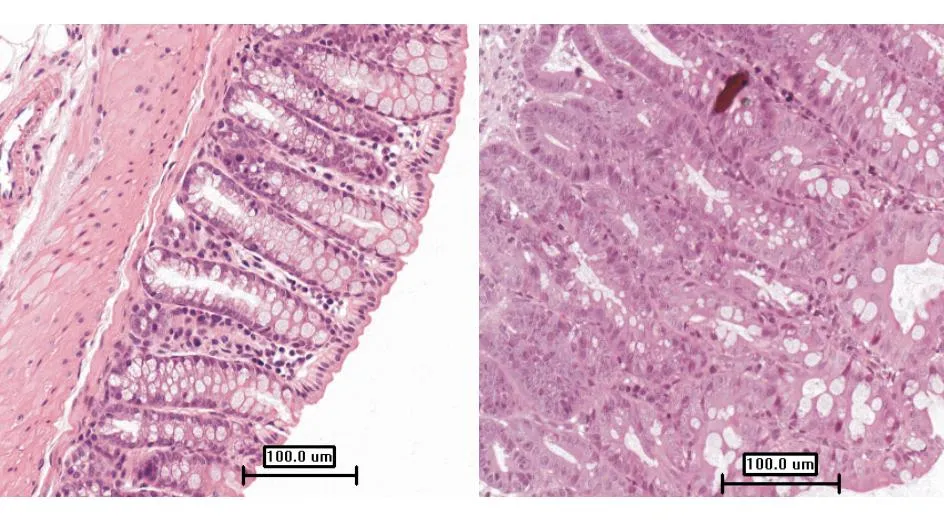
与对照组(2.03±0.48)相比,AD2、AD3组肿瘤好发的下端结肠miR-181b表达逐渐升高(28.61±6.37和61.95±17.74),差异具有统计学意义(P<0.01),AD1组(7.04±4.15)无明显差异;而在不易发生肿瘤的上端结肠,各组miR-181b表达未发生明显变化(图2)。提示miR-181b表达升高与结肠炎相关结肠癌的发生密切相关。
**P<0.01
图2miR-181b在结肠炎相关结肠癌模型发生过程中的表达变化
二、miR-181b表达与DSS引起的慢性炎症的关系
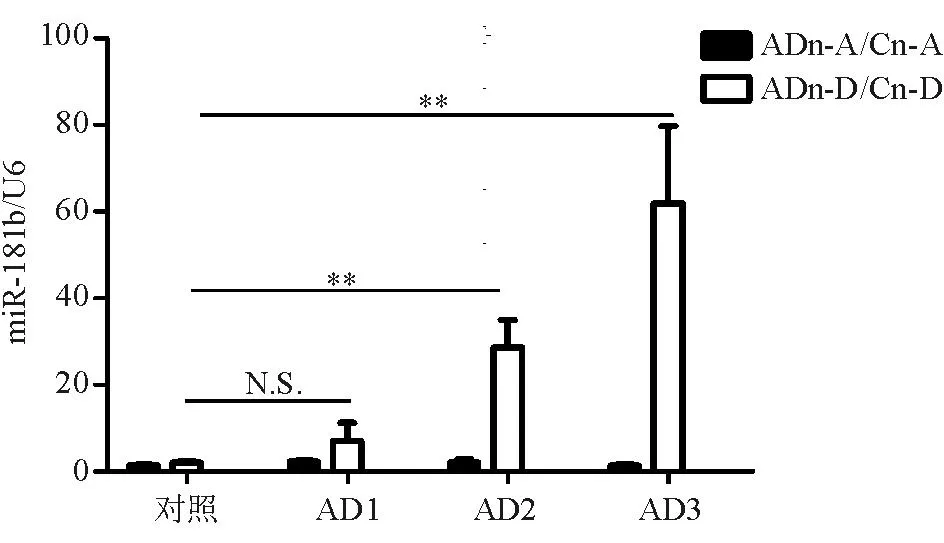
DSS组(1.57±0.72)和AOM组(1.51±0.14)miR-181b表达与对照组(2.03±0.48)相比差异均无统计学意义(P>0.05),但均显著低于AD3组(61.95±17.74)(P<0.05)(图3)。说明miR-181b表达与DSS引起的慢性炎症和AOM引起的DNA突变致癌作用无直接关系。
三、miR-181b靶基因的预测
最终确定Ipmk、E2f5、Klf6、Prkcd、Bai3、Hic2作为备选靶基因进行验证(图4)。同时,对已报道的miR-181b靶基因在基因组芯片中的表达趋势进行分析,结果显示部分靶基因在结肠炎癌变过程中呈下降趋势,如Timp3、Ulk3和Snx25等(图5)。
四、qPCR检测预测靶基因的表达
qPCR结果显示,AD3组中Ipmk、Bai3、Hic2和Prkcd表达明显低于对照组(图6),与全基因组表达谱芯片的结果一致。其中Bai3基因表达下调最为显著。
*P<0.05,**P<0.01
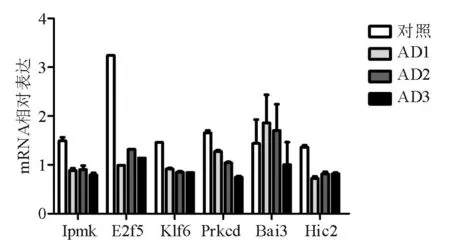
图4全基因组表达谱芯片中表达下调的miR-181b预测靶基因
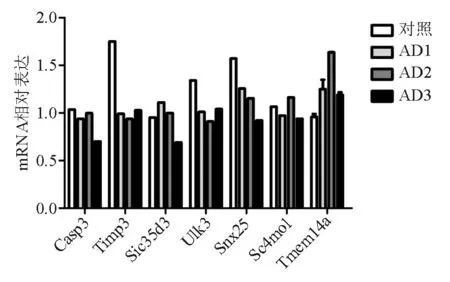
图5部分已知的miR-181b靶基因在全基因组表达谱芯片中下调
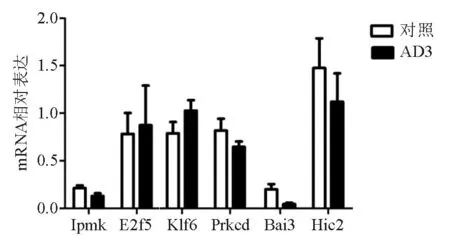
图6 qPCR验证潜在靶基因的表达
讨论
结肠癌的高迁移率和复发率以及抗药性均为其治疗疗效的障碍[14]。临床研究显示miR-181b在结肠癌组织中呈高表达,且与患者的生存率呈负相关[15-16]。本研究利用动物模型模拟了结肠癌的动态发展过程,弥补了临床样本的不足。结果显示miR-181b在肿瘤发生中呈逐渐升高的趋势,进一步证实miR-181b在结肠炎相关结肠癌发生、发展过程中的重要性。此外,miR-181b在肿瘤细胞、巨噬细胞、NK细胞等炎症相关细胞中均可见表达[17-20],但炎症相关结肠癌发生中miR-181b的细胞来源及其作用机制尚需进一步研究。
miRNA靶向抑制抑癌基因表达是肿瘤发生、发展的机制之一,通过抑制不同的下游靶基因来调节肿瘤增殖、侵袭和转移等功能[4]。抑癌基因Bai3作为膜受体蛋白,主要参与胶质瘤的发生[21]。最近研究发现Bai3在其他肿瘤中亦发挥重要作用,如小细胞肺癌[22]。本实验中,AD3组小鼠结肠中Bai3表达显著下降,提示Bai3作为miR-181b可能的下游靶基因参与了结肠炎相关结肠癌的发生,为结肠癌的研究提供了新方向。
此外,多项研究[23-24]发现miR-181b高表达的结肠癌患者对S-1(由替加氟、吉美嘧啶和氧嗪酸钾以 1∶0.4∶1 的比例构成的复合药物)显示出较强的耐药性,但具体机制并不明确。Hic2作为潜在的miR-181b靶基因,其低表达可明显增加癌细胞的抗药性[25],但在结肠癌中目前未见相关报道。因此,AD3组中Hic2表达下降可能参与了结肠癌的耐药性调节,但该假设需行进一步实验验证。
本研究还发现miR-181b表达变化与DSS引起的慢性炎症本身无关。最近研究提示miR-181b-1表达受STAT3调控[26]。STAT3是炎症因子IL-6相关的转录因子,在结肠炎癌变中发挥至关重要的作用[27]。因此,miR-181b表达在小鼠结肠炎相关结肠癌的发生、发展中逐渐升高,可能与IL-6/STAT3信号相关,为miR-181b促进结肠炎癌变的研究提供了新依据。
生物信息学分析显示miR-181b启动子区含有p53结合位点[10],且p53表达在AOM-DSS诱导的小鼠结肠炎相关结直肠癌模型中逐渐升高[28]。提示p53可能参与结肠炎癌变过程中miR-181b表达上调。另一方面,本研究预测的miR-181b靶基因之一Ipmk是一个多功能的蛋白激酶[29],可与p53结合介导其去乙酰化,增强p53活性并促进细胞凋亡[30]。因此本研究提示p53与miR-181b之间的正循环可能参与并促进了结肠炎的癌变过程。
综上所述,miR-181b在结肠炎相关结肠癌的发生中可能发挥重要作用,其具体促进肿瘤发生的分子机制、是否可能作为结肠癌患者诊断或预后评估的标记物,以及作为潜在治疗靶点的可能性还需行进一步实验明确。
参考文献
1 Rubin DC, Shaker A, Levin MS. Chronic intestinal inflammation: inflammatory bowel disease and colitis-associated colon cancer[J]. Front Immunol, 2012, 3: 107.
2 Söderlund S, Brandt L, Lapidus A, et al. Decreasing time-trends of colorectal cancer in a large cohort of patients with inflammatory bowel disease[J]. Gastroenterology, 2009, 136 (5): 1561-1567.
3 Thaker AI, Shaker A, Rao MS, et al. Modeling colitis-associated cancer with azoxymethane (AOM) and dextran sulfate sodium (DSS) [J]. J Vis Exp, 2012 (67). pii: 4100.
4 Guled M, Knuutila S. MicroRNAs and cancer [Article in Finnish] [J]. Duodecim, 2013, 129 (16): 1661-1669.
5 Romero-Cordoba SL, Salido-Guadarrama I, Rodriguez-Dorantes M, et al. miRNA biogenesis: biological impact in the development of cancer[J]. Cancer Biol Ther, 2014, 15 (11): 1444-1455.
6 Wang B, Hsu SH, Majumder S, et al. TGFbeta-mediated upregulation of hepatic miR-181b promotes hepato-carcinogenesis by targeting TIMP3[J]. Oncogene, 2010, 29 (12): 1787-1797.
7 Zhu W, Shan X, Wang T, et al. miR-181b modulates multidrug resistance by targeting BCL2 in human cancer cell lines[J]. Int J Cancer, 2010, 127 (11): 2520-2529.
8 Wang J, Sai K, Chen FR, et al. miR-181b modulates glioma cell sensitivity to temozolomide by targeting MEK1[J]. Cancer Chemother Pharmacol, 2013, 72 (1): 147-158.
9 Sun YC, Wang J, Guo CC, et al. MiR-181b sensitizes glioma cells to teniposide by targeting MDM2[J]. BMC Cancer, 2014, 14: 611.
10Xi Y, Shalgi R, Fodstad O, et al. Differentially regulated micro-RNAs and actively translated messenger RNA transcripts by tumor suppressor p53 in colon cancer[J]. Clin Cancer Res, 2006, 12 (7 Pt 1): 2014-2024.
11Bovell LC, Shanmugam C, Putcha BD, et al. The prognostic value of microRNAs varies with patient race/ethnicity and stage of colorectal cancer[J]. Clin Cancer Res, 2013, 19 (14): 3955-3965.
12Sun X, Icli B, Wara AK, et al. MicroRNA-181b regulates NF-κB-mediated vascular inflammation[J]. J Clin Invest, 2012, 122 (6): 1973-1990.
13李伟伟, 韩文晓, 赵新华, 等. 微小RNA-155在结肠炎相关结肠癌发生过程中的表达变化[J]. 中华肿瘤杂志, 2014, 36 (4): 257-262.
14Farooqi AA, Rehman ZU, Muntane J. Antisense therapeutics in oncology: current status[J]. Onco Targets Ther, 2014, 7: 2035-2042.
15Schetter AJ, Leung SY, Sohn JJ, et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. JAMA, 2008, 299 (4): 425-436.
16Xi Y, Formentini A, Chien M, et al. Prognostic values of microRNAs in colorectal cancer[J]. Biomark Insights, 2006, 2: 113-121.
17Presnell SR, Al-Attar A, Cichocki F, et al. Human natural killer cell microRNA: differential expression of MIR181A1B1 and MIR181A2B2 genes encoding identical mature microRNAs[J]. Genes Immun, 2015, 16 (1): 89-98.
18Pierdomenico AM, Recchiuti A, Simiele F, et al. MicroRNA-181b regulates ALX/FPR2 receptor expression and proresolution signaling in human macrophages[J]. J Biol Chem, 2015, 290 (6): 3592-3600.
19Zhang W, Shen X, Xie L, et al. MicroRNA-181b regulates endotoxin tolerance by targeting IL-6 in macrophage RAW264.7 cells[J]. J Inflamm (Lond), 2015, 12: 18.
20Liu J, Shi W, Wu C, et al. miR-181b as a key regulator of the oncogenic process and its clinical implications in cancer (Review) [J]. Biomed Rep, 2014, 2 (1): 7-11.
21Bolliger MF, Martinelli DC, Südhof TC. The cell-adhesion G protein-coupled receptor BAI3 is a high-affinity receptor for C1q-like proteins[J]. Proc Natl Acad Sci U S A, 2011, 108 (6): 2534-2539.
22Bari MF, Brown H, Nicholson AG, et al. BAI3, CDX2 and VIL1: a panel of three antibodies to distinguish small cell from large cell neuroendocrine lung carcinomas[J]. Histopathology, 2014, 64 (4): 547-556.
23Uchida K, Hayashi K, Kuramochi H, et al. Combination therapy of S-1 and CDDP for patients with colorectal cancer[J]. J Cancer Res Clin Oncol, 2007, 133 (11): 841-846.
24Nakajima G, Hayashi K, Xi Y, et al. Non-coding microRNAs hsa-let-7g and hsa-miR-181b are associated with chemoresponse to S-1 in colon cancer[J]. Cancer Genomics Proteomics, 2006, 3 (5): 317-324.
25Lv L, Deng H, Li Y, et al. The DNA methylation-regulated miR-193a-3p dictates the multi-chemoresistance of bladder cancer via repression of SRSF2/PLAU/HIC2 expression[J]. Cell Death Dis, 2014, 5: e1402.
26Iliopoulos D, Jaeger SA, Hirsch HA, et al. STAT3 activation of miR-21 and miR-181b-1 via PTEN and CYLD are part of the epigenetic switch linking inflammation to cancer[J]. Mol Cell, 2010, 39 (4): 493-506.
27Waldner MJ, Neurath MF. Master regulator of intestinal disease: IL-6 in chronic inflammation and cancer development[J]. Semin Immunol, 2014, 26 (1): 75-79.
28Liang X, Li H, Tian G, et al. Dynamic microbe and molecule networks in a mouse model of colitis-associated colorectal cancer[J]. Sci Rep, 2014, 4: 4985.
29Saiardi A, Erdjument-Bromage H, Snowman AM, et al. Synthesis of diphosphoinositol pentakisphosphate by a newly identified family of higher inositol polyphosphate kinases[J]. Curr Biol, 1999, 9 (22): 1323-1326.
30Xu R, Paul BD, Smith DR, et al. Inositol polyphosphate multikinase is a transcriptional coactivator required for immediate early gene induction[J]. Proc Natl Acad Sci U S A, 2013, 110 (40): 16181-16186.
(2015-09-22收稿;2015-10-12修回)
*基金项目:国家自然科学基金重大研究计划(91129717)
DOI:10.3969/j.issn.1008-7125.2016.04.004
#本文通信作者,Email: hongyingwang@cicams.ac.cn
