亚甲蓝光化学法病毒灭活血浆的制备应用探讨
2016-06-01高炳谏廖小凤甘洁红
高炳谏 廖小凤 甘洁红
亚甲蓝光化学法病毒灭活血浆的制备应用探讨
高炳谏 廖小凤 甘洁红
目的 探讨亚甲蓝光化学法(MB-P)病毒灭活前后新鲜冰冻血浆中凝血因子Ⅷ(FⅧ)、纤维蛋白原(Fib)和总蛋白(TP)、亚甲蓝浓度及血浆容量的变化,为临床应用病毒灭活血浆提供依据。方法 随机抽取2015年7月~12月(每月10份)60份新鲜血浆,分成两组,一组进行病毒灭活,一组不灭活,灭活前后留样,制成新鲜冰冻血浆,48小时后融化,分别对病毒灭活前后血浆中的凝血因子Ⅷ(FⅧ)、纤维蛋白原(Fib)和总蛋白(TP)的含量进行测定,并检测病毒灭活前后血浆中亚甲蓝浓度和称取病毒灭活过滤MB前后血浆的重量,同时计算有效成分的回收率。结果 经病毒灭活后新鲜冰冻血浆中凝血因子Ⅷ(FⅧ)、纤维蛋白原(Fib)和总蛋白(TP)的含量及亚甲蓝浓度、血浆重量明显降低,各项指标均有显著变化,P<0.01,差异均有统计学意义, 凝血因子Ⅷ(FⅧ)、纤维蛋白原(Fib)和总蛋白(TP)回收率分别为84.81%、82.46%和93.76%,亚甲蓝的清除率可达83.93%,血浆回收率为93.97 %。结论 经MB-P病毒灭活血浆能提高血浆输注的安全性,同时,血浆中的有效成分及容量也有一定程度的损失,应加强从采血到血浆病毒灭活各环节的冷链及时间控制,严格按操作规程操作,保证原料血浆的有效成分处于较高水平。
亚甲蓝光化学法; 病毒灭活; 新鲜冰冻血浆; 凝血因子
随着临床输血技术的发展,血浆成分输注的比例不断提高,输注血浆成为临床上治疗各种疾病的重要治疗手段之一,尽管血液检测的水平不断提高,血液的输注仍存在着风险,原因是由于现有的检测方法具有一定的局限性,还不能检出少数血液中感染的病毒和微生物,尤其是对于“窗口期”的血液,漏检的可能性很大[1],同时还有未知病毒不为人们所了解以及一些可能通过输血传播的病毒还未列入常规检测项目,也威胁着血液的安全。亚甲蓝光化学法(MB-P)是目前我国唯一获准用于临床的光化学血浆病毒灭活技术[2-3]。为了解我站病毒灭活血浆的质量,笔者对病毒灭活前后新鲜冰冻血浆的凝血因子Ⅷ(FⅧ)、纤维蛋白原(Fib)和总蛋白(TP)的含量及亚甲蓝浓度、血浆重量的抽样检测结果进行比较分析,探讨影响病毒灭活血浆前后主要成分变化的相关因素及采取的相应措施,现报告如下。
1 材料与方法
1.1 标本来源
随机抽取本站2015年7月~12月(每月抽10袋)采集的60袋400 ml全血,于采后6~8 h内(3 800转/分、10 min、4 ℃)离心,分离出上层血浆并以同样的转速、时间、温度再次离心,去除残余红细胞,制备成新鲜血浆,210~260 ml/袋,然后在百级净化间内按无菌操作将一次性使用病毒灭活输血过滤器的针头穿刺连接血浆袋,使血浆缓慢通过亚甲蓝扣流入病毒灭活过滤器的一个空袋,当血浆袋剩下约6 ml时热合,作为病毒灭活前血浆样本备检。将加入亚甲蓝的血浆轻轻混匀后放入血浆病毒灭活箱内进行光照处理,设置光照强度为30 000~35 000 Lx,温度为2~8 ℃,摆动频率为60次/分,照射时间为35 min,光照完毕后打开MB过滤器管道上的夹子让血浆缓慢通过过滤器滤除亚甲蓝(注:将过滤前、后的血浆袋称重),制备成病毒灭活后血浆,混匀留样6 ml备检,将病毒灭活前、后留样标本立即置-50 ℃速冻机速冻1 h后,放在-20 ℃以下冰箱冻存48小时,待检测。
1.2 主要仪器与试剂
6000i大容量低温离心机、全自动生化分析仪、全自动血凝分析仪、722s可见光光度计、固相萃取仪、百级净化间、病毒灭活箱和一次性使用病毒灭活输血过滤器、凝血因子Ⅷ(FⅧ)检测试剂、纤维蛋白原检测试剂、总蛋白检测试剂、亚甲蓝浓度测定试剂。
1.3 检测方法
将冻存48小时后的血浆样本放在37 ℃水浴中解冻,凝血因子Ⅷ(FⅧ)的含量检测应用凝固法,采用血凝仪测定;总蛋白的检测应用双缩脲法,采用全自动生化分析仪测定,严格按照试剂和仪器使用说明书的要求操作,以灭活后含量/灭活前含量计算有效成分保有率。
1.4 统计学处理

2 结果
病毒灭活后血浆中的FⅧ、Fib、TP均低于病毒灭活前,回收率分别为84.81%、82.46%和93.76%,病毒灭活过滤后血浆容量回收率为93.97%,亚甲蓝的清除率可达83.93%,组间比较差异均有统计学意义(P值<0.05),但均符合GB18469-2012《全血及成分血质量要求》的相关标准,病毒灭活前后血浆相关指标变化见表1。
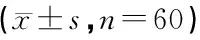
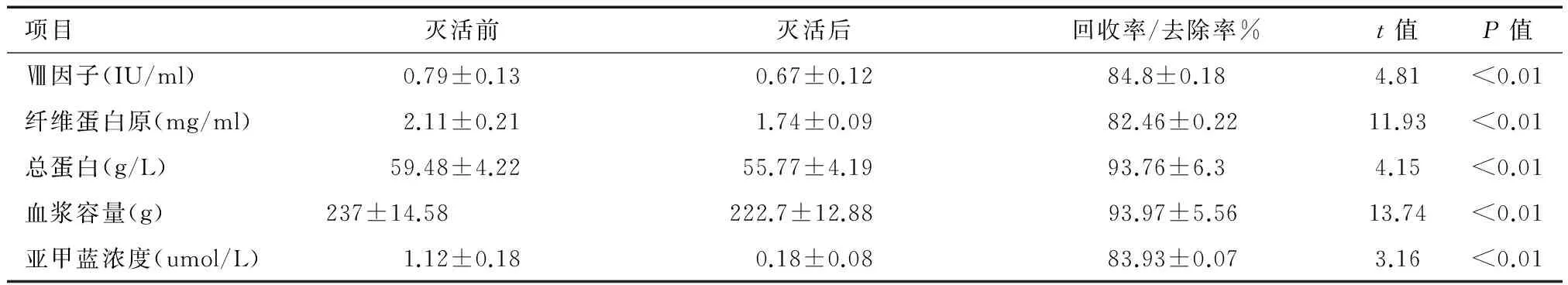
项目灭活前灭活后回收率/去除率%t值P值Ⅷ因子(IU/ml)0.79±0.130.67±0.1284.8±0.184.81<0.01纤维蛋白原(mg/ml)2.11±0.211.74±0.0982.46±0.2211.93<0.01总蛋白(g/L)59.48±4.2255.77±4.1993.76±6.34.15<0.01血浆容量(g)237±14.58222.7±12.8893.97±5.5613.74<0.01亚甲蓝浓度(umol/L)1.12±0.180.18±0.0883.93±0.073.16<0.01
3 讨论
血浆是一种临床需求量大,携带病毒风险较高的血液制品。受检测项目和检测手段的限制,处于“窗口期”的病毒携带者可出现漏检,无法完全阻断经血液传播疾病的发生,因此对血浆进行病毒灭活处理,对于降低由此导致的病毒感染危险是非常重要的。近年来,临床上加大了对血浆病毒灭活的临床研究,并取得了较大的进展。亚甲蓝光化学法(MB-P)是一项成熟的血浆病毒灭活技术[4],这一病原体灭活技术已在我国及部分欧洲国家广泛应用于临床[5-6]。亚甲蓝是一种带正电荷的感光吩噻嗪小分子化学物,其病毒灭活血浆的机制是亚甲蓝光化学法产生的单线态氧对病毒核酸、膜蛋白、腊脂都会造成损伤,光激活产生的自由基(比如羟自由基)可导致DNA单链断裂,从而使病毒完全失去穿透、复制及感染能力[7],达到灭活病毒的目的。
本次研究表明,血浆病毒灭活前、后有效成分的含量发生改变,不稳定凝血因子Ⅷ(FⅧ)、纤维蛋白原(Fib)、总蛋白(TP)的含量明显降低,回收率为84.81%、82.46%和93.76%,差异有统计学意义,虽然符合国家质量标准允许范围内(新鲜冰冻血浆疑血因子Ⅷ(FⅧ)含量≥0.7 IU/ml;病毒灭活新鲜冰冻血浆凝血因子Ⅷ(FⅧ)含量≥0.5 IU/ml;总蛋白含量≥50 g/L)。但低于文献[6-8]报道的病毒灭活前后血浆的有效成分的含量,这可能与病毒灭活血浆因光照、吸附、过滤等原因有关外,还说明我站从采血到血浆制备病毒灭活血浆整个过程的冷链和时间还未得到有效控制,因为,血浆中有效成分的含量易受血液采集、运输、保存等环节的温度、时间及制备方法、制备条件、储存温度等过程质量的影响[9-10],因此,我站必须加强采血、制备工作人员的质量意识和操作技能的培训,必须严格控制好从血液采集至血液制备成病毒灭活血浆整个过程的冷链和时间,以保证灭活前血浆的有效成分处于较高水平,保证临床输注病毒灭活血浆的安全和有效。
表1结果显示,病毒灭活过滤后,血浆容量回收率为93.97%,血浆平均损失量约为15 ml,但在60份标本中,也有8份标本血浆损失量超过20 ml,这可能与个别工作人员操作使导管及过滤器残留过多血浆有关,因此,工作人员特别是新进人员应加强技能操作练习,在操作中应尽量排尽导管及过滤器的血浆到血浆袋中,降低过滤管道和过滤器的残余血浆量,还要在原料血浆上按标士量浮动范围增加约15 ml,以保证病毒灭活后血浆的容量达到标准。
本实验加入MB的浓度为1.12±0.18 umol/L,基本满足了血浆病毒灭活的要求。同时,对滤除后的亚甲蓝残留量进行测定,发现仅为0.18±0.08,去除率达到83.93%,低于我国国标《全血及成分血质量要求》(GB18469-2012)中对MB-FFP规定的MB残留量≤0.3 umol/L的要求[11]。但在60份标本中,有2份MB残余量>0.3 umol/L,这可能是个别工作人员操作不按操作规程进行操作,把未连接过滤器的管道夹子过早打开或过滤器的质量影响有关,尽管MB在病毒灭活过程中的剂量已被证实是安全的,但也有研究指出,MB可能有致突变和引发过敏的风险[13],因此,加强对MB残留量指标的监测,严格按照病毒灭活血浆操作规程进行过滤,尽量减少由于MB残留可能引起的潜在风险,进一步保障输血安全。
综上所述,经过病毒灭活过程对血浆中的有效成分均有一定程度的损失,作者建议,用于制备冷沉淀的原料新鲜冰冻血浆不需进行病毒灭活处理,以免影响冷沉淀的质量,临床病人输注病毒灭活血浆时,根据病情需要,适当增加血浆用量,以保证疗效。为了保证病毒灭活后血浆的质量和病毒灭活血浆能够顺利推广应用,应对采供血工作人员进行病毒灭活相关理论知识及操作技能的培训考核,加强工作人员从采血到血液制备整个过程的各项标准操作规程的培训,加强从血液采集、储存、运输到病毒灭活血浆冻存全过程的冷链和时间控制,以保证输血安全的同时确保血浆的成分和疗效。加强临床医护人员对成分输血、输血安全性等相关知识的培训,增强输血安全意识,共同做好新产品推广应用工作,提高输血安全性。
[1] 聂咏梅,血浆病毒灭活研究进展[J].国外医学病毒学分册,2003,10(5):146-150.
[2] 王 飞,路志浩,古醒辉,等.亚甲蓝光化学法血浆病毒灭活前后血浆成分的变化[J].临床输血与检验,2010,12(2):97-100.
[3] 于建华,王明静.病毒灭血浆若干问题探讨[J].中国现代医生,2010,48(12):19-22.
[4] 王红苹,赵树铭.亚甲蓝灭活血浆病毒的临床应用进展[J].中国输血杂志,2014,27(12):1361-1363.
[5] 叶露露,单桂秋,马 静,等.亚甲蓝光化学法病毒灭活冷沉淀的制备及初步评价[J].华南国防医学杂志,2014,28(9):858-859.
[6] 张 博,王露楠,黄宇闻,等.丙型肝炎病毒样颗粒作为亚甲蓝学化学法灭活HCV效果评价物的可行性研究[J].中国输血杂志,2015,28(1):14-17.
[7] 刘仁强,秦艳兰,何子毅,等.亚甲兰光化学法对FFP中凝血因子及总蛋白含量的影响[J].中国输血杂志,2010,23(6):436-438.
[8] 宋飞峰,李竹兰,杨 莹.病毒灭活过程对血浆成分影响的临床研究[J].中华医院感染学杂志,2015,25(9):1943-1944
[9] 陈镇周,肖明星,陈湘屏,等.亚甲蓝光化学法病毒灭活对血浆质量的影响[J].中国输血杂志,2011,24(06):490-492.
[10]王超英.亚甲蓝光化学法病毒灭活对血浆成分及白细胞残留量的影响[J].临床输血与检验,2014,16(3):290-292
[11]中华人民共和国国家质量标准.全血及成分血质量要求.GB18469-2012[S].中国标准出版社.2012.
[12]杨春晖,边国慧,阳 红,等.病毒灭活血浆中MB残留量检测[J].中国生物制品学杂志,2015,28(4):426-428.
R457.1+4
A
10.3969/j.issn.1671-332X.2016.10.026
高炳谏 廖小凤 甘洁红 : 云浮市中心血站 广东云浮 527300
