窄叶鲜卑花叶超声提取工艺的优化
2016-06-01卫阳飞张宏曦杨永建李建银岳国仁
卫阳飞, 宋 海, 张宏曦, 杨永建, 李建银, 岳国仁 *
(1.河西学院,甘肃省河西走廊特色资源利用重点实验室,甘肃张掖734000;2.甘肃省张掖市甘州区食品药品监督管理局,甘肃张掖734000;3.兰州大学药学院,甘肃兰州730000)
窄叶鲜卑花叶超声提取工艺的优化
卫阳飞1, 宋海1, 张宏曦2, 杨永建3, 李建银3, 岳国仁1 *
(1.河西学院,甘肃省河西走廊特色资源利用重点实验室,甘肃张掖734000;2.甘肃省张掖市甘州区食品药品监督管理局,甘肃张掖734000;3.兰州大学药学院,甘肃兰州730000)
摘要:目的 优化窄叶鲜卑花叶的超声提取工艺。方法 以齐墩果酸和熊果酸的总评值为指标,在单因素试验的基础上,采用响应面分析法对乙醇体积分数、液料比、提取温度、提取时间等条件进行优化。结果 最优提取工艺为浸泡时间2.0 h,乙醇体积分数72.7%,液料比32∶1,提取温度53℃,提取时间1.633 h(约98 min),齐墩果酸平均提取率为14.03 mg/g,熊果酸为0.984 5 mg/g。结论 该工艺稳定合理,对窄叶鲜卑花的开发利用具有一定实践意义。
关键词:窄叶鲜卑花;叶;超声提取;齐墩果酸;熊果酸;响应面分析法
窄叶鲜卑花Sibiraea angustata(Rehd.)Hand.-Mazz为蔷薇科鲜卑花属植物,主要分布于西藏、青海、甘肃、四川等地,生长在海拔2 400~3 500 m的高山、溪边、灌木丛中或林缘[1-2],藏族民间常用其叶作茶饮,用于治疗食后腹胀等原因引起的消化不良症状,命名为“柳茶”。近年来药理研究表明,窄叶鲜卑花叶具有调节脂质代谢[3]、保护肝损伤[4]、抗氧化促进免疫功能[5]、抑制K562和S180肿瘤细胞生长[6-7]等作用。
窄叶鲜卑花叶中含有丰富的齐墩果酸和熊果酸等三萜类成分,是其最主要的一类活性物质[8-11]。在齐墩果酸和熊果酸的提取中,超声提取与浸提、回流提取等传统方法比较,具有明显优势[12-13]。目前,窄叶鲜卑花叶主要以齐墩果酸和熊果酸为指标成分来进行提取工艺研究,只有闫志慧等[14]对熊果酸采用薄层色谱检测,并进行了正交试验优化。本实验以窄叶鲜卑花叶为原料,在单因素试验基础上,以总评OD值[15]为综合评价指标进行响应面试验,对窄叶鲜卑花叶中齐墩果酸和熊果酸的超声提取工艺进行优化,为该植物的综合开发和利用提供理论依据。
1 仪器与材料
1.1 仪器 Agilent 1260高效液相色谱仪,包括四元泵、二极管阵列检测器、智能化柱温箱、OpenLAB工作站(美国安捷伦公司);KQ250B超声波清洗仪(昆山市超声仪器有限公司);AUW120D电子分析天平(日本岛津公司);RE-2000A旋转蒸发仪(上海亚荣生化仪器厂);DZF-6020真空干燥箱(上海博迅实业有限公司)。
1.2 材料 窄叶鲜卑花叶采自甘肃省定西市漳县遮阳山,经兰州大学杨永建教授鉴定为蔷薇科鲜卑花属植物窄叶鲜卑花Sibiraea angustata(Rehd.)Hand.-Mazz的叶。熊果酸(批号110753-200413)、齐墩果酸(批号100080-200207)对照品均购自中国食品药品检定研究院。甲醇为色谱纯;其他试剂均为分析纯;水为超纯水。
2 方法与结果
2.1 提取工艺流程 窄叶鲜卑花叶低温干燥后粉碎,过60目筛,乙醇浸泡,超声提取,抽滤,即得。
2.2 HPLC色谱条件 Phenomenex-C18色谱柱(4.6 mm× 250 mm,5 μm);流动相为甲醇-0.2%磷酸水溶液(88∶12);体积流量为0.8 mL/min;柱温30℃;检测波长210 nm。
2.3 混合对照品溶液的制备与线性关系考察 精密称取齐墩果酸、熊果酸对照品适量,甲醇定容至25 mL量瓶中,制成含0.638 mg/g齐墩果酸、3.85 mg/g熊果酸的混合对照品溶液,精密吸取0.1、0.2、0.5、1.0、2.5 mL,甲醇定容至10 mL量瓶中,得到系列质量浓度的标准溶液。精密吸取10 μL,在“2.2”项色谱条件下,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得到齐墩果酸的回归方程为Y=5 089X+14.80,在0.063 8~6.38 μg范围内线性关系良好(r=0.999 7),而熊果酸为Y= 415.5X-1.576,在0.385~38.5 μg范围内线性关系良好(r=0.999 9)。色谱图见图1。

1.齐墩果酸 2.熊果酸图1 HPLC色谱图
2.4 单因素试验
2.4.1 提取溶剂对提取率的影响 选择不同体积分数的甲醇及乙醇(均为100%、90%、80%、70%、60%)作为提取溶剂,将粉碎后的窄叶鲜卑花叶用提取试剂浸泡2.0 h后,超声(250 W)处理1.5 h,温度50℃,液料比40∶1,每种溶剂平行3次,取平均值,结果见图2。由图可知,随着甲醇和乙醇体积分数的增大,齐墩果酸和熊果酸的提取率都是先增加后减少,而且80%乙醇时两者的提取率均最高,而且乙醇价格相对便宜,故选择70%、80%、90%乙醇继续进行响应面分析。

图2 提取溶剂对提取率的影响
2.4.2 液料比对提取率的影响 选择80%乙醇作为提取溶剂,超声(250 W)1.5 h,温度50℃,考察液料比为5∶1、10∶1、20∶1、30∶1、40∶1、50∶1时对提取率的影响,每个液料比平行3次,取平均值,结果见图3。由图可知,当液料比为40∶1时,齐墩果酸和熊果酸的提取率均最高,但其进一步增加后,反而均有所下降,可能是与液料比增加时提取过程的损失也相应加大有关。

图3 液料比对提取率的影响
2.4.3 提取温度对提取率的影响 选择80%乙醇作为提取溶剂,液料比40∶1,提取时间1.5 h,考察提取温度为20、30、40、50、60℃对提取率的影响,每个温度平行3次,取平均值,结果见图4。由图可知,当提取温度为50℃时,齐墩果酸和熊果酸的提取率均最高,但其进一步升高后,反而均有所下降,可能是由于高温条件下相关成分发生了变化。

图4 提取温度对提取率的影响
2.4.4 提取时间对提取率的影响 选择80%乙醇作为提取溶剂,液料比40∶1,提取溶剂50℃,考察提取时间为0.5、1.0、1.5、2.0 h时对提取率的影响,每个提取时间平行3次实验,取平均值,结果见图5。由图可知,当提取时间为1.5 h时,齐墩果酸和熊果酸的提取率均最高。

图5 提取时间对提取率的影响
2.4.5 浸泡时间对提取率的影响 选择80%乙醇作为提取溶剂,液料比40∶1,提取温度50℃,提取时间1.5 h,考察浸泡时间0、0.5、1.0、1.5、2.0、3.0 h时对提取率的影响,每个浸泡时间平行3次,取平均值,结果见图6。由图可知,当浸泡时间为2.0 h和3.0 h时,齐墩果酸和熊果酸的提取率均最高,从节约时间角度考虑,最终选择2.0 h作为最佳浸泡时间。

图6 浸泡时间对提取率的影响
2.5 响应面试验与结果
2.5.1 响应面试验设计 在单因素试验的基础上,选择乙醇体积分数(A)、液料比(B)、提取温度(C)、提取时间(D)4个因素,以总评OD值为评价指标进行响应面分析,因素水平见表1。
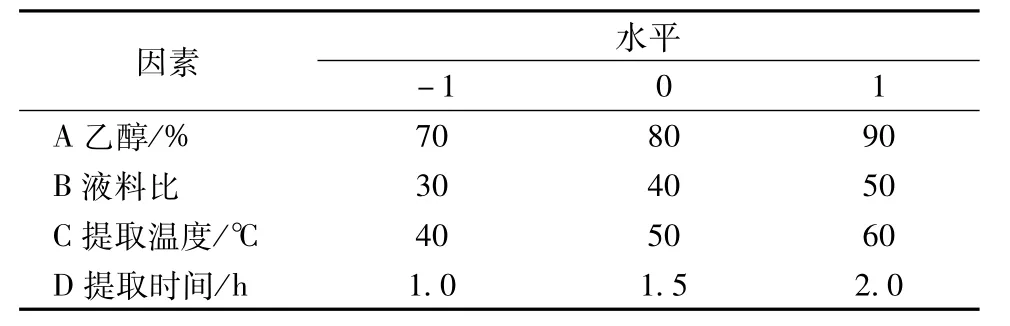
表1 因素水平
总评OD值[15]的计算方法为将各指标首先均标准化为0~1之间的“归一值”,对取值越大越好的指标,采用计算公式di=(Yi-Ymin)/(Ymax-Ymin)。再将各指标“归一值”求算几何平均数,得总评归一值,计算公式为OD= (d1d2…dk)1/k(k为指标个数)。
2.5.2 响应面试验结果 根据Box-Behnken中心组合试验设计原理,结合单因素试验,设计4因素3水平正交表,试验方案与结果见表2。

表2 试验方案与结果
采用Design Expert 8.05软件,以乙醇体积分数(A)、液料比(B)、提取温度(C)、提取时间(D)为响应变量,以总评OD值(Y)为考察指标,对表2数据进行处理,得到二次回归方程为Y=-12.9 +0.184A+0.057B+ 0.171C+2.13D+6.12×10-4AB+7.20×10-4AC+2.70× 10-3AD-4.50×10-4BC+8.51×10-3BD+6.37×10-3CD-1.70×10-3A2-1.42×10-3B2-2.08C2-0.894D2。
方差分析见表3,可知该模型极显著(p<0.000 1),表明不同因素间差异非常明显;失拟项不显著(p> 0.05),相关系数R2=0.975 5,校正决定系数Radj2= 0.951 1,表明该模型拟合程度良好,误差小,可进行实验预测。各因素的影响程度依次为A>B>D>C,即乙醇体积分数>液料比>提取时间>提取温度,其中A、B、C、D、A2、B2、C2、D2对OD值影响非常显著,AC较显著,其他不显著。
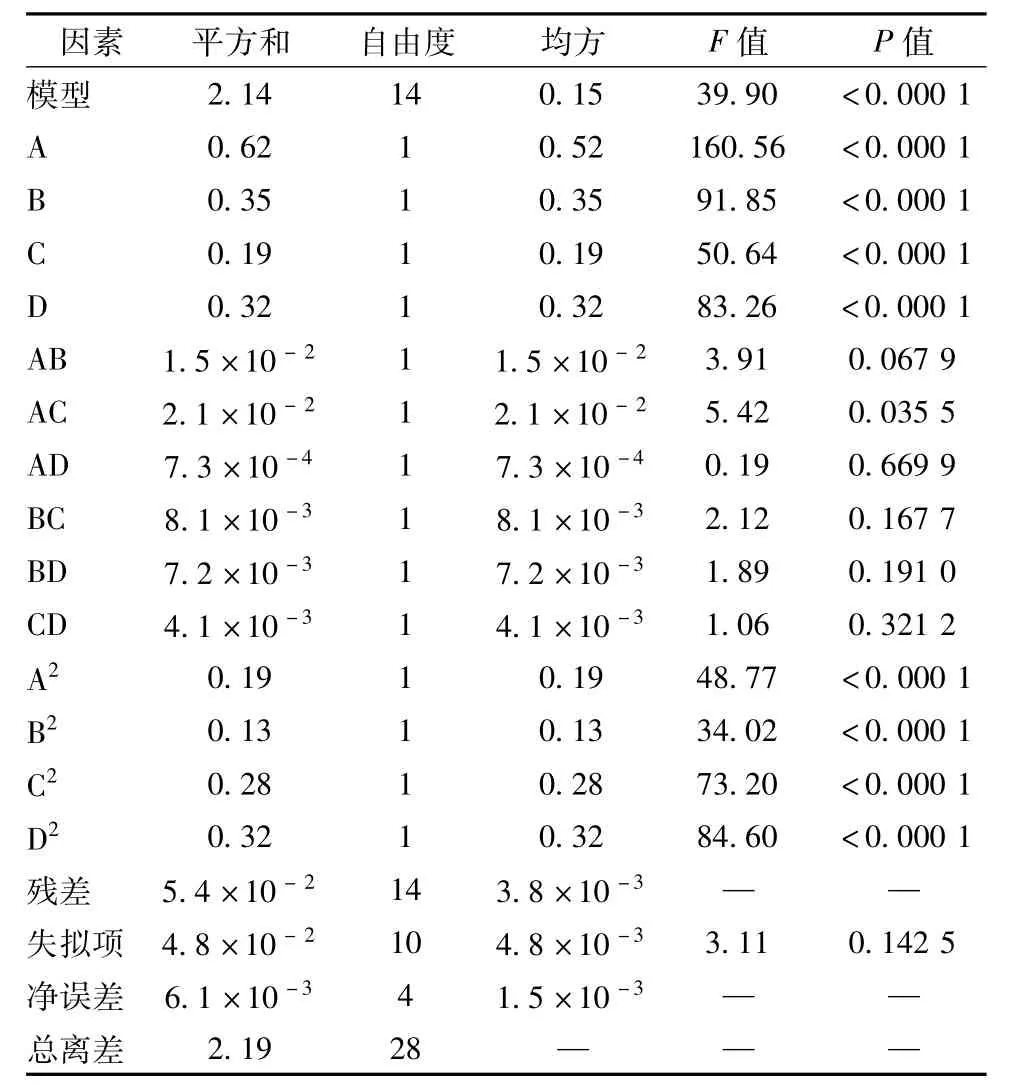
表3 方差分析
根据回归方程,绘制响应面分析图,见图7,得到最佳工艺条件为浸泡时间2.0 h,乙醇体积分数72.66%,液料比32.35∶1,提取温度52.84℃,提取时间1.64 h。考虑实际操作,将最佳工艺修正为浸泡时间2.0 h,乙醇体积分数72.7%,液料比32∶1,提取温度53℃,提取时间1.633 h(98 min)。在此条件下,预测总评OD值为0.998 1。
2.5.3 验证实验 为验证上述最佳条件的可靠性,进行了3组平行实验,测得齐墩果酸和熊果酸的平均提取率分别为14.03 mg/g和0.984 5 mg/g,平均OD值为0.964 8,与预测值(0.998 1)接近,表明该工艺条件稳定可靠。

图7 响应面交互作用图
3 结论
本实验首先通过单因素试验来确定主要因素及水平,在此基础上,再采用响应面法对窄叶鲜卑花叶中齐墩果酸和熊果酸的提取条件进行了优化,得到最佳提取条件为乙醇体积分数72.7%,液料比32∶1,提取温度53℃,提取时间1.633 h(98 min),弥补了以往正交试验无法得到最佳组合因素的不足。然后,通过模型系数显著性检验,发现各因素的影响程度依次为乙醇体积分数>液料比>提取时间>提取温度。综上所述,该提取工艺简单可靠,目标成分损失小,可为窄叶鲜卑花叶的开发和利用提供理论依据。
参考文献:
[1] 甘肃省卫生局.甘肃中草药手册:第3册[M].兰州:甘肃人民出版社,1973:1554.
[2] 赵汝能.甘肃中草药资源志:下册[M].兰州:甘肃科学技术出版社,2004:31-32.
[3] 夏 苗,王晶宇,马晓燕,等.藏药柳茶提取物调节肥胖大鼠脂代谢的作用机制研究[J].中药材,2011,34(6):922-926.
[4] 卢岩松,田青山,王晶宇,等.柳茶提取物对非酒精性脂肪肝大鼠脂质代谢的影响[J].中国新药与临床药理,2011,22(1):40-43.
[5] 段博文,李 运,刘 昕,等.柳茶多糖对小鼠免疫功能的影响[J].中国中药杂志,2010,35(11):1466-1469.
[6] 刘 昕,潘兴斌,李兴玉,等.藏药柳茶提取物对K562肿瘤细胞生长的影响[J].中国病理生理杂志,2003,19 (2):253-255.
[7] 雒 彧.藏药柳茶提取物对S180体内生长的抑制作用及抑瘤机制的实验研究[D].兰州:兰州大学,2006.
[8] 闫志慧,陈立书,朱仝飞,等.藏药柳茶叶乙醇水提取物中化学成分的鉴定[J].应用化学,2014,31(2):237-241.
[9] 王章伟,徐向红,陈笑天,等.窄叶鲜卑花地上部分化学成分研究[J].中药材,2014,37(1):57-60.
[10] 赵 媛,梁国兴,王彩芳,等.窄叶鲜卑花化学成分研究(Ⅰ)[J].北京师范大学学报:自然科学版,2012,48 (6):621-624.
[11] MagalhãesW S,Corrêa C M,Alencastro R B D,et al.The molecular basis of anti-inflammatory action of the oleanolic and ursolic acids on cyclooxygenase isoforms by docking and molecular dynamics[J].QuÍmica Nova,2012,35(2):241-248.
[12] 张 颖,崔英杰,郭守东,等.南蛇藤中齐墩果酸和熊果酸的提取工艺优化及毛细管电泳检测其含量分布[J].食品工业科技,2013,34(22):66-71.
[13] 蔡 娟,刘世尧,韦正鑫,等.皱皮木瓜皮渣齐墩果酸和熊果酸提取工艺优化研究[J].食品工业科技,2015,36 (2):282-290.
[14] 闫志慧,李志刚,杨永建,等.炮制后鲜卑花属植物叶中熊果酸的超声提取工艺[J].时珍国医国药,2008,19 (1):177-178.
[15] 霍丹群,冯 丹,曾 娜,等.响应面法优化醇提荷叶总黄酮和生物碱的工艺研究[J].食品工业科技,2013,34 (18):229-234.
*通信作者:岳国仁(1966—),男,博士,教授,从事有机化合物的应用与合成研究。E-mail:xinziwuzhijin@163.com
作者简介:卫阳飞(1987—),女,硕士,助教,从事药用植物资源开发与利用研究。Tel:18093612285,E-mail:wyfhxxy@163.com
基金项目:河西学院青年教师科研基金项目(QN2014-15)
收稿日期:2015-08-07
doi:10.3969/j.issn.1001-1528.2016.05.045
中图分类号:R284.2
文献标志码:B
文章编号:1001-1528(2016)05-1167-05
