5-Azac诱导急性移植物抗宿主病免疫低反应的甲基化研究
2016-05-31张晓宁赵玉霞王建海苗绪红李克秋李光
张晓宁,赵玉霞,王建海,苗绪红,李克秋,李光
5-Azac诱导急性移植物抗宿主病免疫低反应的甲基化研究
张晓宁,赵玉霞,王建海,苗绪红,李克秋,李光△
摘要:目的建立小鼠急性移植物抗宿主病(aGVHD)模型,检测DNA甲基化转移酶抑制剂5-氮杂胞苷(5-aza⁃cytidine,5-Azac)诱导aGVHD免疫低反应后的甲基化变化,探讨5-Azac对小鼠aGVHD的免疫调节作用。方法选择雄性C57BL/6(H-2b)与雌性BALB/c(H-2d)小鼠分别作为异基因移植供、受体建立移植物抗宿主病小鼠模型。BABL/c受体按照体质量相近进行配对,分为移植对照组和5-Azac实验组。5-Azac实验组于移植后1~7、14、21、28 d尾静脉注射5-Azac 0.25 mg/kg(0.3 mL/只);移植对照组尾静脉注射生理盐水0.3 mL/只。提取3只移植对照组和3 只5-Azac实验组小鼠的外周血DNA,分别等量混匀,采用甲基化DNA免疫共沉淀测序(MeDIP-seq)的方法检测甲基化变化,筛选差异甲基化基因,并对其功能及生物学通路进行分析。结果5-Azac实验组小鼠的生存时间延长,排斥反应减弱,成功诱导移植物抗宿主病免疫低反应状态。2组小鼠DNA MeDIP-seq结果对比显示:5-Azac实验组启动子区存在369个差异甲基化基因,其中上调239个、下调130个;外显子区存在184个差异甲基化基因,其中上调113个、下调71个。利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对差异甲基化基因分析,结果显示其主要参与10个免疫学信号通路,其中TGF-β、GSK-3β、SYK、PI3K、NFAT、CD28、α4β7与aGVHD的发生发展密切相关。结论5-Azac可以通过改变基因的甲基化状态有效诱导aGVHD的免疫低反应。
关键词:移植物抗宿主病;甲基化;5-氮杂胞苷;MeDIP-seq;免疫低反应
△通讯作者E-mail:lig@tmu.edu.cn
异基因造血干细胞移植(HSCT)被广泛应用于各种恶性血液性疾病的治疗,但是移植手术会伴随急性移植物抗宿主病(acute graft-versus-host dis⁃ease,aGVHD)的发生,是异基因骨髓移植的主要障碍[1]。因此如何克服aGVHD成为医学研究的热点课题之一。随着基因甲基化修饰所致表达水平变化研究的深入,DNA甲基化转移酶抑制剂(DNA meth⁃yltransferase inhibitors,DNMTIs)可调节基因的转录过程,为疾病治疗提供了新思路。因此,从甲基化水平探究DNMTIs对aGVHD的影响,能够深入地了解DNMTIs的免疫抑制功能,从表观遗传学的角度为DNMTIs治疗aGVHD,甚至应用于器官移植带来希望。DNA甲基化转移酶抑制剂5-氮杂胞苷(5-aza⁃cytidine,5-Azac)是一种脱氧胞嘧啶类似物,它能激活核苷三磷酸反应并插入到DNA和RNA分子中,从而抑制DNA、RNA和蛋白质的合成[2]。研究发现5-Azac具有免疫调节作用,可抑制T淋巴细胞的活化、增殖及炎性细胞因子的分泌[3]。因此,本研究采用甲基化DNA免疫共沉淀测序(MeDIP-seq)的方法检测5-Azac诱导小鼠异基因造血干细胞移植aGVHD免疫低反应后的基因甲基化变化,探讨5-Azac对小鼠aGVHD的免疫调节作用。
1 材料与方法
1.1材料
1.1.1实验动物健康SPF级雄性C57BL/6(H-2b)小鼠和雌性BALB/c(H-2d)小鼠,8~12周龄,体质量19~22 g,购于北京军事医学科学院实验动物中心,饲养于中国医学科学院放射医学研究所IVC级实验动物房。
1.1.2主要试剂5-Azac(美国Sigma公司);小鼠脾脏淋巴细胞分离液试剂盒(天津灏洋公司);胎牛血清(以色列Bio⁃Ind公司);RPMI-1640培养基(美国Hyclone公司);NEXT⁃flex Methyl-Seq 1 KIT、NEXTflex DNA Barcode-6(美国Bioo公司);Methylated DNA IP KIT(美国Zymo公司);Agencourt AMPure XP 60 mL KIT(美国Beckman公司);Agilent High Sensitivity DNA KIT(美国Agilent公司);QUBIT DNA BR AS⁃SAY KIT、QUBIT DNA HS ASSAY KIT(美国Invitrogen公司);Qiagen PCR Quick KIT(美国Qiagen公司);KAPA SYBR FAST Master Mix Universal 2×qPCR Master Mix、DNA Quantifi⁃cation Standards and Primer Premix KIT(美国Kapa公司)。
1.2实验方法
1.2.1aGVHD模型的建立移植前4 h给予40只BALB/c (H-2d)受体小鼠137Cs射线全身照射(total body irradiation,TBI),照射剂量6.5 Gy。断颈处死供体C57BL/6(H-2b)小鼠,于超净台内无菌分离供体小鼠股骨和脾脏,制备骨髓细胞悬液与脾细胞混合悬液(混合比例1∶1),调整细胞浓度为2×107/mL,经尾静脉注射受体小鼠(0.5 mL/只),并饲养于IVC实验动物房。
1.2.2实验分组将受体小鼠根据体质量进行配对,分别归入移植对照组和5-Azac实验组,每组20只。5-Aza实验组于移植后1~7、14、21、28 d尾静脉注射5-Azac 0.25 mg/kg,0.3 mL/只;移植对照组则尾静脉注射生理盐水,0.3 mL/只。
1.2.3实验观察每日观察记录2组小鼠的体质量、毛发、有无腹泻、弓背、精神萎靡、皮肤溃疡等aGVHD表现,统计其生存率及体质量变化。2组小鼠分别于濒死状态及移植后30 d取外周血及肝脏、小肠组织。
1.2.4病理学检查4%多聚甲醛溶液固定2组小鼠肝脏及小肠组织,石蜡切片、苏木素-伊红(hematoxylin-eosin,H-E)染色,光镜下观察各组织病理学改变。
1.2.5小鼠外周血DNA甲基化的检测2组分别提取3只小鼠的外周血DNA,分别等量混匀,用NanoDrop和琼脂糖凝胶电泳检测基因组DNA的纯度及完整性,采用Covaris超声仪对基因组DNA进行超声随机片段化,片段化后对其末端进行修复,在3′端加A,连接接头,连接产物用Qubit DNABR ASSAY KIT进行定量,用DNA甲基化特异抗体对连接纯化产物(400 ng)进行甲基化位点富集,37℃0.5~1 h孵育反应,然后清洗收集抗体富集的DNA,用于后续PCR;PCR产物切胶纯化,建立文库,上机测序,完成MeDIP-seq。
1.2.6差异甲基化基因筛选根据MeDIP-seq测序结果,计算差异甲基化基因的差异倍数Fold Change,利用统计学分析检验P值(Fold Change > 2,P < 0.01为甲基化水平上调;Fold Change < 0.5,P < 0.01为甲基化水平下调)。
1.2.7生物信息学分析应用InterProScan软件对差异甲基化基因进行GO(gene ontology)基因注释和GO功能分类分析,利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对差异甲基化基因进行信号通路分析。
2 结果
2.1成功建立aGVHD小鼠模型(1)移植对照组小鼠于移植后3~4 d即出现体质量减轻、弓背、腹泻、毛发杂乱等aGVHD表现,13 d内全部死亡;5-Azac实验组小鼠于移植后7 d出现弓背、腹泻、脱毛等aGVHD表现,但症状较轻,移植后第12天体质量逐渐回升,部分小鼠生存期已达30 d,生存时间显著延长,其生存率和平均体质量变化见图1、2。(2)移植组对照组肝脏表现为肝细胞肿胀变性,淋巴细胞浸润并伴有局部性坏死,呈现严重的排斥反应,见图3A;小肠表现为肠黏膜上皮细胞坏死,间质水肿,渗出液明显,见图4A。而5-Azac实验组小鼠组织病理切片H-E染色显示该组小鼠免疫排斥反应较轻,见图3B、4B。

Fig. 1 Comparison of survival time of mice between two groups图1 2组小鼠生存时间比较

Fig. 2 Comparison of average body weight of mice between two groups图2 2组小鼠平均体质量的变化
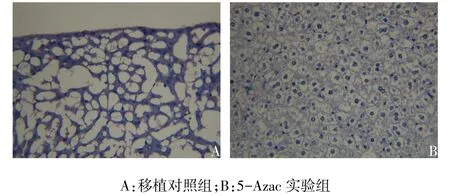
Fig. 3 Pathological changes of livers in two groups(×400)图3 2组肝脏组织病理表现(×400)

Fig. 4 Pathological changes of small intestines in two groups(×200)图4 2组小肠组织病理表现(×200)
2.2差异甲基化基因的筛选及通路分析根据Fold Change>2或<0.5,P < 0.01的筛选标准,5-Azac实验组和移植对照组比较启动子区存在369个差异甲基化基因,其中上调239个、下调130个;外显子区存在184个差异甲基化基因,其中上调113个、下调71个。利用KEGG数据库对差异甲基化基因进行分析发现,它们参与了B细胞受体等10个免疫学相关的信号通路,见表1。其中差异甲基化基因TGF-β、GSK-3β、SYK、PI3K、NFAT、CD28、α4β7与aGVHD的发生发展密切相关,见图5。

Tab. 1 Differentially methylated gene involved immune signaling pathways表1 差异甲基化基因参与的免疫反应通路

Fig. 5 The ratio and function of differential methylation gene图5 aGVHD相关基因的甲基化差异倍数及其功能
3 讨论
3.15-Azac在aGVHD中的作用异基因造血干细胞移植是目前治疗白血病的重要手段,但术后aGVHD是导致移植失败和死亡的主要原因[4]。aGVHD是一种特异的免疫现象,免疫学反应在同种异体造血干细胞移植中起关键作用[5]。文献报道基于非基因序列改变所致基因表达水平变化的表观遗传学修饰作用可有效调节机体免疫功能,减轻aGVHD症状,诱导机体免疫低反应。5-Azac作为一种调节基因转录水平的药物,可以使DNA甲基化转移酶(DNA methyltransferase,DNMT)共价结合到DNA上,形成广泛的蛋白-DNA交联体,导致DNMT蛋白水平降低,最终导致基因组广泛去甲基化和基因的再活化。研究发现5-Azac具有免疫调节作用,成为治疗aGVHD的新靶点[6]。本研究结果显示,5-Azac可有效延长小鼠的生存时间,减轻排斥反应,成功诱导小鼠免疫低反应状态。
3.25-Azac对基因甲基化水平的影响2组小鼠DNA MeDIP-seq测序结果对比显示,5-Azac实验组启动子区与外显子区分别存在有369和184个差异甲基化基因,其中TGF-β、GSK-3β、SYK、PI3K、NFAT、CD28、α4β7等基因与aGVHD密切相关,TGF-β、GSK- 3β甲基化水平下调,SYK、PI3K、NFAT、CD28、α4β7上调。利用KEGG数据库对差异甲基化基因的生物学通路分析发现其参与了B细胞受体信号通路等10个免疫反应相关信号过程。这些信号通路的变化与移植排斥反应、哮喘、移植物抗宿主病、先天性免疫缺陷等免疫相关性疾病的发生发展紧密相关。
3.3差异甲基化基因与免疫耐受的关系转化生长因子(TGF)-β作为一种免疫抑制因子,参与天然免疫和获得性免疫细胞的增殖、活化与分化过程。TGF-β可能通过其强大的免疫调节作用对aGVHD发生过程中的多个重要环节进行综合调控。实验证明药物诱导或增强TGF-β信号通路可以增加调节性T细胞(Tregs)的细胞数量[7]。也有研究发现人类脐带血来源的干细胞可以通过TGF-β/Smad3信号通路诱导免疫耐受[8]。因此增强TGF-β可有效减轻或抑制aGVHD的发生。糖原合成激酶(GSK)-3β是一种多功能的丝氨酸/苏氨酸蛋白激酶,可调控炎症过程,参与白细胞介素(IL)-10和肿瘤坏死因子(TNF)等多种细胞因子和炎症介质表达的调节,在aGVHD的过程中GSK-3β蛋白表达水平降低,可以作为诊断aGVHD的生物标志物[9],而本实验结果显示5-Azac可以使GSK-3β DNA甲基化水平降低,有利于促进其蛋白的表达,诱导aGVHD免疫低反应。TGF-β、GSK-3β对aGVHD起正向调控作用,其甲基化水平降低,会导致其表达水平升高,利于诱导aGVHD免疫低反应。
酪氨酸激酶(SYK)在T细胞和B细胞的成熟过程中起重要作用。Flynn等[10]证实使用SYK基因抑制剂可以有效诱导人类慢性移植物抗宿主病cGVHD患者B淋巴细胞凋亡,阻断B细胞的SYK基因信号通路是治疗cGVHD的潜在新靶点。磷脂酰肌醇-3激酶(PI3K)是一种与细胞内信号转导有关的脂类第二信使,PI3K-AKT信号转导通路对炎症介质的释放过程和炎症细胞的增生过程发挥重要的调节作用。Lai等[11]通过基因表达谱分析鉴定出PI3K可以作为cGVHD的新的生物学标志物。Berges等[12]证实同时抑制PI3K/AKT信号途径和热休克蛋白Hsp90可以抑制T细胞的功能,增加Tregs数量,是预防和治疗aGVHD的理想选择。活化T细胞核因子(NFAT)是一类转录因子家族,在免疫反应中对诱导基因转录起重要作用。抑制T细胞NFAT基因不仅可以减轻aGVHD,还可以维持抗肿瘤活性[13]。α4β7又名整合素,在免疫系统介导的炎症中起重要作用,可以介导炎症细胞向病灶部位迁移和聚集[14]。在aGVHD患者的记忆性CD8+T淋巴细胞上α4β7表达水平明显升高,可以作为aGVHD治疗的新靶点[15]。CD28是一种参与T细胞活化的共刺激分子,它参与T细胞活化信号的转导,使T细胞活化、增殖、启动和维持免疫应答。由CD28介导的共刺激通路在引起同种异体抗原应答的免疫反应中起关键作用。文献报道药物阻断CD28可以减轻aGVHD反应[16-17]。SYK、PI3K、NFAT、CD28、α4β7基因对aGVHD起负向调控作用,其甲基化水平升高会导致其表达水平降低,利于诱导aGVHD免疫低反应。
综上所述,5-Azac可以通过改变基因的甲基化状态诱导aGVHD的免疫低反应,为临床应用表观遗传学药物减轻aGVHD提供理论依据,为aGVHD的治疗提供新的思路和见解。另外,5-Azac实验组出现了基因甲基化上调的现象,其上调的分子机制有待进一步研究。
参考文献
[1] Brennan TV, Rendell VR, Yang Y. Innate immune activation by tis⁃sue injury and cell death in the setting of hematopoietic stem cell transplantation [J]. Front Immunol, 2015, 6: 101. doi: 10.3389/fim⁃mu.2015.00101.
[2] Breccia M, Molica M, Zacheo I, et al. Azacitidine for myelodysplas⁃tic patients aged > 65 years: a review of clinical efficacy [J]. Expert Opin Pharmacother, 2014, 15(11): 1621- 1630. doi: 10.1517/ 14656566.2014.936849.
[3] Bontkes HJ, Ruben JM, Alhan C, et al. Azacitidine differentially af⁃fects CD4+T-cell polarization in vitro and in vivo in high risk my⁃elodysplastic syndromes [J]. Leuk Res, 2012, 36(7): 921-930. doi: 10.1016/j.leukres.2012.03.026.
[4] Levine JE, Hogan WJ, Harris AC, et al. Improved accuracy of acute graft-versus-host disease staging among multiple centers [J]. Best Pract Res Clin Haematol, 2014, 27(3-4): 283-287. doi: 10.1016/j. beha.2014.10.011.
[5] Mosaad YM. Immunology of hematopoietic stem cell transplant [J]. Immunol Invest, 2014, 43(8): 858-887. doi: 10.3109/08820139.2014. 942460.
[6] Goodyear OC, Dennis M, Jilani NY, et al. Azacitidineaugments ex⁃pansion of regulatory T cells after allogeneic stem cell transplanta⁃tionin patients with acute myeloid leukemia (AML) [J]. Blood, 2012, 119(14): 3361-3369. doi: 10.1182/blood-2011-09-377044.
[7] Sawamukai N, Satake A, Schmidt AM, et al. Cell-autonomous role of TGF-β and IL-2 receptors in CD4+and CD8+inducible regulato⁃ry T-cell generation during GVHD [J]. Blood, 2012, 119(23): 5575-5583. doi: 10.1182/blood-2011-07-367987.
[8] Zhang C, Zhang X, Chen XH. Hypothesis: human umbilical cord blood-derived stromal cells regulate the foxp3 expression of regula⁃tory T cells through the TGF-β1/Smad3 pathway [J]. Cell Biochem Biophys, 2012, 62(3): 463-466. doi: 10.1007/s12013-011-9328-8.
[9] Orbach A, Bassan-Levin T, Dan P, et al. Utilizing glycogen syn⁃thase kinase-3β as a marker for the diagnosis of graft-versus-host disease[J]. Transplant Proc, 2013, 45(5): 2051-2055. doi: 10.1016/j. transproceed.2012.11.026.
[10] Flynn R, Allen JL, Luznik L, et al. Targeting Syk-activated B cells in murine and human chronic graft-versus-host disease [J]. Blood, 2015, 125(26): 4085-4094. doi:10.1182/blood-2014-08-595470.
[11] Lai P, Weng J, Lu Z, et al. Gene expression profiling-based identifi⁃cation of CD28 and PI3K as new biomarkers for chronic graft-ver⁃sus-host disease [J]. DNA Cell Biol, 2011, 30(12): 1019-1025. doi: 10.1089/dna.2011.1284.
[12] Berges C, Bedke T, Stuehler C, et al. Combined PI3K/Akt and Hsp90 targeting synergistically suppresses essential functions of al⁃loreactive T cells and increases Tregs [J]. J Leukoc Biol, 2015, 98 (6):1091-1105. doi:10.1189/jlb.5A0814-413R.
[13] Vaeth M, Bäuerlein CA, Pusch T, et al. Selectiven NFAT targeting in T cells ameliorates GVHD while maintaining antitumor activity [J]. Proc Natl Acad Sci U S A, 2015, 112(4) 1125- 1130. doi: 10.1073/pnas.1409290112.
[14] Evans-Marin HL, Cong Y. Gut homing molecule regulation of the pathogenesis and treatment of inflammatory bowel diseases [J]. In⁃flamm Allergy Drug Targets, 2015, 14(1):4-12.
[15] Chen YB, McDonough S, Chen H, et al. Expression of α4β7 integ⁃rin on memory CD8+T cells at the presentation of acute intestinal GVHD [J]. Bone Marrow Transplant, 2013, 48(4): 598- 603. doi: 10.1038/bmt.2012.191.
[16] Akieda Y, Wakamatsu E, Nakamura T, et al. Defects in regulatory T cells due to CD28 deficiency induce a qualitative change of alloge⁃neic immune response inchronic graft-versus-host disease [J]. J Im⁃munol, 2015, 194(9): 4162-4174. doi: 10.4049/jimmunol.1402591.
[17] Li J, Semple K, Suh WK, et al. Roles of CD28, CTLA4, and induc⁃ible costimulator in acute graft-versus-host disease in mice [J]. Bi⁃ol Blood Marrow Transplant, 2011, 17(7): 962-969. doi: 10.1016/j. bbmt.2011.01.018.
(2015-09-09收稿2015-09-24修回)
(本文编辑李鹏)
作者单位:天津医科大学基础医学院生物学教研室(邮编300070)
Analysis of DNA methylation with 5-Azac induced immune hyporesponsiveness following acute graft-versus-host disease
ZHANG Xiaoning,ZHAO Yuxia,WANG Jianhai,MIAO Xuhong,LI Keqiu,LI Guang△
Department of Biology, Basic Medical College, Tianjin Medical University, Tianjin 300070, China
△Corresponding Author E-mail:lig@tmu.edu.cn
Abstract:Objective To analyse the change of DNA methylation with 5-Azac injection in acute graft-versus-host dis⁃book=174,ebook=51ease (aGVHD) mouse model, which received allogeneic bone marrow transplantation, and explore the immunomodulatory ef⁃fects of 5-Azac. Methods Male C57BL/6 (H-2b)and female BALB/c (H-2d) mice were selected as donor and recipient of complete allotransplantation. BABL/c mice were divided into two groups, transplantation control group and 5-Azac experi⁃mental group. At 1-7, 14, 21 and 28-day after transplantion, 5-Azac 0.25 mg/kg (0.3 mL/time) was injected by tail vein in experimental group, while the control group were injected with sterile water 0.3 mL/time. Peripheral blood DNA samples were collected from three control mice and three experimental mice, then mixed with equal amount respectively. The MeDIP-seq method was selected to detect methylation changes in mice, and the differential DNA methylation in the biological path⁃ways was analyzed. Results The survival time was prolonged, and the rejection reaction was decreased in 5-Azac experi⁃mental group, which suggested immune hyporesponsiveness post aGVHD. The MeDIP-seq result showed that 369 different DNA methylation located in the promoter regions, including 239 up-regulated genes and 130 down-regulated genes. There were 184 differential DNA methylation genes located in the exon regions, including 113 up-regulated genes and 71 downregulated genes. Differential DNA methylation genes involved in 10 immunological signaling pathways, respectively. Among them, TGF-β, GSK-3β, SYK, PI3K, NFAT, CD28 and α4β7 were closely related to the development of aGVHD. Conclu⁃sion 5-Azac can effectively induce immune hyporesponsiveness post aGVHD by changing the gene methylation status.
Key words:graft vs host disease;methylation;5-azacytidine;MeDIP-seq;immune hyporesponsiveness
中图分类号:R318.06
文献标志码:A
DOI:10.11958/20150153
基金项目:国家高技术研究发展计划(863计划)资助项目(2012AA021003);国家自然科学基金资助项目(21177091)
作者简介:张晓宁(1990),男,硕士在读,主要从事免疫耐受方面研究
