龙眼生长素受体基因TIR1的克隆及表达分析
2016-05-30赖瑞联钟春水林玉玲赖钟雄
赖瑞联 钟春水 林玉玲 赖钟雄

摘 要 为进一步明确龙眼生长素受体基因TIR1的结构和功能,本试验采用RT-PCR和RACE-PCR对龙眼胚性愈伤组织2个TIR1基因(分别命名DlTIR1-1和DlTIR1-2)进行克隆,并进行生物信息学和表达分析。研究结果表明:DlTIR1-1全长4 343 bp,包含ORF 1 755 bp,编码584个氨基酸(GenBank登录号:KR558759),而DlTIR1-2全长2 821 bp,包含ORF 1 926 bp,编码641个氨基酸(GenBank登录号:KR558760)。生物信息学分析结果表明,DlTIR1-1和DlTIR1-2理化性质较为一致,均属于不稳定蛋白,不含信号肽,具有跨膜螺旋;亚细胞定位于细胞质中,分别含有31个和45个蛋白磷酸化位点;系统进化树分析显示,DlTIR1-1与十字花科的亚麻荠和甜菜处于同一分支,而DlTIR1-2与甜橙和胡杨等木本植物保持较近的遗传距离。qPCR结果表明,DlTIR1-1和DlTIR1-2在龙眼体胚发生过程中和不同组织器官中的表达模式较为一致,且在非胚性愈伤组织、根和花中表达量最高;此外,在一定的浓度范围内,IAA、ETH、ABA和GA3均能适当提高龙眼TIR1的表达量,而添加MeJA却明显抑制TIR1的转录。上述结果表明,DlTIR1-1和DlTIR1-2可能具有相似功能,且均参与龙眼非胚性愈伤组织形成、根系分化以及花器官发育,此外龙眼生长素信号转导途径可能受多种植物激素调控。
关键词 龙眼;TIR1;体细胞胚胎发生;激素
中图分类号 S667.2 文献标识码 A
Abstract To investigate the characteristic and function of TIR1 in longan, RT-PCR and RACE-PCR were used to clone 2 TIR1 genes(named DlTIR1-1 and DlTIR1-2)from embryogenic callus of Dimocarpus longan Lour., and then the expression patterns of the 2 genes were analyzed by qPCR. The results showed that, the sequence of DlTIR1-1 was 4 343 bp, containing ORF sequence 1 755 bp, encoding 584 amino acids(GenBank accession number KR558759), and the sequence of DlTIR1-2 was 2 821 bp, containing ORF 1 926 bp, encoding 641 amino acids(GenBank accession number KR558760). Bioinformatics analysis showed that the physical and chemical properties of DlTIR1-1 and DlTIR1-2 were similar, they were unstable proteins, had no signal peptide, but had transmembrane structure. Phylogenetic tree analysis indicated that DlTIR1-1 belonged to the same branch with Camelina sativa and Beta vulgaris subsp, when DlTIR1-2 kept close genetic distance with Populus euphratica and Citrus sinensis. qPCR results showed that DlTIR1-1 and DlTIR1-2 had the consistent expression pattern in somatic embryogenesis, different tissues and treatments by different hormones, and both genes had the highest expressions in non-embryogenic callus, roots and flowers of longan. In addition, DlTIR1-1 and DlTIR1-2 had different expression patterns under different treatments of IAA, ABA, GA3, MeJA and ETH. The results indicated that, DlTIR1-1 and DlTIR1-2 had the similar function in the process of NEC growth, root differentiation and floral organ development of longan. In addition, the auxin signal transduction of longan might be regulated by several kinds of hormones.
Key wards Dimocarpus longan Lour.; TIR1; Somatic embryogenesis; Hormones
doi 10.3969/j.issn.1000-2561.2016.01.023
龍眼(Dimocarpus longan Lour.),无患子科龙眼属,又称桂圆、益智,其果实富含多糖、多酚、粗蛋白和维生素等多种营养和药用成分,是中国热带亚热带地区重要果树。龙眼体细胞胚胎发生(简称体胚发生)系统作为木本植物优良的模式系统之一,是开展植物胚胎发育研究良好的替代材料。研究表明,生长素能够调控植物体胚发生,而生长素受体是生长素信号转导途径的关键因子,因此开展生长素受体相关研究对于进一步揭示植物体胚发生的机理以及生长素在体胚发生中的响应机制具有重要意义。
2005年,Dharmasiri等[1]首次成功证实生长素运输抑制剂响应蛋白(Transport Inhibitor Response 1,TIR1)为植物的生长素受体。随后,TIR1的作用机理及其在不同植物中的功能也越来越受关注。植物体Aux/IAA蛋白质中包含4个保守结构域,其中结构域Ⅱ为TIR1结合域以及Aux/IAA蛋白的去稳定性区域,而结构域Ⅲ和Ⅳ是生长素应答因子ARF的结合部位。当细胞内未检测生长素信号时,Aux/IAA与ARF结合抑制其转录;而生长素信号出现后,生长素作为“分子胶黏剂”活化TIR1使其与Aux/IAA蛋白的结构域Ⅱ结合,Aux/IAA从染色体上脱落,形成SCFTIR1-Aux/IAA复合体被泛素化,并迅速被26S蛋白酶体降解,ARF被释放并开始转录[2-5]。
TIR1作为生长素受体对植物生长发育具有重要调控功能。研究发现,TIR1能够改变李果实成熟进程[6],促进拟南芥根系形成[7-8],参与茶树冬芽休眠[9]等。此外,TIR1与其调控miRNA互作可提高水稻分蘖[10]和玉米抗病[11]。而在龙眼中,TIR1同样参与了体胚发生过程,但目前相关研究较少[12]。鉴于此,本试验以龙眼胚性愈伤组织为材料,采用RT-PCR和RACE-PCR对TIR1基因进行分离和克隆,同时通过qPCR技术对龙眼不同组织器官、不同体胚发育阶段以及不同激素作用下TIR1的表达模式进行研究,以期进一步揭示龙眼TIR1的功能。
1 材料与方法
1.1 材料
龙眼‘红核子品种胚性愈伤组织由福建農林大学园艺植物生物工程研究所提供[13]。龙眼体胚不同发育阶段培养物参照赖钟雄[13]建立的方法培养获得,包括非胚性愈伤组织(NEC)、胚性愈伤组织(EC)、体胚发生早期的不完全胚性紧实结构(IcpEC)、球形胚(GE)以及后期的子叶胚(CE)5种。不同激素处理材料为MS液体培养基中分别添加不同浓度生长素(IAA)、脱落酸(ABA)、赤霉素(GA3)、茉莉酸甲酯(MeJA)和乙烯(ETH)进行24 h处理的龙眼EC。此外,试验所用的‘四季蜜龙眼根、叶、花、果和种子等不同组织器官于2014年11月采自福建省莆田农科所果树良种繁育场。
1.2 方法
1.2.1 总RNA提取及cDNA逆转录 龙眼体胚不同发育阶段培养物以及不同激素处理的EC采用Tripue试剂盒进行RNA提取,而龙眼根、叶、花、果实和种子采用天根多糖多酚试剂盒进行RNA抽提,RNA质量和浓度检测合格后采用GeneRacerTM Kit逆转录cDNA用于RT-PCR,采用PrimerscriptTM RT Reagent Kit逆转录cDNA用于qPCR。具体操作步骤参考使用说明书。
1.2.2 TIR1基因克隆 根据基因功能注释从本研究所龙眼胚性愈伤组织转录组数据库(GenBank登录号:SRA059205)筛选表达量较高的TIR1部分序列信息,通过Blast从NCBI数据库中搜索并下载与之同源性较高的其他物种TIR1完整序列,再采用同源克隆进行保守区序列扩增。随后,参照陈裕坤等[14]的方法进行3′末端和5′末端序列扩增、TIR1序列拼接以及TIR1全长验证。试验所用引物均购自北京六合华大基因科技股份有限公司,具体信息如表1所示。
RT-PCR扩增程序和反应体系参考李惠华等[12]建立的方法,并根据所用引物TM值和扩增片段长度的不同适当调整。获得的目的片段进行割胶回收,TA克隆并挑选阳性克隆子进行菌液PCR,再将具有相应目的条带的菌液送上海博尚生物技术有限公司测序。
1.2.3 生物信息学分析 采用ExPASy ProtParam进行翻译蛋白的理化性质预测;采用TMHMM 2.0进行跨膜结构预测与分析;采用SignaIP 3.0 Server进行信号肽预测;采用PSORT进行亚细胞定位;采用Jpred进行蛋白质二级结构预测;采用SWISS-MODEL进行蛋白质三维结构预测;采用NetPhos 2.0进行磷酸化位点预测与分析;采用MEGA 5.2.2邻位归并法(NJ)构建系统进化树。
1.2.4 qPCR分析 参考Lin等[15-16]建立的方法,以龙眼EIF4a、EF-1a和FSD作为内参基因。采用LightCyclers480和SYBRRPrumix EX TaqTMⅡ 进行龙眼不同体胚发育阶段、不同组织器官以及不同激素处理下TIR1表达模式的qPCR试验,并通过Excel2003进行数据分析和图表制作,同时采用SPSS19.0进行不同表达水平之间的差异显著性分析。
2 结果与分析
2.1 DlTIR1-1和DlTIR1-2 cDNA全长序列获得
从龙眼转录组数据库中筛选得到2条表达量较高的龙眼TIR1序列,分别命名DlTIR1-1和DlTIR1-2。DlTIR1-1序列长度为4 182 bp,包含完整的ORF序列,但中间存在部分碱基缺失。以龙眼胚性愈伤组织cDNA为模板,两端设计上下游引物PCR扩增完整ORF序列;随后分别设计3′RACE和5′RACE引物,采用RACE-PCR技术扩增获得3′UTR和5′UTR分别为128、162 bp。拼接比对获得DlTIR1-1 cDNA序列4 335 bp,两端设计特异引物全长验证发现DlTIR1-1 cDNA全长为4 343 bp,其中包含ORF 1 755 bp,编码584个氨基酸,5′UTR为356 bp,起始密码子为ATG,3′UTR为2 232 bp,终止密码子为TAA,PolyA尾长度为26 bp。将该序列通过NCBI进行Blast,其与柑橘的相似性达到81%,而与麻风树和胡杨的相似性均为80%,说明该基因为龙眼TIR1家族成员。而DlTIR1-2在龙眼转录组数据库中的序列长度为1 633 bp,利用NCBI进行Blast发现,DlTIR1-2与柑橘、蓖麻和葡萄具有很高的同源性,而5′端区域仍有较多的缺失,通过同源克隆扩增5′端序列981 bp,随后RACE-PCR得到3′RACE和5′RACE片段分别246、104 bp,拼接发现DlTIR1-2基因cDNA全长为2 821 bp,全长验证结果与该拼接结果一致,DlTIR1-2包含1 926 bp ORF序列,共编码641个氨基酸,5′UTR为364 bp,起始密码子为ATG,3′UTR为531 bp,终止密码子为TGA,PolyA尾长度为43 bp。通过NCBI进行Blast发现,DlTIR1-2与葡萄、杨树和麻风树的相似性均达到79%,也是龙眼TIR1基因的一员。
2.2 生物信息学分析
DlTIR1-1和DlTIR1-2理化性质分析结果如表2所示,2个蛋白之间理化性质指标差异较小,且均为不稳定亲水性蛋白质;亚细胞定位分析显示DlTIR1-1和DlTIR1-2可能定位于细胞质中;而ExPASy TMpred预测表明二者均含有跨膜螺旋;NetPhos分析表明DlTIR1-1含有31个蛋白磷酸化位点(Ser:22,Thr:6,Tyr:3),而DlTIR1-2有45个(Ser:34,Thr:7,Tyr:4)。
采用Jpred进行蛋白质二级结构预测发现,DlTIR1-1编码的氨基酸序列主要包含α-螺旋和β-折叠,分别占35.05%和6.23%,可能存在的功能位点包括5个N-糖基化位点、2个依赖cAMP和cGMP蛋白激酶磷酸化位点、5个蛋白激酶C磷酸化位点、8个蛋白激酶Ⅱ磷酸化位点以及3个N-豆蔻酰化位点;而DlTIR1-2中α-螺旋和β-折叠比例分别为35.56%和8.03%,包含的功能位点有6个N-糖基化位点、1个依赖cAMP和cGMP蛋白激酶磷酸化位点、6个蛋白激酶C磷酸化位点、8个蛋白激酶Ⅱ磷酸化位点以及4个N-豆蔻酰化位点。进一步通过Swiss-Model进行三维结构分析发现,这2种氨基酸序列与拟南芥TIR1(PDB:3c6o.1.B)相似度分别为58.56%和50.36%,以该TIR1为模型构建DlTIR1-1和DlTIR1-2三维结构如图1所示。
DlTIR1-1、DlTIR1-2與其他物种TIR1进行比对结果如图2所示,2条氨基酸序列含有F-box结构域。进一步进行TIR1系统进化树分析发现不同物种的TIR1氨基酸序列大体可以分为3个大类,其中甜橙、胡杨、苹果等大部分木本植物进化距离较近,其他类草本植物归为另一类,此外,十字花科的甜菜和亚麻荠又单独归类。龙眼DlTIR1-2与木本植物保持了较近的进化距离,例如甜橙和胡杨等,而龙眼DlTIR1-1与十字花科的亚麻荠和甜菜保持较近的亲缘关系(图3)。
2.3 DlTIR1-1和DlTIR1-2转录水平的qPCR分析
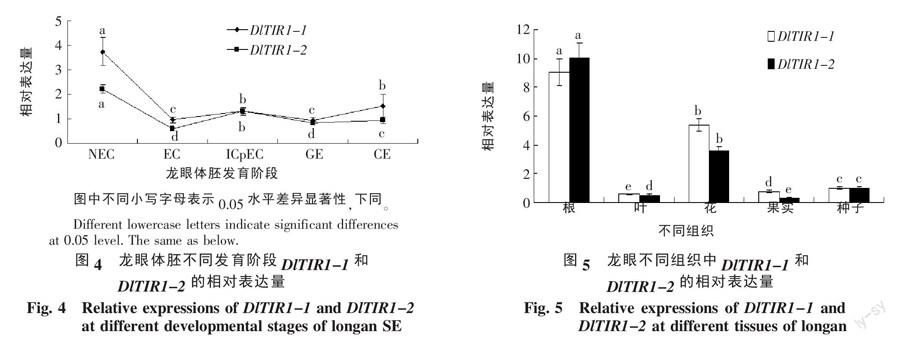
2.3.1 DlTIR1-1和DlTIR1-2在龙眼体胚不同发育阶段转录水平的qPCR分析 DlTIR1-1和DlTIR1-2在龙眼体胚不同发育阶段的表达模式如图4所示,在龙眼体胚不同发育阶段,DlTIR1-1和DlTIR1-2的表达趋势较为一致,均先降后升再降,近似“W”模型。DlTIR1-1和DlTIR1-2在龙眼体胚发生过程不同阶段的表达差异较大,且非胚性愈伤组织中的表达量(NEC)明显高于体胚发生其他阶段。而在同一个阶段的培养物中,除不完全胚性紧实结构外,DlTIR1-1在其他阶段的表达量均高于DlTIR1-2。可见DlTIR1-1和DlTIR1-2可能在龙眼体胚发挥过程中发挥重要的调控功能,且DlTIR1-1的调控作用更为显著。
2.3.2 DlTIR1-1和DlTIR1-2在‘四季密龙眼不同组织器官中转录水平的qPCR分析 龙眼根、叶、花、果实和种子等组织器官中DlTIR1-1和DlTIR1-2的表达模式如图5所示。DlTIR1-1和DlTIR1-2在不同组织器官中的表达趋势一致,在根中的表达量最高,其次是花,而在叶片和果实中的表达量最低。此外,同一个基因在不同组织器官中的表达具有显著差异,DlTIR1-1在根中的相对表达量达到9.032,而最低时在叶片中的表达量仅为0.603,仅为前者的1/15;DlTIR1-2在根中的相对表达量为10.020,而最低时在果实中的表达量0.343,相差29倍。可见,DlTIR1-1和DlTIR1-2在龙眼不同组织器官中存在较大的功能差异,可能参与了根系的分化和花器官发育。
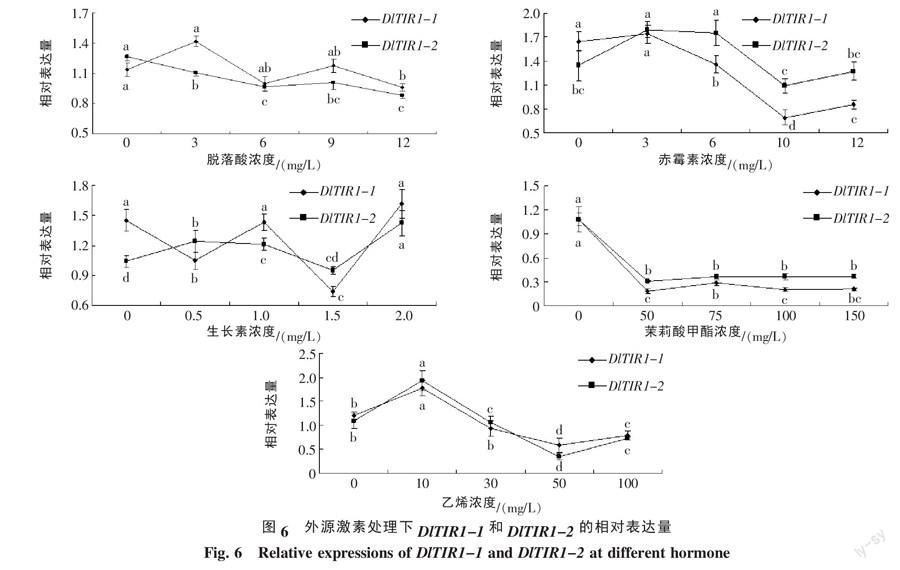
2.3.3 DlTIR1-1和DlTIR1-2在不同激素处理下表达模式的qPCR分析 不同浓度ABA、GA3、IAA、MeJA和ETH处理下DlTIR1-1和DlTIR1-2的表达模式如图6所示,2个基因对不同种类和不同浓度激素均有响应,且在同一激素处理下,二者表达趋势较为相似。采用ABA不同浓度处理时,DlTIR1-1的表达随着ABA浓度的升高先升后降,而DlTIR1-2表达量则逐步下调;在GA3和IAA不同浓度处理下,DlTIR1-1均为先上升后下降,而DlTIR1-2表达趋势与DlTIR1-1略有差异。试验中,DlTIR1-1和DlTIR1-2对ABA、GA3和IAA的响应较弱,而受MeJA和ETH影响较为显著。采用50 mg/L的MeJA处理时,DlTIR1-1和DlTIR1-2的表达迅速下降,随着浓度继续升高,二者的表达量有所上升,但上升幅度较小,远比处理前的表达水平低;ETH处理中,DlTIR1-1和DlTIR1-2的转录水平迅速上调,随后下降,并在10 mg/L时表达量达到最大。可见,ABA、GA3、IAA、MeJA和ETH可能参与了DlTIR1-1和DlTIR1-2介导的龙眼生长素信号的转导,而不同TIR1成员对这些激素的敏感性和亲和力也有一定差异。
3 讨论与结论
3.1 DlTIR1-1和DlTIR1-2基因功能相似
长期以来,激素受体作为植物激素代谢和信号转导的关键因子一直是研究热点,而一种激素的不同受体也往往具有特异的作用方式[17-19]。2005年,Dharmasiri等[1]证实TIR1为植物生长素受体以后,TIR1基因及其调控功能在烟草[20]、黄瓜[21]、番茄[22]等多种植物中均有广泛研究。在龙眼中,李惠华等[12]也进行了TIR1的初步研究,然而,作为一个多基因家族,龙眼TIR1仍缺乏较为系统全面的研究,对其功能调控方式的系统阐释形成了较大的局限。本试验通过对龙眼TIR1基因进一步挖掘和分析发现,DlTIR1-1和DlTIR1-2翻译的氨基酸序列具有相似的理化性质且二者在龙眼体胚发生过程、组织器官分化以及不同激素响应过程中的表达模式具有较高的一致性。由此可见,龙眼DlTIR1-1和DlTIR1-2在进化上具有一定的保守性和功能相似性。
3.2 TIR1可能调控龙眼体胚发生
植物的生长发育是由复杂的基因调控网络共同作用的结果。在龙眼体胚发生相关研究中发现龙眼TIR1[12]会响应内外源生长素的综合作用,而生长素受体下游基因DlARF1[23]和DlARF5a[24]作为抑制型的生长素应答因子在体胚发生过程中与前者表达趋势相反,进一步验证生长素信号转导途径参与了龙眼体胚发生。然而,早期研究中,龙眼非胚性愈伤组织作为一个重要的材料却很少见报道。本试验分别对龙眼非胚性愈伤组织和体胚发生过程进行研究,发现DlTIR1-1和DlTIR1-2在体胚发生过程中的表达与李惠华等[12]研究结果较为一致,而在龙眼非胚性愈伤组织中的表达却远高于其他阶段,二者在龙眼体胚发生整个过程中的表达呈现较大的时间差异性,由此可见龙眼TIR1基因不同时间的差异表达参与了龙眼体胚发生,其在龙眼非胚性愈伤组织的形成和生长过程中可能也发挥更重要的调控作用。
3.3 TIR1的组织特异表达可能参与龙眼组织器官分化
在不同植物组织器官TIR1基因的表达研究中,CsTIR1[9]在茶树叶片中的表达量最高,根和花中的表达量最低,MaTIR1[25]在桑树叶片和根中的表达量最高。由此可见,TIR1的组织特异性表达可能与不同物种组织的形成方式和所行使的生物学功能有关。在本试验中,龙眼DlTIR1-1和DlTIR1-2在龙眼根系中的表达量最高,其次是花,推测该TIR1可能参与龙眼根系分化和开花过程。而在拟南芥的研究中,王金祥等[26]和Chen等[27]等发现拟南芥TIR1突变体或抑制TIR1表达会减少不定根和侧根的形成,而TIR1过表达则增加侧根的数目,即TIR1调控拟南芥根系形成过程,与本研究结果一致。而在TIR1调控植物开花的研究中,董秀春[28]通过遗传转化也验证了毛白杨PtTIR1基因具有调控花发育功能。由此可见,龙眼TIR1的组织特异表达可能参与组织器官的形成,尤其可能与根系分化和花器官发育密切相关。
3.4 植物激素可能调控龙眼生长素信号转导
植物体中激素的调控作用具有偶联效应,一种植物激素往往能够通过复杂的调控网络体系影响其他激素的作用[29]。已有研究表明,茶树[9]和南瓜[21]等TIR1受IAA、ABA、MeJA、GA3等多种植物激素的影响,但不同物种TIR1对这些激素的亲和力和敏感性差异较大。试验中,DlTIR1-1和DlTIR1-2对IAA、ABA、MeJA、GA3和ETH均有响应,但不同激素对基因的影响效果差异较大,且同一种激素处理下2个基因间同样存在表达差异。在一定的浓度范围内,IAA、ETH、ABA和GA3均能适当提高龙眼TIR1的表达量,而添加MeJA却明显抑制TIR1的转录。TIR1作为生长素受体会响应IAA的诱导作用,但Badescu等[30]研究表明不同基因对其亲和作用不同,故在0~2 mg/L范围内,DlTIR1-1的响应效果均较明显,而在0~1.5 mg/L范围内DlTIR1-2的几乎不发生改变;Sunker等[31]认为ABA能够上调miR393的表达,而miR393会裂解TIR1,故本试验中2个基因随ABA浓度的升高逐步下调表达;Ouaked等[32]研究表明,乙烯信号转导的一部分是生长素信号转导的第二信使,二者之间可能存在一个连接点,故乙烯浓度的变化会影响TIR1的转录水平;在GA3和生长素的互作关系研究中,吴建明等[33]发现外源GA3会适当提高生长素的含量但差异并不显著,因此在本试验中,提高赤霉素的浓度时TIR1基因会适当上调表达,而浓度继续升高时,表达量下降,随后开始上升,但之间的调控幅度较小;Cai等[34]研究发现,MeJA信号转导途径会与生长素生物合成和极性运输串扰,这也是本试验中DlTIR1-1和DlTIR1-2劇烈响应MeJA变化的可能原因。综合分析,不同植物激素在一定程度上都会调控龙眼TIR1基因的表达,即不同植物激素可能调控龙眼生长素信号转导途径,而这种调控机制仍有待后期进一步验证。
参考文献
[1] Dharmasiri N, Dharmasiri S, Estelle M. The F-box protein TIR1 is an auxin receptor[J]. Nature, 2005, 435(7 041): 441-445.
[2] Dos Santos Maraschin F, Memelink J, Offringa R. Auxin-induced, SCFTIR1-mediated poly-ubiquitination marks AUX/IAA proteins for degradation[J]. The Plant Journal, 2009, 59(1): 100-109.
[3] 王 腾, 孙宏伟, 陈 兰, 等. 拟南芥 TIR1 与生长素 IAA 相互作用的分子对接及分子动力学研究[J]. 高等学校化学学报, 2009, 30(9): 1 835-1 838.
[4] Gray W M, Kepinski S, Rouse D, et al. Auxin regulates SCFTIR1-dependent degradation of AUX/IAA proteins[J]. Nature, 2001, 414(6 861): 271-276.
[5] Laskowski M. Model of the TIR1 pathway for auxin-mediated gene expression[J]. Science Signaling, 2006, 2006(322): tr1.
[6] El-Sharkawy I, Sherif S M, Jones B, et al. TIR1-like auxin-receptors are involved in the regulation of plum fruit development[J]. Journal of Experimental Botany, 2014, 65(18): 5 205-5 215.
[7] Scheitz K, Lüthen H, Schenck D. Rapid auxin-induced root growth inhibition requires the TIR and AFB auxin receptors[J]. Planta, 2013, 238(6): 1 171-1 176.
[8] Arase F, Nishitani H, Egusa M, et al. IAA8 involved in lateral root formation interacts with the TIR1 auxin receptor and ARF transcription factors in Arabidopsis[J]. PLoS One, 2012, 7(8): e43 414.
[9] 曹紅利, 岳 川, 周艳华, 等. 茶树生长素受体基因CsTIR1的克隆与表达分析[J]. 茶叶科学, 2015, 35(1): 45-54.
[10] Xia K, Wang R, Ou X, et al. OsTIR1 and OsAFB2 downregulation via OsmiR393 overexpression leads to more tillers, early flowering and less tolerance to salt and drought in rice[J]. PLoS One, 2012, 7(1): e30 039.
[11] Luo M, Gao J, Peng H, et al. MiR393-targeted TIR1-like (F-box)gene in response to inoculation to R. Solani in Zea mays[J]. Acta Physiologiae Plantarum, 2014, 36(5): 1 283-1 291.
[12] 李惠华, 赖钟雄, 苏明华, 等. 龙眼TIR1和ABP1基因的克隆及其在体胚发生过程中的表达分析[J]. 园艺学报, 2012, 39(2): 253-264.
[13] 赖钟雄. 龙眼生物技术研究[M]. 福州: 福建科学技术出版社, 2003: 18-22.
[14] 陈裕坤, 林玉玲, 田奇琳, 等. 龙眼胚性愈伤组织DlGRAS4 与DlGRAS54基因的克隆及表达分析[J]. 西北植物学报, 2014, 34(2): 215-224.
[15] Lin Y, Lai Z. Comparative analysis reveals dynamic changes in miRNAs and their targets and expression during somatic embryogenesis in longan(Dimocarpus longan Lour.)[J]. PLoS One, 2013, 8(4): e60 337.
[16] Lin Y, Lai Z. Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J]. Plant Science, 2010, 178(4): 359-365.
[17] Razem F A, El-Kereamy A, Abrams S R, et al. The RNA-binding protein FCA is an abscisic acid receptor[J]. Nature, 2006, 439(7 074): 290-294.
[18] Ariizumi T, Murase K, Sun T-p, et al. Proteolysis-independent downregulation of DELLA repression in Arabidopsis by the gibberellin receptor Gibber ellin Insensitive Dwarf1[J]. The Plant Cell Online, 2008, 20(9): 2 447-2 459.
[19] Klee H, Tieman D. The tomato ethylene receptor gene family: form and function[J]. Physiologia Plantarum, 2002, 115(3): 336-341.
[20] Tian Y, Zhang C, Yang H, et al. Molecular cloning and characterization of a Transport Inhibitor Response 1(TIR1)from Nicotiana tabacum[J]. Russian Journal of Plant Physiology, 2011, 58(1): 149-156.
[21] Cui L, Zhang T, Li J, et al. Cloning and expression analysis of Cs-TIR1/AFB2: the fruit development-related genes of cucumber(Cucumis sativus L.)[J]. Acta Physiologiae Plantarum, 2014, 36(1): 139-149.
[22] Qiao Y, Feng X, Liu Z, et al. Cloning and expression analysis of LeTIR1 in tomato[J]. Acta Biologica Cracoviensia Series Botanica, 2011, 53(2): 25-31.
[23] 李惠华, 赖钟雄, 苏明华, 等. 龙眼生长素应答因子基因克隆及其在体胚中的表达分析[J]. 西北植物学报, 2012, 32(12): 2 383-2 389.
[24] 林丽霞, 屈 莹, 徐 洋, 等. 龙眼体胚发生过程生长素响应因子DlARF5a的克隆及表达分析[J]. 西北植物学报, 2014, 34(6): 1 075-1 082.
[25] 唐 壮, 杜 伟, 李小玉, 等. 桑树TIR1基因的克隆及在组织器官和扦插生根过程的表达分析[J]. 蚕业科学, 2014, 40(5): 790-796.
[26] 王金祥, 陈碧丽, 廖 红, 等. 生长素, 乙烯和一氧化氮对拟南芥下胚轴插条形成不定根的调节[J]. 植物生理学通讯, 2009, 4(1): 986-990.
[27] Chen Z H, Bao M L, Sun Y Z, et al. Regulation of auxin response by miR393-targeted transport inhibitor response protein 1 is involved in normal development in Arabidopsis[J]. Plant molecular biology, 2011, 77(6): 619-629.
[28] 董秀春. 毛白杨生长素信号转导因子基因的分离与功能的初步分析[D]. 泰安: 山东农业大学, 2008: 78-89.
[29] Shan X, Yan J, Xie D. Comparison of phytohormone signaling mechanisms[J]. Current Opinion in Plant Biology, 2012, 15(1): 84-91.
[30] Badescu G O, Napier R M. Receptors for auxin: will it all end in TIRs?[J]. Trends in plant science, 2006, 11(5): 217-223.
[31] Sunkar R, Zhu J K. Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis[J]. The Plant Cell Online, 2004, 16(8): 2 001-2 019.
[32] Ouaked F, Rozhon W, Lecourieux D, et al. A MAPK pathway mediates ethylene signaling in plants[J]. The EMBO Journal, 2003, 22(6): 1 282-1 288.
[33] 吳建明, 李杨瑞, 杨 柳, 等. 赤霉素诱导甘蔗节间伸长与内源激素变化的关系[J]. 热带作物学报, 2009, 30(10): 1 452-1 457.
[34] Cai X, Xu P, Zhao P, et al. Arabidopsis ERF109 mediates cross-talk between jasmonic acid and auxin biosynthesis during lateral root formation[J]. Nature Communications, 2014(5): 5 833.
责任编辑:黄 艳
