甘蔗黄叶病与花叶病CP基因RNAi载体构建与转化甘蔗研究
2016-05-30陈利平陈平华陈忠伟王恒波许莉萍刘迪高三基郭晋隆陈如凯
陈利平 陈平华 陈忠伟 王恒波 许莉萍 刘迪 高三基 郭晋隆 陈如凯

摘 要 甘蔗黄叶病和甘蔗花叶病是我国甘蔗最主要的病毒病,感病品种产量下降和品质变劣,传统方法难以防治。RNA干扰技术使培育抗病毒甘蔗品种成为可能。本研究根据甘蔗黄叶病毒和侵染甘蔗的高粱花叶病毒结构与功能特性,广泛收集不同来源病毒分离物CP基因序列,经过比对选取保守序列作为干扰序列。通过在序列两端添加酶切位点,合成并连接成双价甘蔗黄叶病和花叶病毒干扰序列,然后构建到中间载体pHANNIBAL上,形成双价RNAi干扰结构,最后插入到pART27上形成干扰表达载体。利用基因枪轰击甘蔗品种福农15号愈伤组织进行转化,经G418筛选获得抗性再生植株。通过提取DNA和 RNA分析,证实双价RNAi干扰结构不仅以不同拷贝整合到甘蔗基因组中,而且得到了转录表达。
关键词 甘蔗黄叶病毒;甘蔗花叶病毒;CP基因;双价RNAi表达载体构建;遗传转化
中图分类号 S566.1 文献标识码 A
Abstract Diseases caused by Sugarcane mosaic virus(SCMV)and Sugarcane yellow leaf virus(SCYLV)are widespread virus diseases in the growth of sugarcane in China. Sugarcane varieties infected the viruses produce less tonnage and sugar potential. Conventional methods don't work to control the diseases. The RNA interference technology makes it possible to create antiviral sugarcane varieties by genetic engineering. Based on the viral structure and functional characteristics of SrMV and SCYLV, sequences of the coat protein CP genes were collected and conserved sequences were selected as the RNA interference sequences after alignment. The two RNAi fragments were combined by designing PCR primers with restriction enzyme sites and constructed into vector pHANNIBAL to form the binary ihpRNA antiviral structure. The structure was then inserted the expression vector pART27. The expression vector was transformed into the calli of sugarcane cultivar FN15 via gene gun bombardment. Sugarcane plants were regenerated from G418 screening media. The regenerated plants were detected in DNA and RNA levels, which verifying the binary ihpRNA antiviral structure was not only integrated into the host genome in copies, but also transcribed successfully.
Key words SCYLV;SCMV;CP gene;Construction of binary ihpRNA expression vector;Genetic transformation
doi 10.3969/j.issn.1000-2561.2016.01.018
甘蔗是全世界最重要的糖料和能源作物[1]。甘蔗花葉病和黄叶病是甘蔗生产上最为普遍的两种病毒病害[2-3]。我国的甘蔗花叶病多数情况下是由高粱花叶病毒(Sorghum moaic virus, SrMV)侵染引起[4],主要破坏甘蔗叶绿体,对甘蔗产量和含糖量造成严重损失[5],黄叶病不仅可造成甘蔗产量下降、品质变劣,而且会引起种性退化,严重可导致减产40%~60%[6]。化学防治对病毒病无效,防治方法主要是通过组织培养脱去甘蔗已经感染的病毒,但缺点是还会重新感染[7]。由于甘蔗是高度杂合的异源多倍体植物,其遗传背景非常复杂,加之抗病毒病甘蔗种质匮乏[1],通过杂交培育抗病品种异常困难。随着现代分子生物技术的发展,针对病毒病的RNA干扰技术为培育甘蔗抗病毒新品种指明了方向。如选取两种病毒关键致病基因的保守序列,构建成RNA干扰结构,转化甘蔗创制转基因品种,干扰病毒RNA转录,则可培育抗病毒病甘蔗新品种。高梁花叶病毒是甘蔗花叶病的病原病毒之一[4],属于马铃薯Y病毒属[8],其基因组为正单链RNA,约有10 000个核苷酸。甘蔗花叶病毒CP基因致病机理的研究较多,其表达产物不仅可以包被病毒核酸,还可以促进蚜传、系统侵染等[9]。目前已经有利用病毒CP基因保守序列构建RNAi表达载体转化作物研究[10]。甘蔗黄叶病毒属于马铃薯卷叶病毒[11],由蛋白质外壳及其包裹着的一条约5 890 bp单链正义RNA(ssRNA)构成[12],有6个明确的ORF框,5′端非翻译区(UTR)以ACAAAA保守序列开始,3′端无Poly(A)尾巴,其中ORF3编码病毒外壳蛋白(CP),对病毒RNA转录和病毒外壳组装起作用。已有利用甘蔗黄叶病毒CP基因保守序列构建RNAi表达载体转化烟草研究[13]。目前尚未有利用RNAi技术创制兼抗甘蔗花叶病和黄叶病甘蔗的研究报道。本研究拟在分析甘蔗花叶病毒和黄叶病毒分离物序列的基础上,选取对病毒病致病起关键作用的CP基因,通过序列比对获得保守序列,利用RNA干扰技术创制双价抗花叶病和黄叶病聚合转基因甘蔗新种质,为甘蔗产业持续健康发展提供核心技术支撑。
1 材料与方法
1.1 材料
1.1.1 植物受体材料 用作转基因的受体甘蔗品种福农15号由福建农林大学国家甘蔗工程技术中心选育、保存。
1.1.2 菌株及质粒 RNAi中间载体pHANNIBAL和表达载体pART27、大肠杆菌感受态DH5α、福州地区甘蔗分离物高粱花叶病毒CP蛋白基因序列SrMV-FZ由福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室提供。克隆载体pMD18-T购自TaKaRa公司。
1.1.3 试剂 甘蔗黄叶病毒CP基因保守序列由上海生物工程公司合成;限制性内切酶购自Fermentas公司;E.Z.N.A.TMGel Extraction Kit(D2500-02)、E.Z.N.A.TMPlasmid Mini Kit(D6942-02)购自OMEGA公司;T4 DNA Ligase 和DNA分子量标准D15 000+2 000 DNA Marker(MD116)、100 bp DNA Ladder(MD109)购自天根生化科技(北京)有限公司;Biospin Plant Genomic DNA Extraction Kit(BSC13S1)购自杭州博日科技有限公司;SYBRR Select Master Mix购自ABI公司;TrizolR试剂购自invitrogen公司;Premix TaqTM(RR902A)和RNA kit ver.3.0试剂盒购自TaKaRa公司。
1.1.4 仪器 德国Eppendorf公司5331型PCR仪,美国ABI公司ABI7500型实时荧光定量PCR仪,美国伯乐公司Bio-Rad PDS-1000/He基因枪及其耗材。
1.2 方法
1.2.1 甘蔗花叶病毒和黄叶病毒分离物序列比对与干扰序列获得 通过登录GenBank数据库和查阅文献,检索甘蔗花叶病不同来源分离物SCMV的CP基因序列(以福州分离物高粱花叶病毒SrMV-FZ为参照)和甘蔗黄叶病毒不同来源分离物SCYLV的CP基因序列,利用BLAST方法对分离物进行同源比对,根据各病毒分离物CP基因共有的保守区域,选取适宜长度作为干扰序列,甘蔗花叶病毒CP基因干扰序列记为MCP,甘蔗黄叶病毒CP基因干扰序列记为YCP。根据质粒载体pHANNIBAL插入位置两侧内切酶位点和选取的保守序列设计引物,在MCP引物正义链的5′端分别引入ClaⅠ和EcoRⅠ酶切位点,反义链5′端引入XbaⅠ酶切位点;在YCP引物正义链5′端引入XbaⅠ位点,反义链5′端分别引入XhoⅠ和HindⅢ位點。MCP保守序列从本实验室保存质粒中克隆,YCP保守序列以及PCR引物由上海生物工程公司合成。
1.2.2 双价正反序列ihpRNA的中间载体构建
MCP和YCP用XbaⅠ酶切并回收,用T4 DNA Ligase连接形成双价目的片段,经PCR扩增合成双价连接片段 MYCP,测序确认。然后克隆到pMD18-T,重组质粒记为pT-MYCP,转化DH5α。提取pT-MYCP和pHANNIBAL质粒,用XhoⅠ和EcoRⅠ双酶切,回收目的片段、连接,重组质粒记为pHB-MYCP,转化DH5α。提取质粒,用ClaⅠ和Hind Ⅲ分别双酶切pT-MYCP和pHB-MYCP,回收目的片段,连接形成含内含子发夹结构的中间载体pRNAi YCP-MCP-intron-MCP-MCP,记为pHB-MYCP-YMCP,转化DH5α,酶切验证。
1.2.3 RNAi表达载体构建 对质粒pHB-MYCP-YMCP和pART27分别用NotⅠ酶切,回收pHB-MYCP-YMCP的4 290 bp片段和pART27的11 667 bp片段,连接形成含内含子发夹结构ihpRNA表达载体,命名为pART27-MYCP,转化DH5α,酶切鉴定。
1.2.4 遗传转化和抗性苗筛选 以甘蔗品种福农15号愈伤组织为材料,按照陈平华等基因枪转化甘蔗愈伤组织的方法[14],用构建的双价RNAi表达载体pART27-MYCP包被钨粉,利用基因枪轰击转导愈伤组织。轰击后的愈伤组织用含40 mg/L G418的MS分化培养基筛选,对抗性再生植株提取DNA并进行分子鉴定。其中,分化筛选培养基成分:MS+3 mg/L 6-BA+0.5 mg/L KT+0.2 mg/L NAA +8.5 g/L琼脂+30 g/L蔗糖+40 mg/L G418(pH 5.8);生根培养基:MS+3 mg/L NAA+0.2 mg/L 6-BA+8.5 g/L 琼脂+30 g/L 蔗糖(pH 5.8)。
1.2.5 抗性再生植株DNA的制备与目的序列PCR检测 按照Biospin 植物基因组DNA提取试剂盒说明书提取福农15号转化抗性再生植株叶片DNA,测定DNA质量并将其浓度调整到50 ng/μL。为防止假阳性结果,按照张卓等的方法[15]对福农15号转化抗性再生植株的DNA进行甘蔗內源ALS基因的PCR检测,如果出现目的条带则说明DNA样品质量达到PCR反应要求,可以作为模板进行目的序列的PCR鉴定。
2 结果与分析
2.1 甘蔗花叶病毒和黄叶病毒分离物CP基因序列比对与干扰序列获得
通过检索Genbank数据库和相关文献,对国内外甘蔗花叶病毒已发布分离物的CP基因序列进行比对,所选序列Genbank登录号分别为AY042184、AY149118、AF494510、AJ278405、AJ297628、NC004035、NC003398、AJ310198、smu57358,以本实验室分离的福州地区分离物(本实验室分离保存,未提交)的CP基因序列SrMV-FZ为参照。比对结果显示,各分离物CP基因序列在8 900~9 500 bp同源性较高,达到85.3%,但中间穿插若干1~3 bp同源性低的小微片段,因序列保守性不是特别强,为提高对各病毒株系的干扰效果,选取了CP基因序列中8 960至9 382 bp之间、含多个同源性100%的区段、长度为423 bp的保守序列为甘蔗花叶病毒干扰序列MCP。
通过检索Genbank数据库和相关文献,收集了国内外甘蔗黄叶病毒分离物22个,即bra-yl1、chn-yl1、per-yl1a、per-yl1b、reu-yl1a、reu-yl1b、reu-yl2、scylv-a、scylv-c3、scylv -chn1、scylv-cub2、scylv-f、scylv-fj1、scylv-fj2、scylv-fj3、scylv-gd1、scylv-gd2、scylv-gx1、scylv-gx2、scylv-in、scylv-yn1、scylv-yn2,序列比对结果显示,不同来源甘蔗黄叶病毒分离物CP基因序列同源性极高,在180~400 bp同源性高达94.8%,同源小微片段很少且长度不超过2 bp。根据比对结果,以本地分离物ScYLV-fj1序列为参照,选取CP基因序列中180至409 bp之间高度保守的230 bp为甘蔗黄叶病毒干扰序列YCP。
根据选取的保守序列和质粒载体插入区域两侧内切酶位点,利用软件Primer 5.0设计两种病毒CP基因干扰序列MCP和YCP克隆引物如下:
连接产物克隆到pMD18-T,经转化DH5α,提取质粒,用XhoⅠ和EcoRⅠ酶切鉴定,获得3 377 bp的pT-MYCP。
2.3 双价目的片段RNAi表达载体构建过程
pT-MYCP和pHANNIBAL质粒经过XhoⅠ和EcoRⅠ双酶切,回收pT-MYCP小片段与质粒pHANNIBAL大片段,连接形成中间载体pHB-MYCP。再对pHB-MYCP和pT-MYCP分别同时进行ClaⅠ和Hind Ⅲ双酶切,回收pT-MYCP小片段和pHB-MYCP大片段,连接形成含有双价目的片段正反方向序列的中间载体pHB-MYCP-YMCP。最后对pHB-MYCP-YMCP和pART27用NotⅠ酶切,回收大片段,连接形成RNAi表达载体pART27-MYCP,总长度15 957 bp,用可以同时鉴别目的序列和供体质粒pART27的NotⅠ和SalⅠ酶切消化,预期可以产生4个条带,SalⅠ(Ⅰ)至Lac Z 多克隆位点上NotⅠ(978)之间长度为978 bp,两个NotⅠ中间插入的目的 RNAi 序列长度4 290 bp,第2个NotⅠ(5 268)与SalⅠ(7 954)位点间片段长度为2 686 bp,剩余片段长8 003 bp。质粒图谱和酶切电泳结果见图2,与预期一致,载体构建成功。
2.4 基因枪轰击转化及抗性苗再生与PCR检测
通过基因枪轰击和抗性筛选,获得了161株再生苗,见图3。
对提取的抗性植株DNA进行内参基因ALS检测。取能够扩增出171 bp特异性片段(对照正常)的抗性植株DNA,用正、反向检测引物MYf和MYr进行干扰序列PCR检测。随机抽取其中20株检测结果见图4(相同编号为同一植株),可以看出,20株抗性植株检测到正、反向干扰序列的植株各有3株(图4-A中泳道6,11,15,图4-B中泳道6,15,16),同时转入正反向双价抗病干扰序列的植株有2株(图4-A和图4-B中泳道6和15),说明已经将双价抗病干扰序列转入部分甘蔗植株中。
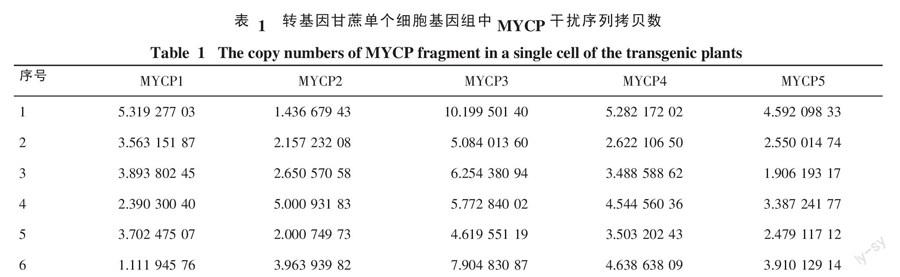
2.5 PCR阳性植株拷贝数测定
取5株具有完整正、反向干扰序列的转基因植株(命名为MYCP1、MYCP2、MYCP3、MYCP4、MYCP5),依据用质粒建立的标准曲线方程,将各样品的Ct值代入计算出相应的拷贝数。由于甘蔗基因组比较复杂,80%的甘蔗高贵种的基因组大小在7 500×106~8 500×106 bp之间[17],因此取甘蔗基因组平均值7 740×106 bp,则由拷贝数/2×{[6.02×1023×10-9×100/(7 740×106×660)]}得出各个样品中MYCP干扰序列在甘蔗单个细胞基因组的拷贝数见表1。
通过标准差分析数据(保留小数点后2位),获得各个转基因样品 MYCP干扰序列的拷贝数依次为 MYCP1 3.77±1.04,MYCP2 3.15±1.29,MYCP3 5.93±1.27,MYCP4 4.29±0.78,MYCP5 3.64±1.03。可见,5个转基因植株MYCP的拷贝数范围在2~7之间。
2.6 转基因阳性植株干扰序列的表达分析
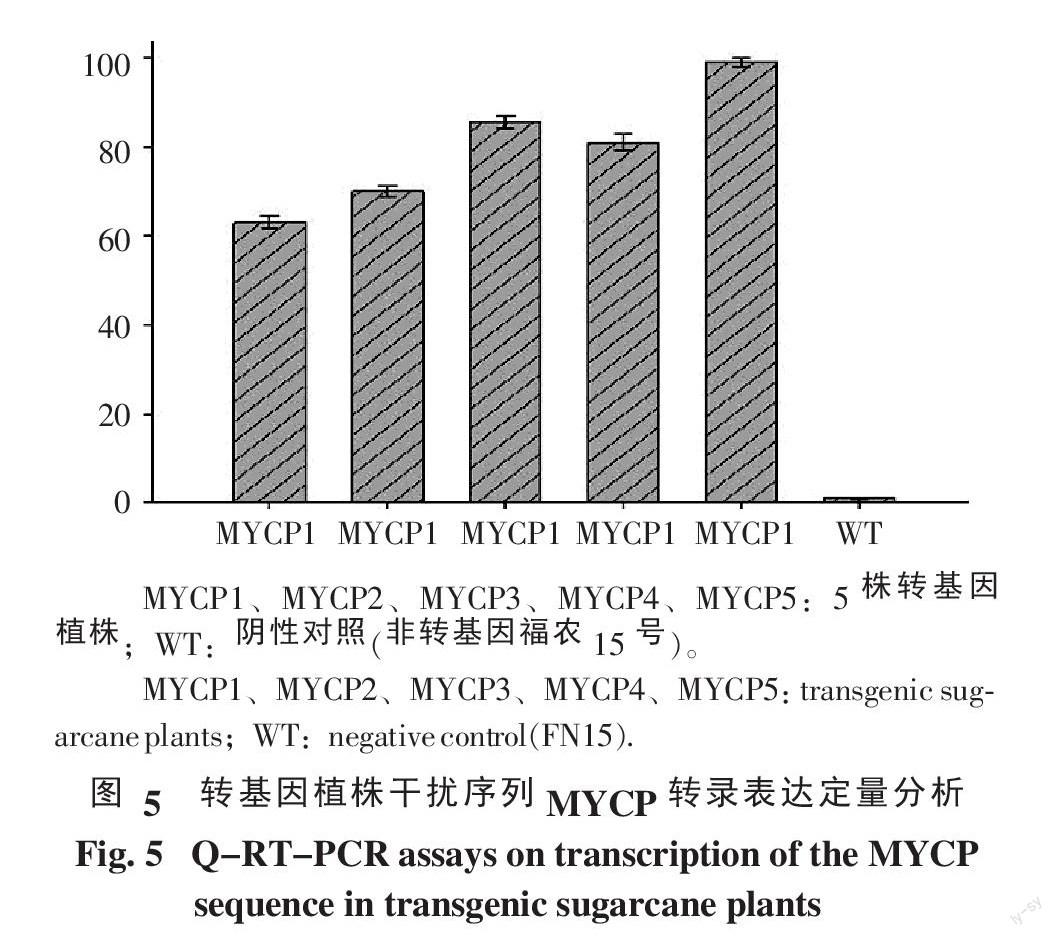
利用实时荧光定量RT-PCR对上述5株转基因植株的MYCP干扰序列的表达量进行分析,以25SrRNA为内参基因,非转基因福农15号为阴性对照,结果如图5。
从图5中的表达量中可以看出,所选的5株转基因植株的MYCP干扰序列都进行了转錄表达,但不同植株表达量存在差异,其中MYCP5的表达量比其它植株都高,而其干扰序列的拷贝数并不是最高,可见,MYCP干扰序列表达量与拷贝数没有直接关系。
3 讨论与结论
入选病毒分离物的代表性。本研究随机选取不同来源的甘蔗花叶病与黄叶病分离物,既有国外,也有国内不同地域,比对结果发现不同来源的病毒分离物CP基因序列均存在不同程度的同源性,只是不同区段的同源性程度有差异。说明病毒在进化过程中尽管在不同地域发生了变异,形成了不同株系,但病毒的基本结构相似,这也解释了为什么同类病毒尽管有多种不同株系,但其病征和症状大体相同的原因。因不同来源的病毒分离物CP基因序列均有同源性,通过选取同源性较高的区段就有可能获得广谱的干扰效果。
植物干扰片段大小选择。经典的RNAi理论中,起干扰作用的RNAi片段较短,一般只有几十个bp[18],但在植物上RNAi靶基因片段长度一般可以达到几百个bp,相对容易操作成功[19]。较长的保守序列含有较多同源位点,通过转化,有可能使受体作物同时获得沉默一族病毒基因表达的优良转基因甘蔗材料。保守序列是病毒长期进化或变异中保留下来的相对稳定的遗传组成,可以经受时间的考验,有可能较长期地保持对同族多种病毒的抗病性。
转基因植株分子检测。一般情况,转基因植物的分子鉴定应该有Southern blot检测和蛋白表达方面的内容。可能由于干扰片段较短、拷贝数较低以及甘蔗基因组较大等原因,Southern blot检测结果不理想,因此选用定量分析的方法检测出各转基因植株目的序列的拷贝数,RNA检测结果进一步表明干扰序列在转录水平进行了表达,证明干扰序列已成功整合入甘蔗基因组中。蛋白表达方面,RNAi抗病原理是在转录水平起作用,在病毒侵染转基因作物后,干扰序列产生与病毒RNA同源的双链RNA片段,使病毒mRNA发生降解而导致相应基因表达沉默,其干扰功能在RNA水平发挥,而不是依靠产生的蛋白起作用;加之,干扰序列只是DNA片段,不是基因,因此,没有进行蛋白表达分析。
参考文献
[1] 陈如凯. 现代甘蔗遗传育种[M]. 北京: 中国农业出版社, 2010.
[2] 许东林, 周国辉. 侵染华南地区甘蔗的SCMV遗传多样性初探[J]. 植物病理学报, 2005, 35(6): 143-144.
[3] 许东林, 李俊光, 周国辉. 广东甘蔗黄叶病田间调查及病原病毒的分子检测[J]. 植物病理学报, 2006, 36(5): 404-406.
[4] 许东林, 周国辉, 沈万宽,等. 侵染甘蔗的高梁花叶病毒遗传多样性分析[J]. 作物学报, 2008, 34(11): 1 916-1 920.
[5] Grisham M, Benda G T A, Koike H. Field losses in sugarcane from sugarcane mosaic virus(SCMV)infection[J]. Phytopathol, 1986, 76: 1 109-l 110.
[6] Lockhart B E L,Irey M J,Comstock J C. Sugarcane bacilliform virus, sugarcane mild mosaic virus and sugarcane yellow leaf syndrome[J]. In: Sugarcane Germplasm Conservation and Exchage B J, Croft C1V1, Piggin E S, Wallis and D M Hogarth(eds), AC1AR Proceedings. 1996, 67: 113-115.
[7] 周雪平, 李德葆. 抗病毒基因工程与转基因植物释放的环境风险评估[J]. 生命科学, 2000, 12(1): 4-6.
[8] Koike H, Gillaspie A G, Hughes G. G Mosaic. In: Ricaud C, Egan B T, Gillaspie A G, et al. Diseases of sugarcane: major diseases[G]. Elsevier Amsterdam, 1989: 301-322.
[9] Shukla D D, Ward C W. Structure of potyvirus coat proteins and its application in the taxonomy of the potyvirus group[J]. Adv. Virus Res., 1989, 36: 273-314.
[10] 秦 荣, 张 伟, 刘炜炜, 等. 黄瓜花叶病毒和番茄花叶病毒双价抗性RNA沉默表达载体的构建[J]. 石河子大学学报, 2012, 4(8): 429-433.
[11] Moonan F, Molina J, Mirkov T E. Sugarcane yellow leaf virus: an emerging virus that has evolved by recombination between luteoviral and poleroviral ancestors[J]. Virology, 2000, 269(1): 156-171.
[12] Scagliusi S M, Lockhart B E L. Transmission, characerization and serology of a Lutrovirus associated with yellow leaf syndrome of sugarcane[J]. Phytopathology, 2000. 90: 120-124.
[13] 张雨良, 熊国如, 王健华,等. 甘蔗黄叶病毒CP蛋白基因ihpRNA表达载体构建及烟草转化[J]. 植物研究, 2011, 31(5): 537-542.
[14] 陈平华, 陈如凯. 基因枪转化甘蔗愈伤组织体系的优化[J]. 福建农林大学学报(自然科学版), 2004, 33(3): 355-358.
[15] 张 卓, 陈平华, 许莉萍, 等. 四价抗病虫除草剂RNAi植物表达载体构建与转化甘蔗研究[J]. 基因組学与应用生物学, 2014, 33(3): 661-673.
[16] Livak K J, Schmittgen T D. Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2-ΔΔCT Method[J]. Methods, 2001, 25(4): 402-408.
[17] Zhang J S, Nagai C, Yu Q Y, et al. Genome size variation in three Saccharum species[J]. Euphytica, 2012, 185(3): 511-519.
[18] Gupta P K. RNA interference-gene silencing by double-stranded RNA: The 2006 Nobel Prize for Physiology or Medicine[J]. Current Science, 2006, 91(11): 10.
[19] 郭志鸿, 王亚军, 张金文, 等. 采用一种新型RNAi载体培育转基因高直链淀粉马铃薯[J]. 作物学报, 2009, 35(5): 809-815.
责任编辑:凌青根
