茶树不同组织结构中纤维素酶的活性差异研究
2016-05-30周汉琛雷攀登杨停丁勇黄建琴
周汉琛 雷攀登 杨停 丁勇 黄建琴

摘 要 纤维素酶是重要的水解酶,对植物的生长发育及新陈代谢发挥着重要作用。为了解茶树中纤维素酶的活性变化特征,以茶树品种‘凫早2号为研究对象,测定其不同组织结构中纤维素酶3种主要组分内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的活性。结果显示,内切葡聚糖酶在茶树一芽四叶中随着叶片成熟度增加,酶活性增加,表现为:第四叶>第三叶>第二叶>第一叶>芽,与β-葡萄糖苷酶活性呈现相反趋势;外切葡聚糖酶和β-葡萄糖苷酶都是在第四叶活性最低。内切葡聚糖酶在茶树花朵中活性最高,而外切葡聚糖酶和β-葡萄糖苷酶分别在叶片、果皮中活性最高。胞质蛋白中内切葡聚糖酶和β-葡萄糖苷酶活性显著高于膜蛋白中的酶活性,但胞质蛋白、膜蛋白中都未检测到外切葡聚糖酶活性。
关键词 茶树;组织器官;亚细胞结构;纤维素酶 ;酶活性
中图分类号 S571.1 文献标识码 A
纤维素酶是一类多组分的复合酶系,各组分间具有协同作用,能够将纤维素降解成葡萄糖[1]。纤维素酶做为一种细胞壁水解酶,在植物整个生长发育期间都有重要作用[2]。目前根据酶的作用方式不同,纤维素酶主要分为3 种:内切葡聚糖酶(endo-glucanase,EG)、外切葡聚糖酶(exo-glucanase,EXG)以及β-葡萄糖苷酶(β-glucosidase,BG)。内切葡聚糖酶与植物的组织生长、器官成熟、果实脱落密切相关[3];外切葡聚糖酶和β-葡萄糖苷酶都能通过糖基化反应参与植物的生长发育过程[4]。
茶树是中国重要的经济作物,主要生长在气候湿热的热带、亚热带地区。茶树生长发育周期中以及后期的茶叶加工过程容易受多种因素影响,而纤维素酶就是影响因素之一。β-葡萄糖苷酶能够催化茶树糖苷类香气前体的水解反应,与芳樟醇、香叶醇等香气物质的生成密切相关,其产生的茶树香气物质不仅参与茶树对病虫害的防御反應,还是茶叶重要的物质基础[5-6]。在乌龙茶加工过程中,做青前期有效地发挥纤维素酶的活性,不仅可以促使可溶性糖类较多的积累,而且可以破坏细胞间的胞壁区隔,促进水分和物质转运,并激发后续反应,从而为茶叶奠定物质基础[7]。
目前,纤维素酶组分之一的β-葡萄糖苷酶在茶树中的研究很丰富,而关于茶树的内切葡聚糖酶和外切葡聚糖酶的研究几乎未见报道。已知纤维素酶各组分间存在协同作用,对茶树的影响是一系列的复杂反应,因此本研究通过分析其3个主要组分在茶树嫩梢不同部位及不同组织器官中的活性变化,并从亚细胞结构方面分析纤维素酶活性在茶树叶片细胞中的差异,希望为研究纤维素酶对茶树生长发育的影响及在茶叶加工过程中的作用提供理论参考。
1 材料与方法
1.1 材料
试验于2015年9月份在本实验室及试验茶园进行,以试验茶园中的茶树[Camellia sinensis (L.)O. Kuntze]品种‘凫早2号为供试材料。
1.2 方法
1.2.1 茶树粗酶液的提取 称取茶树叶片、花、茎、果皮及种胚等新鲜样品2 g,加入冰镇的20 mL 100 mmol/L柠檬酸三钠-柠檬酸缓冲液(pH5.0),以及等量的聚乙烯吡咯烷酮(Polyvingypyrrolidone,PVPP)和0.5 g石英砂,在冰上用研钵迅速研磨至匀浆。匀浆液在8 000×g下低温离心5 min ,取上清液再以10 000×g 低温离心10 min,上清液即为茶树组织粗酶液[8]。
1.2.2 纤维素酶各组分活性测定方法 内切葡聚糖酶活性测定采用DNS(3,5-Dinitrosalicylic acid,DNS)试剂法,将200 μL茶树样品粗酶液、200 μL 5 g/L羧甲基纤维素钠(内切葡聚糖酶底物)和600 μL 100 mmol/L柠檬酸三钠-柠檬酸缓冲液(pH5.0)加入10 mL离心管中,49 ℃保温3 h后,加入3 mL DNS试剂,煮沸10 min进行颜色反应。将待测样品反应前加3 mL DNS试剂并煮沸10 min设为对照,所有样品用紫外分光光度仪于540 nm下测吸光值[9]。外切葡聚糖酶与β-葡萄糖苷酶活性测定时,底物为10 mmol/L PNPC(4-Nitrophenyl-beta-D-cellobioside,
PNPC)和10 mmol/L p-NPG(4-Nitrophenyl-beta-D-glucopyranoside,p-NPG),反应体系及条件与内切葡聚糖酶相同,反应结束后,加入2.5 mL 1 mol/L Na2CO3终止反应,用紫外分光光度仪于405 nm下测定吸光值,将待测样品反应前加2.5 mL Na2CO3设为对照[10-11]。
1.2.3 酶活性计算方法 内切葡聚糖酶活性计算方法:利用还原糖标准曲线计算出反应体系中生成的葡萄糖含量,以每毫升粗酶液每10 min催化生成1 μmol葡萄糖为1个酶活单位。外切葡聚糖酶与β-葡萄糖苷酶活性计算方法:用对硝基苯酚标准曲线计算出反应体系中生成的对硝基苯酚含量,以每毫升粗酶液每10 min催化生成1 μmol对硝基苯酚为1个酶活单位。
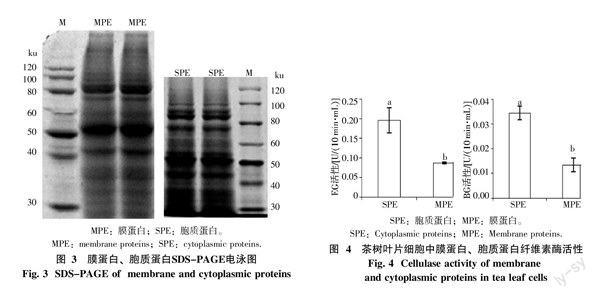
1.2.4 茶树叶片胞质蛋白、膜蛋白分离提取及SDS-PAGE电泳 利用膜蛋白分级分离和胞质蛋白提取试剂盒(FOCUSTM Global Fractionation,G-Biosciences)分离提取茶树叶片细胞全蛋白中胞质蛋白、膜蛋白,方法与步骤严格按照试剂盒说明书操作。蛋白电泳采用12% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),以考马斯亮蓝R-250染色[12],用凝胶成像系统BIORAD Gel DOCTM XR拍照分析,蛋白图谱采用BIORAD凝胶定量软件Quantity one将条带标出。
1.3 数据处理
采用Excel 2007进行数据整理,用SPSS 19.0统计软件对数据进行方差分析。
2 结果与分析
2.1 茶树一芽四叶不同部位中纤维素酶活性分析
如图1所示,茶树一芽四叶不同部位中酶活性变化趋势为:内切葡聚糖酶随着茶树叶片成熟度的增加,酶活性增加,在第四叶中酶活性最高,为单芽中酶活的 3.16倍,整体趋势表现为第四叶>第三叶>第二叶>第一叶>芽;外切葡聚糖酶活性在第二叶中最高,分别是第三叶、第四叶中酶活的1.36、2.15倍;β-葡萄糖苷酶活性在单芽中活性最高,随着叶片成熟度增加,酶活性缓慢降低,第四叶中酶活性为单芽中的82.95%。整体看来,在茶树嫩梢不同部位中内切葡聚糖酶活性变化趋势与外切葡聚糖酶、β-葡萄糖苷酶存在负相关性,另外,在同等反应体系及条件下,茶树新梢中β-葡萄糖苷酶活性比外切葡聚糖酶活性高。
2.2 茶树不同组织器官中纤维素酶活性变化
如图2所示,茶树花朵中内切葡聚糖酶活性比其他部位强烈,尤其是完全展开的花朵中酶活性最高,为3.51U/(10 min·mL),分别是叶片、茎段、果皮的13.67、72.41、15.23倍,而外切葡聚糖酶与β-葡萄糖苷酶在花朵中的活性则比较低。外切葡聚糖酶在茶树叶片中的酶活性高于其他组织器官。β-葡萄糖苷酶活性在果皮中有最高值,但是在茶树果皮中却无法检测到外切葡聚糖酶活性。另外对茶树种胚中的纤维素酶活性进行检测,却无法检测到各组分的酶活性,这与种胚中的内含物,如大量的淀粉相关,导致粗酶液呈现浑浊而无法检测。
2.3 茶树叶片细胞膜蛋白、胞质蛋白分离提取与纤维素酶活性分析
利用试剂盒分离提取茶树叶片细胞中胞质蛋白(SPE)和膜蛋白(MPE),后进行SDS-PAGE 电泳分析,结果表明SPE与MPE的SDS-PAGE电泳图谱相似,主要条带均有7个,其分子量相似(图3)。酶活性测定中,SPE与MPE中可以检测到内切葡聚糖酶和β-葡萄糖苷酶活性,但是未能检测到外切葡聚糖酶的活性。MPE中內切葡聚糖酶和β-葡萄糖苷酶活性分别是SPE中的44.29%、38.75%,显著低于SPE。
3 讨论与结论
3.1 茶树不同组织器官中纤维素酶的活性差异
内切葡聚糖酶基因在植物的不同发育阶段均可以被诱导表达,如植物的开花、果实成熟及其器官脱落等过程。 草莓EG基因Cel1在果实成熟过程中特异表达[13];而拟南芥EG基因Cel1则在正在伸展的幼嫩组织中表达[14]。番茄内切葡聚糖酶基因cel5和cel6与花的脱落有关,不同的是cel6在花脱落整个过程中有持续表达,而cel5只在花脱落后期中有表达[15]。本研究结果表明花朵中内切葡聚糖酶活性强烈,与其他组织器官中酶活性相比差异显著,尤其是完全展开的花朵中酶活性最高,这与前面研究报道的结论相一致[13-15]。β-葡萄糖苷酶在植物种子中含量最多,尤其是发芽部位、幼嫩组织和子叶基部[16]。茶树叶片中β-葡萄糖苷酶活性在秋季高,春季低,在幼嫩部位活性高[17-18]。本试验中β-葡萄糖苷酶在果皮中的酶活相比其他组织器官有显著性差异,与内切葡聚糖酶活性在芽叶部位呈:现相反趋势,内切葡聚糖酶活性高低趋势为:芽<第一叶<第二叶<第三叶<第四叶,而β-葡萄糖苷酶活性趋势为:芽>第一叶>第二叶>第三叶>第四叶,这与内切葡聚糖酶和β-葡萄糖苷酶基因表达特性有关,后续实验中可通过基因表达量分析两者之间的酶活性差异。
本试验结果表明外切葡聚糖酶与β-葡萄糖苷酶在同一反应体系及条件下酶活性显著差异,表现出外切葡聚糖酶活性在各个茶树组织器官中活性均比β-葡萄糖苷酶活性低。Nigorikawa等[19]在水稻中的研究表明:如果过量表达外切葡聚糖酶基因,虽然纤维素酶活性增加,水稻各组织中的糖分也会增加,但是转基因水稻植株叶片、叶脉以及叶绿体都出现不同程度的缺陷变异,同时有部分植株出现不育;而过量表达β-葡萄糖苷酶基因,转基因植株与野生型在生长发育过程以及果实成熟过程中无差异,并且不会引起转基因水稻在形态上的变异。如果过量表达内切葡聚糖酶,则无法获得转基因植株,过量表达的内切葡聚糖酶对水稻再生体系存在毒害作用。这些结果表明,纤维素酶对植物生长发育的重要性,同时也揭示3个组分内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶植物生长发育中所扮演的角色重要性不同,如Rodrigues等[20]研究表明内切葡聚糖酶与β-葡萄糖苷酶的协同水解作用时,发现β-葡萄糖苷酶含量与水解生成的生物量成正比;内切葡聚糖酶含量不会限制水解速率,而β-葡萄糖苷酶含量是影响水解速率的决定因素。
3.2 茶树亚细胞结构中纤维素酶的活性差异
拟南芥内切葡聚糖酶家族基因分为3个亚类(α,β和γ),不同亚类调控着不同的生理生长过程 ,其中α亚类基因AT1G70710被定位于细胞的叶绿体和胞外区;γ亚家族基因含有与细胞质膜相关的蛋白域,并与膜结合的纤维素合成酶一起参与纤维素的合成[1]。植物中的 β-葡萄糖苷酶基因多被定位在质体、质膜、细胞质、液泡及线粒体基质等亚细胞器官中表达[21-22]。茶树 β-葡萄糖苷酶基因mNRA在细胞质中有表达信号[23]。玉米外切葡聚糖酶基因ExGase在细胞壁与细胞膜中均有表达[24]。这些结果表明,纤维素酶相关基因在细胞膜、细胞质中均有表达。在本试验结果中,茶树叶片胞质蛋白与膜蛋白中能够检测到内切葡聚糖酶和β-葡萄糖苷酶活性,却无法检测到外切葡聚糖酶活性,可能是通过此方法提取的蛋白中外切葡聚糖酶活性太低而无法通过分光光度计检测到。另外,胞质蛋白中内切葡聚糖酶和β-葡萄糖苷酶活性显著高于膜蛋白中酶活,这也许与内切葡聚糖酶、β-葡萄糖苷酶基因家族在亚细胞中的定位及表达量有关,也可能与蛋白提取过程中相关,先提取胞质蛋白,而后进行膜蛋白的提取,造成膜蛋白中的酶活性降低。
参考文献
[1] Libertini E, Li Y M S. Phylogenetic analysis of the plant endo-beta-1,4-glucanase gene family[J]. J Mol Evol, 2004, 58(5): 506-515.
[2] Roberts J A, Elliott K A, Gonzalezcarranza Z H. Abscission, dehiscence, and other cell separation processes[J]. Annu Rev Plant Biol, 2002, 53(1): 131-58.
[3] Molhoj M, Pagant S, Hofte H. Towards understanding the role of membrane-bound endo-beta-1,4-glucanases in cellulose biosynthesis[J]. Plant Cell Physiol, 2002, 43(12): 1 399-1 406.
[4] Furukawa K, Ichikawa S, Nigorikawa M, et al. Enhanced production of reducing sugars from transgenic rice expressing exo-glucanase under the control of a senescence-inducible promoter[J]. Transgenic Res, 2014, 23(3): 1-7.
[5] 周汉琛, 雷攀登, 丁 勇. 茶树β-葡萄糖苷酶研究进展[J]. 茶叶科学, 2016, 36(2): 111-118.
[6] Yang Z, Baldermann S, Watanabe N. Recent studies of the volatile compounds in tea[J]. Food Res Int, 2013, 53(2): 585-599.
[7] 唐 颢, 杨伟丽, 文海涛. 乌龙茶加工中纤维素酶的活性与相关生化成分的动态变化[J]. 贵州茶叶, 2003(2): 19-21.
[8] 江昌俊, 李叶云. 茶芽叶中β-葡萄糖苷酶活性的日变化(简报)[J]. 植物生理学报, 2000(4): 324-326.
[9] 张树河, 谢志君, 林一心, 等. 利用能源植物斑茅纤维固态发酵产纤维素酶及其糖化的研究[J]. 热带作物学报, 2011, 32(12): 2 346-2 351.
[10] 江昌俊,李叶云. 茶叶中β-D-葡萄糖苷酶活性测定条件的研究[J]. 安徽农业大学学报, 1999(2): 212-215.
[11] 李志强, 廖祥儒, 陆 芳. 碧桃[(Prunus persicaL.)叶中β-葡萄糖苷酶的分离纯化和某些特性分析[J]. 植物生理学报, 2007, 43(2): 359-362.
[12] 周琼琼,孙威江. 茶树总蛋白质提取方法及双向电泳体系的建立[J]. 热带作物学报, 2014, 35(8): 1 517-1 522.
[13] Woolley L C, James D J, Manning K. Purification and properties of an endo-beta-1, 4-glucanase from strawberry and down-regulation of the corresponding gene, cel1[J]. Planta,2001, 214(1): 11-21.
[14] Ziv S, Mara D, Levava R, et al. Expression of endo-1,4-β-glucanase(cel1)in Arabidopsis thaliana is associated with plant growth, xylem development and cell wall thickening[J]. Plant Cell Rep, 2006, 25(10): 1 067-1 074.
[15] Campillo E D, Bennett A B. Pedicel breakstrength and cellulase gene expression during tomato flower abscission[J]. Plant Physiol, 1996, 111(3): 813-820.
[16] Mkpong O E, Sayre R T. Purification, characterization, and localization of linamarase in cassava[J]. Plant Physiol, 1990, 93(1): 176-181.
[17] 陈 亮, 赵丽萍, 马春雷, 等. 茶树β-葡萄糖苷酶和β-樱草糖苷酶基因表达差异分析[J]. 园艺学报, 2009, 36(1): 87-92.
[18] 骆耀平, 董尚胜, 童启庆,等. 7个茶树品种新梢生育过程中β-葡萄糖苷酶活性变化[J]. 茶叶科学, 1997(S1): 25-28.
[19] Nigorikawa M, Watanabe A, Furukawa K, et al. Enhanced saccharification of rice straw by overexpression of rice exo-glucanase[J]. Rice, 2012, 5(1): 14-14.
[20] Rodrigues M A, Teixeira R S S, Bon E P D S. Untreated Chlorella homosphaera biomass allows for high rates of cell wall glucan enzymatic hydrolysis when using exoglucanase-free cellulases[J]. Biotechnol Biofuel, 2015, 8(1): 1-16.
[21] Xu Z, Escamilla-Trevino L, Zeng L, et al. Functional genomic analysis of Arabidopsis thaliana glycoside hydrolase family 1[J]. Plant Mol Biol, 2004, 55(3): 343-367.
[22] Gómez-Anduro G, Ceniceros-Ojeda E A, Casados-Vázquez L E, et al. Genome-wide analysis of the beta-glucosidase gene family in maize(Zea mays L. var B73)[J]. Plant Mol Biol,2011, 77(1-2): 159-183.
[23] 李遠华, 江昌俊, 余有本. 茶树β-葡萄糖苷酶基因mRNA的表达[J]. 南京农业大学学报, 2005, 28(2): 103-106.
[24] Kim J B, Olek A T, Carpita N C. Cell wall and membrane-associated exo-beta-D-glucanases from developing maize seedlings[J]. Plant Physiol, 2000, 123(2): 471-485.
