植物促生菌对桉树幼苗生长及其氮素来源的影响
2016-05-30袁辉林康丽华
袁辉林 康丽华


摘 要 利用15N稳定性同位素示踪法,研究施氮水平对接种或不接种植物促生菌的桉树幼苗生物量、N和P吸收量及其吸收氮素来源的影响。结果表明:随着施氮量的增加,桉树幼苗植株生物量、N和P吸收量均显著增加。接种PGPR SZ7-1植物促生菌能显著促进桉树幼苗生物量的增加和养分量的吸收。未接种植物促生菌的桉树幼苗,其植株吸收氮素主要来源于土壤,其次是肥料;而接种PGPR SZ7-1植物促生菌的桉树幼苗,其植株吸收的氮素则主要来源于生物固氮。PGPR SZ7-1植物促生菌具有较好的固氮能力,固氮率达40%以上。结果还显示,随着施氮量的增加,接种植物促生菌的桉树幼苗生物固氮能力下降,植株氮素主要来源于土壤氮,其次为生物固氮和肥料氮。在较低的氮素水平下,接种植物促生菌能有效促进桉树植株的生长发育和养分吸收,是一种减少肥料施用、保护生态环境的农业措施之一。
关键词 桉树;PGPR SZ7-1;氮素;15N示踪
中图分类号 Q949.762.2 文献标识码 A
植物促生菌(plant growth-promoting rhizobacteria简称 PGPR)是指定殖于植物根际系统,并能促进植物生长的一类细菌的总称[1]。PGPR对宿主植物生长的影响及其固氮量一直受到广大研究者关注[2-4]。一般认为PGPR具有固氮、解磷、释钾、产生植物激素和分泌抗生素等能力或至少具有其中之一的能力,且对土壤中有害病原微生物与非寄生性根际有害微生物具有一定的生防作用[5-7],对植物吸收利用矿物质营养有促进作用,并可以产生有益于植物生长的代谢产物,从而促进植物的生长发育[8-9]。世界发达国家对PGPR的研究开发和应用已有多年历史,国内对PGPR的研究及生物菌肥的生产近年来也在不断增加,且越来越多的研究指出,PGPR 接种剂经过商品化生产,可作为杀虫剂和无机肥料的替代品而广泛应用到农业生产领域中[10-11]。然而,当前PGPR的研究大部分局限于菌种的筛选和作用效果的比较上,而对其深层的促生机理研究不多,尤其是植物在接种PGPR后,氮在土壤-微生物-植物系统中的迁移和转化规律研究较少。
肥料氮、土壤氮以及生物作用固定的氮在土壤-微生物-植物系统中的迁移和转化受众多因素的影响,其过程比较复杂,利用15N同位素示踪法测定生物固氮率可以避免间接效应对固氮量测定的影响,被认为是确定固氮作用定性和定量最直接、最可靠、最标准的方法[12]。该法依据固氮系统在N基质中经过一定时间的生长后,如在该系统中发现N被稀释,则证明发生了固氮作用[13-14]。本研究应用15N示踪技术对本实验分离保存的一株 PGPR SZ7-1[15]的固氮效果进行研究,并通过盆栽试验探讨了不同施氮水平下该促生菌的固氮效果和氮素在土壤-微生物-桉树系统中的迁移和转化规律,以便为 PGPR肥的产业化开发生产提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试植物和土样 植物品种为尾叶桉(Eucalyptus urophylla),来自雷州半岛。土壤养分为:有机质3.116 g/kg、全氮0.222 g/kg、全磷0.147 g/kg、全钾8.058 g/kg、速效氮18.50 g/kg 、速效磷0.26 g/kg、速效钾17.66 g/kg、交换酸4.816 cmol(H++1/3Al3+)/kg,土壤pH值为4.43。
1.1.2 供试菌株 促生菌PGPR SZ7-1菌株,由本实验室从红树林植物根系中分离筛选并保存[15]。
1.2 方法
1.2.1 试验设计 采用盆栽方法,共设2组处理,分别为接菌和不接菌,接菌组接菌量为10 mL/植株(109 CFU);不接菌为对照组(CK),加入10 mL已灭菌的水;3个氮素处理水平分别为N0(0 mg/kg)、N1(30 mg/kg)、N2(60 mg/kg),每个处理重复9盆。试验氮肥为15N丰度11.22%的硫酸铵,施用方法:将同位素溶于水,种植前均匀施入土壤。实验用盆钵为H×D=10.5 cm×11.5 cm的塑料盆,每盆装入直径为5 cm的已灭菌土(121 °C,60 min)1.4 kg,且每盆一次性施入Jensen无氮营养液250 mL。首先将尾叶桉种子在95%酒精中浸泡10 min,再放入0.1%氯化汞溶液中消毒5 min后,用灭菌水冲洗多次;然后将种子播种于已灭菌的沙盘中,1个月后,待生长至3~4 cm时移苗,每盆一株幼苗。将氮肥配成水溶液一次性施入。温室条件为:湿度60%,夜晚温度18 °C,白天温度25 °C,每天浇水2次。
1.2.2 样品处理 栽种16周后,植株样品采集分地上和地下2部分进行,每处理取5组重复,收割后量株高,并于烘箱中80 °C烘干48 h至恒重,再分别称取干重。样品经烘干、粉碎、过筛后用于全氮、全磷及15N的分析测定。
1.2.3 测定项目与方法 全氮含量测定采用改良凯氏消化法,全磷含量测定采用钼锑抗比色法[16]。将植株样品进行质谱分析,测定15N丰度,具体计量方法参见文献[17]进行。用15N同位素稀釋法计算尾叶桉幼苗氮素中来自生物固氮的百分数(%Ndfa)、来自肥料的百分数(%Ndff)、来自土壤氮的百分数(%Ndfs)[18]。
1.3 数据处理
原始数据采用Excel软件处理,统计分析采用Minitab15.0软件处理。计算公式如下:
氮吸收量=植株干重(g/盆)×植株含氮量(%)
%Ndfa=(1-固氮植株15N原子百分超÷非固氮植株的15N原子百分超)×100%
%Ndff=植株15N原子百分超÷肥料15N原子百分超×100%
%Ndfs=1-%Ndfa-%Ndff
2 结果与分析
2.1 施氮水平与促生菌对尾叶桉幼苗生物量的影响
盆栽试验结果(表1)表明,接种 PGPR SZ7-1的尾叶桉幼苗无论在株高,还是干重方面均明显优于不接菌。在同等施肥水平下,其中接菌比不接菌(CK)处理全植株(N0、N1和N2)株高分别提高了22.87%、31.59%、31.36%;地上部分干重分别增加了136.61%、75.23%、70.80%;地下部分干重分别增加了75.47%、38.71%、16.67%,且方差分析结果显示均差异显著。这说明接种 PGPR SZ7-1能明显促进尾叶桉幼苗生长,增加其生物量。
在不同施肥水平下,株高随施氮量的增加而增高,但接菌较不接菌(CK)处理差异不显著。地上部分干重也随施氮量的增加而增加,其中不接菌(CK)处理地上部分干重而言,N1和N2水平分别比N0水平提高了43.23%和76.77%;接菌处理地上部分干重N1和N2水平比N0水平提高了8.36%和30.36%。地下部分干重而言,不接菌(CK)处理随施氮量的增加而增加,其中N1和N2水平分别比N0水平分别提高了75.47%和92.45%,而接菌处理地下部分干重则随施氮量的增加而呈现先增加后减少的趋势,其中N1和N2水平分别比N0水平提高了38.71%和27.96%。
总之,在同等施肥水平下,无论是地上部分干重还是地下部分干重,接菌处理比不接菌(CK)处理增加明显;但接菌处理在3个氮水平上增加幅度较不接菌(CK)处理要小得多,这可能与接菌后该促生菌能提供营养有很大关系。
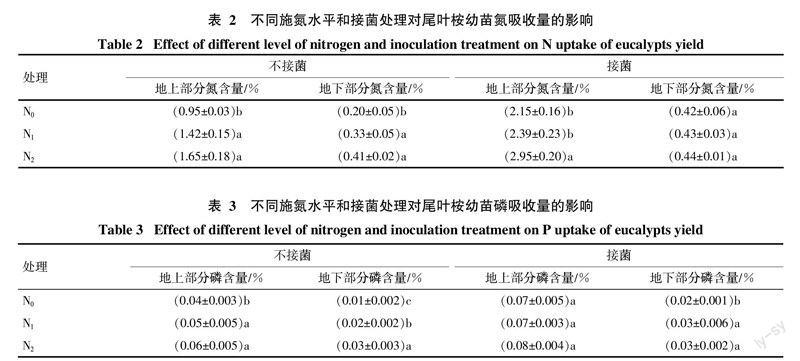
2.2 施氮水平和促生菌对尾叶桉幼苗氮吸收的影响
分析结果(表2)表明,各接菌处理的尾叶桉幼苗对氮素的吸收量均比不接菌(CK)处理显著增加,说明接菌处理能明显提高尾叶桉幼苗的供氮能力。
各不接菌(CK)和接菌处理之间,在不同的施氮水平上,尾叶桉幼苗对氮素的吸收量均呈现增加的趋势,且在N2水平上,地上和地下部分全氮量均最高。其中不接菌(CK)处理的N1和N2水平地上部分氮吸收量分别比N0水平提高了49.47%和73.68%,地下部分氮吸收量分别比N0水平提高了65.00%和105.00%;接菌处理N1、N2水平地上部分吸收量分别比N0水平提高了11.16%和37.21%,地下部分氮吸收量分别比N0水平提高了2.38%和4.76%。接菌处理较不接菌(CK)处理在3个氮水平上增加幅度要小得多,这间接表明PGPR SZ7-1能为植物提供氮素营养,具有一定的固氮能力。
2.3 施氮水平和促生菌对尾叶桉幼苗磷吸收的影响
表3显示,各接菌处理的尾叶桉幼苗对磷的吸收量均比不接菌(CK)处理显著增加,说明接菌后促生菌能明显促进尾叶桉幼苗对磷的吸收。且各不接菌(CK)处理和接菌处理之间,在不同的施氮水平上,尾叶桉幼苗对磷素的吸收量也均呈现随施氮量增加而增加的趋势,但接菌处理的增加幅度较小,这间接表明PGPR SZ7-1能提高植物对磷的吸收量,具有一定的解磷作用。
2.4 施氮水平对尾叶桉幼苗不同氮素来源的影响
从测定结果(表4)可知,在试验研究的施肥水平内,无论是接菌还是不接菌处理,随着施氮含量的增加,植株全氮含量均随之增加,且接菌明显比不接菌(CK)处理的植株全氮含量高,是后者的2~3倍,方差分析显示差异极显著。
15N示踪试验结果显示,不同施氮水平不接菌(CK)处理的尾叶桉幼苗对土壤氮的吸收率最高,且施氮水平对尾叶桉幼苗的氮素来源有一定影响,但影响幅度较小,表现为随施肥量的增加,来自肥料氮的吸收率也随之增加,而来自土壤的则减少;不同施氮水平接菌处理的尾叶桉幼苗多了一个氮素来源,即来自生物固氮,且固氮效率达到40%以上。可见,PGPR SZ7-1具备良好的固氮能力,有着广阔的应用前景。同时,在接菌处理中尾叶桉幼苗的氮素来源发生了一定变化,表现为:随着施氮量的增加,来自肥料氮和土壤氮的氮素增加;相反,来自生物固氮的氮素则相应减少。
3 讨论与结论
由试验结果可知,PGPR SZ7-1能明显促进植株对氮和磷的吸收,接菌处理的氮、磷含量素较对照处理均显著增加。且接菌处理较不接菌(CK)处理在3个氮水平上對氮和磷的吸收量增加幅度明显要小,这间接表明PGPR SZ7-1能为尾叶桉幼苗提供氮素和磷素营养,兼具固氮和解磷2种能力,对植株有着良好的促生作用,这与此前的报道(PGPR SZ7-1能促进植物生长)一致[15]。
试验结果表明,相比不接菌(CK)处理,接菌处理表现为生物量显著增加,且接菌处理的生物量在3个氮水平上增加幅度较不接菌(CK)处理明显要小,这可能与接菌后该促生菌能提供营养有关系,说明PGPR SZ7-1对尾叶桉幼苗具有很好的促生能力。同时,本实验室还考察了PGPR SZ7-1菌株对木榄植株的促生效果,研究表明,接种该菌株能很好地促进木榄幼苗的生长[19]。这说明PGPR SZ7-1对植株有着良好的促生作用,且不针对某一特定植物,具有广泛的应用前景。
研究结果显示,在本研究的施氮水平内,不接菌(CK)处理表现为随着施氮量的增加,尾叶桉幼苗对肥料氮的吸收率增加,而对土壤氮的吸收率则降低。而接菌处理的尾叶桉幼苗多了一个氮素来源,即可以来自生物固氮,固氮效率达到40%以上,且随着施氮量的增加尾叶桉幼苗对肥料氮和土壤氮的吸收率增加,而来自生物固氮的氮吸收率则降低。可见,施氮水平能影响植株的氮素来源,对生物固氮和土壤氮的吸收有影响,这与李跃森等[20]指出的施氮水平能影响植株的氮素来源的结论类似。用PGPR SZ7-1当接种菌剂时可适当减少有关肥料的用量,能有效地提高土壤速效氮素的积累,这证实了Gaskins 等[21]提出的固氮菌在长期氮素平衡中能有效积累氮素的结论。肥料氮、土壤氮以及生物作用固定的氮在土壤-植株系统中的迁移和转化受众多因素的影响,其过程是相当复杂的,还有待进行深入的详细的研究。
参考文献
[1] Brown M E. Seed and root bacterization[J]. Annual Review of Phytopathology, 1974, 12: 181-197
[2] Kloepper J W, Ryu C M, Zhang S. Induced systemic resistance and promotion of plant growth by Bacillusspecies[J]. Phytopathology, 2004, 94(11): 1 259-1 266.
[3] 刘淑琮, 冯 断,于 洁. 植物根际促生菌的研究进展及其环境作用[J]. 湖北农业科学, 2009, 48(11): 2 882-2 886.
[4] 戴 梅, 宫象辉, 丛 蕾, 等.PGPR制剂研发现状与发展趋势[J]. 山东科学, 2006, 19(6): 45-47.
[5] 赵 爽, 刘伟成, 裘季燕, 等. 多粘类芽孢杆菌抗菌物质和防病机制之研究进展[J]. 中国农学通报,2008, 24(7): 347-350.
[6] 张伟琼, 聂 明,肖 明. 荧光假单胞菌生防机理的研究进展[J]. 生物学杂志, 2007, 24(3): 9-11
[7] Yang J, Kloepper J W, Ryu C M. Rhizosphere bacteria help plants tolerate abiotic stress[J]. Trends in Plant Science, 2009, 14(1): 1-4.
[8] Mantelin S, Touraine B. Plant growth-promoting bacteria and nitrate availability: Impacts on root development and nitrate uptake[J]. Journal of Experimental Botany, 2004, 55: 27-34.
[9] Adesemoye AO, Torbert H A, Kloepper J W. Enhanced plant nutrientuse efficiency with PGPR and AMF in an integrated nutrient management system[J]. Canadian Journal of Microbiology, 2008, 54(10): 876-886.
[10] Domenech J, Reddy M S. Cornbined application of the biological product LS213 with Bacillus,Pseudomonas or Chryseobacterium for growth promotion and biological control of Soil-home diseases in pepper and tomato[J]. Biocontrol, 2006, 51: 245-258.
[11] 孟 瑶, 徐凤花, 孟庆有, 等. 中国微生物肥料研究及应用进展[J]. 中国农学通报, 2008, 24(6): 276-279.
[12] 程励励, 文启孝, 李 洪. 盆栽和田问条件下土壤15N标记肥料氮的转化[J]. 土壤学报, 1989, 26(2): 124-130.
[13] 褚贵新, 沈其荣, 张 娟, 等. 用15N富积标记和稀释法研究旱作水稻/花生间作系统中氮素固定和转移[J]. 植物营养与肥料学报, 2003, 9(4): 385-389.
[14] Hardarson G, Hera C. Use of 15N isotope dilution method to quantify nitrogen fixation in legumes and its potential use for non-legumes[M]//Malik K A, Mirza M S, Ladha J K. Proceedings of the 7th International Symposiumon Nitrogen Fixation with Non-legumes. The Netherlands: Kluwer Publishers, 1998: 307-312.
[15] 陸俊锟, 陈 俊, 康丽华. 四株红树林促生菌的遗传分析鉴定及其促生能力[J]. 微生物学报, 2010, 50(10): 1 358-1 365.
[16] Boto K G, Wellington J T. Soil characteristics and nutrient status in a northern Australian mangrove forest[J]. Estuaries, 1984, 7(1): 61-69.
[17] 王福钓. 农学中同位素示踪技术[M]. 北京: 农业出版社, 1989: 243-278.
[18] 褚贵新,沈其荣,张 娟,等. 用 15N富积标记和稀释法研究旱作水稻/花生间作系统中氮素固定和转移[J]. 植物营养与肥料学报, 2003, 99(4):385-389.
[19] 李 玫, 廖宝文, 康丽华, 等. PGPB对红树植物木榄幼苗的接种效应[J]. 林业科学研究, 2006, 19(1): 109-113.
[20] 李跃森, 王义祥, 应朝阳, 等. 施氮对圆叶决明生物固氮及氮肥利用效率的影响[J]. 热带作物学报, 2009, 30(4): 430-434.
[21] Gaskins M H, Albrecht S L, Hubbell D H. Rhizosphere bacteria and their use to increase plant productivity[J]. Agric Ecosyst Environ, 1985, 12(2): 99-106.
