银后粗肋草的离体培养和快速繁殖
2016-05-30刘俊仙熊发前龙明华罗丽李松刘丽敏刘红坚杨尚东
刘俊仙 熊发前 龙明华 罗丽 李松 刘丽敏 刘红坚 杨尚东


摘 要 以银后粗肋草的幼嫩叶片为材料,研究不同植物生长调节剂组合对愈伤组织诱导和分化的影响;以带侧芽的茎段为材料,研究不同接种方式、不同6-BA和NAA组合对丛生芽诱导的影响;以愈伤组织诱导的不定芽和茎段诱导的丛生芽为材料,研究不同植物生长调节剂组合对丛生芽的增殖和生根的影响;最后研究不同移栽基质组合对试管苗移栽成活的影响。结果表明: (1)叶片接种在MS+6-BA 2.5 mg/L+NAA 0.1 mg/L培养基培养中60 d后,愈伤组织诱导率为63.41%,不定芽再生率为26.88%,平均生成芽数为3.80个。 (2)带侧芽的茎段水平放置接种在MS+6-BA 2.0 mg/L+NAA 0.1 mg/L培养基上,丛生芽诱导率为91.91%,平均生成芽数为5.29个。(3)将经叶片诱导愈伤组织分化所得的不定芽和经茎段诱导所得的丛生芽切成单株,接种到MS+6-BA 3.0 mg/L+NAA 0.1 mg/L或MS+KT 3.0~4.0 mg/L+NAA 0.1 mg/L增殖培养基中,不定芽和丛生芽增殖和生长良好。(4)将在增殖培养基中长至4 cm 以上的小植株转入到1/2 MS+NAA 0.2 mg/L的生根培养基中培养20 d后,生根率达100%,平均根长4.49 cm,每株平均根数6.80条。(5)生根苗移栽到1/2木屑+1/4珍珠岩+1/4菜园土混合基质中,成活率达95.40%。
关键词 银后粗肋草;幼嫩叶片;带侧芽的茎段;离体培养;快速繁殖
中图分类号 Q949.717.2 文献标识码 A
In Vitro Culture and Rapid Propagation of
Aglaonema commutatum Schott cv.‘Silver Queen
LIU Junxian1,3, XIONG Faqian2*, LONG Minghua3*, LUO Li4,
LI Song1, LIU Limin1,LIU Hongjian1, YANG Shangdong3
1 Sugarcane Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
2 Cash Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
3 College of Agriculture,Guangxi University, Nanning, Guangxi 530004, China
4 Institute of Agricultural Sciences and Technology Information, Guangxi Academy of
Agricultural Sciences, Nanning, Guangxi 530007, China
Abstract Taken the young leaves of Aglaonema commutatum Schott cv.‘Silver Queenas the explants, the effects of different combinations of various plant growth regulators on callus induction were explored; taken the stem with axillary buds as the explants, the effects of both 6-BA and NAA on cluster buds were conducted; taken both the buds from callus and cluster buds from stems as the explants, the effects of different combinations of various plant growth regulators on multiplication and rooting of buds were explored. The results showed that, after 60 days of culturing leaves on MS basal medium supplemented with 2.5 mg/L 6-BA and 0.1 mg/L NAA, the callus induction rate and the adventitious bud induction rate was 63.41% and 26.88% respectively, with average 3.80 buds; the cluster buds rate reached up to 91.91% with 5.29 average buds, when the stems with axillary buds cultured horizontally on the MS basal medium supplemented with 2.0 mg/L 6-BA and 0.1 mg/L NAA; the cluster buds multiplied normally and grew well when transferring the single bud from either the buds from callus or cluster buds from stems to either the basal medium supplemented with 3.0 mg/L BA and 0.1 mg/L NAA or the basal medium supplemented with 3.0-4.0 mg/L KT and 0.1 mg/L NAA; after 20 days of culturing the over 4 cm plantlets on the rooting medium, viz., the half MS basal medium supplemented with 0.2 mg/L NAA, the rooting rate reached up to 100%, with average 4.49 cm root length, average 6.80 root number; when transplanted the seedlings in the mixed substrates composed of half wood chips, one fourth perlite and one fourth garden soil, the survival rate reached up to 95.40%.
Key words Aglaonema commutatum Schott cv.‘Silver Queen;Yung leaves;Stem segment with side buds;In vitro culture;Rapid propagation
doi 10.3969/j.issn.1000-2561.2016.02.019
银后粗肋草(Aglaonema commutatum Schott cv.‘Silver Queen)又名银后亮丝草、银后万年青,为天南星科(Araceae)粗肋草属(Aglaonema Schott)多年生草本观叶植物,是黑美人粗肋草(Aglaonema commutatum Schott‘Treubii)和箭羽粗肋草(Aglaonema commutatum Schott ‘Curtisii)的杂交种[1]。粗肋草原产于亚洲热带地区,主要分布于泰国、马来西亚、菲律宾、非洲、中国东南部等地[2-4],株高30~40 cm,茎直立不分枝,节间明显,叶片披针形或长卵形,浅绿色,叶面有灰绿或银灰色的斑纹,四季常青,叶色美丽,具有很强的耐阴性,小型容器栽培,也可水培于盛水的玻璃容器中,是室内观赏和装饰的佳品[5-6],银后粗肋草常用分株繁殖和扦插繁殖[7],繁殖系数低,且容易感染病毒,大规模快速繁殖可采用组织培养的方式[8]。目前,国外对粗肋草属植物研究主要集中在育种[9-13]及种间亲缘关系[1]、抗逆性[14-16]、病理[17-18]方面,有关组织培养方面的研究尚未见报道,国内的有关研究也较少[19-20]。本研究以银后粗肋草的幼嫩叶片和带侧芽的茎段为材料,探讨银后粗肋草的离体快繁技术,以期建立完善、高效、实用的粗肋草组织培养离体培养快速繁殖体系,为粗肋草试管苗规模化、工业化和商业化生产提供技术支撑和参考。
1 材料与方法
1.1 材料
以广西大学农学院花卉基地引进的生长健壮的银后粗肋草的幼嫩叶片和带侧芽的茎段为试验材料。
1.2 方法
1.2.1 外植体的预处理和消毒灭菌 选取生长健壮、无病虫害的植株,从茎基部上2个节间剪断,剥去外面老叶和枯叶,然后在饱和洗洁精液中用软毛刷或纱布轻拭外植体表面的尘埃,在流水中冲洗干净。叶片用0.1%的HgCl2(氯化汞)消毒8 min;茎段先用75%酒精浸泡30 s,再用0.1%的HgCl2消毒20 min,消毒过程中不断摇动,无菌水漂洗4~5次,用无菌滤纸吸干表面水分,放在灭菌过的不锈钢盘子里,备用。
1.2.2 叶片愈伤组织的诱导与分化 将灭菌的叶片剪成约1 cm×1 cm的小块,叶背朝下接种到愈伤组织诱导培养基上。诱导培养基为MS培养基,附加3%蔗糖,5.0 g/L琼脂粉(如无特殊说明,下同),分别添加不同浓度的2,4-D(2,4-二氯苯氧乙酸丁酯)、6-BA(6-苄氨基腺嘌呤)和NAA(萘乙酸)。在2,4-D和6-BA组合设计中,2,4-D浓度为1.0、1.5、2.0、2.5、3.0 mg/L,6-BA浓度为1.0 mg/L,共5个组合处理;在6-BA与NAA组合设计中,6-BA浓度为1.0、1.5、2.0、2.5、3.0 mg/L,NAA浓度为0.1 mg/L,共5个组合处理。接种后的材料于(25±3)℃,暗培养7 d,然后转为光照培养,温度(25±3)℃,光照强度1 000~1 200 lx,光照时间14 h/d,每处理接种10瓶,每瓶接种6块外植体,试验重复3次,定期观察并统计结果,研究不同植物生长调节剂组合和配比对叶片愈伤组织诱导和分化的影响。愈伤组织诱导率/%=(产生愈伤组织外植体数/接种外植体数)×100。不定芽诱导率/%=(诱导出不定芽的外植体数/接种外植体数)×100。
1.2.3 茎段丛生芽的诱导 将灭菌的带侧芽的茎段切成长约1.0 cm带一个侧芽的小段,接种到丛生芽诱导培养基上;以MS为基本培养基,设计NAA浓度为0、0.1、0.2 mg/L,6-BA浓度为1.0、2.0、3.0、4.0 mg/L;共12个处理,每个处理接种20瓶,每瓶接种1个外植体,重复3次;设芽眼朝上水平放置和生物学下端向下2种接种方式,观察不同接种方式和不同处理对丛生芽诱导的影响。丛生芽诱导率/%=(诱导出丛生芽的外植体数/接种外植体数)×100。
1.2.4 不定芽和丛生芽的增殖 将经叶片诱导愈伤组织分化所得的不定芽和经茎段诱导所得的丛生芽切成单株,接种到增殖培养基中,增殖培养基(1)MS+(1.0、2.0、3.0、4.0、5.0)mg/L KT+0.1 mg/L NAA,(2)MS+(1.0、2.0、3.0、4.0、5.0)mg/L 6-BA+0.1mg/L NAA。每个处理接20瓶,每瓶接种3棵无根试管苗,重复3次,30 d后统计结果。芽增殖倍数/倍=芽发生总数/接种总芽数。
1.2.5 生根、炼苗与移栽 当增殖的芽苗长到4 cm左右时,转入到生根培养基中,生根培养基为1/2 MS+(0、0.1、0.2、0.3)mg/L NAA,每个处理接种20瓶,每瓶接种1~3株,重复3次,30 d后统计结果,生根率/%=生根株数/接种株数×100。将生长健壮、叶色浓绿、根系较发达的无菌苗从培养室移到炼苗室,在室温自然光照条件下不打开瓶盖炼苗5~7 d,再打开瓶盖进行炼苗2~3 d,然后洗净根部培养基进行移栽,移栽基质为1/2木屑+1/4珍珠岩+1/4(细沙、黄泥、菜园土、泥炭)。30 d后统计成活率。成活率/%=成活植株数/移栽株数×100。
1.3 数据处理
数据采用DPS数据统计软件进行方差分析和多重比较分析(Duncans 法)。
2 结果与分析
2.1 不同植物生长调节剂组合对叶片愈伤组织诱导和分化的影响
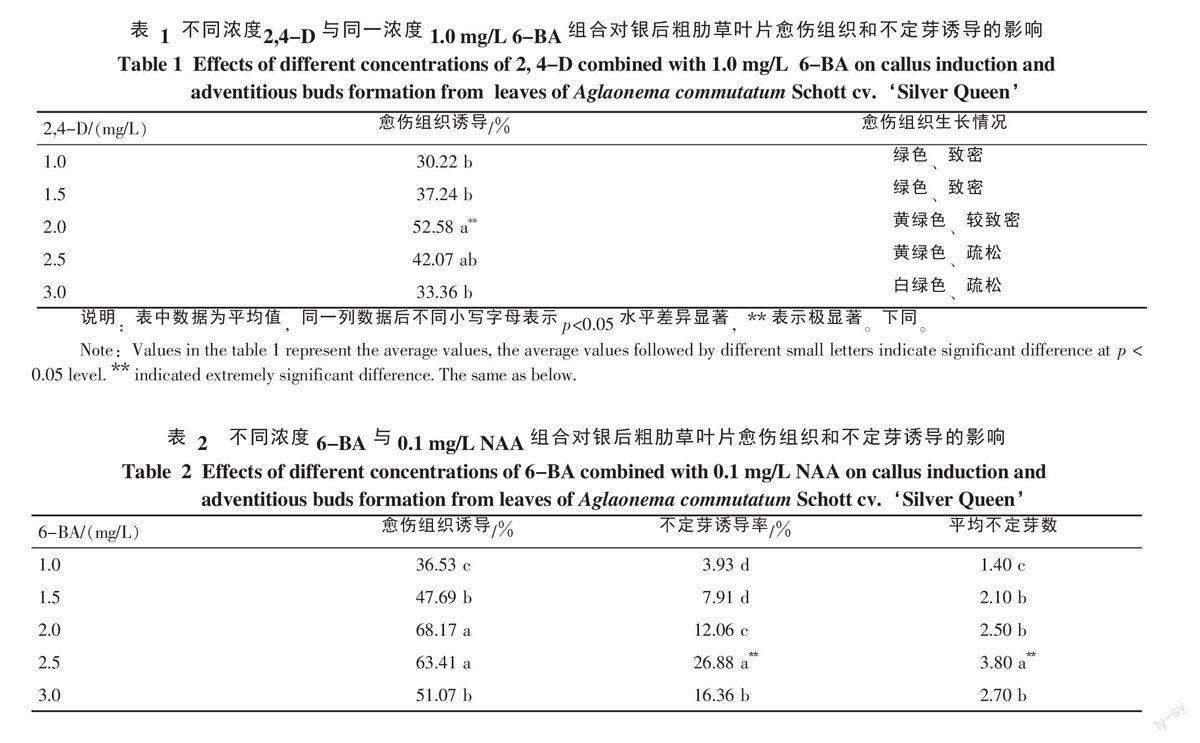
2.1.1 6-BA和2,4-D组合的影响 将银后粗肋草叶片接种到6-BA和2,4-D组合的培养基上,暗培养7 d后转到光照培养,10 d后观察到在边缘切口处有不同程度的褐变,20 d后叶片有卷起、增厚、肿胀现象,30 d后叶片边缘的开始膨大,逐渐形成黄绿色的颗粒状愈伤组织(图1-A)。由表1可看出,不同浓度的2,4-D对银后粗肋草叶片愈伤组织的诱导有差异,当2,4-D浓度为2.0 mg/L时,愈伤组织诱导率最高,达52.58%。在添加2,4-D的处理中,虽然均有不同程度的愈伤组织形成,但均未有不定芽的产生。
2.1.2 6-BA和NAA组合的影响 在添加6-BA和NAA组合的诱导培养基中培养2周后,叶片的切口处略微卷起、膨大且有褐变现象,也有部分外植体逐渐褐化,直至死亡,30 d后外植体的切口处形成颗粒状的愈伤组织,愈伤组织的质量和诱导率都较6-BA和2,4-D组合高,愈伤组织继续培养至60 d时有不定芽的分化(图1-B)。不同浓度6-BA对银后粗肋草叶片愈伤组织和不定芽的诱导差异明显,当6-BA浓度为2.0 mg/L时最高,达68.17%,与6-BA为2.5 mg/L时差异不显著;但6-BA为2.5 mg/L时不定芽的诱导率最高,达26.88%,平均生成芽数为3.80个(表2)。综合考虑,以MS+6-BA 2.5 mg/L+NAA 0.1 mg/L为银后粗肋草叶片愈伤组织诱导和分化的最适条件。
2.2 不同植物生长调节剂组合对银后粗肋草茎段丛生芽诱导的影响
不同接种方式对粗肋草丛生芽的诱导至关重要,带侧芽的茎段采用水平接种的丛生芽诱导率明显高于竖直插入培养的茎段,芽的发生时间也较早,一般在接种5 d后侧芽开始萌发,15 d时侧芽基部又萌发小侧芽,逐渐形成丛生芽(图1-C)。还有一种情况是茎段在接种5 d后侧芽萌发,随后在茎段两端的切口处有黄绿色和绿色的愈伤组织,当长至芽周围时出现绿色或黄绿色的芽点,逐渐形成丛生芽(图1-D)。由表3可看出,2.0 mg/L 6-BA+0.1 mg/L NAA组合丛生芽诱导率最高,为91.91%,平均诱导丛生芽数为5.29。据试验中观察,当6-BA浓度过高(﹥3 mg/L)时,外植体接种后在切口处有褐化的现象,且诱导出的芽长势也较差,芽体出现畸形现象,这也是6-BA浓度提高丛生芽诱导率反而下降的原因。当NAA浓度为0.2 mg/L时,芽体基部会有大量的愈伤组织产生,继续培养还会有不定根的生成,从而影响粗肋草丛生芽的诱导。
2.3 不同植物生长调节剂组合对银后粗肋草增殖的影响
2.3.1 6-BA和NAA组合的影响 由表4可知,在添加6-BA的增殖培养基中,随着6-BA浓度的增加,丛生芽的增殖倍数呈现增加的趋势,但当6-BA浓度>4.0 mg/L时,丛生芽的质量有所下降,愈伤组织增多,芽苗的伸长生长受到抑制,节间缩短,芽体生长不正常,有矮小畸形、叶片卷曲、黄化的现象。而6-BA浓度为3.0 mg/L时,增殖倍数较高,而且丛生芽的生长质量也较好,叶片呈深绿色,生长健壮,苗的高度也较高(图1-E),苗高为7.48 cm。因此,以6-BA为细胞分裂素进行增殖培养时,其最适浓度为3.0 mg/L。
2.3.2 KT和NAA组合的影响 由表5可知,在添加KT的增殖培养基中,较高浓度的KT有利于丛生芽的增殖,在KT浓度为4.0 mg/L时,增殖倍数最高,达到4.38。与6-BA相比,6-BA处理对芽的增殖效果要比KT处理的效果好,但从苗的长势来看,KT处理的苗较高且健壮,长势整齐,叶较多且叶色浓绿。当KT浓度>4.0 mg/L时,芽的生长也受到影响,叶片卷曲不能展开。综合考虑,KT的适宜浓度为3.0~4.0 mg/L。
2.4 生根培养与移栽
2.4.1 不同浓度NAA对生根的影响 将增殖培养所得的长至4 cm以上的无根苗转入到添加不同浓度NAA的生根培养基中,10 d时有根原基的出现,20 d时平均根长达1.73~4.49 cm。由表6可知,不添加NAA的生根培养基中的生根率为95.18%,其他均达到100%(图1-F、G)。平均生根数随着NAA浓度的增加呈现上升的趋势,但当NAA浓度为0.2 mg/L时,平均根长最长,为4.49 cm。据试验中观察,随着NAA浓度的升高,根变得粗短,苗的高度也有所下降,植株叶片数也变少,长势较弱。
2.4.2 不同移栽基质组合对试管苗移栽的影响 试管苗移栽一般在生根培养20 d左右,根长到3~5 cm时适合移栽,这时诱导出的根处于生长旺盛时期,根粗且色白,生活力强,移栽后能较快的适应移栽环境。将长到3 cm以上的生根苗先在室内打开瓶盖炼苗2~3 d,再移出室外炼苗2 d,取出洗净苗根部的培养基进行移栽,移栽前用多菌灵或者高锰酸钾对基质进行消毒。由表7可知,在本移栽试验中,1/2木屑+1/4珍珠岩+1/4菜园土是银后粗肋草较为理想的栽培基质,移栽成活率达到最高,为95.40%(图1-H);且在此组合中苗的生长素质也较好,抽出的新叶数多,面增高幅度最大且生长健壮。移栽后用塑料薄膜盖住并遮光50%,同时注意保湿、通风。在移栽后期管理过程中,需要控制光照强度,避免阳光直射,适当的散射光有利于叶面斑纹更清新、亮丽。
3 讨论与结论
近年来,在国内外花卉市场上,花卉产品的消费种类除盆花和切花外,市场上对室内荫生观叶植物的需求也呈直线上升趋势[21],其中天南星科观赏植物便是现在流行的种类之一。该科植物在世界花卉业中占有重要的地位,而粗肋草属植物在荷兰占盆栽花卉的第18位[22]。粗肋草对于净化室内空气悬浮粒子有着显著的效果,可推广为净化空气的室内观赏植物。
目前,对粗肋草离体培养的文献报道较少[20,23],而天南星科中的花叶万年青(Dieffenbachia)[24]、合果芋(Syngonium podophyllum Schott)[25]、红掌(Anthurium scherzerianum)[26]等通过器官发生的途径获得再生植株的报道不少。研究结果表明[22,27-30],在植物组织培养中,细胞分裂素对芽的诱导有显著的作用。Zhang等[31]研究了不同植物生长调节剂对合果芋(Syngonium podophyllum ‘Variegatum)叶片、叶柄和茎段再生体系建立的影响,结果发现叶柄和茎段诱导的愈伤组织在MS+2.0 mg/L 6-BA+0.2 mg/L NAA培养基上能成功分化不定芽。费昭雪[32]研究了不同培养基对不同品种红掌(Anthurium andraeanum)叶片、叶柄离体培养的影响,结果表明MS+2.0 mg/L 6-BA+0.25 mg/L NAA组合诱导不定芽分化率较高。本研究中发现适合银后粗肋草叶片诱导愈伤组织和不定芽的组合为MS+2.5 mg/L 6-BA+0.1 mg/L NAA,与前人的研究结果较为一致。
本研究结果还表明不同接种方式对粗肋草茎段丛生芽的诱导至关重要。采用茎段侧芽芽眼朝上水平放置的接种方式较适合粗肋草丛生芽的诱导。本试验结果以MS+2.0 mg/L 6-BA+0.1 mg/L NAA对茎段丛生芽的诱导最佳;6-BA对丛生芽的增殖效果较好,而KT对苗素质的提高有较大的影响。综合以MS+3.0 mg/L 6-BA+0.1 mg/L NAA对银后粗肋草的增殖效果最佳。与田郎等[19]对银王粗肋草(Aglaonema commutatum Schott cv.‘Silver King)的研究有所不同,其研究结果认为MS+2.0~2.5 mg/L 6-BA较为适宜银王粗肋草芽的诱导,张施君等[20]则认为以MS+2.5 mg/L 6-BA+0.05~0.1 mg/L NAA对黄金宝玉亮丝草(Aglaonema commutatum Schott cv.‘Golden Jewelry)丛生芽增殖的效果最好,本研究结果与上述研究结果有品种上的差异。
生根试验中采用1/2MS作为基本培养基,在试验结果中发现不添加生长素的生根率也达到95.18%,可见银后粗肋草较易生根。在生根培养基中添加不同浓度NAA,其平均生根数随生长素NAA浓度的增加而增加,当超过0.2 mg/L时,平均根长反而降低,同时苗的伸长生长也受到了抑制。较适宜的生根培养基为1/2MS+0.2 mg/L NAA,而田郎等[19]的研究认为3/4MS+3.0~3.5 mg/L IBA适合银王粗肋草的生根。
参考文献
[1] Mayo S J, Bogner J, Boyce P C. The genera of Araceae[M]. London: Royal Botanic Gardens, Kew, 1997.
[2] Nicolson D H. A revision of the genus Aglaonema(Araceae)[M]. Washington: Smithsonian Institution Press. 1969: 1-69.
[3] Hay A. A new spesies of Aglaonema Schott(Araceae)from Terengganu, Malaysia[M]. Singapore: Gardens Bull, 1998: 1-4.
[4] 曾宋君, 余志满, 柯萧霞. 常见观叶花卉-天南星科植物[M]. 北京:中国林业出版社,2004:17-80.
[5]向其柏, 向 民, 刘玉莲. 室内观叶植物[M]. 上海: 上海科学技术出版社, 1999: 27-36.
[6] 柏文富, 陈白冰,聂东伶. 广东万年青扦插繁殖技术研究[J]. 湖南林业科技, 2008, 35(4): 30-35.
[7] Henny R J, Chen J, Mellich T A. Tropical foliage plant development: breeding techniques for Aglaonema and Dieffenbachia[J]. University of Florida IFAS Extension, 2009, 1117: 1-5.
[8] Henny R J. Aglaonema breeding-past, present and future[J]. Proc Fla State Hort Soc, 1983, 96(1): 140-141.
[9] Hull D L, Henny R J. Anthrium and Aglaonema production in dade county, Florida[J]. Proc Fla State Hort Soc, 1995, 108(1): 4-5.
[10] Chen J, Henny R J, McConnell D B. Development of new foliage plant cultivars[J]. Flo Agric Exp St J, 2002, 41(1): 1-8.
[11] Henny, R J,Chen J. Foliage plant cultivars development[J]. Plant Breeding Rev, 2003, 21(2): 245-290.
[12] Budiarto K. Conventional propagation of several Aglaonema accessions using split single-bud sten cutting[J]. J Agrivigor,2008, 7(2): 99-104.
[13] Chen J, Devanand P S, Norman D J, et al. Genetic relationships of Aglaonema species and cultivars inferred from AFLP markers[J]. Annals of Botany, 2004, 93(1): 157-166.
[14] Elliott M S, Griffis J L, Mcconnell D B, et al. A light and scanning electron microscope study of bent-tip in Aglaonema‘silver queen[J]. Proc Fla State Hort Soc, 1997, 110(1):107-110.
[15] Chen J, Henley R W, Henny R J, et al. A simple leaf-assay method for evaluating Aglaonema sensitivity to chilling temperatures[J]. Proc Fla State Hort Soc, 1998, 111(1): 43-46.
[16] Chen J, Henley R W, Henny R J, et al. Chilling Injury in Tropical Foliage Plants: II. Aglaonema[M]. Florida: University of Florida IFAS Estension, 2001: 1-4.
[17] Pearson M N, Clover G R G, Guy P L, et al. A review of the plant virus, viroid and mollicute records for New Zealand[J]. Australasian Plant Pathology, 2006, 35(2): 217-252.
[18] Nelson S. Bacterial Leaf Blight of Aglaonema[J]. Plant Disease,2009, 93(1): 64.
[19] 田 郎, 谭海燕. 银王亮丝草的试管微繁殖[J]. 植物生理学通讯, 1999, 35(1): 38.
[20] 张施君, 江如蓝,周厚高. 黄金宝玉亮丝草的离体快速繁殖研究[J]. 中国农学通报, 2004, 20(4): 39-40.
[21] 杜普江, 黄循精. 世界花卉产销概况及发展趋势[J]. 热带作物研究, 1996, 65(3): 21-25.
[22] 朱根发. 天南星科植物组培快繁技术[J]. 花木盆景, 2002, 10(1): 4-5.
[23] 刘俊仙, 熊发前,于文进,等. 黑美人粗肋草的组织培养研究[J]. 热带作物学报, 2013, 34(5): 899-904.
[24] 朱根发, 张远能, 邹春萍,等. 花叶万年青的组织培养和快速繁殖[J]. 热带亚热带植物学报, 1999, 7(3): 243-247.
[25 蒋亚莲, 桂 敏, 黎 霞, 等. 合果芋组织培养快繁技术研究[J]. 北方园艺, 2009, 33(3): 62-65.
[26] 郭军战, 费昭雪,成密红. 红掌不同外植体愈伤组织诱导与不定芽分化的研究[J]. 西北林学院学报, 2006, 21(3): 72-74.
[27] 丰 锋, 梁钾贤, 叶春海, 等. 花叶万年青的组织培养[J]. 北方园艺, 1998, 22(3): 105-106.
[28] 张文珠, 林德钦, 李 梅. 绿巨人叶柄离体培养及植株再生[J]. 亚热带植物科学, 2001, 30(1): 32-35.
[29] 廖飞雄, 邹春萍, 王恒明,等. 观叶花烛的组织培养和快速繁殖[J]. 植物生理学通讯, 2005, 41(2): 189.
[30] Ma G H, He C X, Ren H, et al. Direct somatic embryogenesis and shoot organogenesis from leaf explants of Primulina tabacum[J]. Biologia Plantarum, 2010, 54(2): 361-365.
[31] Zhang Q, Chen J J, Henny R J. Regeneration of Syngonium podophyllum‘Variegatumthrough direct somatic embryogenesis[J]. Plant Cell, Tissue and Organ Culture, 2006, 84(1): 181-188.
[32] 费昭雪. 红掌组织培养快速繁殖技术的研究[D]. 西安: 西北农林科技大学, 2006.
