菠萝蜜多糖提取工艺优化及初步鉴定
2016-05-30朱科学张彦军谭乐和徐飞贺书珍
朱科学 张彦军 谭乐和 徐飞 贺书珍


摘 要 以菠萝蜜果肉为试验原料,在单因素试验基础上,利用三因素三水平的Box-Benhnken中心组合试验和响应曲面法优化液料比、提取时间和提取温度对多糖类物质的提取工艺和建立数学模型,并对制备的多糖进行初步鉴定。结果表明,二次方程模型拟合试验数据效果显著,菠萝蜜多糖提取工艺为:液料比为30 ∶ 1,提取时间为2.5 h,提取温度为90 ℃,验证试验得率为6.18%,多糖初步鉴定结果显示,菠萝蜜精制多糖中总糖含量为31.6%,不含有还原糖、含有微量多酚类物质(含量为0.6%)。
关键词 响应曲面法;菠萝蜜;多糖;提取工艺
中图分类号 Q946.3;O658 文献标识码 A
Optimized Extraction and Identification of Polysaccharides Isolated
From Jackfruit(Artocarpus heterophyllus Lam.)Pulp
ZHU Kexue, ZHANG Yanjun, TAN Lehe*, XU Fei, HE Shuzhen
Spice and Beverage Research Institute, CATAS, Wanning, Hainan 571533, China
Abstract On the basis of single-factor experiments, Design-Expert software was utilized to optimize the extraction process and establish the mathematical model of polysaccharides extracted from jackfruit(Artocarpus heterophyllus Lam.)pulp. The physicochemical properties of jackfruit polysaccharides(JFP)was analyzed by measuring the contents of total sugar, reduction sugar and total polyphenols. The results showed that quadratic model was the best model with R-Squared was 0.978 5 and adjusted R-Squared was 0.951 0. The optimal extraction conditions were found that the optimal water to material ratio, extraction time and extraction temperature were 30 ∶ 1(mL/g), 2.5 h and 90 ℃, respectively. Under these conditions, the actual yield of JFP was 6.18%.The physicochemical properties results indicated that JFP contained 31.6% total sugar, small accounts of total polyphenols and no reduction sugar included. The results might be useful for future studies on the activity and structure-activity relationship of JFP.
Key words Response surface meltmdology; Jackfruit(Artocarpus heterophyllus Lam.); Polysaccharides; Extraction optimization
doi 10.3969/j.issn.1000-2561.2016.02.030
菠萝蜜(Artocarpus heterophyllus Lam.)作为一种桑科(Moraceae)木菠萝属(Artocarpus)热带果树,素有“热带珍果”、“热带水果皇后”等美誉[1]。其果肉中含有丰富的糖类化合物、蛋白质、氨基酸、多酚、脂肪酸、维生素、矿物质等营养成分,可作为一些重要营养素的食物来源。Baliga等[2]通过分析发现菠萝蜜果肉中含碳水化合物16.0%~25.4%,蛋白质1.2%~1.9%,脂肪0.1%~0.4%,矿物质0.87%~0.9%。研究还发现,菠萝蜜对人体相关生理活动具有抗氧化、抗炎、降血糖等多种药理药效活性[3-5]。近年来,有关菠萝蜜营养成分及其生物活性的相关研究越来越受到重视,但大多集中在微量元素、多酚和黄酮类物质等方面,菠萝蜜多糖的研究仍处于摸索阶段。
多糖是一类由醛糖或酮糖通过糖苷键连接而成的天然高分子多聚物,在自然界分布很广,常见的有植物多糖、真菌多糖、海洋生物多糖。同时,关于多糖生物活性的研究主要集中在其抗氧化、免疫调节、抗肿瘤、抗糖尿病等方面[6]。邹勇芳等[7]对菠萝蜜水提物中多糖含量进行测定,苯酚-硫酸法测定结果显示菠萝蜜多糖含量为5.53%;Tan等[8]研究发现菠萝蜜果肉中粗多糖具有免疫增强活性。但目前对于菠萝蜜多糖的提取工艺优化及鉴定尚未进行系统的研究。因此,本研究拟利用Box-Benhnken中心组合试验和响应曲面法,优化菠萝蜜多糖的提取工艺,并通过总糖、还原糖及总酚含量分析进行初步鉴定,结果可为菠萝蜜多糖类物质的深入研究和精深加工提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 菠萝蜜鲜果(马来西亚1号品种),由中国热带农业科学院香料饮料研究所提供。
无水乙醇、氯仿、正丁醇、丙酮、无水乙醚均为分析纯试剂,购自西陇化工股份有限公司;苯酚、浓硫酸为分析纯试剂,购自国药集团化学试剂有限公司;葡萄糖标品,购自美国Sigma公司;没食子酸,上海阿拉丁生化科技股份有限公司出品;福林酚,上海荔达生物科技有限公司出品。
1.1.2 仪器与设备 ME4002E电子天平(梅特勒-托利多);旋转蒸发仪RV10(IKA仪器设备有限公司);SHB-IIIB循环水式多用真空泵(郑州长城科工贸有限公司);LXJ-IIB多管离心机(上海安亭科学仪器厂);JDG-0.2真空冷冻干燥机(兰州科近真空冻干技术有限公司);ST-987沙冰料理机(松泰电器有限公司);HH-4数显恒温水浴锅(金坛市富华仪器有限公司);透析袋MD34(截留分子量10000,美国光谱医学公司);分液漏斗(蜀牛玻璃仪器有限公司);SPECORD 250 PLUS紫外可见分光光度计(德国耶拿分析仪器公司)。
1.2 方法
1.2.1 菠萝蜜多糖提取工艺流程 菠萝蜜鲜果去除果皮、果丝和种子后,收集菠萝蜜果肉,采用ST-987冰沙料理机粉碎,加入无水乙醇使乙醇-菠萝蜜水溶液的终浓度为80%,浸泡过夜,重复2次,脱除色素及醇溶性物质,干燥备用。菠萝蜜多糖按照图1所示流程进行提取。
菠萝蜜果肉冻干粉末经水浴加热浸提,抽滤收集上清液,旋转蒸发仪进行真空浓缩,浓缩液加入无水乙醇至乙醇浓度为70%(V/V),搅拌均匀,4 ℃静置过夜,3 000 r/min离心5 min,收集醇沉物,真空冷冻干燥,制备菠萝蜜粗多糖。称取一定重量的粗多糖样品用蒸馏水溶解后,再用Sevag(氯仿 ∶ 正丁醇=4 ∶ 1,V/V)脱除游离蛋白质,透析(自来水48 h,蒸馏水24 h),浓缩后70%醇沉,再分别用无水乙醇、丙酮、无水乙醚洗涤,冷冻干燥得精制多糖。
1.2.2 菠萝蜜多糖得率 根据精制多糖的质量和菠萝蜜果肉干燥粉末的重量,按如下公式计算菠萝蜜多糖得率:
菠萝蜜多糖得率=×100%(1)
1.2.3 单因素试验 选取液料比、提取时间和提取温度3个因素,每个因素设置5个水平,每个水平重复3次:①固定提取温度和提取时间,研究液料比(分别为10 ∶ 1、20 ∶ 1、30 ∶ 1、40 ∶ 1、50 ∶ 1)对菠萝蜜多糖得率的影响;②固定液料比和提取温度,分别考察不同提取时间(1、2、3、4、5 h)对菠萝蜜多糖得率的影响;③固定液料比和提取时间,分别考察不同提取温度(55、65、75、85、95 ℃)对菠萝蜜多糖得率的影响。提取工艺按照图1流程进行,并按照公式(1)计算菠萝蜜多糖的得率。
1.2.4 响应曲面法 在单因素试验结果的基础上,分别考察液料比、提取时间、提取温度对多糖得率的影响。采用Box-Benhnken中心组合试验及响应曲面法优化菠萝蜜多糖提取工艺。
1.2.5 菠萝蜜多糖理化性质鉴定 苯酚-硫酸反应分析样品中总糖含量,费林试剂反应[9]鉴定还原糖含量,Folin-Ciocalteu法[10-11]检测总酚含量。
1.3 数据分析
采用Design-Expert软件进行实验设计、数据分析及模型的建立,以液料比(A)、提取时间(B)、提取温度(C)3个变量为参数,试验因素与水平设计见表1。运用Design-Expert软件对实验数据进行回归分析,模型方程的拟合性质由决定系数R2及方差分析判定,统计显著性和回归系数显著性由F值来检测,P值取0.05、0.01二个不同水平。
2 结果与分析
2.1 液料比对菠萝蜜多糖得率的影响
由于多糖类生物大分子物质在水中的溶解度不高,因此浸提过程中用水量是限制多糖得率的重要因素[12]。结果如图2所示,在10 ∶ 1~20 ∶ 1间,菠萝蜜多糖得率显著上升,在30 ∶ 1之后得率有所降低。因此,初步选定液料比在20 ∶ 1~40 ∶ 1范围。
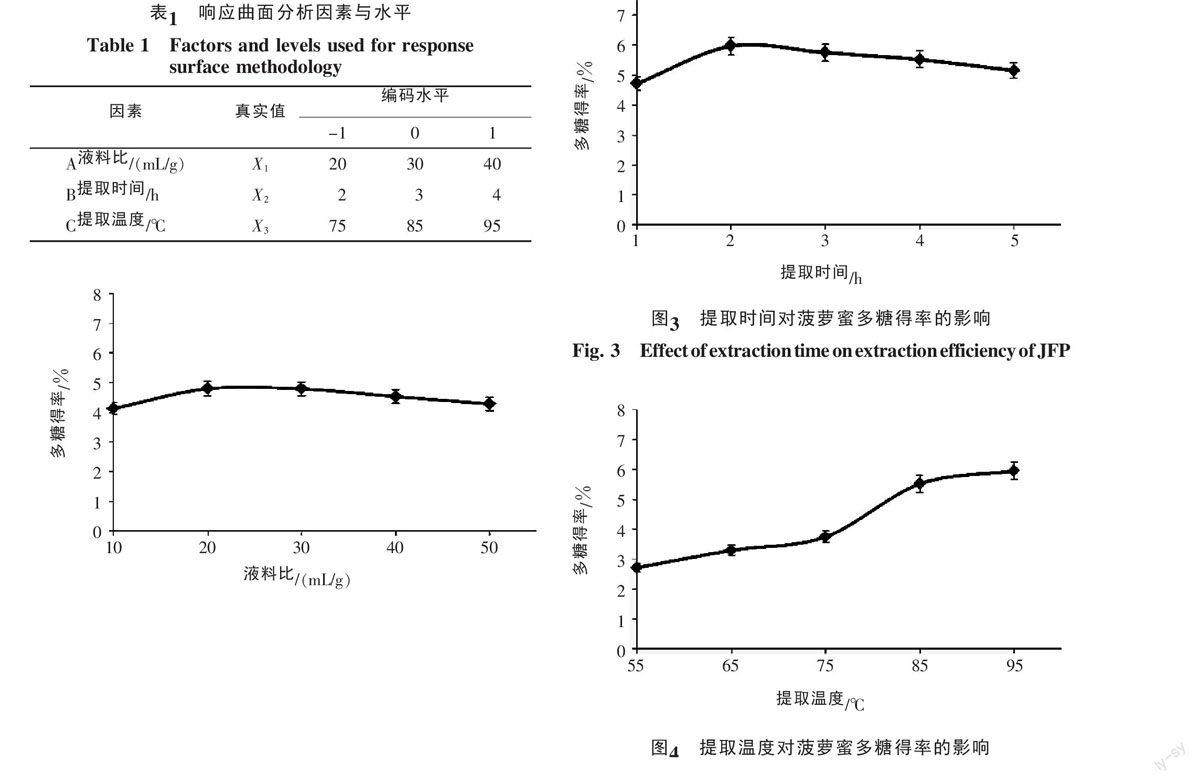
2.2 提取时间对菠萝蜜多糖得率的影响
提取时间对菠萝蜜多糖得率的影响见图3,结果显示,提取时间在2 h时多糖的得率达到最高,之后随着提取时间的延长呈下降的趋势。故本实验初步选择提取时间范围为2~3 h。这表明,菠萝蜜多糖的浸出过程与时间密切相关:浸提初期,时间过短,产物溶解不充分;但浸提时间过长,可能由于部分多糖水解的原因,造成多糖得率降低[13]。
2.3 提取温度对菠萝蜜多糖得率的影响
提取温度对菠萝蜜多糖得率的影响效果显著,多糖提取率随着温度的升高而增加(图4)。温度在85~95 ℃范围内,温度的作用效果趋于平稳,可能与温度越高,体系中溶液的粘度越低,有助于胞内多糖分子向外扩散有关。
2.4 响应曲面分析方案及结果
根据Box-Benhnken的中心组合试验设计原理,综合单因素试验结果,选取液料比、提取时间和提取温度对菠萝蜜多糖提取率影响的3个因素,每一个自变量的低、中、高试验水平分别以-1、0、+1进行编码。试验方案、菠萝蜜多糖得率试验值及预测值见表2。
2.5 菠萝蜜多糖得率与各变量关系模型
表3和表4分别为Design-Expert给出的多糖得率与不同操作参数之间关系多种拟合模型的方差分析。从表3多种模型方差分析中的均方及F值和概率>F检验结果综合来看,二次方程模型的拟合效果要好于其他方程模型,Design-Expert系统推荐二次方程模型。表4对多种拟合模型的标准偏差、相关系数R2、校正系数R2值及偏差平方和的结果进行了分析,表明自变量与响应值之间线形关系显著,可以用于菠萝蜜多糖实验的理论预测。
结合上述分析,用Design-Expert进行二次方程回归拟合,得到菠萝蜜多糖得率与编码自变量液料比(A)、提取时间(B)、提取温度(C)的二次多项回归方程:
Y=5.90+0.19A-0.066B+1.11C-0.31A2-0.052AB+0.042AC-0.31B2-0.25BC-1.03C2
2.6 菠萝蜜多糖得率回归模型方差分析
对响应曲面回归方程方差分析发现,提取温度和液料比对多糖得率的影响显著,而提取时间较不显著,各影响因素对多糖得率作用大小的顺序依次为提取温度>液料比>提取时间。方程的决定系数为R2=0.978 5,校正系数R2值为0.951 0,表明用上述二次多项回归方程预测各因素与响应值之间的关系时,因变量和全体自变量之间的线性关系显著,说明该模型与实际实验拟合较好(表5)。
2.7 因素间的交互对菠萝蜜多糖得率的影响
通过固定液料比、提取时间或提取温度其中一个因素,观察另外两个因素及其交互作用对多糖得率的影响,进而得到一组响应曲面和等高线图[14]。图5~7直观地反映了液料比与提取时间、液料比与提取温度及提取时间与提取温度相互作用对菠萝蜜多糖得率的影响;结果显示,提取温度与提取时间对多糖提取率作用显著,液料比与提取时间、液料比与提取温度作用不显著,与表5结果显示一致。
2.8 Design-Expert系统的模拟寻优与检验
由上述分析结果可知,响应值存在最大值,通过软件进一步分析计算,得到菠萝蜜多糖提取率预测值最大时的最优条件:液料比为34 ∶ 1,提取时间为2.78 h,提取温度为90.5℃,预测值为6.27%。考虑到实际提取条件,提取液量的增加会提高能源的消耗,同时过高的提取温度可能会对多糖的活性具有一定的损害[15]。因此,综合考虑能耗问题与活性保持问题,将菠萝蜜多糖提取工艺条件修正为:液料比为30 ∶ 1,提取时间为2.5 h,提取温度为90 ℃。为验证结果的可靠性,采用修正条件进行提取实验,结果得出菠萝蜜多糖实际得率为6.18%,表明利用响应曲面分析法得到的菠萝蜜多糖提取工艺参数真实可靠,具有实用价值。
2.9 菠萝蜜多糖的鉴定
苯酚-硫酸法的基本原理是利用糖类在浓硫酸作用下,水解生成糠醛或其衍生物,与苯酚试剂缩合反应后溶液呈橙黄色,且其颜色深浅与糖的浓度成正比;本实验结果显示,菠萝蜜多糖样品溶液经苯酚硫酸法分析后,溶液呈橙黄色,证明菠萝蜜提取物中含有多糖类物质,经分析发现总糖含量为31.6%。费林试剂反应的实验原理为糖中的还原糖(如葡萄糖、果糖)与斐林试剂发生作用,可以生成砖红色沉淀;本实验菠萝蜜精制多糖样品与费林试剂后没有砖红色沉淀产生,说明菠萝蜜精制多糖中不含游离的还原糖。本实验进一步采用Folin-Ciocalteu法测定样品中总酚含量,结果发现菠萝蜜多糖中多酚类物质含量为0.6%。
3 讨论与结论
多糖是自然界中广泛存在的一类生物大分子化合物,不仅广泛参与各种生命活动,而且还具有包括免疫调节在内的多种生物功效。多糖常用的提取纯化方法为水提醇沉后去蛋白、超滤;常用的分析方法有苯酚-硫酸法、蒽酮-硫酸法、菲林试剂反应等。Tan等[8]研究发现,水提醇沉菠萝蜜果肉多糖的得率为3.91%,总糖含量为21%。本实验菠萝蜜精制多糖得率最高可达6.18%,其总糖含量为31.6%,说明本研究工艺明显提高多糖的得率及总糖含量。
响应曲面法是一种以回归模型函数近似拟合多因子试验中因素与指标关系的工具,通过分析函数的等高线和响应面,讨论因素之间以及因素与响应面之间的相互关系,对反应条件和加工工艺参数进行优化[16]。本实验首次应用响应曲面法优化菠萝蜜多糖提取工艺,在单因素试验基础上,采用响应曲面法对影响菠萝蜜多糖提取率的3个主要因素:液料比、提取时间和提取温度进行了优化。分析结果表明,二次方程模型的拟合效果要好于其他方程模型,用Design-Expert进行拟合得到二次方程式为:
Y=5.90+0.19A-0.066B+1.11C-0.31A2-0.052AB+0.042AC-0.31B2-0.25BC-1.03C2,方程的决定系数为R2=0.978 5,R2校正值为0.951 0,说明该模型与实际实验拟合较好。
综上所述,通过响应曲面和等高线圈,直观地反映了各影响因素之间交互作用,优化得到菠萝蜜多糖提取工艺条件为:液料比为30 ∶ 1,提取时间为2.5 h,提取温度为90 ℃,验证实验结果显示菠萝蜜多糖实际得率为6.18%,说明利用响应曲面分析法得到的菠萝蜜多糖提取工艺参数真实可靠。菠萝蜜多糖的初步鉴定结果显示,提取得到的样品为多糖类物质,且样品中不含有还原糖及含有微量多酚类物质,实验结果可为菠萝蜜多糖后续的研究提供理论参考。
参考文献
[1] Swami S B, Thakor N J, Haldankar P M, et al. Jackfruit and its many functional components as related to human health: A review[J]. Comprehensive Reviews in Food Science and Food Safety, 2012, 11(6): 565-576.
[2] Baliga M S, Shivashankara A R, Haniadka R, et al. Phytochemistry, nutritional and pharmacological properties of Artocarpus heterophyllus Lam(jackfruit): A review[J]. Food Research International, 2011, 44(7): 1 800-1 811.
[3] 张 涛, 潘永贵. 菠萝蜜营养成分及药理作用研究进展[J]. 广东农业科学, 2013, 40(4): 88-90.
[4] Fang S, Hsu C, Yen G. Anti-inflammatory effects of phenolic compounds isolated from the fruits of Artocarpus heterophyllus[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4 463-4 468.
[5] Omar H S, El-Beshbishy H A, Moussa Z, et al. Antioxidant activity of Artocarpus heterophyllus Lam.(Jack Fruit)leaf extracts: remarkable attenuations of hyperglycemia and hyperlipidemia in streptozotocin-diabetic rats[J]. The Scientific World Journal, 2011, 11: 788-800.
[6] Braccini I, Grasso R P, P ì rez S. Conformational and configurational features of acidic polysaccharides and their interactions with calcium ions: a molecular modeling investigation[J]. Carbohydrate Research, 1999, 317(1): 119-130.
[7] 邹勇芳, 苏玉凤, 李清容, 等. 木菠萝水提物中多糖含量的测定[J]. 右江民族医学院学报, 2009, 31(3): 369-370.
[8] Tan Y, Li H, Lai W, et al. Crude dietary polysaccharide fraction isolated from Jackfruit enhances immune system activity in mice[J]. Journal of Medicinal Food, 2013, 16(7): 663-668.
[9] 赵光华, 马红芳, 田山林. 费林试剂法测定香菇等食用菌中总糖含量研究[J]. 饲料博览, 2010, (11): 39-41.
[10] Singleton V L, Rossi J A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture, 1965, 16(3): 144-158.
[11] Oliveira I, Sousa A, Ferreira I C F R, et al. Total phenols, antioxidant potential and antimicrobial activity of walnut(Juglans regia L.)green husks[J]. Food and Chemical Toxicology, 2008, 46(7): 2 326-2 331.
[12] 李景恩. 江香薷多糖和两种阿拉伯胶的结构解析及功能特性[D]. 南昌: 南昌大学, 2014.
[13] 贺 寅, 王 强, 钟 葵. 响应面优化酶法提取龙眼多糖工艺[J]. 食品科学, 2011, 32(2): 79-83.
[14] 李景恩, 聂少平, 杨 超, 等. 响应曲面法优化香薷多糖的提取工艺[J]. 食品科学, 2009, (18): 131-134.
[15] 韩 伟, 张玲玲, 黄 兮, 等. 桑葚多糖的絮凝纯化及其抗氧化性[J]. 南京工业大学学报(自然科学版), 2014, 36(1): 97-101.
[16] 万 阅, 齐计英, 曾 红, 等. 响应面法优化香菇多糖的超声辅助提取工艺[J]. 生物技术通报, 2015, 31(1): 79-85.
