茎瘤芥(榨菜)杂交种涪杂2号种子纯度SSR鉴定
2016-05-30沈进娟刘雪姣冉广葵曾胜于晓虎杨仕伟冷容李娟朱学栋
沈进娟 刘雪姣 冉广葵 曾胜 于晓虎 杨仕伟 冷容 李娟 朱学栋


摘要:【目的】利用SSR分子标记技术对茎瘤芥涪杂2号种子纯度进行检测,为茎瘤芥及其他杂交种纯度鉴定提供参考,也为加快涪杂2号的推广应用打下基础。【方法】以茎瘤芥杂交种涪杂2号、父母本及易混杂植株为试验材料,应用SSR分子标记技术结合改良CTAB法快速提取DNA,进行特异引物筛选及验证,对涪杂2号种子纯度进行快速检测,并对检测结果进行田间表型鉴定。【结果】从80对SSR特异引物中筛选出6对特异性强的引物,其中引物Na14-G06能清晰地扩增出父、母本的特异性条带,并且双亲互补,该引物同时可将杂交种中的异源花粉植株分离出,其余5对引物可将机械混杂植株区分开;两对引物联用Na14-G06+Ol11-H02、Na14-G06+Na14-G10或Na14-G06+Ol12-D09能较好区分假杂株。利用所筛选引物对涪杂2号杂交种群体进行SSR检测,检测结果显示种子纯度为95.8%,与田间生物学表现性状检测结果(96.7%)基本一致。【结论】两对引物联用可用于涪杂2号杂交一代种子纯度的快速检测和准确鉴定,SSR分子标记技术应用于茎瘤芥杂交种子纯度检测具有可行性。
关键词: 茎瘤芥;种子纯度;快速检测;SSR分子标记
中图分类号: S339.31 文献标志码:A 文章编号:2095-1191(2016)07-1064-07
0 引言
【研究意义】茎瘤芥(Brassica juncea var. tumida Tsen & Lee)属十字花科芸薹属植物,其加工产物榨菜是重庆市重要特色支柱产业之一。近年来,茎瘤芥鲜销产物青菜头已形成产业化并逐步发展壮大,不仅弥补了北方冬春新鲜蔬菜的淡季市场,还成为广大菜农增产增收、脱贫致富的重要途径。涪杂2号是由重庆市渝东南农业科学院(原重庆市涪陵区农业科学研究所)选育出的瘤茎產量优势明显、综合性状较好、提早播种15 d而不出现先期抽薹且收获可提早45 d的优良杂交一代新品种(范永红等,2008),该品种可用作早市青菜头的主栽品种(冷容等,2011),使用周期长,推广面积大,目前对整个榨菜产业发展有较大影响。涪杂2号种子的纯度直接影响青菜头的生产,茎瘤芥杂交种制种过程中易混入父母亲本及异源花粉而造成纯度下降,甚至存在一些不法商贩人为掺入常规种出售假种子,致使大幅减产,严重影响菜农的经济利益。因此,在茎瘤芥杂交种大面积种植之前快速准确地鉴定种子质量,是非常关键和必要的步骤。【前人研究进展】种子质量优劣通常利用田间生物学性状进行鉴定,但此法周期长、成本高,容易受外界环境和检测人员水平的影响,难以适时准确指导;酯酶同工酶(黎杰强等,2005)虽然对大多数品种能保证纯度的鉴定,但对少数品种特别是杂种酶谱偏母本型的品种不能准确鉴定。目前,作物品种鉴定和纯度分析的检验技术已经从传统的形态学方法发展到分子水平。在各种DNA分子标记中,SSR分子标记(孙海燕等,2014;周志成等,2014;李海梅等,2015;尤佳等,2015)在杂交种的鉴定和种子纯度检测方面具有很大优越性且已得到广泛应用。SSR分子标记技术直接反映品种的遗传基础差异,为种子的纯度鉴定提供了一种更快速、高效的方法,具有试验操作简单、结果稳定可靠、引物序列易交流等优点(李召华等,2006),可弥补和克服种子纯度的形态学鉴定及同工酶电泳鉴定中的许多缺陷和难题,是对种子纯度进行快速、准确鉴定的发展方向和必然选择。随着高通量测序技术和生物信息学的发展,海量EST、SNP数据被提交至数据库并共享,为SNP的筛选创造了有利条件(兰青阔等,2012),易于实现自动化。但由于茎瘤芥分子研究起步较晚,EST、SNP数据较少,目前还不便于SNP标记。【本研究切入点】茎瘤芥杂交种涪杂2号种子从生产到播种时间间隔短,尤其是早市青菜头比大面积生产播种提早10~15 d,能否快速准确鉴定茎瘤芥杂交种涪杂2号种子纯度非常关键,制约着早市青菜头产业的快速健康发展。目前,对茎瘤芥杂交种种子纯度的检测常用田间种植法,而应用分子标记技术进行茎瘤芥杂交种快速鉴定的研究尚无相关报道。【拟解决的关键问题】以涪杂2号、父母本及易混杂植株为试验材料,结合田间种子鉴定,利用SSR分子标记技术筛选出能清晰扩增出父、母本的特异性条带,并且双亲互补,同时可将杂交种中的机械混杂植株清晰分离出的SSR引物,建立一套快速检测涪杂2号纯度的方法,为茎瘤芥及其他杂交种的纯度鉴定提供理论基础和数据参考,也为加快涪杂2号的推广应用打下基础。
1 材料与方法
1. 1 试验材料
供试材料为茎瘤芥杂交品种涪杂2号、其自交系父本920145和不育系母本96154-5A及易混杂植株,均由重庆市渝东南农业科学院提供。
1. 2 试验方法
1. 2. 1 基因组DNA提取 用于引物筛选的亲本材料及杂交种基因组DNA,以及用于引物验证的人工混杂涪杂2号种子单株均采用CTAB法(曲士松等,2000)进行提取。待鉴定的杂交种单株材料用改良CTAB法(王家保等,2006)提取并略有改进(提取过程中不用液氮处理)。待种子发芽4~7 d后,剪取整株幼苗,置于研钵中,为减少泡沫,先加入200 μL CTAB快速研磨,再加入200 μL CTAB继续研磨,转移匀浆至1.5 mL离心管中;加入40 μL 5 mol/L醋酸钾和400 μL氯仿,混勻;5000 r/min离心10 min,取上清液于新的离心管中;再用氯仿抽提1次,取上清液于新的离心管中;加入2/3体积预冷的异丙醇(或无水乙醇),混匀;12000 r/min离心5 min;沉淀用70%酒精清洗1~2次,晾干,加入适量ddH2O溶解DNA,4 ℃保存备用。
1. 2. 2 SSR标记验证和鉴定 试验参照Chen等(2011)已公布的SSR序列,由上海英骏生物技术有限公司合成80对SSR引物序列,分子标记所用试剂及DNA Marker由生工生物工程(上海)股份有限公司提供。经PCR反应体系和扩增程序优化,PCR反应体系15.000 μL:10 μmol/L上、下游引物各0.400 μL,DNA模板1.000 μL,10×PCR Buffer 1.500 μL,25 mmol/L MgCl2 1.000 μL,10 mmol/L dNTP Mixture 0.225 μL,5 U/μL Tap DNA聚合酶0.150 μL,加ddH2O补足至15.000 μL。扩增程序:95 ℃预变性5 min;95 ℃ 40 s,62 ℃ 30 s,72 ℃ 1 min(每个循环降1 ℃),进行11个循环;95 ℃ 40 s,52 ℃ 40 s,72 ℃ 1 min,进行30个循环;最后72 ℃延伸5 min;4 ℃低温保存(Chen et al.,2011)。扩增产物在10%变性聚丙烯酞胺凝胶上电泳分离,0.2%硝酸银染色,1.5%氢氧化钠和0.4%甲醛显色,显色3~5 min后拍照。
1. 2. 3 田间表型性状鉴定 2014年8~12月,人工混杂一小批涪杂2号种子,在重庆市渝东南农业科学院试验地种植,使其农艺性状充分展现,与筛选引物扩增图进行一一比较,验证引物分离假杂株的准确性,将SSR鉴定结果与田间种植鉴定结果进行比对,验证SSR标记鉴定的有效性。2015年6~8月,选择一批待鉴定的涪杂2号种子进行鉴定,将其均匀地撒播到苗床地,待植株长到4~5片真叶时开始鉴定,根据植株株型、叶型、叶缘、叶色、有无刺毛、有无腊粉等,对杂交种进行田间纯度鉴定。
2 结果与分析
2. 1 特异引物筛选
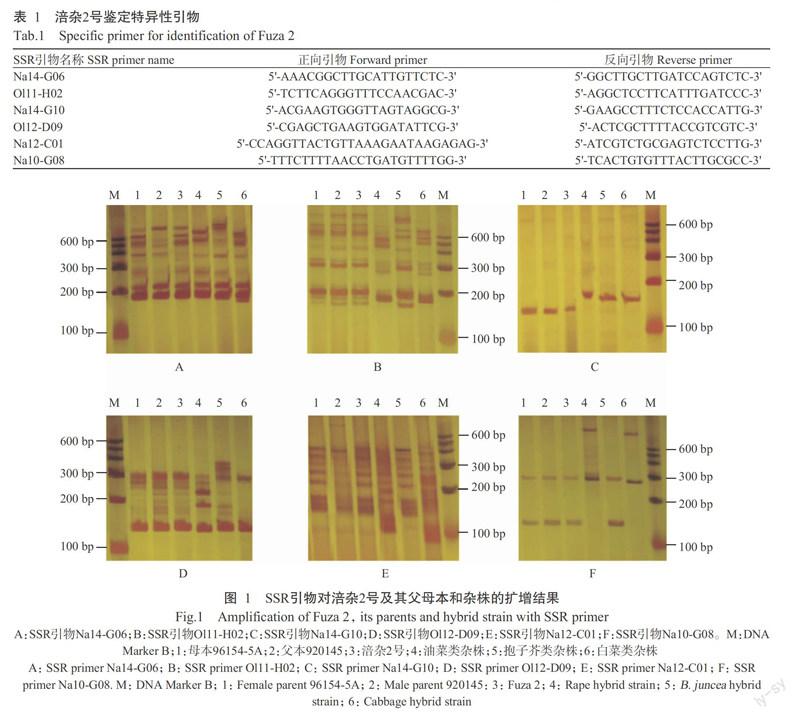
利用分子标记技术进行种子纯度检测的重要前提是筛选合适引物,共显性是进行杂交种纯度检测的理想类型,对筛选的引物应同时具有较高的稳定性和重复性。本研究利用80对特异性好的SSR引物,对涪杂2号、父母本及从涪杂2号群体中选择性狀典型的油菜类、抱子芥类和白菜类杂株进行引物筛选,最终获得6对特异性引物(表1),其中1对共显性的SSR引物Na14-G06能清晰地扩增出父、母本的特异性条带,其余5对可将机械混杂植株分离开。扩增结果表明,引物Na14-G06(图1-A)可同时将父、母亲本及杂交种中的机械混杂植株从涪杂2号中清晰分离出;引物Ol11-H02(图1-B)可清晰分离机械混杂植株的类型和数量;引物Na14-G10(图1-C)可清晰分辨机械混杂植株数量,但无法确定混入杂株的类型;引物Ol12-D09(图1-D)能清晰分离油菜类杂株和抱子芥类杂株,但对白菜类杂株的分离效果不太清晰;引物Na12-C01(图1-E)和Na10-G08(图1-F)能清晰分离油菜类和白菜类杂株,但无法分离抱子芥类杂株。
2. 2 引物验证
为验证筛选出的引物对涪杂2号及其父母本,以及机械混杂植株分离的准确性,将表型鉴定出的混杂单株与引物扩增图谱进行逐一比对。随机选择32株人工混杂种子,统计田间鉴定杂株率及机械混杂种子的类型,田间调查结果显示,3株为油菜类杂株,4株为抱子芥类杂株,3株为白菜类杂株,1株为母本杂株,1株为父本杂株,其余为涪杂2号。用CTAB法提取田间鉴定的植株DNA,分别用筛选出的分离效果较好的4对特异引物(Na14-G06、Ol11-H02、Na14-G10、Ol12-D09)进行扩增,SSR鉴定结果与田间鉴定结果一致,引物Na14-G06(图2)鉴定出假杂株12株,引物Ol11-H02(图3)鉴定出机械混杂植株10株及其类型;引物Na14-G10(图4)鉴定出10株机械混杂植株;引物Ol12-D09(图5)鉴定结果与引物Ol11-H02一致,但白菜类杂株分离不太清晰。引物扩增结果显示鉴定出的每个假杂单株类型与田间表型一致。
在种子生产过程中需既节约成本又数据可靠,为确保机械混杂植株被全部鉴定出来,通常选择2对引物进行检测,以期有效鉴定种子纯度。本研究发现,通过引物Na14-G06对杂交种杂株数量及类型的初步鉴定,结合田间杂株类型的不同,可有针对性选择特异性强的引物对机械混杂植株进一步验证。此外,引物Ol12-D09对油菜类和抱子芥类杂株、Ol11-H02对白菜类杂株能更有效鉴定出来,Na14-G10对所有机械混杂植株能更清晰分离出。因此,综合SSR引物扩增条带的特异性,选择两对引物联用Na14-G06+Ol11-H02、Na14-G06+Na14-G10或Na14-G06+Ol12-D09可准确快速鉴定涪杂2号种子纯度。
2. 3 杂交种纯度鉴定
利用引物Na14-G06对120株涪杂2号杂交种群体进行SSR检测,对比茎瘤芥杂交种及其父、母本的谱带特征,统计出涪杂2号杂交种样品中具有双亲特异带型的植株数量和只具有父、母本带型的假杂种数量及机械混杂油菜和白菜类杂株的谱带特征,电泳结果显示,涪杂2号杂交种中异型株共5株,其中拥有母本条带1株,父本条带2株,油菜类杂株1株,白菜类杂株1株;用引物Ol11-H02、Na14-G10和Na14-G10分别进行验证,均鑒定出油菜类和白菜类杂株各1株,与引物Na14-G06对机械混杂植株的鉴定结果一致,SSR标记鉴定结果表明本批涪杂2号群体的种子纯度为95.8%(图6)。
2. 4 田间种植鉴定
大田种植涪杂2号杂交种及其父母本材料(图7),通过植株株型、裂片数、叶形、叶色等表型症状鉴定,同时从涪杂2号群体中随机选取300株植株进行表型性状鉴定,发现有290株表现为叶缘浅裂细锯齿、叶形长椭,无腊粉,鉴定为涪杂2号;1株叶缘近全缘,叶面微皱、叶形倒卵圆,无腊粉,鉴定为母本杂株;3株叶面中皱、叶缘浅裂粗锯齿、叶形长椭,无腊粉,鉴定为父本杂株;4株叶色灰绿、有腊粉、叶柄比叶片长,鉴定为油菜类杂株;2株叶色浅绿、叶柄宽厚,鉴定为白菜类杂株;田间检测结果显示该批涪杂2号群体种子纯度为96.7%。
3 讨论
SSR分子标记具有多态性好、重复性高、操作简便的特点,被认为是一种发展前景良好的DNA指纹技术(苏顺宗等,2003),已被广泛用于杂交种纯度鉴定(刘军等,2013;阴云伙等,2015;杨宏等,2016)、生物遗传多样性分析及指纹图谱构建(王兵伟等,2014;徐海风等,2014;杨章旗等,2014;倪先林等,2015;王清明等,2016)等。SSR的高分辨力及其共显性遗传特点在杂交种纯度鉴定方面具有快速稳定、成本低廉、多态性丰富等特点(谭智丹等,2006)。尽管茎瘤芥材料遗传基础狭窄,但本研究结果表明,SSR分子标记对茎瘤芥杂交种涪杂2号及其父母本有较好的区分效果,且SSR分子标记鉴定与田间鉴定结果吻合度高。但由于表型鉴定属传统鉴定方法,鉴定时的外界生长环境必须严格控制,只有在植株生长整齐一致时的检测结果才较可靠,若检测时植株生长不整齐、外界环境发生变化,检测结果均会受到影响。每年新生产榨菜杂交种的田间检测正值高温干旱时期,苗期管理难度大,极易造成鉴定用苗的损失,耽误检测时间并增大检测误差。进行大田生产和大量种子纯度检测时,检测结果因环境多变会受到一定影响,分子标记检测既节省时间又可随到随检,能确保高效、快速、准确地检测出种子纯度。尽管进行引物筛选的过程较复杂,但筛选出适合的引物应用时操作则非常简单和便捷,其准确性和快速性田间检测在一定程度上无法比拟。杂交种在实际推广应用时最好将两种方法相结合,既能确保杂交种安全生产,又能加快杂交新品种推广进程。
本研究结果测得田间种子检测纯度略高于SSR检测纯度,与前人在茄子(刘军等,2013)、辣椒(吉振勇等,2014)、杂交粳稻(孙海燕等,2014)及甜瓜(周志成等,2014)种子纯度检测方面的研究结果一致。这是由于在田间鉴定时苗期植株性状未能充分显示,其亲本尤其是母本与杂交种植株极其相似,不易辨认,容易遗漏部分亲本植株。田间鉴定过程中对操作人员的专业素质要求也比较高,专业人员对杂种及其亲本农艺性状的了解程度会直接影响调查结果(孙海燕等,2014)。针对混杂的油菜类、芥菜类和白菜类蔬菜苗期田间鉴定较易辨认,不易混淆,SSR检测时该类杂株电泳谱带也明显不同于涪杂2号电泳谱带。杂交种生产过程中由于隔离不严、蜜蜂串粉,或少量父本混种到母本中,对杂交种纯度均会产生一定影响;为保证杂交种纯度,建议远离其他十字花科类蔬菜进行杂交種制种。茎瘤芥整个生长周期较长(180~200 d),期间种子还需休眠,从制种到使用种子的过程间隔时间短,农艺性状在苗期还未充分显示时就必须进行鉴定,否则影响种子的包装、销售和大面积种植及早市青菜頭的种植,因此快速准确鉴定茎瘤芥杂交种纯度显得非常必要。采用SSR分子标记检测杂交种,种子发芽4~7 d后便可快速鉴定出杂交种纯度,与田间纯度鉴定相比,SSR分子标记鉴定方法快速、高效,不受检测季节和环境条件限制,且可根据需要随时检测,能确保新品种的及时推广,也为种子营销赢得时间(杨瑞环等,2012)。
4 结论
本研究应用SSR分子标记技术对茎瘤芥杂交种涪杂2号进行纯度检测及分析,结果表明,选用的80对SSR引物中有6对特异性引物,其中共显性引物Na14-G06可将父、母亲本及机械混杂的植株清晰分离出,其余5对可将机械混杂植株分离出,两对引物联用可用于涪杂2号杂交一代种子纯度的快速检测和准确鉴定,SSR分子标记技术应用于茎瘤芥杂交种子纯度检测具有可行性。
参考文献:
范永红,周光凡,林合清,刘义华,王彬,陈材林,王旭祎. 2008. 茎瘤芥新品种涪杂2号的选育[J]. 中国蔬菜,(8):38-40.
Fan Y H,Zhou G F,Lin H Q,Liu Y H,Wang B,Chen C L,Wang X Y. 2015. A new cultivar of Brassica juncea var. tumida Tsen & Lee Fuza 2[J]. China Vegetables,(8):38-40.
吉振勇,刘菲,王恒州,卢海林,张振峰,卢国强,王云. 2014. 辣椒品种镇研20号种子纯度的SRAP鉴定[J]. 辣椒杂志,12(4):34-36.
Ji Z Y,Liu F,Wang H Z,Lu H L,Zhang Z F,Lu G Q,Wang Y. 2014. Seed purity test of hybrid hot pepper variety Zhenyan 20 with SRAP marker[J]. Journal of China Capsicum,12(4):34-36.
兰青阔,张桂华,王永,程奕,赵新,朱珠,崔兴华,郭永泽. 2012. 基于SNP标记的黄瓜杂交种纯度鉴定方法[J]. 中国蔬菜,(6):58-63.
Lan Q K,Zhang G H,Wang Y,Cheng Y,Zhao X,Zhu Z,Cui X H,Guo Y Z. 2012. SNP-based molecular assay for cucumber hybrid seed purity identification by pyrosequencing[J]. China Vegetables,(6):58-63.
冷容,范永红,胡代文,刘义华,林合清,王旭祎,张召荣. 2011. 涪陵早市青菜头(鲜榨菜)高产优质无公害栽培技术[J]. 长江蔬菜,(18):32-33.
Leng R,Fan Y H,Hu D W,Liu Y H,Lin H Q,Wang X Y,Zhang Z R. 2011. High-yield and high-quality pollution-free cultivation techniques of Fuling morning of greengrocery(fresh mustard)[J]. Journal of Changjiang Vegetables,(18):32-33.
李海梅,沈佳,赵娟,娄群峰,李季,陈劲枫. 2015. 黄瓜线粒体基因组SSR标记开发及其在种子纯度鉴定中的应用[J]. 南京农业大学学报,38(5):764-771.
Li H M,Shen J,Zhao J,Lou Q F,Li J,Chen J F. 2015. Develop-
ment of mtSSR markers in cucumber(Cucumis sativus L.)and their application in the identification of seed purity[J]. Journal of Nanjing Agricultural University,38(5):764-771.
李召华,朱克永,陈祖武,詹庆才. 2006. SSR分子标记技术在杂交水稻种子纯度鉴定中的应用[J]. 杂交水稻,21(4):11-14.
Li Z H,Zhu K Y,Chen Z W,Zhan Q C. 2006. Application of SSR molecular marker on purity identification of hybrid rice seeds[J]. Hybrid Rice,21(4):11-14.
黎杰强,彭艺,徐翔飞,邓翀,刘晖,张顺佳,范红超. 2005. 酯酶同工酶电泳鉴定天优122、培杂双七种子纯度研究[J]. 广东农业科学,(5):22-24.
Li J Q,Peng Y,Xu X F,Deng C,Liu H,Zhang S J,Fan H C. 2005. Study on identification of seed purity of Tianyou 122 and Peiza shuangqi by using esterase isozyme electrophoresis[J]. Guangdong Agricultural Sciences,(5):22-24.
刘军,周晓慧,庄勇. 2013. 茄子杂交品种种子纯度的SSR分子标记鉴定[J]. 分子植物育种,11(6):790-794.
Liu J,Zhou X H,Zhuang Y. 2013. Application of SSR markers to the identification of seed purity of eggplant hybrids[J]. Mo-
lecular Plant Breeding,11(6):790-794.
倪先林,赵甘霖,刘天朋,胡炯凌,李元,陈国民,汪小楷,丁国祥. 2015. SSR分子标记在糯高粱种质资源遗传多样性分析中的应用[J]. 江苏农业学报,31(1):16-22.
Ni X L,Zhao G L,Liu T P,Hu J L,Li Y,Chen G M,Wang X K,Ding G X. 2015. Genetic diversity analysis of glutinous sorghum germplasm by simple sequence repeat[J]. Jiangsu Journal of Agriculture Science,31(1):16-22.
曲士松,刘宪华,黄宝勇,王淑芬,徐培文. 2000. CTAB法提取大蒜、白菜基因组DNA[J]. 山东农业大学学报(自然科学版),31(4):427-429.
Qu S S,Liu X H,Huang B Y,Wang S F,Xu P W. 2000. Isolation of genome DNA in garlic and Chinese cabbage by CTAB method[J]. Journal of Shandong Agricultural University(Natural Science),31(4):427-429.
苏顺宗,黄玉碧,杨俊品,丁仲芳,高世斌. 2003. 利用SSR鉴定水稻杂交种子纯度的研究[J]. 种子,127(1):26-28.
Su S Z,Huang Y B,Yang J P,Ding Z F,Gao S B. 2003. The study on testing the seeds purity of hybrid rice by SSR[J]. Seed,127(1):26-28.
孫海燕,顾雯雯,王淑园,徐港明,罗兵,杨志刚,沈宗根,端木银熙. 2014. 利用SSR标记鉴定杂交粳稻‘常优1号种子纯度[J]. 分子植物育种,12(6):1128-1132.
Sun H Y,Gu W W,Wang S Y,Xu G M,Luo B,Yang Z G,Shen Z G,Duanmu Y X. 2014. Identification of seed purity on hybrid japonica rice‘Changyou 1 using SSR markers[J]. Mole-
cular Plant Breeding,12(6):1128-1132.
谭智丹,余显权,高健强,陈能刚. 2006. 利用SSR鉴定杂交水稻种子纯度的研究[J]. 种子,25(4):27-29.
Tan Z D,Yu X Q,Gao J Q,Chen N G. 2006. The application on testing the seeds purity of hybrid rice by SSR[J]. Seed,25(4):27-29.
王兵伟,覃嘉明,黄安霞,覃永嫒,郑加兴,秦洪波,时成俏. 2014. SSR分子标记分析60份玉米自交系的遗传多样性[J]. 西南农业学报,27(4):1358-1362.
Wang B W,Qin J M,Huang A X,Qin Y A,Zheng J X,Qin H B,Shi C Q. 2014. Analysis of genetic diversity by SSR molecular markers for 60 maize inbred lines[J]. Southwest China Journal of Agricultural Sciences,27(4):1358-1362.
王家保,杜中軍,雷新涛,徐碧玉. 2006. 改良CTAB法提取番石榴叶片总DNA[J]. 生物技术通讯,17(5):757-759.
Wang J B,Du Z J,Lei X T,Xu B Y. 2006. Extracting total DNA from guava(Psidium guajava L.) leaves by improved CTAB method[J]. Letters in Biotechnology,17(5):757-759.
王清明,程怡,马建伟,张云婷,张勇. 2016. 基于引物“随机组合”构建观赏桃SSR指纹图谱[J]. 广西植物,36(3):289-296.
Wang Q M,Cheng Y,Ma J W,Zhang Y T,Zhang Y. 2016. Construction of SSR fingerprint for ornamental peach based on primers “random combination”[J]. Guihaia,36(3):289-296.
徐海风,程保山,杨加银,沈业松. 2014. 黄淮海地区夏大豆品种(系)指纹图谱的构建及其遗传多样性分析[J]. 西南农业学报,27(5):1814-1819.
Xu H F,Cheng B S,Yang J Y,Shen Y S. 2014. Establishment of SSR fingerprint map and analysis of genetic diversity among soybean variety in Huang-Huai-Hai region[J]. Southwest China Journal of Agricultural Sciences,27(5):1814-1819.
杨宏,刘小俊,梁根云,李跃建. 2016. 黄瓜品种‘川绿2 号SSR指纹图谱的构建和纯度鉴定[J]. 西南农业学报,29(2):374-378.
Yang H,Liu X J,Liang G Y,Li Y J. 2016. Fingerprint construction and purity identification of cucumber cultivar ‘Chuanlv 2 hybrid with SSR marker[J]. Southwest China Journal of Agricultural Sciences,29(2):374-378.
杨瑞环,崔兴华,李鹏宇,张桂华,李淑菊. 2012. SSR技术检测‘津优48种子纯度试验[J]. 北方园艺,(16):108-109.
Yang R H,Cui X H,Li P Y,Zhang G H,Li S J. 2012. Detection of Jinyou 48 seed purity using SSR technology[J]. Northern Horticulture,(16):108-109.
楊章旗,冯源恒,吴东山. 2014. 细叶云南松天然种源林遗传多样性的SSR分析[J]. 广西植物,34(1):10-14.
Yang Z Q,Feng Y H,Wu D S. 2014. Analysis of genetic diversity of Pinus yunnanensis var. tenuifolia nature populations by SSR marker[J]. Guihaia,34(1):10-14.
阴云伙,温和楦,陈龙,程攀,曲姗姗,田发春,彭炳生,吴帅,李土明,周卫营. 2015. 利用SSR标记鉴定两系杂交稻“广两优7203”的种子纯度[J]. 江西农业学报,27(11):20-22.
Yin Y H,Wen H X,Chen L,Cheng P,Qu S S,Tian F C,Peng B S,Wu S,Li T M,Zhou W Y. 2015. Identification of seed purity of two-line hybrid rice “Guangliangyou 7203” by u-
sing SSR markers[J]. Acta Agriculturae Jiangxi,27(11):20-22.
尤佳,王晋,文朝慧,王军平,周小平. 2015. 应用SSR技术鉴定杂交种种子纯度的方法探究[J]. 种子,34(5):46-49.
You J,Wang J,Wen C H,Wang J P,Zhou X P. 2015. Study on method for identifying hybrid seed purity through SSR[J]. Seed,34(5):46-49.
周志成,王惠林,王賢磊,李冠. 2014. SSR标记鉴定甜瓜品种‘红月亮种子纯度[J]. 中国瓜菜,27(1):21-24.
Zhou Z C,Wang H L,Wang X L,Li G. 2014. Genetic purity test of melon variety ‘Red Moon F1 using SSR marker[J]. China Cucurbits and Vegetables,27(1):21-24.
Chen F B,Yang K C,Zhou G F,Fan Y H,Zhang Z Y,Shen J J,Zhang H,Jiang L L. 2011. Analysis of heterosis, combining ability and genetic diversity in tuber mustard(Brassica juncea var. tumida Tsen & Lee) inbred lines based on SSR markers and combining ability estimates[J]. Philippine Agriculturist,94(2):124-131.
(责任编辑 王 晖)
