中国水仙花瓣类黄酮的提取与HPLC—MSn鉴定方法的建立
2016-05-30柯毅湧潘腾飞叶如梦张蒙郭志雄佘文琴周玉潘东明
柯毅湧 潘腾飞 叶如梦 张蒙 郭志雄 佘文琴 周玉 潘东明
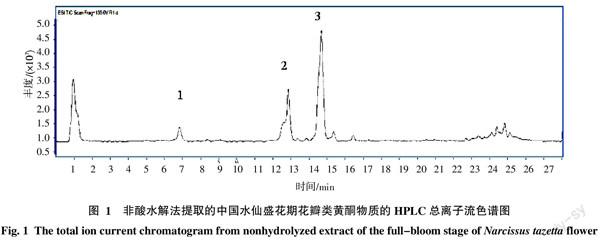
摘 要 以‘中国水仙(Narcissus tazetta L. var. Chinensis Roem)盛花期花瓣为试验材料,采用高效液相色谱与多级质谱联用(HPLC-MSn)技术进行鉴定,比较采用2种提取方法(非酸水解法与酸水解法)提取类黄酮物质的优缺点。结果表明:用非酸水解法和酸水解法在盛花期花瓣中共鉴定到了4种黄酮醇类物质,1种酚酸类物质,其中,用非酸水解法首次在中国水仙花瓣中鉴定到了水仙苷,说明该法能在提取过程中避免水仙花瓣类黄酮物质糖苷键的断裂,获得更丰富的类黄酮物质结构信息,为中国水仙类黄酮物质成分的分析提供参考。
关键词 中国水仙;盛花期;酸水解法;非酸水解法;HPLC-MSn
中图分类号 S682.21 文献标识码 A
Abstract In this study,the petals of‘Narcissus tazetta L. var. chinensis Roemduring full-bloom stage were taken as the experimental materials. The comparison between non-acid hydrolyzation and acid hydrolyzation methods on flavonoids extraction was carried out. High Performance Liquid Chromatography(HPLC) and High Performance Liquid Chromatography-mass spectrometry(HPLC-MSn)techonlogy were employed to compare the advantages and disadvantages of the two extraction methods. The experiment results showed that four flavonols and one phenolic acid were identified in the petals during full-bloom stage by means of non-acid hydrolyzation and acid hydrolyzation. It was the first time that the narcissoside was identified in the petals of Narcissus by means of non-acid hydrolyzation,which indicating that this method could avoid the fracture of glycosidic bond of flavonoids in narcissus petals and obtain more abundant structural information. The results would provide references for analyzing the components of flavonoids in ‘Narcissus tazetta L. var. chinensis Roem.
Key words Narcissus tazetta L. var. chinensis Roem;Full-bloom stage;Acid hydrolyzation;Non-acid hydrolyzation;HPLC-MSn
doi 10.3969/j.issn.1000-2561.2016.08.027
花是观赏植物最主要的观赏部分,花色是观赏花卉最直观的观赏性状之一[1],花色五彩缤纷,其主要由三大类花色素决定:即类黄酮、类胡萝卜素及与生物碱有关的其它色素,如甜菜碱、小檗碱等[2]。
中国水仙是石蒜科水仙属多花水仙(Narcissus tazetta)亚属的多年生草本植物,其花洁白清香,花婷玉立,绚丽多姿,素有“凌波仙子”的美称,是中国的十大传统名花之一[3]。中国水仙花色形成主要受类胡萝卜途径和类黄酮途径调控,其中类胡萝卜途径是中国水仙黄色副冠花色合成的主要途径[4]。张慧平[5]研究表明,中国水仙黄色副冠的花色素成分主要是类胡萝卜途径中的叶黄素和β-胡萝卜素,白色花瓣中2种色素含量都很少。在已有的报道中,关于中国水仙花瓣类黄酮途径的色素成分尚不明确。何炎森[6]使用非酸水解法提取中国水仙盛花期花瓣的类黄酮成分并用高效液相色谱(HPLC)技术进行检测,得出其主要成分为柚皮苷、芦丁和绿原酸。罗鹏[7]利用盐酸、氨水的特征显色和染色法结合鉴定了中国水仙盛花期白色花瓣的类黄酮成分,得出其主要的黄酮类物质为黄酮和黄酮醇,不含花色素苷或花色素苷的含量极低。
HPLC鉴定方法是将二极管阵列(DAD)检测器获得的吸收光谱与标准品进行对照,从而鉴定出类黄酮的化学结构,此法对于已知成分的定性具有一定的优势[8-10],但其不能对未知成分的物质进行定性。使用盐酸、氨水的特征显色和染色法虽然简单高效,不过只能对类黄酮物质的类别进行分析,未能做到准确的定性。高效液相色谱与多级质谱联用法(HPLC-MSn)技术具有样品消耗量小、灵敏度高、选择性强、分离和结构确证一次完成等优点[11],在未知物的定性方面,目前已在甘薯[12]、枇杷[10]、金莲花[13]、火龙果[14]等植物上有所报道,但使用这种技术识别中国水仙盛花期花瓣的黄酮类成分尚未见报道。本研究拟用HPLC-MSn法鉴定不同提取方法所得的中国水仙白色花瓣的类黄酮成分,为其色素成分的研究提供参考。
1 材料与方法
1.1 材料
本研究试验材料为中国水仙三年生种球,购于福建漳州龙海市九湖镇田中央村。于2015年1月取盛花期花瓣用于中国水仙类黄酮成分提取。所有材料均在采后用液氮速冻,置于-80 ℃冰箱中保存备用。
1.2 方法
1.2.1 非酸水解法提取类黄酮 参照陈源[15]的方法提取类黄酮。
1.2.2 酸水解法提取类黄酮 参照Muir等[16]的方法提取类黄酮。
1.2.3 HPLC-MSn检测类黄酮 HPLC(Agilen1260)检测条件为:C18色谱柱(Agilent Eclipse Plus, 2.1×100 mm,i.d),柱温为30 ℃,流动相A为1%乙酸水溶液,流动相B为乙腈。梯度洗脱程序为:0~2 min,5%B;2~20 min,5%~30%B;20~23 min,30%~95%B。
质谱(6410,Agilent)条件为:电喷雾电离源(ESI),毛细管电压3.5 kV,离子源温度350 ℃,干燥器(N2)流速11 L/min,雾化压力(350 psi,Delta EMV)300 V ,mass 采集 200~1 000 Da,负离子模式。
质谱分析参考文献[17-19]进行,花色苷类物质在540 nm 下分析,类黄酮类物质在280 nm 下分析。为确定各类物质在紫外-可见光下的吸收特征,对所检测到的峰在波长 200~540 nm 的物质进行扫描。
2 结果与分析
2.1 非酸水解法提取的中国水仙盛花期花瓣类黄酮成分的鉴定
非酸水解法提取的中国水仙盛花期花瓣类黄酮物质的HPLC总离子流色谱图见图1。在负离子模式下,3种酚酸和类黄酮物质在28 min内均得到很好的分离,按保留时间出峰顺序先后分别为1号峰、2号峰和3号峰,从峰面积可推测3种物质的含量大小顺序为3号峰>2号峰>1号峰。从图1可以看出,3种物质的峰型和分离度较好,可满足不同极性的类黄酮物质的分离要求。经DAD检测可知,3种物质在280 nm和320 nm处均有紫外吸收峰(表1),1号峰物质的出峰时间为6.99 min,一级质荷比为353,二级质荷比为191、85;2号峰物质的出峰时间为13.118 min,一级质荷比为609,二级质荷比为300、271;3号峰物质的出峰时间为14.933 min,一级质荷比为623,二级质荷比为315。根据物质一级质谱母荷离子数据以及二级质谱碎片离子信息,推测1号峰物质为酚酸类的绿原酸,2号、3号峰物质分别为黄酮醇类的芦丁和水仙苷。
2.2 酸水解法提取的中国水仙盛花期花瓣类黄酮成分的鉴定
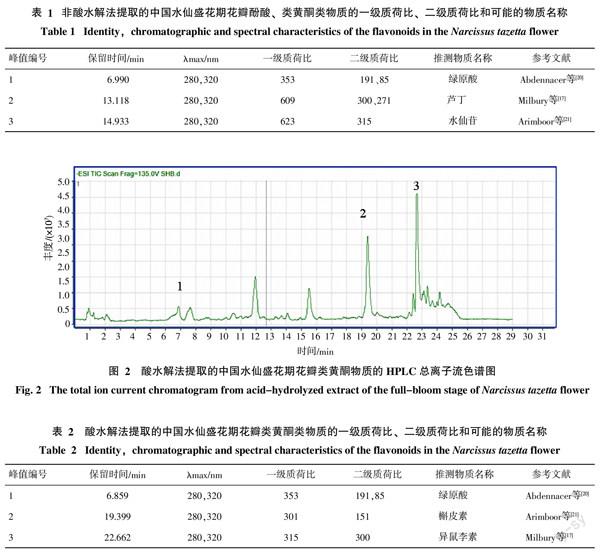
酸水解法提取的中国水仙盛花期花瓣类黄酮物质的HPLC总离子流色谱图见图2。在与非酸水解法相同的HPLC-MSn检测条件下,28 min内分离得到了3种酚酸类和类黄酮物质,按保留时间出峰顺序先后分别为1号峰、2号峰和3号峰,从峰面积可推测3种物质的含量大小顺序为3号峰>2号峰>1号峰。如图2所示,3种物质的峰型较非酸水解法提取的类黄酮物质好,说明酸水解法提取的类黄酮物质杂质较少,对检测的干扰小。经DAD检测可知,3种物质在280 nm和320 nm处均有紫外吸收峰(表2),1号峰物质的出峰时间为6.859 min,一级质荷比为353,二级质荷比为191、85;2号峰物质的出峰时间为19.399 min,一级质荷比为301,二级质荷比为151;3号峰物质的出峰时间为22.662 min,一级质荷比为315,二级质荷比为300。经对比,推测1号峰物质为酚酸类的绿原酸,2号、3号峰物质分别为黄酮醇类的槲皮素和异鼠李素。
3 讨论
3.1 不同提取方法所得中国水仙花瓣类黄酮成分的差异
本研究采用非酸水解法和酸水解法提取中国水仙花瓣类黄酮成分,其中的酸水解法被广泛运用于黄酮苷元化合物的提取。罗美红等[22]采用酸水解法提取了枇杷叶片的总黄酮成分,得到了黄酮苷元山萘酚和槲皮素。文瑞芝[23]采用萃取-酸水解法分离得到了大豆异黄酮苷元。邓少东等[24]测定了橘红中酸水解前后类黄酮成分的变化,酸水解前主要为柚皮苷、野漆树苷,酸水解后柚皮苷和野漆树苷分别形成苷元柚皮素和芹菜素。
非酸水解法提取得到黄酮苷已在番茄[16]、刺茉莉[25]、杜鹃[26]中有所报道。由于类黄酮化合物的特性,即可以在多个位置结合多种糖苷,仅几十种黄酮苷元可形成种类繁多的黄酮苷化合物。将提取得到的黄酮苷化合物经HPLC-MSn技术鉴定可获得糖苷键连接的位置和糖苷的碎片离子等多种信息[19],有助于研究推断类黄酮化合物在花色形成过程中的作用。
本研究通过酸水解法提取鉴定得到的槲皮素和异鼠李素分别是非酸水解法提取得到的芦丁和水仙苷的苷元,说明酸水解能够使芦丁和水仙苷的糖苷键充分断裂。通过2种方法的比较,确认了中国水仙花瓣中类黄酮物质在自然状态下主要是以芦丁和水仙苷2种形态存在,这与何炎森等[27]通过非酸水解法并利用液相色谱技术(HPLC)在中国水仙盛花期提取鉴定到的2种主要的类黄酮成分(芦丁、柚皮苷)有所不同,这可能与2种鉴定技术的差异有关,何炎森等[27]采用的HPLC法鉴定类黄酮物质周期长,所测成分单一,需有对照品才能对未知物质进行定性;而本研究采用的高效液相色谱与多级质谱联用(HPLC-MSn)技术是将高效液相色谱的分离与质谱的选择性和灵敏性结合起来,尤其是在缺少对照品的情况下能对化合物进行准确的定性分析。
3.2 HPLC-MSn结合ESI和DAD技术在定性苷类物质中有独特的优势
观赏植物花瓣类黄酮物质大部分以苷类的形式存在,由于苷类物质有很大的极性,高温强酸等剧烈条件下易分解,挥发性不强。质谱作为一种常用的分析手段,在植物类黄酮研究中发挥了重要作用,传统的电子轰击质谱(EI-MS)、化学电离质谱(CI-MS)等难以准确地对未衍化的苷类化合物进行定性分析[28],存在较多的局限性。随着各种软电离源(即质谱分析中采用各种离子源把分子解离成离子或碎片)如电离子喷雾(ESI)、大气压雾化电离源(APCI)、快源子轰击源质谱(FAB)等的出现,直接测定黄酮苷类物质成为可能,同时结合多级质谱联用、二级管阵列检测器(DAD)的碰撞诱导、捕捉紫外吸收峰等功能,可以获得丰富的物质结构信息。ESI-MS技术适用于极性大、难挥发的物质,其灵敏度、重现性均优于其它电离源,在糖苷化合物的分析上有明显的优势。本研究采用HPLC-MSn结合ESI和DAD技术,分析了经非酸水解法提取得到的中国水仙盛花期花瓣中的类黄酮苷类化合物,得到了其经ESI源轰击产生的负离子一级质谱母荷信息、二级质谱下的碎片离子信息和其DAD紫外吸收峰范围。其中2号峰信息与Milbury等[17]、吴子江[29]、李自红等[30]获得的芦丁一级质谱和二级质谱下的碎片离子信息和其DAD紫外吸收峰范围。其中2号峰信息与Milbury等[17]、吴子江[29]、李自红等[30]获得的芦丁一级质谱和二级质谱的相关信息相吻合,3号峰的相关信息也在Schieber等[31]、Milbury等[17]报道的水仙苷信息中得到验证,可以推断2、3号峰物质分别为芦丁和水仙苷。本研究说明该法在中国水仙花瓣类黄酮苷类物质的定性分析中具有相对准确、可迅速判断、得到的物质结构信息丰富等优势,较前人研究中国水仙花瓣类黄酮成分中所采用的HPLC法[27]、显色法[7]更加精确、高效等。
4 结论
本研究采用了非酸水解法和酸水解法提取中国水仙盛花期花瓣的类黄酮成分,比较了2种方法的优缺点。非酸水解法在提取过程中能够避免类黄酮物质糖苷键的断裂,能获取更多的结构信息,因此该方法较适合用于中国水仙花瓣类黄酮物质的提取。此外,本研究首次建立了中国水仙花瓣类黄酮物质的HPLC-MSn鉴定方法,为中国水仙花瓣类黄酮成分的定性提供了参考。
参考文献
[1] 李 玲. 仙客来花色及相关生理特性的研究[D]. 保定: 河北农业大学, 2012.
[2] 李 丽. 高山杜鹃开花过程中生理生化及花色素的研究[D]. 保定: 河北农业大学, 2010.
[3] 郭春良. 世界水仙花的研究特点[J]. 世界农业, 1990(9): 52-54.
[4] 曾原飞, 张慧平, 温 超, 等. 漳州水仙花瓣和副冠类胡萝卜素成分分析及合成途径基因表达研究[J]. 热带作物学报, 2012, 33(4): 663-667.
[5] 张慧平. 中国水仙遗传转化及花色素成分分析[D]. 福州: 福建农林大学, 2010.
[6] 何炎森. 多花水仙花色相关基因的分离及功能分析[D]. 福州: 福建农林大学, 2013.
[7] 罗 鹏. 漳州水仙鳞茎盘转录组分析及类黄酮合成途径基因的表达[D]. 福州: 福建农林大学, 2014.
[8] Gomez-Miguez M, Gonzalez-Miret M L, Heredia F J. Evolution of colour and anthocyanin composition of Syrah wines elaborated with pre-fermentative cold maceration[J]. Journal of Food Engineering, 2007, 79(1): 271-278.
[9] 蔡 欣, 李宝丽, 玉佳男, 等. 纯橙汁中类黄酮的RP-HPLC-DAD-ESI-MS2分离鉴定[J]. 核农学报, 2014, 28(12): 2 200-2 207.
[10] 吕 寒, 李维林, 裴咏萍, 等. 枇杷叶中黄酮类化学成分的HPLC-MSn分析[J]. 现代中药研究与实践, 2009(6): 56-58.
[11] Cuyckens H, Claeys M. Mass spectrometry in the structural analysis of flavonoids[J]. Journal of Mass Spectrometry, 2004, 39(4): 461.
[12] 江连洲, 王晰锐, 张 超, 等. HPLC-MS法鉴定不同品种紫甘薯中花色苷组成[J]. 中国食品学报, 2011, 11(5): 176-181.
[13] 黄 睿, 张贵君, 潘艳丽, 等. 金莲花化学成分的HPLC-MS表征分析与鉴定[J]. 中草药, 2012, 43(4): 670-672.
[14] 袁亚芳, 赵珍珍, 王 威, 等. 红肉火龙果果皮色素的分离、纯化和HPLC-MS分析[J]. 福建农林大学学报(自然科学版), 2013, 42(6): 589-592.
[15] 陈 源. 金柑等柑橘类果实黄酮类化合物提取、纯化及分离鉴定[D]. 福州: 福建农林大学, 2011.
[16] Muir S R, Collins G J, Robinson S, et al. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J]. Nat Biotechnol, 2001, 19(5): 470-474.
[17] Milbury P E, Chen C Y, Dolnikowski G G, et al. Determination of flavonoids and phenolics and their distribution in almonds[J]. Journal of Agricultural and Food Chemistry, 2006, 54(14): 5 027-5 033.
[18] Wang Y, Chuang Y, Ku Y. Quantitation of bioactive compounds in citrus fruits cultivated in Taiwan[J]. Food Chemistry, 2007, 102(4): 1 163-1 171.
[19] de Rijke E, Out P, Niessen W M A, et al. Analytical separation and detection methods for flavonoids[J]. Journal of Chromatography A, 2006, 1 112(1-2): 31-63.
[20] Abdennacer B, Karim M, Yassine M, et al. Determination of phytochemicals and antioxidant activity of methanol extracts obtained from the fruit and leaves of Tunisian lycium intricatum Boiss[J]. Food Chemistry, 2015, 174: 577-584.
[21] Arimboor R, Arumughan C. HPLC-DAD-MS/MS profiling of antioxidant flavonoid glycosides in sea buckthorn(Hippophae rhamnoides L.)seeds[J]. International Journal of Food Sciences and Nutrition, 2012, 63(6): 730-738.
[22] 罗美红, 吕 寒,李维林. 枇杷叶中总黄酮含量的高效液相色谱测定[J]. 时珍国医国药, 2011(3): 582-583.
[23] 文瑞芝, 杨明生, 刘建庄. 萃取-酸水解法提取纯化豆粕中大豆异黄酮甙元[J]. 光谱实验室, 2004, 21(5): 925-928.
[24] 邓少东, 王莲婧, 林 励, 等. UPLC法测定酸水解前后化橘红中4种黄酮类成分的含量[J]. 中华中医药杂志, 2012, 27(4): 924-928.
[25] Bennett R N, Mellon F A, Rosa E, et al. Profiling glucosinolates, flavonoids, alkaloids, and other secondary metabolites in tissues of Azima tetracantha L.(Salvadoraceae)[J]. Journal of Agricultural and Food Chemistry, 2004, 52(19): 5 856-5 862.
[26] Samanidou V, Tsagiannidis A, Sarakatsianos I. Simultaneous determination of polyphenols and major purine alkaloids in Greek Sideritis species, herbal extracts, green tea, black tea, and coffee by high-performance liquid chromatography-diode array detection[J]. Journal of Separation Science, 2012, 35(4): 608-615.
[27] 何炎森, 杨碧云, 李 科, 等. 多花水仙花期类胡萝卜素物质和类黄酮物质的含量变化[J]. 热带作物学报, 2013, 34(3): 504-510.
[28] 郭继芬, 陈四平, 乔善义, 等. 黄芩总黄酮提取物的HPLC-MS/MS分析[J]. 药物分析杂志, 2005, 25(3): 267-269.
[29] 吴子江. 无花果叶类黄酮提取、 纯化、鉴定及抗氧化研究[D]. 福州: 福建农林大学, 2013.
[30] 李自红, 魏 悦, 范 毅, 等. 芦丁的电喷雾离子阱质谱分析[J]. 分析试验室, 2015, 34(2): 186-189.
[31] Schieber A, Keller P, Carle R. Determination of phenolic acids and flavonoids of apple and pear by high-performance liquid chromatography[J]. Journal of Chromatography A, 2001, 910(2): 265-273.
