甜菜碱处理对于番木瓜果实采后冷害及抗氧化系统的影响
2016-05-30袁梦麒潘永贵张伟敏李艺筱何凤平李尚斌
袁梦麒 潘永贵 张伟敏 李艺筱 何凤平 李尚斌
摘 要 以海南主栽品种‘中白番木瓜为试材,采用15 mmol/L甜菜碱浸泡处理,随后于冷害温度6 ℃下贮藏,研究甜菜碱处理对番木瓜冷害及其抗氧化代谢的影响。结果表明,甜菜碱处理可有效地抑制番木瓜果实SOD、POD和CAT酶活性的下降,使超氧阴离子产生速率和过氧化氢浓度保持较低的水平,减少细胞膜透性的增加和膜脂过氧化产物MDA的积累,减缓了番木瓜果实采后冷害的发生。
关键词 甜菜碱;番木瓜;冷害;抗氧化系统
中图分类号 S667.9 文献标识码 A
Abstract The papayas variety‘Zhong Baifrom Cheng-mai was used in the study. After picking, the fruit was immersed in the 15 mmol/L betaine solution and then was stored under 6 ℃ for 40 days. The change of the chilling-injury degree and anti-oxidant system were determined per 10 days. The results suggested that the betaine treatment could efficiently inhibit the decrease of the activities of various enzymes, such as SOD, POD and CAT, keep the degree of super oxygen anion producing rate and hydrogen peroxide concentration low, reduce the increase of cell membrane permeability and the accumulatation of MDA products of membrane lipid peroxidation. It can be concluded that the betaine treatment could inhibit the chilling injury of papayas after picking。
Key words Betaine; Papaya; Chilling injury; Antioxidant system
doi 10.3969/j.issn.1000-2561.2016.08.022
番木瓜(Carica papaya L.)果实具有丰富的营养价值和药用价值,近年来市场对于番木瓜的需求量逐年上升。但番木瓜属于呼吸跃变型水果,采后极易软化腐烂[1]。低温贮藏能够保持果实的采后品质,延长其货架期[2]。但是对于番木瓜这类热带亚热带水果来说,不恰当的低温会导致果实出现冷害[3]。近年来研究发现甜菜碱处理对于果蔬采后冷害有着显著的缓解作用。甜菜碱(glycine betaine,GB)属于季胺型水溶性生物碱,是植物组织细胞内的一种重要的调节物质[4]。GB的积累有助于维持细胞渗透压、保护细胞膜结构和酶活性,增强植物抗逆性等[3]。研究表明,外源甜菜碱处理桃果实可以有效地降低其细胞膜渗透性和细胞中MDA含量,有效地维持桃果实细胞膜完整性,并减轻桃果实低温贮藏过程中的冷害[5]。甜菜碱处理有助于提高植物和果实细胞的抗氧化能力。5 mmol/L甜菜碱处理辣椒果实,发现其过氧化氢酶和过氧化物酶的活性都得到提高,冷害情况也得到缓解[6]。此外,研究还发现甜菜碱处理能够有效地缓解香蕉[7]、黄瓜[8]、枇杷[9]等果实的冷害。但目前对于甜菜碱处理预防或缓解番木瓜采后冷害的研究鲜有报道,本研究以海南‘中白番木瓜为试材,研究甜菜碱处理对番木瓜果实采后低温贮藏过程中细胞膜透性、MDA含量、O2·- 产生速率和H2O2含量,以及POD、SOD及CAT活性的影响,探讨采后甜菜碱处理对番木瓜果实冷害与抗氧化系统的影响,为番木瓜冷藏运输中的冷害预防提供参考。
1 材料与方法
1.1 材料及处理
‘中白品种番木瓜(Carica papaya L.)采自海南省澄迈县番木瓜果园,选择果皮总体呈亮绿色,并有10%左右为黄绿色的果实作为采收果实。果实采收后于2 h内运送回实验室。选择大小基本一致,无病虫害的果实,先用0.1%浓度的施保功(拜耳制药)浸果2 min进行杀菌,而后分成两组,每个处理组各50个果实:一组用15 mmol/L甜菜碱浸泡10 min(预实验确定最佳处理条件),另一组用蒸馏水浸泡10 min,作为对照。果实自然风干后,用厚度为0.01 mm的聚乙烯保鲜袋(40 cm×30 cm)包装,每袋5个果实。置于6 ℃下存放。每隔10 d取样,每组随机取6个果实,检测各项指标,每个指标重复测定3次。
1.2 测定方法
1.2.1 冷害指数 参照Shadmani[9]的方法略有修改。取30个番木瓜果实用于统计冷害指数,将冷害程度分为5级。0级:果面完好无冷害症状;1级:果皮出现凹陷,有轻微的水渍斑,占果面10%以下;2级:果皮凹陷,有水渍斑,占果面30%以下;3级:果蒂果皮干瘪,果皮有明显水渍斑,占果面50%以下;4级:果蒂果皮严重干瘪,果皮水渍斑较多,占果面50%以上。
冷害指数=Σ(冷害级别×该级别个数)/(最高级数×总果数)×100%
1.2.2 腐烂率 腐烂率测定参照王静等[10]的方法略作修改。按照腐烂面积,将番木瓜果实的腐烂程度分为4级。0级:果皮光洁无损;1级:果面有1~3个小腐烂斑;2级:果实部分腐烂,腐烂面积占果面25%~50%;3级:果实大面积腐烂,腐烂面积占果面50%以上。
腐烂率=Σ(腐烂级别×该级别个数)/(最高级数×总果数)×100%
1.2.3 相对电导率 参照Shadmani等[11]的方法略有修改。每组随机选取3个果实,在赤道线上相对两个部位削去2 mm厚的果皮,用内径为0.5 cm的打孔器取果肉组织,切取4片相同厚度(2 mm)的薄片。分别置于20 mL的蒸馏水中浸泡、振荡1 h。采用电导仪(上海雷磁DDS-370A型)测定电导值R1,煮沸15 min后冷却至室温,再测1次电导值R2。以煮沸前后电导率的比值表示细胞膜透性。每个处理重复3次。
1.2.4 丙二醛(MDA)含量 参照Wang等[12]的方法略作修改。准确称取2 g果肉,加入5 mL 10%的三氯乙酸(TCA)冰浴研磨匀浆后在4 ℃下12 000 r/min离心15 min。取1.5 mL上清液,加入0.67%的TBA 2 mL,煮沸15 min,冷却后相同条件下离心。分别测上清液在532 nm和600 nm波长处的吸光值。对照管加入2 mL 10%的TCA溶液代替提取液。
1.2.5 过氧化氢酶(CAT)活性 参照Shadmani等[11]的方法略作修改。准确称取2 g果肉,加入0.2 mol/L pH7.8磷酸缓冲液5 mL(含5% PVP)冰浴研磨成匀浆,4 ℃下12 000 r/min离心20 min。取0.1 mL上清液,加入2.9 mL 20 mmol/L H2O2溶液振荡摇匀后于240 nm波长处测定吸光值的变化。以每分钟吸光度变化0.01为1个酶活单位,酶活性表示为:U/(g FW·min)。
1.2.6 超氧化物歧化酶(SOD)活性 准确称取2 g果肉,加入0.2 mol/L pH7.8磷酸缓冲液5 mL(含5 mmol/L DTT和5% PVP)冰浴研磨成匀浆,4 ℃下12 000 r/min离心20 min。取上清液采用SOD试剂盒(购自南京建成公司,产品编号A001-1)测定SOD活性,并用考马斯亮蓝法测定样品中蛋白质含量。
1.2.7 过氧化物酶(POD)活性 参照Shadmani等[11]的方法略作修改。准确称取2 g果肉,加入0.2 mol/L pH7.8磷酸缓冲液5 mL(内含1 mmol/L PEG、4% PVP和1% Triton X-100)冰浴研磨成匀浆,4 ℃下12 000 r/min离心20 min。取0.5 mL上清液加入25 mmol/L愈创木酚溶液3 mL和0.5 mol/L H2O2溶液0.2 mL反应,然后迅速于470 nm波长处测定吸光值变化。以每分钟吸光值变化0.01为一个酶活单位,酶活性表示为:U/(g FW· min)。
1.2.8 过氧化氢(H2O2)含量 参照Wang等[12]的方法略作修改。准确称取2 g果肉,加入5 mL预冷的丙酮在冰浴条件下研磨成匀浆,在4 ℃条件下12 000 r/min离心20 min。取1 mL上清液,加入1 mL 10%的四氯化钛的盐酸溶液和0.2 mL的浓氨水,反应5 min后在相同条件下离心15 min,弃上清液,向沉淀中加入3 mL 2 mol/L的硫酸,振荡溶解后于412 nm波长处测定吸光值。以标准H2O2 制作标准曲线。
1.2.9 超氧阴离子(O2·- )产生速率 参照Cao等[13]的方法略作修改。准确称取2 g果肉,加入5 mL 50 mmol/L、pH7.8的磷酸钠缓冲液在冰浴条件下研磨成匀浆,在4 ℃条件下12 000 r/min离心20 min。取1 mL上清液,加入1 mL 50 mmol/L、pH7.8的磷酸钠缓冲液和1 mL 1 mmol/L的盐酸羟胺溶液,摇匀于25 ℃保温1 h。取出后加入1 mL 17 mmol/L对氨基苯磺酸溶液和1 mL 7 mmol/L α-萘胺溶液,摇匀后于25 ℃保温20 min。于530 nm处测定吸光值。以KNO2溶液制作标准曲线。
1.3 数据处理
运用SPSS 19.0软件进行方差显著性差异分析;另外利用Sigmaplot12.2软件作图。
2 结果与分析
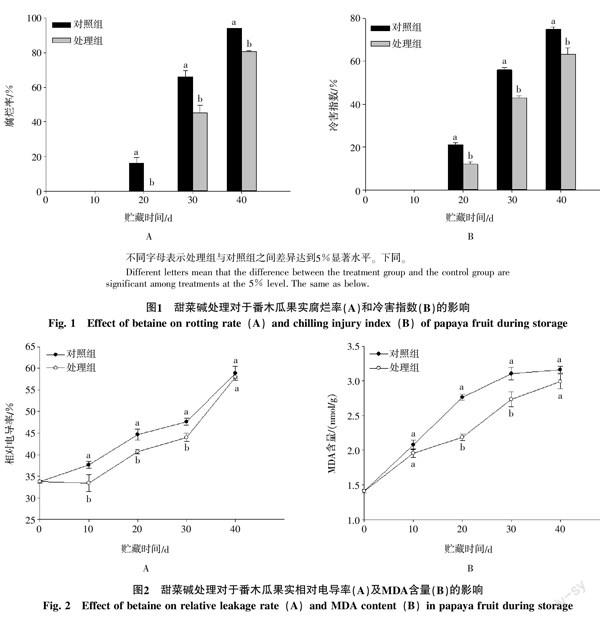
2.1 甜菜碱处理对于番木瓜果实腐烂率及冷害指数的影响
如图1-A所示,在低温贮藏期间,两组果实的腐烂率均呈上升趋势,未经甜菜碱处理的果实在冷藏期间第20天时已开始发生腐烂,而甜菜碱处理的番木瓜果实直到30 d时才出现腐烂现象。且到40 d时,对照组果实的腐烂率已达到94%,而甜菜碱处理的番木瓜果实腐烂率只有80%。表明甜菜碱处理能够有效地抑制番木瓜果实低温贮藏期间腐烂的发生。
从图1-B可看出,对照组和甜菜碱处理的果实在20 d时均出现冷害,且冷害程度随贮藏时间的延长而上升,贮藏40 d时甜菜碱处理的番木瓜果实冷害指数较未经甜菜碱处理的番木瓜果实低14.67%。整个贮藏期间,甜菜碱处理的番木瓜果实冷害指数都低于对照,且在20~40 d期间达到显著差异(p<0.05)。
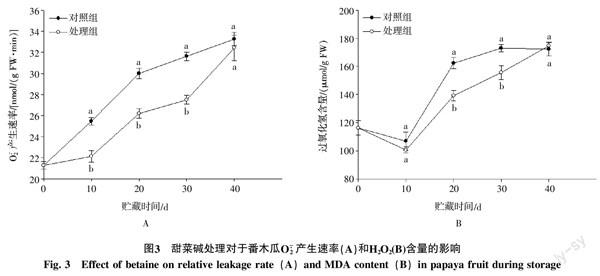
2.2 甜菜碱处理对于番木瓜果实相对电导率及MDA含量的影响
电导率与细胞膜透性密切相关,MDA是脂质过氧化的主要产物与膜脂过氧化程度有密切关系[14]。如图2-A所示,随着贮藏时间的增加,两组番木瓜果实中相对电导率均呈上升趋势,到第40天时,对照组和处理组果实相对电导率已分别上升到61%和58%。但甜菜碱处理的番木瓜果实相对电导率在整个贮藏过程中均低于对照组,统计分析表明,二者间呈显著性差异(p<0.05);对于MDA而言,对照组和甜菜碱处理的番木瓜果实内MDA含量同样均随着贮藏时间延长而上升(图2-B)。并且对照组的番木瓜果实MDA含量明显高于处理组果实。表明甜菜碱处理可以有效地抑制番木瓜果实内相对电导率的上升和MDA的积累。
2.3 甜菜碱处理对于番木瓜果实O2·- 产生速率和H2O2含量的影响
通常认为,低温对于果实细胞膜结构完整性的破坏与其诱发的氧化胁迫有关[15]。如图3-A所示,两组的番木瓜果实O2·- 产生速率均随贮藏时间的延长而上升。其中对照组的果实在20 d前上升迅速,之后缓慢升高,而处理组的果实内O2·- 产生速率在30 d前上升缓慢,贮藏30 d后迅速增加。在整个贮藏过程中,甜菜碱处理的番木瓜果实O2·- 产生速率均显著低于对照组(p<0.05)。
对于H2O2,两组果实均表现出相同的变化趋势,在贮藏前10 d有所下降,而后逐渐升高,至贮藏末期(40 d)升幅已分别达到151%和157%。甜菜碱处理的番木瓜果实H2O2含量在整个贮藏过程中均低于对照组,且二者之间呈显著差异(p<0.05)。
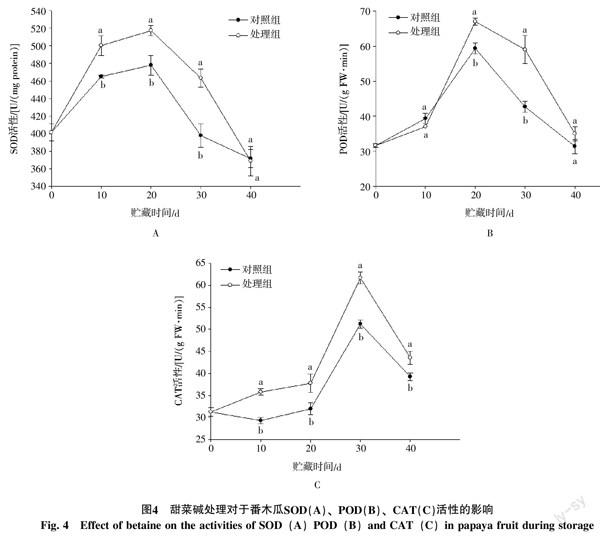
2.4 甜菜碱处理对于番木瓜果实SOD、POD和CAT活性的影响
为了缓解活性氧引起的损伤,果实组织内产生的活性氧会被POD、SOD和CAT这一类酶促清除系统和非酶促清除系统清除[16]。由图4-A和4-B可知,两组番木瓜果实SOD和POD活性在整个贮藏过程中均表现出先上升后下降的趋势,且均在第20天时达到峰值。并且除了POD在贮藏初期(前10 d)比对照略低外,在整个贮藏过程中,甜菜碱处理的番木瓜果实中SOD活性和POD活性均明显高于对照组,但在贮藏结束时,两者SOD活性降到了相似的水平。表明甜菜碱处理有助于提高番木瓜果实SOD和POD活性。
在整个贮藏过程中,两组果实中CAT活性同样均呈现先上升后下降的趋势,与SOD和POD不同的是,二者在30 d时达到峰值,然后迅速降低,到贮藏结束(40 d)时,处理组和对照组CAT活性分别为其最大值的76%和69%(图4-C)。且在贮藏30~40 d期间甜菜碱处理的番木瓜果实CAT活性都明显高于对照组(p<0.05),表明甜菜碱处理同样可以提高番木瓜低温贮藏过程中CAT活性。
3 讨论与结论
甜菜碱在果实的低温胁迫过程中扮演着重要角色。许多植物在低温胁迫时会迅速合成和积累甜菜碱,以提高其对低温的抗性[10]。对于甜菜碱减轻果实冷害的机理目前尚未明确。通常认为,低温对于果实细胞膜完整性的破坏与其诱发的氧化胁迫有关。有研究认为果实中甜菜碱的积累可以维持细胞内渗透压,并保护细胞中酶,特别是抗氧化相关酶的活性,增强果实清除活性氧的能力,以防止低温贮藏下果实组织中活性氧的异常升高和细胞膜结构的损害[17]。黄瓜果实经外源甜菜碱处理后,其细胞膜透性降低,丙二醛含量明显降低,SOD酶活性明显升高[9]。本研究结果也表明,甜菜碱处理显著地提高贮藏过程中番木瓜果实中SOD、POD和CAT活性,延缓了其活性的下降。而正常低温情况下,SOD、POD和CAT活性受到抑制[11]。与此相对应,活性氧代谢失调,细胞中H2O2和O2·- 大量积累,从而导致生物膜脂过氧化,通透性增加并最终致使果实腐烂[18-19]。因此,这些清除自由基酶系活性的升高,将有助于降低活性氧的积累,保持膜的完整性。本研究的结果也表明,甜菜碱处理的番木瓜果实中维持了较低的O2·- 生成速率和H2O2含量。与此相对应,番木瓜果实经外源甜菜碱处理后,其MDA和相对电导率明显低于对照。说明甜菜碱处理有效地维持了低温贮藏过程中番木瓜果实膜脂结构的完整性。而生物膜构象和结构改变被认为是果实冷害发生的最初反应,低温环境首先对果实生物膜造成伤害[20]。例如遭受冷害的黄瓜细胞内的电解质大量外渗,膜透性增大[21]。类似的结果在草菇[22]、茄子[23]、番茄[24]等果蔬上也有报道。因此,膜完整性的保持,将会延缓果蔬冷害的发生和减轻冷害症状。本研究也可以看出,在贮藏中后期,甜菜碱处理的番木瓜果实冷害指数和冷害引起的腐烂率都明显低于对照。表明外源甜菜碱处理可以减轻番木瓜果实低温贮藏过程中的冷害。
总之,本研究表明,甜菜碱处理可以提高番木瓜果实中SOD、POD和CAT等清除自由基酶系的活性,降低果实活性氧O2·- 生成速率和H2O2含量,延缓番木瓜果实中MDA产生和相对电导率的上升,从而延缓低温贮藏中番木瓜果实冷害的发生。
参考文献
[1] 刘学文, 王圣俊. 海南番木瓜产业发展的优势及政策建议——兼谈世界番木瓜产业[J]. 农业现代化研究, 2013, 9(4): 451-455.
[2] 陈 亮, 高兆银, 李 敏, 等. 贮藏温度对神秘果果实采后品质、 生理代谢及病害的影响[J]. 热带作物学报, 2015, 36(6): 1 173-1 178.
[3] Almeida R F D, Resende E D D, Vitorazi L, et al. Chilling injury in papaya fruits(Carica papaya L.)cv ‘Golden[J]. Revista Brasileira De Fruticultura, 2005, 27(1): 17-20.
[4] 王贵平, 薛晓敏, 路 超, 等. 甜菜碱提高植物抗逆性的作用及其作用机理[J]. 江西农业学报, 2014, 22(8): 22-26.
[5] Shan T M, Jin P, Xu J, et al. Effects of exogenous glycine betaine treatment on chilling injury and quality of cold-stored peach fruits[J]. Acta Horticulturae Sinica, 2015, 42(11): 2 244-2 252.
[6] 丁 天, 庞 杰, 王 清, 等. 外源甜菜碱对辣椒抗冷性的影响[J]. 广东农业科学, 2012, 39(21): 52-55.
[7] 鹿常胜, 潘永贵, 何 其, 等. 甜菜碱结合热处理降低采后香蕉果实冷害的研究[J]. 食品工业科技, 2014, 35(4): 300-305.
[8] 张海英, 王有年, 韩 涛, 等. 外源甜菜碱对黄瓜果实冷藏期间延缓冷害的影响[J]. 中国农业科学, 2008, 8(8): 2 407-2 412.
[9] 孙玉洁, 金 鹏, 单体敏, 等. 甜菜碱处理对枇杷果实采后冷害和活性氧代谢的影响[J]. 食品科学, 2014, 35(14): 210-215.
[10] 王 静, 王晓鹏, 妥丽敏, 等. 哈密瓜采前套袋对贮期腐烂的影响[J]. 果树学报, 2013, 3(3): 465-469.
[11] Shadmani N, Ahmad S H, Saari N, et al. Chilling injury incidence and antioxidant enzyme activities of Carica papaya L. ‘Frangi as influenced by postharvest hot water treatment and storage temperature[J]. Postharvest Biology & Technology, 2015, 9(9): 114-119.
[12] Wang Y L, Jian L, Wang J Z, et al. Exogenous H2O2 improves the chilling tolerance of manilagrass and mascarenegrass by activating the antioxidative system[J]. Plant Growth Regulation, 2010, 2(2): 195-204.
[13] Cao S, Yang Z, Cai Y, et al. Fatty acid composition and antioxidant system in relation to susceptibility of loquat fruit to chilling injury[J]. Food Chemistry, 2011, 127(4): 1 777-1 783.
[14] Haiping S, Lin L, Xu W, et al. Ascorbate-glutathione cycle of mitochondria in osmoprimed soybean cotyledons in response to imbibitional chilling injury[J]. Journal of Plant Physiology, 2011, 168(3): 226-232.
[15] Luo Z, Wu X, Xie Y, et al. Alleviation of chilling injury and browning of postharvest bamboo shoot by salicylic acid treatment[J]. Food Chemistry, 2012, 131(2): 456-461.
[16] Cao S, Yang Z, Cai Y, et al. Fatty acid composition and antioxidant system in relation to susceptibility of loquat fruit to chilling injury[J]. Food Chemistry, 2011, 127(4): 1 777-1 783.
[17] Wang F G, Han T, Zhang H Y, et al. Effect of exogenous glycine betaine on oxidative metabolism in cucumber during low-temperature storage[J]. Food Science, 2013, 34(8): 313-316.
[18] Lukatkin A S, Brazaityte A, Bobinas C, et al. Chilling injury in chilling-sensitive plants: a review[J]. Zemdirbyste-agriculture, 2012, 99(2): 111-124.
[19] Fogelman E, Kaplan A, Tanami Z, et al. Antioxidative activity associated with chilling injury tolerance of muskmelon(Cucumis melo L.)rind[J]. Scientia Horticulturae, 2011, 128(3): 267-273.
[20] 金 鹏, 王 静, 朱 虹, 等. 果蔬采后冷害控制技术及机制研究进展[J]. 南京农业大学学报, 2012, 35(5): 167-174.
[21] 韩 晋, 田世平. 外源茉莉酸甲酯对黄瓜采后冷害及生理生化的影响[J]. 园艺学报, 2006, 33(2): 289-293.
[22] 段学斌, 庞学群. 草菇低温贮藏及有关生理变化研究[J]. 热带作物学报, 2000, 21(4): 75-79.
[23] 余 挺, 钱冬梅. 茄子果实冷害生理的研究[J]. 园艺学报, 1998(3): 303-305.
[24] 李丽萍, 韩 涛. 热处理条件对番茄采后冷害的影响[J]. 农业工程学报, 1996(4): 189-193.
