不同接种和处理方式对巨桉幼苗青枯病发生的影响
2016-05-30范春节姚海荣曾炳山王胜坤郭光生覃伟权
范春节 姚海荣 曾炳山 王胜坤 郭光生 覃伟权

摘 要 桉树青枯病的发生由于影响因素较多导致其人工接种重复性差,因此需要获得稳定的青枯病感染,同时在此基础上可以进行桉树苗期青枯病的防治研究。在本研究中采用水培后伤新根和袋苗未经水培直接伤根后转移到青枯菌液中浸泡6、12、18、24 h后移植,调查桉树幼苗青枯病发病率和生长状况,同时通过在接种前喷施不同浓度的BR、MeJA、SA 3种激素,诱导桉树抵抗青枯菌侵染,调查处理后苗木死亡率。结果表明,未经过水培直接伤根移植的苗木更容易感染青枯菌,经过24 h菌液浸泡处理后的幼苗的死亡率,达到86.67%,同时发现SA对缓解桉树青枯病的发病有明显的作用,且在喷施浓度为0.001 mmol时使用,青枯菌侵染的植株仍有75.0%的存活率。本研究获得了桉树幼苗稳定感染青枯病的一种方式,为室内研究桉树幼苗感染青枯病的机制奠定基础,同时获得了降低桉树青枯病发生的处理方式,为桉树苗期青枯病的防治提供一种方案。
关键词 巨桉;桉树青枯病;青枯雷尔氏菌
中图分类号 S763.7 文献标识码 A
Abstract To study the mechanism of denfending Eucalyptus bacterial wilt, obtaining an efficient inoculation method for Ralstonia solanacearum on Eucalyptus was necessary owing to its scarce and low replicability. On the basis of this, different concentrations of BR, MeJA and SA treatments were used to improve Eucalyptus resistance for R. solanacearum. In this study, immersion of wounded roots by water culture and soil culture in bacterial cell suspension 6 hours, 12 hours, 18 hours and 24 hours were tested. The plants wounded roots by soil culture in bacterial cell suspension 24 hours were proved to be the most efficient for inoculating Eucalyptus with R. solanacearum and the rate of death reached the highest for 86.67%. Meanwhile, it was found that SA treatments increased defence to R. solanacearum individually. Moreover, SA significantly increased the rate of survive by full coverage foliage spray before plants inoculated with R. solanacearum, which 0.001 mmol SA treatment gained the major improvement for 75.0% survival. This study developed an effective protocol for inoculation of R. solanacearum, which based for further investigated the mechanism of R. solanacearum infect Eucalyptus and supplied a method for affect against Eucalyptus bacterial wilt.
Key words Eucalyptus grandis; Eucalyptus bacterial wilt; Ralstonia solanacearum
doi 10.3969/j.issn.1000-2561.2016.08.017
桉树青枯病是危害桉树生产的主要病害之一,其病原为青枯雷尔氏菌(Ralstonia solanacearum Smith),在土壤中通过根部自然孔口或伤口侵入,然后沿输导组织大量繁殖导致维管束输导组织堵塞,水分及营养运输困难。其外观表现特征为生长势弱、叶片枯萎但仍保持青色,后期叶片脱落整株枯萎死亡。桉树青枯菌侵染的部位出现变褐坏死、根系腐烂变黑且坏死的根茎有发酵味,横切后经保湿数分钟出现黄褐色或乳白色细菌溢脓[1-2]。桉树青枯病发生受栽培条件、土壤养分、气象因子、树种等多种因素影响。如土壤养分不足,且栽培过易感的烟草、番茄等或曾发生过青枯病流行的区域更易发生,尤其是对于中国大面积推广单一的尾叶桉、巨尾桉、巨桉无性系更易发生大面积的青枯病危害[3]。在高温多雨的6~8月为发病高峰期,9~10月为病树枯死期,尤其是经历台风后的桉树无性系林,其青枯病危害更为严重[4]。
尽管目前开展了一些桉树青枯菌感病机制的相关研究[5-6],由于青枯菌对桉树根的吸附及发病影响因素较多[7-8],在试验中常发现桉树青枯病的发病存在着不确定性。常采用剪顶包扎菌液法、伤根淋灌菌液法、WFT培养接种法在接种后常发现没有出现发病现象,这成为室内或苗圃研究桉树青枯病的侵染机制和机理的限制性因素。因此建立起稳定的侵染和感病方法显得尤为重要。在进行桉树青枯病防治中,国内外开展了大量的研究,主要采用生化试剂[9]、菌根[10-11]、拮抗细菌防治[12]、诱导性激素[13-15]等方法。而水杨酸(Salicylic acid,SA)、油菜素内酯(Brassinolide,BR)、茉莉酸甲酯(Methyl jasmonate,MeJA)等生长调节剂是应对生物胁迫及非生物胁迫反应的重要信号分子,能诱导多种植物对生物和非生物胁迫产生持续抗性,减缓植物对包括病原菌侵染等多种逆境胁迫的伤害[16-19]。尤其是水杨酸在早期的研究中通过灌根或根部浸泡等方式发现其对缓解桉树青枯病的发生有一定的作用[13-15],值得注意的是这些操作方法在苗圃大规模育苗过程中操作难度大,难以真正实现。而油菜素内酯和茉莉酸甲酯等激素尚未开展相关研究。
在本研究通过使用水培和土培2种方式接种桉树青枯菌,研究其不同的侵染时间对桉树感染青枯菌的影响,以期获得稳定的青枯菌侵染和发病。同时直接将不同浓度的水杨酸、油菜素内酯、茉莉酸甲酯喷施到叶片,研究其对缓解桉树青枯病发病的影响,筛选出合适的激素以及浓度,为进一步苗期桉树青枯病的防治应用奠定基础。
1 材料与方法
1.1 材料
试验所需材料以巨桉(E. grandis)无性系GL1组培苗为材料,由中国林业科学研究院热带林业研究所繁育中心保存。将组培生根苗移植到苗圃3个月,以黄心土为基质,待其高度为20~30 cm,取生长良好的植株进行试验。
1.2 方法
1.2.1 青枯菌菌株分离与培养 感染青枯病的植株2015年7月9日采集于广东省惠州市惠东县。在野外观察发现,发病植株症状为整株植物枯死,叶片为青色,叶片不脱落,截断15 min后出现乳白色细菌溢脓(图1-A和图1-B),具有典型的青枯菌感染症状。取回2 m长树干后,进行青枯菌分离和鉴定。使用单面刀片切取木质部进行病原菌分离,采用稀释分离法培养于2,3,5-氯化三苯基四氮唑(TTC)培养基平板上,分离出菌落为圆形、乳白色、中间隆起、液化、具光泽(图1-C),具有典型的青枯菌菌株特征。纯化的菌株采用无菌水在4 ℃下保存。接种的菌株在TTC培养基上培养,30 ℃培养箱中培养36 h,配置成浓度为3×108 CFU/mL的菌液备用。
1.2.2 侵染与处理 对于水培后侵染的植株,首先洗去黄心土,然后水培培养14 d,长出大量新根后作为试验材料进行处理,测量苗高。使用双面刀片进行伤根处理,将新根划伤后放置在菌液中6、12、18、24 h后,移植到营养盆中,栽培基质选用泥炭土,为防止土壤中其他微生物对青枯菌感染的影响,所用的泥炭土采用121 ℃、0.1 Mpa灭菌30 min处理,以下处理与之相同。未经水培处理的植株,将根清洗干净后后直接放入到青枯菌菌液中6、12、18、24 h后移植到营养盆中,栽培基质选用泥炭土。1个月后统计死亡率和苗高。
1.2.3 桉树青枯菌PCR验证 DNA提取和PCR检测方法采用王胜坤等[20]的方法,以16S rRNA为靶基因的青枯菌特异性引物序列OLI1/Y2, 由上海生工生物工程有限公司合成。序列如下:上游引物OLI1:5′-GGGGGTAGCTTGCTACCTGCC-3′、下游引物Y2:5′-CCCACTGCTGCCTCCCGTAGGAGT-3′,扩增片断长度为288 bp。
1.2.4 BR、MeJA、SA的施用 试验用BR、MeJA、SA母液购自Sigma-Aldrich,用无水乙醇配制成母液,根据浓度所需使用无菌水稀释到所需浓度,营养液和喷施液的乙醇终浓度控制在0.1%(V/V)。对照采取施用相同浓度的乙醇溶液。采用浓度分别为0、0.001、0.01、0.05、0.1、0.25 mmol的24-epiBR、MeJA、SA喷施整株桉树,2 d后将植株进行浸根24 h处理,每个处理重复3次,每个重复10株。以未喷施激素植株接种病原菌植株作为对照。1个月后统计成活率。
1.3 数据处理
死亡率、抽高率和成活率经过反正弦转换后进行分析,其中抽高率=(1个月后苗高-原苗高)/原苗高×100%。显著性分析采用Sigmaplot进行统计分析,使用One-way ANOVE方法进行多重比较分析,p≤0.10为显著性差异。
2 结果与分析
2.1 不同处理方式对青枯病染菌的影响
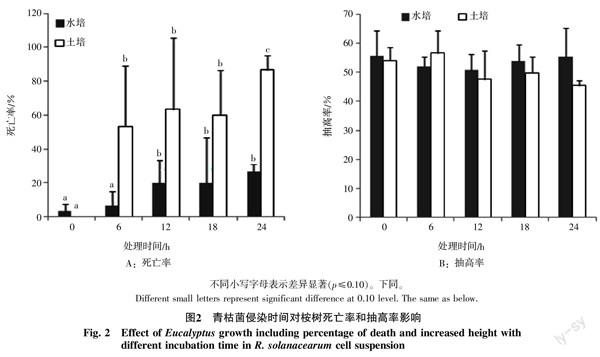
结果表明,使用水培和土培的植株浸泡青枯菌菌液时,浸泡时间对桉树感染青枯菌起到显著性影响。且都是随着时间的增加,桉树苗木死亡率逐渐增加。在浸泡24 h时,水培和土培植株的死亡率分别达26.67%和86.67%(图2-A)。而对土培植株进行处理时,6~18 h处理之间并没有显著性差异。值得注意的是使用水培植株在菌液中浸泡6 h时,与对照相比并没有显著性差异,只有在12~24 h达到显著。说明从根接触到菌液到青枯菌进入到桉树根维管组织中需要一定的时间。同时发现,直接使用土培植株的死亡率高于使用水培植株。土培植株在浸泡6 h时植株死亡率已达到53.33%,远高于采用水培植株浸泡青枯菌菌液导致的最高值。可能是由于在清理土培植株的根时,会对根造成更大的伤害,使得青枯菌易于吸附和进入桉树根细胞内。而在水培植株中主要是幼嫩的新根,幼根中未形成完整的输导组织,不利于青枯菌的吸附和运输,说明新根可能并不是青枯菌浸染的主要途径。同时对不同处理时间的水培苗和土培苗生长高度进行测量,发现水培苗和土培苗的生长高度并未受到显著性的影响,可能是由于生长时间的原因。尽管如此,仍然可以看到采用土培苗经过24 h泡菌处理中,抽高率仅为45.42%,低于对照54.01%(图2-B)。可能是在24 h浸泡处理时,青枯菌菌株已经进入桉树体内,但并未致死,从而导致桉树的生长受到抑制;也可能是由于长时间菌液浸泡对桉树的根产生了一定的伤害。
2.2 桉树青枯病染菌的确定
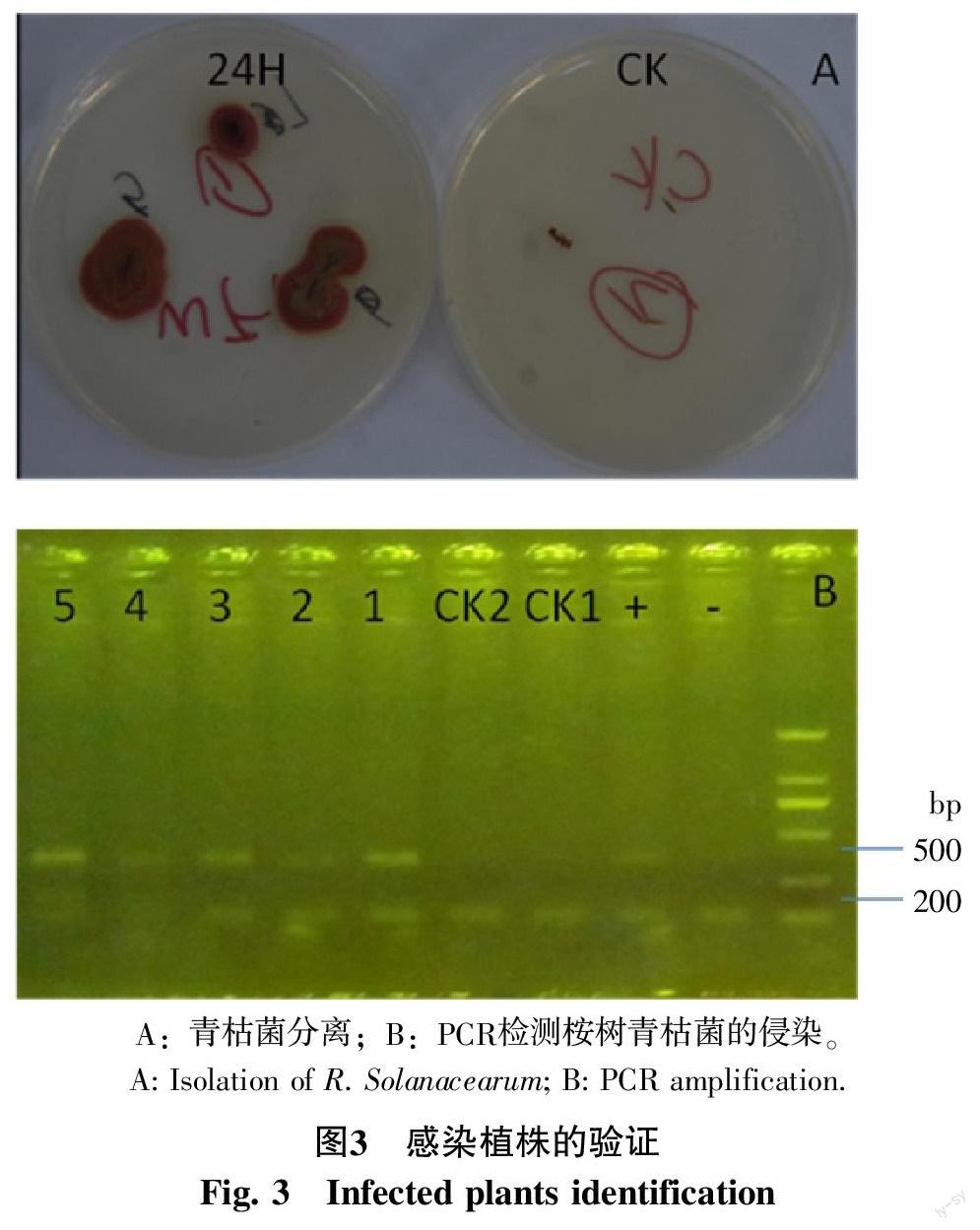
为了进一步确认死亡植株是否感染青枯菌菌株,通过取茎部木质部组织,进行病原菌的再分离,结果发现死亡植株茎部能够重新分离出青枯菌菌株,且菌落具有明显的青枯菌的生长特征(图3-A),而对照组并未分离出青枯菌菌株。进一步通过PCR验证,如图3-B所示,能够扩增出青枯菌的特异性条带,说明确实是青枯菌的感染导致。
2.3 激素处理对缓解青枯病的作用
通过对不同激素预处理苗木,然后进行菌液浸根接种。由图4可以看出,SA、BR、MeJA都能在不同程度上缓解青枯菌引起的桉树苗木死亡。其中SA对缓解桉树青枯菌的发生起到显著性的影响,在所有浓度处理的SA都能提高桉树对青枯菌的抗性,尤其是在喷施0.001和0.01 mmol SA处理时,桉树苗木存活率分别达到75.00%和71.17%,远超过未进行处理的对照植株的25.0%,而随着浓度的升高,存活率反而下降,说明合适的SA处理浓度为0.001~0.01 mmol。同时在喷施0.01和0.10 mmol的BR对缓解桉树青枯病的发生起到显著性的抑制。在此浓度下桉树获得了超过50.0%的存活率。尽管如此,在0.001和0.25 mmol时外施BR并不能显著的提高桉树的存活率,说明BR的浓度对于缓解青枯病的发生非常重要。而在0.01和0.10 mmol浓度MeJA处理时,对于缓解桉树青枯病的发生也起到显著的效果,其中在施加0.10 mmol的MeJA时桉树苗木存活率达到58.33%。这些结果表明,SA、BR和MeJA的处理都能显著性的提高桉树对青枯病的抗性,其中SA的效果最明显,在所有的处理中,桉树苗木存活率都超过了50.0%。而MeJA和BR处理在一定程度上可以缓解桉树青枯病的危害,但需要筛选出合适的浓度。在浓度较低或较高时都难以达到预期的效果,如在0.001 mmol浓度的BR处理时,桉树存活率只有35.0%,与对照相比并没有达到显著性差异。这些结果说明不同的激素在诱导桉树抵御青枯菌侵入有特定的浓度响应机制。
3 讨论与结论
通过不同的侵染处理获得了青枯菌有效的侵染方式,土培植株清洗干净的根经过24 h浸泡会导致86.67%的桉树植株感染青枯病死亡,为研究桉树青枯菌的侵染机制奠定基础。本研究中发现直接接种青枯病浸染率较高,可能是由于在直接接种过程中清洗根时会导致较多的根出现伤口。在国内研究中多采用水培处理方法进行相关研究[21],水培法操作简单,易观察到苗木发病。但水培法由于无法完整的模拟野外青枯病感染方式,同时青枯菌的吸附侵入受温度、pH值、菌液浓度、菌种活力以及胞外多糖和脂多糖等内外多种因素的影响[7-8]。因此在试验中发现多种处理条件下青枯病发病不稳定等现象。而在使用浇灌土壤、伤根侵染和注射菌液到茎基部进行测试青枯菌对桉树的侵染,发现注射法接种效果最明显,大多数植株和无性系出现典型的青枯病症状[22]。在本研究中发现直接进行移植的植株,在24 h侵染后获得最好的效果,可能是在去除根部土壤过程中对根的伤害更多,为青枯菌进入桉树维管束提供了更多的条件,同时说明青枯菌吸附到桉树根部以及青枯菌进入桉树根细胞内需要一定的时间。
在本研究中,通过施用不同浓度的激素诱导植物抗病性,发现不同的BR、MeJA、SA对降低青枯病的死亡率具有不同的作用。SA的作用最明显。在对尾叶桉幼苗SA淋根处理中也发现1~5 mmol水杨酸能明显缓解其青枯菌的伤害[14-15],而采用浸泡方式进行处理发现0.5 mmol的SA能够明显抑制桉树幼苗发病率,而且在进一步的研究中证实这种抑制桉树幼苗青枯病发病率是通过诱导作用而不是直接抑制或毒杀细菌[13]。本研究中发现通过喷施低浓度的SA(0.001~0.01 mmol)就能够缓解青枯菌的侵染。同时在前期发现高浓度水杨酸的浸泡对桉树苗有毒害作用[15],因此在生产中使用喷施法可更加有效预防桉树幼苗青枯病的发生,尤其是预防苗圃青枯病的发生和流行。同时在本研究中发现BR和MeJA对桉树青枯病的缓解作用有限,但仍能够起到一定的作用,鉴于其作用的机制与SA处理诱导植物的抗性机制不同,因此可以在使用SA处理时,同时施加特定浓度的BR和MeJA,可能对于缓解桉树青枯病的发生有更好的作用。
参考文献
[1] WANG Y, R ARNOLD, L I Q G, et al. Identification and rapid detection of bacterial wilt in plantation Eucalyptus in China[J]. Australian Forestry, 2104, 77: 133-139.
[2] 吴志华, 谢耀坚, 罗联峰, 等. 我国桉树青枯病研究进展[J]. 林业科学研究, 2007, 20(4): 569-575.
[3] 吴光金, 林雪坚, 石明旺, 等. 桉树抗青枯病树种和无性系的鉴定[J]. 中南林学院学报, 2003, 23(4): 32-34.
[4] 张民兴, 吴光金. 桉树青枯病发病规律的研究[J]. 中南林学院学报, 1996, 16(2): 28-33.
[5] Fonseca N R, Guimaraes L M S, Hermenegildo P S, et al. Molecular characterization of Ralstonia solanacearum infecting Eucalyptus spp. in Brazil[J]. Forest Pathology, 2014, 44(2): 107-116.
[6] Eder Marques, Carlos H Uesugi, Marisa A S V Ferreira, et al. Characterization of isolates of Ralstonia solanacearum biovar 2, pathogenic to Eucalyptus “urograndis” hybrids[J]. Tropical Plant Pathology, 2012, 37(6): 399-408.
[7] 王胜坤, 王 军, 康丽华, 等. 不同温度、 pH值和接种浓度对青枯菌在尾巨桉苗木根部吸附和侵入的影响[J]. 林业科学, 2010, 46(12): 80-85.
[8] 王胜坤, 王 军, 徐大平. 胞外多糖和脂多糖在青枯菌对尾巨桉根部吸附和侵入过程中的作用研究[J]. 林业科学研究, 2007, 20(2): 176-180.
[9] 李 波, 孙 思, 伍慧雄, 等. 几种生化制剂诱导桉树对青枯病的抗性研究[J]. 福建林学院学报, 2014, 34(3): 244-248.
[10] 弓明钦, 陈 羽. 外生菌根对桉树青枯病的防治效应[J]. 林业科学研究, 1999, 12(4): 339-345.
[11] 马海宾, 康丽华, 江业根, 等. 联合固氮菌对桉树青枯病菌的抑制作用研究[J]. 林业科学研究, 2007, 20(4): 473-476.
[12] 冉隆贤, 向妙莲, 李正楠, 等. 将两种抗病机制结合控制桉树青枯病的研究[J]. 中南林业科技大学学报, 2008, 28(4): 87-91.
[13] 冉隆贤, 曾令才. 芳香酸诱导桉树抗青枯病研究[J]. 中南林学院学报, 2003, 23(4): 35-38.
[14] 冉隆贤, 谷文众, 吴光金. 水杨酸诱导桉树抗青枯病的作用及相关酶活性变化[J]. 林业科学研究, 2004, 17(1): 12-18.
[15] 向妙莲, 冉隆贤, 周 斌. 水杨酸处理对桉树抗青枯病诱导作用研究[J]. 江西农业大学学报, 2007, 28(6): 868-871.
[16] BAJGUZ A, HAYAT S. Effects of brassinosteroids on the plant responses to environmental stresses[J]. Plant Physiology and Biochemistry, 2009, 47(1): 1-8.
[17] DREHER K, CALLIS J. Ubiquitin, hormones and biotic stress in plants[J]. Annals of botany, 2007, 99: 787-822.
[18] 江厚龙, 李 鹏, 李钠钾, 等. 外源诱抗剂对烟草青枯病的诱抗效果研究[J]. 中国农学通报, 2014, 30(28): 286-290.
[19] 向妙莲, 陈 明, 宋水林, 等. 水杨酸诱导辣椒抗疫病的作用研究[J]. 生物灾害科学, 2012, 35(2): 9.
[20] 王胜坤, 王 军, 徐大平. 四种桉树青枯菌DNA提取方法及PCR检测灵敏度比较[J]. 中国森林病虫, 2007(5): 4-7.
[21] 冉隆贤, 向妙莲, 李正楠. 在液体培养系统中诱导桉树抗青枯病的快速测定[J]. 河北林果研究, 2008, 23(3): 301-304.
[22] Natália R Fonseca, Leonardo S S Oliveira, Lúcio M S Guimaraes, et al. An efficient inoculation method of Ralstonia solanacearum to test wilt resistance in Eucalyptus spp[J]. Tropical Plant Pathology, 2016, 41(1): 42-47.
