杨桃果实过氧化物酶特性及其抑制条件研究
2016-05-30詹嘉红
詹嘉红


摘 要 以愈创木酚为底物,采用分光光度法对杨桃果实过氧化物酶(POD)的酶学特性进行研究。结果表明,杨桃POD反应时间不宜超过3.5 min,最适pH为 5.6,最适温度为30 ℃,100 ℃处理 30 s 后 POD 活性完全丧失。POD催化的酶促褐变反应动力学符合米氏方程,动力学参数Km=1.68×10-2 mol/L,Vmax=15.267 U/min,相应的动力学方程为v=15.267[S]/(0.0168+[S])(U/min)。抑制剂对 POD活性的抑制效果从大到小依次为抗坏血酸>L-半胱氨酸>亚硫酸氢钠>柠檬酸。本研究可为杨桃保鲜贮藏和深加工过程中的酶促褐变控制提供理论参考。
关键词 杨桃;过氧化物酶;酶学特性;抑制剂
中图分类号 TS201.5 文献标识码 A
Abstract With spectrophotometry method and based on substrate of guaiacol, the enzymatic characteristics of peroxidase(POD) from Averrhoa carambola fruit were investigated. The results showed that the reaction time for POD should not exceed 3.5 min, the optimum pH and temperature of POD were 5.6 and 30 ℃, respectively. The POD activity was completely inactivated when it was incubated at 100 ℃ for 30 s. The reaction kinetic of enzymatic browning was accordant with Michaelis-Menten equation. The Km, Vmax and kinetic Equation were 1.68×10-2 mol/L,15.267 U/min and v=15.267[S]/(0.0168+[S])(U/min), respectively. Four inhibitors demonstrated different effects on POD activity,and their inhibitory capacity was decreased in the order:ascorbic acid>L-cysteine>NaHSO3> citric acid. This research aimed to provide reference and theoretical basis to protect Averrhoa carambola fruit from enzymatic browning in the course of processing and storage.
Key words Averrhoa carambola;Peroxidase;Enzymatic characteristics;Inhibitor
doi 10.3969/j.issn.1000-2561.2016.08.008
杨桃(Averrhoa carambola Linn.),又称阳桃、五敛子、洋桃等,属酢酱草科五敛子属,是一种热带亚热带常绿乔木或灌木果树,其果实也是中国南方重要的热带水果之一。杨桃果脆汁多、甜酸可口,其深加工产品有杨桃饮料、杨桃罐头、杨桃蜜饯等。杨桃果实营养丰富,其富含的多酚物质具有抗肿瘤、抗氧化和抗动脉硬化等多种生理功能[1]。然而,杨桃鲜果在贮藏、运输和加工过程中极易产生酶促褐变现象,严重影响其食用品质和商品价值。前人的研究表明,水果中的多酚氧化酶(POD)和过氧化物酶(POD)参与下的酶促反应是果实褐变的主要原因:果实中的酚类化合物在PPO和POD的催化条件下进行氧化还原反应而醌式化,再通过一系列的反应而聚合成黑色素[2],从而导致果实褐变,如橄榄[3]、荔枝[4]、枇杷[5]等的褐变均与自身存在的这些酚酶密切相关。目前有关杨桃的褐变与其PPO的关系研究已有一些报道[6-7],但针对杨桃POD活性及其与褐变关系的研究则鲜见报道。本试验通过对杨桃鲜果中POD 的部分酶学特性进行探讨,以期为杨桃保鲜贮藏和深加工过程中的酶促褐变控制提供理论参考。
1 材料与方法
1.1 材料
试验材料为红种甜杨桃,购自当地果场。愈创木酚、30%过氧化氢、磷酸二氢钠、磷酸氢二钠、柠檬酸、亚硫酸氢钠、抗坏血酸、L-半胱氨酸等为分析纯。
FA2004电子天平(上海精密科学仪器有限公司天平仪器厂);UV2100型紫外可见分光光度计(尤尼柯(上海)仪器有限公司);JJ-2组织捣碎匀浆机(富华仪器有限公司);GL-16G-Ⅱ型高速冷冻离心机(上海安亭科学仪器厂);HH-2数显恒温水浴锅(江苏省金坛市友联仪器研究所);PHS-2C型精密酸度计(上海雷磁仪器厂)等。
1.2 方法
1.2.1 杨桃POD粗酶液的提取 称取杨桃果肉25 g,先加适量4 ℃预冷的磷酸盐缓冲溶液(0.05 mol/L,pH5.8),低温研磨至匀浆,并定容至50 mL,放于4 ℃下的冰箱里浸提30 min后,将匀浆液以10 000 r/min转速在4 ℃下离心20 min,上清液即为酶的粗提液,低温保存用于酶活性分析。
1.2.2 杨桃POD活性测定 参考李合生[8]的愈创木酚法,略有改进。吸取 0.05 mol/L pH5.8磷酸缓冲液2.25 mL,加入0.05 mol/L愈创木酚2.0 mL,加入2% H2O2 0.25 mL,再加入0.5 mL粗酶液后迅速摇匀启动反应,于室温下测定波长470 nm的OD值,对照以缓冲液代替酶液。
1.2.3 反应时间对POD活性的影响 按照1.2.2 的测定方法,总反应体系分别反应 0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5 min,测其吸光值。
1.2.4 pH对POD活性的影响 配制pH值分别为2.2、2.6、3.0、3.4、3.8、4.2、4.6、5.0、5.2、5.4、5.6、5.8、6.2、6.6、7.0、7.4、8.0的磷酸氢二钠-柠檬酸缓冲溶液。按1.2.2的方法,在室温下测定不同pH值下的吸光值。
1.2.5 反应温度对POD活性的影响 按1.2.2方法建立反应体系,分别于5、10、15、20、25、30、35、40、45、50、55、60、65 ℃下预先保温10 min,再加入0.5 mL粗酶液,振荡后在原温度条件下继续保温3 min,然后测定吸光值
1.2.6 POD的热稳定性研究 取等量酶液若干份,在100 ℃水浴中分别热烫5、10、15、20、25、30 s,取出后迅速冷却,按1.2.2的方法测定不同热烫时间的吸光值。
1.2.7 底物浓度对POD活性的影响 分别配制浓度为0.005、0.01、0.02 、0.05、0.1、0.15 mol/L的愈创木酚溶液为底物,按照 1.2.2 的测定方法,测其在最适温度、最适pH值及酶液浓度保持固定条件下的吸光值,计算酶活性。以每分钟吸光度变化0.01为1个酶活性单位(以U/min表示)。
1.2.8 抑制剂对POD活性的影响 探讨抗坏血酸(0、0.5、1.0、1.5、2.0、2.5 mmol/L)、亚硫酸氢钠(0、20、40、60、80、100 mmol/L)、L-半胱氨酸(0、2、4、6、8、10 mmol/L)和柠檬酸(0、50、150、250、350、450 mmol/L)等抑制剂对POD活性的抑制作用,按1.2.2的方法,向反应体系分别加入各种浓度的抑制剂0.5 mL,缓冲液的量相应减少0.5 mL,在室温下测定不同抑制剂作用下的吸光值。
1.3 数据处理
所有数据均取3次重复平均值,采用Microsoft Excel进行数据分析。
2 结果与分析
2.1 杨桃POD反应进程曲线
由图1可见,在反应初期,即3.5 min内,随着反应的进行,OD值(即产物生成量)几乎成直线上升,即在这一时间段,酶促反应速率基本保持不变。因此,本实验确定酶促反应时间以不超过3.5 min为宜。
2.2 pH对杨桃POD活性的影响
由图2可见,该酶在pH值为5.6时,酶活性最高,表明该酶的最适pH值为5.6,当pH值为2.2和8.0时,POD活性分别为最大时的29.7%和55.9%。
2.3 温度对杨桃POD活性的影响
由图3可以看出,温度与杨桃POD活性的关系曲线为较典型的钟形曲线,在30 ℃以下酶活性随着温度的升高而升高,当温度达到30 ℃时,吸光度出现峰值,酶活性达到最高,当温度超过30 ℃,酶活性随着温度的升高而降低。当温度达到65 ℃时,POD残留的相对活性降至10.3%,而在5 ℃时,POD的相对活性是27.0%。因此,30 ℃为该酶的最适温度。
2.4 杨桃POD热稳定性
由图4可知,随着处理时间的增加,POD活性迅速下降。当处理20 s后,残存活性仅剩下38.1%,而处理30 s后,酶活性已很微弱。
2.5 底物浓度对杨桃POD活性的影响
由图5可以看出,在底物浓度较低时(<0.01 mol/L),反应速率与底物浓度的关系几乎呈斜率大于零的线性关系;随着底物浓度增大,反应速率依然升高,但由于酶的数量有限,反应速率与底物浓度的关系不再是线性关系;当底物浓度相当高时(>0.1 mol/L),酶促反应速率与底物浓度无关,反应达到最大反应速率[9]。
由Lineweaver-Burk方程1/v=Km/Vmax×1/[S]+1/Vmax,作出1/v对1/[S]的双倒数图(图6),得直线方程y=0.001 1x + 0.065 5,根据直线斜率和截矩求得该反应的米氏常数Km=1.68×10-2 mol/L,最大反应速率Vmax=15.267 U/min,相应的动力学方程为v=15.267[S]/(0.016 8+[S])(U/min),其中拟合直线相关系数达到0.999,可见杨桃POD的酶促反应动力学符合米氏方程。
2.6 抑制剂对杨桃POD活性的影响
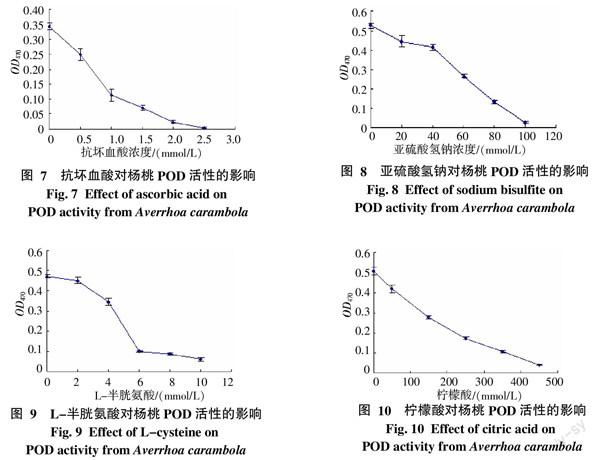
由图7可见,随着抗坏血酸浓度增加抑制效果明显增强,当抗坏血酸浓度为1.0 mmol/L时,POD受抑制程度为66.8%;当浓度为2.5 mmol/L时,酶活性几乎被完全抑制。
由图8可知,当亚硫酸氢钠浓度小于40 mmol/L时,POD酶活性被抑制的效果较弱,当浓度大于40 mmol/L时,随着亚硫酸氢钠浓度增加抑制效果显著提高,当浓度为100 mmol/L,酶活性受抑制程度高达95.0%。
由图9可见,当L-半胱氨酸浓度小于6 mmol/L时,随着浓度的升高,其抑制效应逐渐增强。当浓度从6 mmol/L增加到10 mmol/L时,抑制作用增强不明显,酶活性受抑制程度仅从79.0%增至87.5%。
图10显示,杨桃中POD 活性抑制需要使用较高浓度柠檬酸溶液,当柠檬酸浓度为150 mmol/L时,其受抑制程度为45.2%;当浓度为450 mmol/L时,其受抑制程度达到91.9%。
根据上述研究结果,以较低的抑制剂浓度呈现的最佳抑制效应分析,抗坏血酸的抑制效果最佳,其次是L-半胱氨酸,再次是亚硫酸氢钠,柠檬酸抑制效果最差。
3 讨论与结论
POD广泛存在于动物、植物和微生物体内,是一类以血红素为辅基的氧化还原酶,在 H2O2存在下,它能催化酚类、类黄酮的氧化和聚合,从而导致组织褐变。POD活性受pH、温度、底物浓度、抑制剂等因素的影响。杨桃果实POD有较广泛的pH范围,最适pH值为5.6,与甘薯叶[10]的最适pH一致,略高于枇杷果肉[11]POD的最适pH(5.0),在pH2.2~8.0之间,杨桃果实POD活性保持在30%以上,说明耐受范围较广。此外,本研究结果表明,杨桃果实POD的最适温度为30 ℃,与香蕉果皮[12]、草莓[13]的最适温度一致,略低于雪莲果[14]和香蕉果实[15]的最适温度(均为35 ℃)。POD是一种非常耐热的酶,在果蔬加工中常被用作热处理是否充分的指标[16]。大蕉的POD具有良好的热稳定性,100 ℃下加热 30 min残存活性还保持18.28%[17],龙眼果肉中POD在100 ℃水浴处理7 min即完全失活[18],相比之下杨桃果实POD对热敏感,经沸水浴30 s处理酶活则被钝化。对于酶促褐变来说,在适宜温度下,反应酶活越强,则酶促褐变程度越高,因此在实际操作中,可通过短时间高温灭酶来抑制杨桃果实酶促褐变。
在POD活性测定系统中,以愈创木酚为底物的杨桃果实POD的Km值为1.68×10-2 mol/L,这比梅州金柚[19]POD的Km(8.74 mmol/L)值大,但比富士苹果[20]POD的Km(129.09 mmol/L)值小很多,米氏常数(Km)是酶的一个特征性常数,Km值可近似地表示酶与底物之间的亲和程度。说明杨桃果实POD氧化酚类物质的能力比梅州金柚POD的氧化能力弱,但比富士苹果POD的氧化能力强很多。
抗坏血酸、亚硫酸氢钠、L-半胱氨酸和柠檬酸均能有效抑制杨桃果实POD活性,但抗坏血酸抑制杨桃果实POD活性的效果最佳,当抗坏血酸浓度为2.5 mmol/L时,酶活性几乎为零。虽然抗坏血酸抑制效果好、安全性高,但若添加量过大时,也易引起非酶褐变。目前,在果蔬防褐处理中,提倡多种抑制剂结合使用以提高抗褐变效果。因此,在单因素抑制剂研究的基础上,对不同抑制剂多因素协同作用的抑制效应今后还有待进一步深入研究。
参考文献
[1] 冯 丽, 宋曙辉, 赵 霖, 等. 植物多酚种类及其生理功能的研究进展[J]. 江西农业学报, 2007, 19(10): 105-107.
[2] Montgomery M W, Sgarbieri V C. Isoenzymes of banana polyphenol oxidase[J]. Phytochemistry, 1975, 14(4): 1 245-1 249.
[3] 谢 倩, 陈清西, 王 威,等. 橄榄果实过氧化物酶和多酚氧化酶酶学特性研究[J]. 热带作物学报, 2013, 34(8): 1 519-1 524.
[4] 庞学群, 段学武, 张昭其,等. 荔枝过氧化物酶的纯化及部分酶学性质研究[J]. 热带亚热带植物学报, 2004, 12(5): 449-454.
[5] Ding C K, Chachin K, Ueda Y, et al. Inhibition of loquat enzymatic browning by sulfhydryl compounds[J]. Food Chemistry, 2002, 76: 213-218.
[6] 杨昌鹏, 胡艳妮, 陈智理,等. 杨桃多酚氧化酶的部分纯化及其特性研究[J]. 食品与发酵工业, 2010, 36(1): 34-38.
[7] 胡艳妮, 杨昌鹏, 黄卫萍,等. 杨桃若干品种及贮藏期间多酚氧化酶活性的变化[J]. 安徽农业科学, 2008, 36(3): 884-886.
[8] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2003: 164-165.
[9] 张丽萍, 杨建雄. 生物化学简明教程(第4版)[M]. 北京: 高等教育出版社, 2009: 159-160.
[10] 付伟丽, 唐靓婷, 王 松,等. 甘薯叶过氧化物酶的分离纯化及其部分性质研究[J]. 食品科学, 2010, 31(7): 223-227.
[11] 林建城, 吴智雄,彭在勤. 枇杷果肉过氧化物酶的分离纯化及其性质研究[J]. 四川农业大学学报, 2007, 25(4): 419-424.
[12] Yang C P, Fujita S, Kohno K, et al. Partial purification and characterization of polyphenol oxidase from banana(Musa sapientum L.)peel[J]. J Agric Food Chem, 2001, 49(3): 1 446-1 449.
[13] 韩 涛, 李丽萍. 果实和蔬菜中的过氧化物酶[J]. 食品与发酵工业, 2000, 26(1): 69-73.
[14] 周向军, 高义霞,张生财. 雪莲果过氧化物酶的特性和抑制研究[J]. 中国酿造, 2011(1): 109-112.
[15] 杨昌鹏, 罗菊珍, 郭静婕,等. 香蕉果肉过氧化物酶初步纯化及特性研究[J]. 安徽农业科学, 2008, 36(36): 16 148-16 150.
[16] 王 璋. 食品科学[M]. 北京:中国轻工业出版社, 1999: 224-225.
[17] 李 健, 杨昌鹏, 陈智理, 等. 3个香蕉品种果实过氧化物酶的特性分析[J]. 湖北农业科学, 2011, 50(15): 3 093-3 101.
[18] 刘 畅, 徐玉娟, 李升锋,等. 龙眼果肉中多酚氧化酶和过氧化物酶性质研究[J]. 食品工业科技, 2008, 29(7): 102-104.
[19] 黎 婕, 陈 中,林伟锋. 梅州金柚果肉中过氧化物酶特性的研究[J]. 食品工业科技, 2014, 35(1): 133-136.
[20] 王 倩, 刘 伟, 刘成梅,等. 苹果POD酶学性质及动态高压微射流对POD的影响[J]. 食品与机械, 2011 ,27(2): 4-7, 21.
