短期高温胁迫对茄子主要生理指标及叶片解剖结构的影响
2016-05-30李艳艳王俊青李植良孙保娟
李艳艳 王俊青 李植良 孙保娟


摘 要 为了探讨不同耐热性茄子苗期短期高温胁迫响应机制的差异,以茄子热敏品系05-1和耐热品系05-4为研究材料,研究不同时间(0、6、12、18 h)高温胁迫对叶片细胞膜透性、AsA、GSH、可溶性糖含量变化和叶片解剖结构的影响。结果表明:高温胁迫后,耐热品系的相对膜透性升高幅度明显低于热敏品系;同时耐热品系较热敏品系AsA和GSH含量高,而且耐热品系GSH开始增加的时间早于热敏品系;耐热品系可溶性糖含量呈持续上升趋势,而热敏品系可溶性糖含量先上升后下降。从叶片解剖结构来看,正常生长温度下,耐热品系要较热敏品系茄子的叶肉细胞排列紧密;高温胁迫后耐热品系叶肉细胞和叶绿体发生膨大、变形的时间要迟于热敏品系,与此同时,叶绿体淀粉类多糖颗粒呈现先下降后上升的趋势。
关键词 茄子;高温胁迫;生理指标;解剖结构
中图分类号 S641.1 文献标识码 A
Effects of Short Period of High Temperature on the Main
Physiological Index and Anatomical Structure of Leaves
in Eggplants with Different Thermo-tolerance
LI Yanyan1,2, WANG Junqing2, LI Zhiliang1,3, SUN Baojuan1,3 *
1 Vegetable Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou, Guangdong 510640, China
2 Pingdingshan University, Pingdingshan, Henan 467000, China
3 Guangdong Key Lab for New Technology Research of Vegetables, Guangzhou, Guangdong 510640, China
Abstract To study the different response mechanism to high temperature of different thermo-tolerance eggplant, thermo-tolerance eggplant inbreeding line 05-4 and thermo-sensitive inbreeding line 05-1 were used to investigate the changes in the membrane permeability, the concentrations of ascorbate(AsA), glutathione(GSH), soluble sugar, and anatomical structure under different period of high temperature stress(0, 6, 12, 18 h). The results showed that the increase of the relative electrolyte leakage in 05-4 was evidently lower than that of 05-1 under high temperature stress. The concentrations of AsA and GSH in thermo-tolerance line were significantly higher than those of in thermo-sensitiveline, what's more, the starting time of GSH increase in thermo-tolerance line was much earlier than that of in thermo-sensitive line; Simultaneously, the soluble sugar concentrations in 05-4 continuously increased, but in 05-1 increased at 6h, then decreased rapidly. Compared with the thermo-sensitive line, it was observed that the mesophyll cells of the thermo-tolerance line 05-4 were more compact under normal temperature. The swell and deformation of the mesophyll cells and chloroplast in thermo-resistant line-4 was later than that of in thermo-sensitive line 05-1. Meanwhile, the particles of polysaccharide starch-like in the chloroplast decreased at the earlier stage of high temperature treatment, and slightly increased at the last two stages of high temperature stress.
Key words Eggplant; High temperature stress; Physiological index; Anatomical structure
doi 10.3969/j.issn.1000-2561.2016.09.019
茄子(Solanum melongema L.)为喜温型蔬菜,在我国蔬菜生产上占有重要地位。茄子生长适宜温度为22~30 ℃,在35 ℃以上生长发育各个阶段都会表现出一定的高温伤害症状,如叶片灼伤、花器官发育不良、座果率下降、畸形果增多,进而导致产量和品质的下降[1-3]。高温会引起植物叶片生理代谢紊乱和细胞结构改变,对光合系统和抗氧化系统产生破坏[4]。高温胁迫对细胞的伤害之一是细胞膜透性提高,电解质外渗,因而电解质的渗漏率可以作为细胞受高温胁迫伤害程度的指标,它可用相对电导率表示[5]。AsA(抗坏血酸)和GSH(谷胱甘肽)能清除叶绿体内的活性氧,对叶绿体有一定的保护作用[6],氧自由基动态平衡被破坏,植物的结构与功能就可能受到损伤甚至出现死亡。渗透调节是植物忍耐和抵御高温逆境的重要生理机制之一,可溶性糖是备受关注的渗透调节物质[7]。关于持续高温胁迫对于茄子苗期生理指标的影响已有研究报道[3,8],但是短期高温胁迫对不同耐热性茄子苗期主要生理指标以及叶肉细胞解剖结构的影响尚未见报道。本实验以热敏茄子品系05-1和耐热茄子品系 05-4为植物材料,通过测定短期高温胁迫条件下叶片主要生理指标,结合观察叶肉细胞解剖结构,研究其对高温胁迫的响应,比较耐热和热敏品系的变化差异,以期为探讨茄子高温胁迫响应机制奠定基础。
1 材料与方法
1.1 材料
所用的茄子材料为广东省农业科学科院蔬菜研究所选育的苗期高温胁迫鉴定及田间自然高温开花结实鉴定均表现为耐热的亲本自交系05-4和热敏感的亲本自交系05-1[2-3]。其中05-4为华南特色紫红长茄骨干系亲本自交系,05-1为北方茄子类型中分离出来的自交系。
1.2 方法
1.2.1 植物材料的处理 供试品系的种子经催芽后,采用穴盘育苗,待幼苗具4~5片真叶时放入人工智能光照培养箱,昼夜温度为28 ℃/25 ℃,光/暗周期为12 h/12 h预培养3 d,湿度保持在70%~80%。然后,将材料分为两组,一组进行高温43 ℃处理,另一组仍在原培养条件下生长作对照,湿度保持不变。每处理3次重复,每个重复至少20株。分别在高温胁迫0、2、6、12、18 h取材,取样部位为植株茎端开始数第3片真叶。
1.2.2 相对电导率的测定 参照刘鸿先等[8]和贾开志等[9]的方法,略加修改,打孔器规格不一样,但取的叶片面积是一样的。幼苗经高温胁迫后,取相同部位叶片,用直径1.0 cm打孔器在茄子叶片上取10个小圆片,放入试管中,加入蒸馏水20 mL,静置2.5 h后,测定初始电导率(R1);80 ℃水浴10 min,冷却至初始温度,测定电导率R2。两次电导率的比值即为相对电导率(R'=R1/R2)。
1.2.3 AsA含量的测定 参照Kampfenkel等[10]Fe3+还原法。
1.2.4 GSH含量的测定 参照Ellman[11]的方法,稍加修改,在提取样品的质量和试剂体积上做了同等比例的缩小。取样品液0.2 mL,加入150 mmol/L的NaH2PO4溶液(pH7.7)2.6 mL,混合后再加入DTNB试剂(75.3 mg DTNB 溶于30 mL、0.1 mol/L 的磷酸缓冲液,pH6.8),以加磷酸缓冲液代替DTNB试剂作空白,摇匀,于30 ℃保温5 min,然后测定412 nm波长下的光吸收值。
1.2.5 可溶性糖含量的测定 采用蒽酮法[12]。
1.2.6 制片及解剖结构观察
(1)半薄切片法及甲苯胺蓝染色。参照李正理[13]的方法。取高温处理不同时间的茄子叶片(选取处理和对照植株从茎端开始数第3片叶,于叶片中部主脉与边缘取约4 mm长,1 mm宽的小组块),迅速固定于0.2 mol/L磷酸缓冲液(pH7.2)配制的4%戊二醛中,Epon812环氧树脂包埋,奥地利Reichert-Jung超薄切片机切片,切片厚2 μm。用0.05%甲苯胺蓝染色45 s,中性树胶封片,Leica DMLB显微镜观察,Leica DFC320数码相机照相。
(2)多糖类的组织化学定位。参照匡海学[14]的方法。半薄切片采用高碘酸-席夫试剂(PAS)进行反应,在Leica DMLB显微镜下观察拍照。
2 结果与分析
2.1 高温胁迫对茄子幼苗叶片相对膜透性的影响
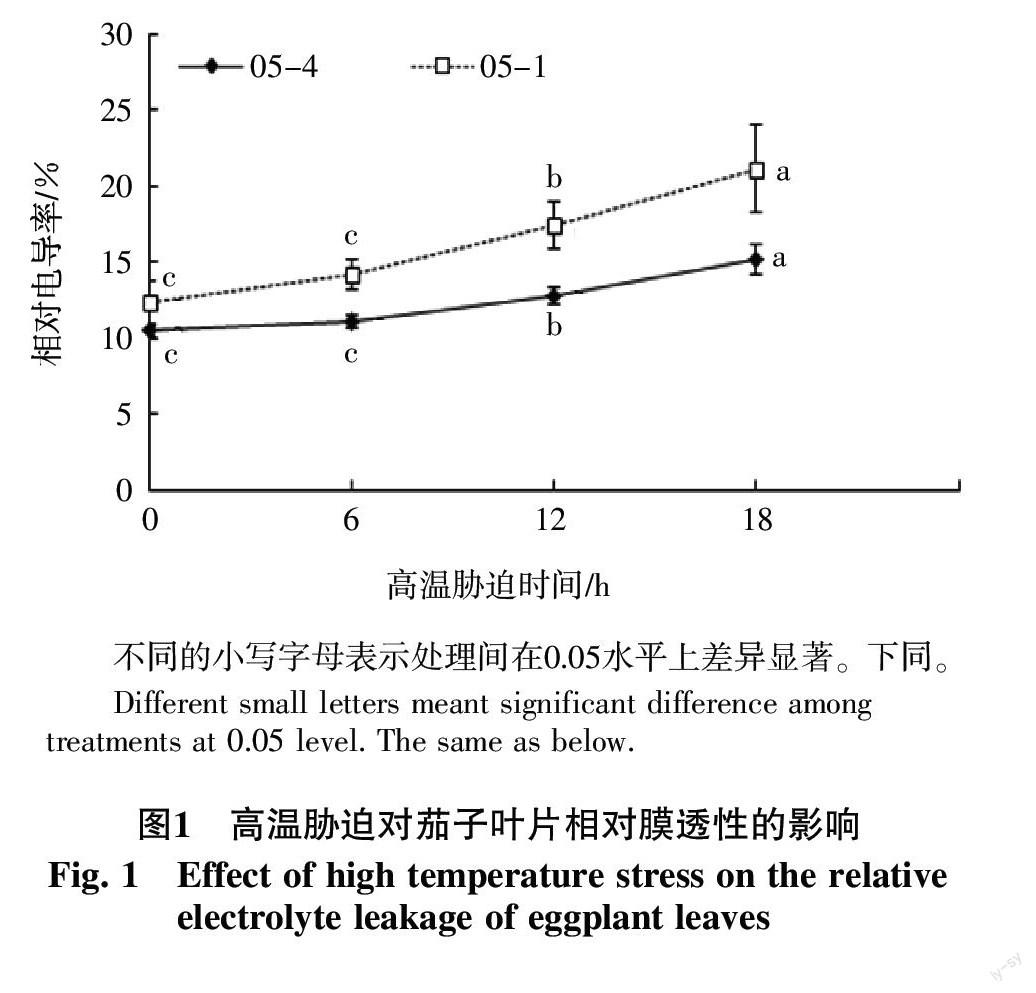
从图1可知,在高温胁迫过程中,05-1和05-4茄子幼苗叶片相对膜透性均表现出上升趋势,高温胁迫18 h相对膜透性都达到最大,但耐热品系05-4比热敏品种05-1提高幅度小,前者为43.4%,后者为71.7%,说明耐热品系05-4细胞膜较稳定,受热害程度较轻。
2.2 高温胁迫对茄子幼苗叶片AsA和GSH含量的影响
图2表明,随着高温处理时间的延长,05-1和05-4茄子幼苗叶片AsA的含量达到最大后下降;与对照0 h相比,高温胁迫6 h AsA含量在耐热和热敏品系中均升高,之后随着胁迫时间的延长逐渐下降,且在整个高温胁迫期间耐热品系AsA含量保持着较热敏品系高的趋势。相对0 h而言,高温胁迫6 h时GSH含量变化在05-1和05-4中相反,前者显著降低,后者显著升高;随着高温胁迫时间延长二者均表现缓慢上升,但耐热品系一直显著高于热敏品系。上述结果说明短期高温胁迫过程中耐热品系05-4 AsA和GSH含量的升高可以降低氧化胁迫对细胞的破坏程度,从而表现出较好的耐热性。
2.3 高温胁迫对茄子幼苗叶片可溶性糖含量的影响
植物体内的可溶性糖有利于降低细胞的渗透势,减少水分的损失。从图3可以看出,高温胁迫初期,05-1和05-4可溶性糖含量都显著增加,但热敏品种随高温处理时间的延长出现了显著下降的趋势,而耐热品系可溶性糖含量一直处于增加的趋势,高温胁迫12 h后,耐热品系可溶性糖含量显著高于热敏品系。说明随着胁迫时间的持续耐热品系05-4的可溶性糖含量保持增加并最终高于热敏品系05-1。因此推测高温胁迫下可溶性糖含量变化趋势与品种耐热性存在一定的相关性。
2.4 高温胁迫下茄子幼苗叶片组织结构和叶绿体中贮存物质的变化
从叶片形态上看,05-4与05-1相比,叶色浓绿,叶片较厚,具体表现为对用于电导率测定的1 cm孔径的圆片称重,05-4的每20个圆片重量为(0.434 8±0.000 8)g,05-1的每20个圆片重量为(0.384 4±0.000 3)g,二者差异显著。从叶片半薄切片显微观察结果可见,茄子叶片上、下表皮各有一层细胞组成,在横切面上成方形或长方形(图4-A、B);与热敏品系05-1相比(图4-B),耐热品系05-4栅栏组织和海绵组织中的叶肉细胞排列都更加紧密整齐,胞间隙小(图4-A),这有利于保持水分,降低高温失水伤害。
未高温胁迫时,叶绿体紧密排列在叶肉细胞膜的周围。在高温胁迫2 h时,热敏品系05-1叶肉细胞表现出轻微的质壁分离,出现不同程度的细胞膨胀,叶绿体膨大变形,分布位置也发现了明显变化,部分叶绿体转移至细胞质中央(图4-D),耐热品系叶肉细胞也出现了膨胀,但细胞结构正常,叶绿体依然沿细胞壁边缘分布(图4-C)。随着高温胁迫时间的延长,热敏品系05-1叶片叶肉细胞的叶绿体膨胀程度加重,破坏的数量增多,且叶绿体排列出现无规则状态;叶片栅栏组织细胞畸形,且因膨胀缩短加剧,且排列紊乱,并有海绵组织细胞垛叠的现象(图4-F、H、J);耐热品系高温胁迫12 h内叶肉细胞形态结构变化并不显著,且叶绿体排列变化不大(图4-E、G),18 h时叶肉细胞的变形程度加重(图4-I)。
高碘酸-席夫试剂(PAS)反应可对不溶性多糖进行定位,细胞内的糖原或多糖会形成红色染料而沉积于细胞中,颜色深浅与多糖含量成正比。淀粉是在叶绿体或淀粉体中通过一系列酶促反应合成的。在正常生长温度下,茄子叶肉细胞叶绿体和细胞质内可以观察到淀粉颗粒的存在(图5-A、B),而且耐热品系的密度高于热敏品系;高温胁迫2 h后,耐热品系和热敏品系叶肉细胞内的淀粉颗粒密度均降低且淀粉颗粒变小(图5-C、D),耐热仍高于热敏;高温胁迫6 h时,耐热品系和热敏品系叶肉细胞内都基本观察不到淀粉颗粒的存在(图5-E、F);高温胁迫12 h和18 h后淀粉颗粒又有上升的趋势(图5-G、H、I、J)。
3 讨论与结论
高温胁迫的本质就是氧化胁迫,在正常情况下细胞内活性氧的产生与清除处于动态平衡,不会引起植物细胞伤害,但在高温胁迫条件下,活性氧积累会导致植物代谢失活、细胞死亡、光合作用速率下降[15-16]。温度逆境对植物的伤害涉及到一系列生理生化变化,而由高低温导致的活性氧积累及其所引起的氧化胁迫被认为是植物受冷热伤害的重要原因[17],高温逆境对植物细胞的伤害多为膜系统受损,直观表现为电解质泄漏,电导率上升[18]。本研究表明,在短期高温胁迫处理过程中,耐热品系05-4相对膜透性较热敏品系05-1低,孙保娟等[19]在持续高温胁迫对不同耐热性茄子膜相对透性的影响中也得到了相同的结果。在植物叶绿体和细胞质中,AsA主要通过抗坏血酸-谷胱甘肽(AsA-GSH)循环清除H2O2[20],从而在维护膜结构的完整性和防御膜脂过氧化中起着重要作用。高AsA含量不仅能提高作物的品质,而且增加了对逆境的抗性[21-22]。从本研究结果来看,高温胁迫初期,耐热品系05-4 GSH含量显著上升,同时相同处理条件下,05-4较热敏品系05-1 AsA含量高。由于较高含量AsA 增强了细胞清除活性氧自由基的能力,所以不但减轻了其对膜系统的攻击与破坏,也维持正常的细胞膜透性。高温胁迫初期耐热品系茄子叶片GSH含量表现出先上升,原因可能是由于胁迫初期其合成能力增强,对逆境响应迅速,但随着胁迫加剧,因为在清除逆境导致的活性氧积累中起主要作用的AsA-GSH循环需要大量GSH的参与[23-24],导致胁迫后期GSH水平变化不大。而热敏品系05-1高温胁迫下GSH含量表现出先下降但随后上升,说明热敏品系中GSH对逆境响应迟钝,而后期GSH含量上升可能是高温损伤的结果。总体表现出热敏品系对高温逆境的适应能力明显较弱。
另外还观察到,耐热品系的叶肉细胞排列紧密,这一结构特点均与保持水分、避免高温失水伤害相适应。这些特征表明在高温下不易造成叶片水分过度蒸发而发生细胞内部结构的变化,造成叶片损伤。这些都体现了旱生植物叶片的结构特征[25]来抵御热伤害。高温胁迫引起植物体各个细胞和亚细胞结构紊乱,从而对植物产生伤害,特别是光合作用的主要器官叶片对高温胁迫较为敏感[26]。高温胁迫下叶肉细胞出现不同程度细胞膨胀变形,这与病菌侵染的叶肉细胞观察结果相似[27],且热敏品系比耐热品系的较早出现,这也证明了前面测定耐热品种较高含量的AsA和GSH对细胞膜的完整性和细胞正常功能的保护作用。
高温胁迫下耐热和热敏茄子品系叶片中叶绿体淀粉颗粒减少,这与豇豆(Vigna unguiculata)的组织培养细胞、菜豆幼苗和番茄花期高温胁迫处理时观察到质体内淀粉颗粒变化一致[28-29]。同时测定耐热品系比热敏品系可溶性糖的含量有增高的趋势,推测此方式有利于增强抗高温的能力。热敏品系在高温胁迫12 h出现淀粉颗粒的大量积累,耐热品种出现则相对较晚,进而后者表现出相对强的抗性。淀粉颗粒减少累积的原因可能是高温胁迫影响叶片光合作用, 在处理初期,光合产物形成少,而呼吸作用加剧消耗大;而随着高温胁迫时间的增长,光合同化物的利用率下降或呼吸作用降低所致淀粉颗粒增大,或者是它们共同作用的结果,张洁等[30]认为是植株韧皮部胼胝体增多,堵塞维管束,影响同化产物在韧皮部的运输,这一原因有待研究。
综上所述,不同耐热性茄子在高温胁迫下有关生理指标和解剖结构的变化是不同的,这些不同在一定程度上揭示了茄子耐热生理和结构特征的基础。
参考文献
[1] 王炳天. 茄子高产栽培[M]. 北京: 金盾出版社, 1992: 10-12.
[2] 李植良, 孙保娟, 罗少波, 等. 高温胁迫下华南茄子的耐热性表现及其鉴定指标的筛选[J]. 植物遗传资源学报, 2009, 10(2): 244-248.
[3] 孙保娟, 黎振兴, 罗少波, 等.持续高温胁迫对茄子幼苗几个主要生理指标的影响[J]. 热带作物学报, 2010, 31(9): 1 528-1 534.
[4] 张宗申. 高温胁迫下辣椒叶片GSH和ASA的变化[J]. 中国农业科学, 2001, 24(1): 213-217.
[5] Ahrens M J, Ingram D L. Heat tolerance of citrus leaves[J]. Hort Sci, 1988, 23: 747-748.
[6] 阎成士, 李德全, 张建华. 植物叶片衰老与氧化胁迫[J]. 植物学通报, 1999, 16(4): 398-404.
[7] 张显强, 罗在柒, 唐金刚, 等. 高温和干旱胁迫对鳞叶藓游离脯氨酸和可溶性糖含量的影响[J].广西植物, 2004, 24 (6): 570-573.
[8] 刘鸿先, 曾韶西, 王以柔, 等. 低温对不同耐寒力的黄瓜 (Cucumis sativus L.)幼苗子叶细胞器的超氧化物歧化酶(SOD)的影响[J]. 植物生理学报, 1985, 11(1): 48-57.
[9]贾开志, 陈贵林. 高温胁迫下不同茄子品种幼苗耐热性研究[J]. 生态学杂志, 2005, 24(4): 398-401.
[10] Kampfenkel K, Van M M, Inzè D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J]. Anal Biochem, 1995, 225: 165-167.
[11] Ellman G L. Tissue sulfhydryl groups[J]. Arch Biochem Biophys, 1959, 82: 70-77.
[12] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 150-170.
[13] 李正理. 植物制片技术[M]. 北京: 科学出版社, 1978: 76-94.
[14] 匡海学. 中药化学[M]. 北京: 中国中医药出版社, 2003: 121-140.
[15] Bowler C, Montagu M V I D. Superoxide dismutase and stress tolerance[J]. Annu Rev Plant Physiol Plant Mol Boil, 1992, 43: 83-116.
[16] Mallick N. Reactive oxygen species and antioxidants: response of algal cells[J]. J Plant Physiol, 2000, 157: 183-193.
[17] Xu S, Li J L, Zhang X Q, et al. Effects of heat acclimation pretreatment on changes of membrane lipidper oxidation, antioxidant metabolites, and ultrastructure of chloroplasts in two cool season turfgrass species and heat stress[J]. Environ Exp Bot, 2006, 56: 274-285.
[18] 吴国胜, 曾婉虹, 王永健, 等.细胞膜热稳定性及保护酶和大白菜耐热性的关系[J]. 园艺学报, 1995, 22(4): 353-358.
[19] 孙保娟, 李植良, 黎振兴, 等. 茄子耐热性苗期鉴定研究[J]. 广东农业科学, 2007(2): 27-29.
[20] Scandqlios J G. Oxidative Stress and the Molecular Biology of Antioxidant Defenses[M]. New York: Cold Spring Harbor Laboratory Press, 1997: 343-406.
[21] Chen Z, Gallie D R. Increasing tolerance to ozone by elevating foliar ascorbic acid confers greater protection against ozone than increasing avoidance[J]. Plant Physiol, 2005, 138: 1 673-1 689.
[22] Mahan J R, Wanjura D F. Seasonal patterns of glutathione and ascorbate metabolism in field grown cotton under water stress[J]. Crop Sci, 2005, 45: 193-201.
[23] Mahan J R, Wanjura D F. Seasonal patterns of glutathione and ascorbate metabolism in field grown cotton under water stress[J]. Crop Sci, 2005, 45: 193-201.
[24] Torres-Franklin M L, Contour-Ansel D, Zuily-Fodil Y, et al. Molecular cloning of glutathione reductase cDNAs and analysis of GR gene expression in cowpea and common bean leaves during recovery from moderate drought stress[J]. J Plant Physiol, 2008, 165: 514-521.
[25] 苗 琛, 利容千, 王建波. 热胁迫下不结球白菜和甘蓝叶片组织结构的变化[J]. 武汉植物学研究, 1994, 12(3): 207-211.
[26] Krause G H. Relative thermostability of the chloroplast envelope[J]. Planta, 1975, 127: 286-298.
[27] 刘文娜, 汪 矛, 孔令安, 等. TM侵染番茄引起的细胞结构变化及细胞程序化死亡[J].中国农业大学学报, 2003, 8(3): 19-23.
[28] Dylewski D P, Singh N K, Cherry J H. Effects of heat shock and thermoadaptation on the ult rastructure of cowpea(Vigna unguiculata)cells[J]. Protoplasma, 1991, 163: 125-129.
[29] 王光耀, 刘俊梅. 菜豆四个不同抗热性品种的气孔特性[J]. 农业生物技术学报, 1997(3): 267-270.
[30] 张 洁, 李天来.日光温室亚高温对番茄光合作用及叶绿体超微结构的影响[J]. 园艺学报, 2005, 32 (4): 614-619.
