盐胁迫对甜椒种子萌发、幼苗生长及PSⅡ光化学特性的影响
2016-05-30张天翔林宗铿林艺华
张天翔 林宗铿 林艺华
摘 要 采用不同浓度的NaNO3、Na2SO4及其混合盐模拟次生盐胁迫,对甜椒种子和幼苗进行处理,研究次生盐分胁迫对甜椒种子萌发、幼苗生长及光系统Ⅱ(PSⅡ)光化学特性的影响。结果表明:盐分胁迫显著抑制了甜椒种子萌发和幼苗生长,表现为盐分胁迫下甜椒种子发芽指数、胚根长度和侧根数、幼苗株高和根长显著下降,叶片相对电导率和丙二醛(MDA)含量显著增大,且盐分浓度越大,甜椒所受抑制程度越强。随着盐分浓度的增大,甜椒叶片PS最大光化学效率(φPo)、用于电子传递的量子产额(φEo)、捕获的激子将电子传递到电子传递链中超过QA- 的其它电子受体的概率(φo)、光合性能指数(PIABS)、光合推动力(DFABS)逐渐降低,反应中心吸收的光能用于热耗散的量子比率(φDo)逐渐升高。与φPo相比,PIABS能更好地反应盐分胁迫对甜椒叶片光合性能的影响。
关键词 甜椒;次生盐胁迫;种子萌发;幼苗生长;叶绿素荧光
中图分类号 Q949.777.7 文献标识码 A
保护地土壤由于地表长期覆盖栽培、作物种类单调及过量施肥等原因,容易导致土壤次生盐渍化问题,目前土壤次生盐渍化已成为蔬菜设施栽培中普遍存在的问题[1]。然而,中国不同地区次生盐渍化土壤中的盐分组成存在一定差异[2]。薛继澄等[3]研究发现,温室、大棚土壤盐分中,阳离子以Ca2+为主,阴离子则以NO3-为主;李先珍等[4]发现大棚土壤中SO42- 离子积累量较大;冯永军等[5]认为设施土壤中Ca2+、K+、NO3- 及SO42- 增幅较大;刘媛媛等[6]的研究表明,施用有机肥使设施土壤中的K+、Na+、Cl- 等离子含量增加。
甜椒(Capsicum annuum L. var. grossum)是茄科(Solanaceae)辣椒属能结甜味浆果的一个亚种,富含维生素、有机酸等营养物质,近年已逐渐成为设施栽培的主要茄果类蔬菜之一[7]。有关盐分胁迫对甜椒生长发育影响的研究主要集中在NaCl胁迫[7-8]的影响方面,而关于非NaCl为主的次生盐胁迫对甜椒的影响尚未见报道。本研究以甜椒种子和幼苗为试材,采用NaNO3和Na2SO4 2种单盐及其混合盐来模拟次生盐胁迫,研究不同盐分胁迫对甜椒种子萌发、幼苗生长及其光合性能的影响,探索甜椒的早期耐盐性反应及变化规律,以期为甜椒在次生盐胁迫下的耐盐生理研究及抗盐育种提供理论依据。
1 材料与方法
1.1 材料
供试甜椒品种为‘中椒105号,由北京中蔬园艺良种研究开发中心提供。
1.2 方法
1.2.1 试验设计 (1)盐胁迫设计。分别采用NaNO3、Na2SO4及其混合盐(按摩尔浓度1 ∶ 1混合)模拟盐胁迫,设5个浓度水平,分别为0(CK)、50、100、150、200 mmol/L。
(2)种子胁迫处理。选取色泽好、饱满度一致的甜椒种子,经55 ℃温水浸泡20 min后,自然冷却至室温,然后进行培养皿纸床发芽试验。在直径15 cm的培养皿底部铺2层滤纸后,分别加入10 mL各浓度的盐处理液,以加入蒸馏水为对照,每处理播种100粒种子,重复3次,置于28 ℃恒温培养箱中培养,每天补充蒸发消耗的水量并记录发芽情况。
(3)苗期胁迫处理。将55 ℃温水浸泡过的甜椒种子播种于10 cm×10 cm的营养钵中,以蛭石和珍珠岩(3 ∶ 1)为基质,每3 d浇1/2 Hoaglands营养液1次;待幼苗长出3~4片真叶后,开始浇完全营养液;幼苗长至五叶一心时,进行盐胁迫处理,处理液为NaNO3、Na2SO4及其混合盐的Hoaglands营养液,各处理液的盐终浓度分别为0(CK,仅浇Hoaglands营养液)、50、100、150、200 mmol/L,重复3次;培养室温度为(28±1)℃,光照12 h/d,光照强度100 μmol/(m2·s)。苗期盐胁迫处理15 d后,取鲜株和心叶下第3~4片叶进行各项指标测定。
1.2.2 测定方法 (1)种子萌发指标的测定。种子播种后第7 天统计其发芽势;于第14天统计其发芽率与发芽指数,并每皿随机取15株幼苗用于测定主根长及侧根数。
发芽势=(7 d内发芽的种子数/供试种子数)×100%;
发芽率=(发芽种子数/供试种子数)×100%;
发芽指数=∑(Gt/Dt)(Gt为在第t天的发芽数,Dt为相应的天数)。
(2)苗期生长指标和生物量的测定。每处理随机取5棵植株,测量其株高、根长、地上部和根部鲜重;同时将地上部和根部放入105 ℃烘箱中杀青15 min,之后于70 ℃烘干至恒重,测量地上部和根部干重,并计算生物产量和地上部、根部含水量[9]。
生物产量=地上部干重+根干重
含水量=(鲜重-干重)/鲜重×100%
(3)幼苗叶片细胞质膜相对透性和膜质过氧化水平的测定。采用电导仪法[9]测定叶片的相对电导率,表示细胞质膜相对透性。采用硫代巴比妥酸(TBA)法[10]测定叶片丙二醛(MDA)含量,表示膜质过氧化水平。
(4)幼苗叶片快速叶绿素荧光诱导动力学曲线的测定与JIP-测定(JIP-test)分析。用Handy PEA植物效率仪测定叶片的快速叶绿素荧光诱导动力学(OJIP)曲线,测定前将叶片用叶夹暗适应30 min,将饱和光强设为2 500 μmol/(m2·s),从10 μs开始记录荧光信号,至1 s结束,每处理测定5株。
根据李鹏民等[11]和孙永平等[12]方法对获得的OJIP曲线进行JIP-测定(JIP-test)分析,设定50 μs时荧光为Fo、2 ms时荧光为Fj、30 ms时荧光为Fi,并按照Srivastava 等[13]方法计算以下参数:光系统Ⅱ(PSⅡ)最大光化学效率(φPo)、捕获的激子将电子传递到电子传递链中超过QA- 的其它电子受体的概率(ψo)、反应中心吸收的光能用于电子传递的量子产额(φEo)、反应中心吸收的光能用于热耗散的量子比率(φDo)、以吸收光能为基础的光合性能指数(PIABS)、以吸收光能为基础的推动力(DFABS)。
1.3 统计分析
所有试验数据均以3次重复的平均值±标准误差(SE)表示,采用Microsoft Excel、DPS软件对数据进行处理,用Duncans新复极差法进行显著性分析。
2 结果与分析
2.1 盐胁迫对甜椒种子萌发的影响
由表1可知,在NaNO3、Na2SO4及其混合盐胁迫下,当盐浓度为50 mmol/L时,甜椒种子发芽势与对照相比差异不显著,而随着盐浓度的升高,盐分胁迫则会对发芽势产生显著的抑制,且盐浓度越高,抑制作用越强。从甜椒种子发芽率来看,除50 mmol/L NaNO3的处理外,其他盐分胁迫处理对发芽率均有显著的抑制作用,且盐分胁迫浓度越高,抑制作用越强。所有盐分胁迫处理的甜椒种子发芽指数均显著低于对照组,且盐分胁迫浓度越高,对发芽指数的抑制作用越强。从总体上看,NaNO3、Na2SO4及其混合盐对甜椒种子发芽势、发芽率、发芽指数的影响程度均为:Na2SO4>NaNO3+Na2SO4>NaNO3。
在盐分胁迫下,甜椒胚芽的主根长度均显著低于对照,且随着盐分浓度的增加,主根长度显著降低(表1)。盐分胁迫对甜椒胚芽的侧根生长有显著的抑制作用,盐分浓度越高,侧根生长受抑制程度越大,当NaNO3浓度为200 mmol/L、Na2SO4及NaNO3+Na2SO4混合盐浓度≥150 mmol/L时,无侧根长出。从总体上看,3种盐分对甜椒胚芽的主根长度及侧根数的影响程度均为:NaNO3+Na2SO4>Na2SO4>NaNO3。
2.2 盐胁迫对甜椒幼苗生长指标的影响
由表2可知,盐分胁迫对甜椒幼苗的株高和根长有明显的抑制作用,且随盐分浓度的增加,抑制作用越大。盐分浓度较低(50 mmol/L)时,NaNO3、Na2SO4及其混合盐对甜椒幼苗株高的抑制幅度分别为9.08%、13.15%、16.55%,对根长的抑制幅度分别为5.40%、8.48%、12.88%,表明低浓度盐分胁迫对株高的影响大于对根长的影响。而盐分浓度较高(200 mmol/L)时,NaNO3、Na2SO4及其混合盐对甜椒幼苗株高的抑制幅度分别为19.69%、27.32%、29.87%,对根长的抑制幅度分别为24.10%、30.91%、35.48%,表明高浓度盐分胁迫对根长的影响大于对株高的影响。从总体上看,3种盐分对甜椒幼苗株高和根长的影响程度为:NaNO3+Na2SO4>Na2SO4>NaNO3。
随着NaNO3、Na2SO4及其混合盐浓度的增加,甜椒幼苗地上部干重、根干重、生物产量与对照相比逐渐降低(表2)。除50 mmol/L NaNO3处理的地上部干重和生物产量外,其他各盐分胁迫处理的地上部干重、根干重及生物产量均显著低于对照。当NaNO3+Na2SO4混合盐浓度≥150 mmol/L时,根冠比显著低于对照,而其他盐分胁迫处理的根冠比与对照相比无显著差异,这说明浓度较大的NaNO3+Na2SO4混合盐对根部干重的抑制要强于其对地上部干重的抑制。当盐分浓度为200 mmol/L时,3种盐分胁迫下甜椒幼苗地上部干重分别较对照低约33.33%、35.00%、43.33%,根干重分别较对照低约31.25%、43.75%、62.50%。从总体上看,3种盐分对甜椒幼苗地上部和根部干物质积累的影响程度均为:NaNO3+Na2SO4>Na2SO4>NaNO3。
从图1可以看出,在总体趋势上,盐胁迫下甜椒幼苗地上部、根部的含水量均随盐分浓度的增加而逐渐降低。当盐分浓度达200 mmol/L时,3种盐分胁迫下地上部、根部的含水量均显著低于对照,且根部含水量的降幅大于地上部含水量的降幅,这表明在高浓度盐分胁迫下根部水分含量所受到的抑制作用比地上部水分含量更大。
2.3 盐胁迫对甜椒幼苗叶片细胞质膜透性的影响
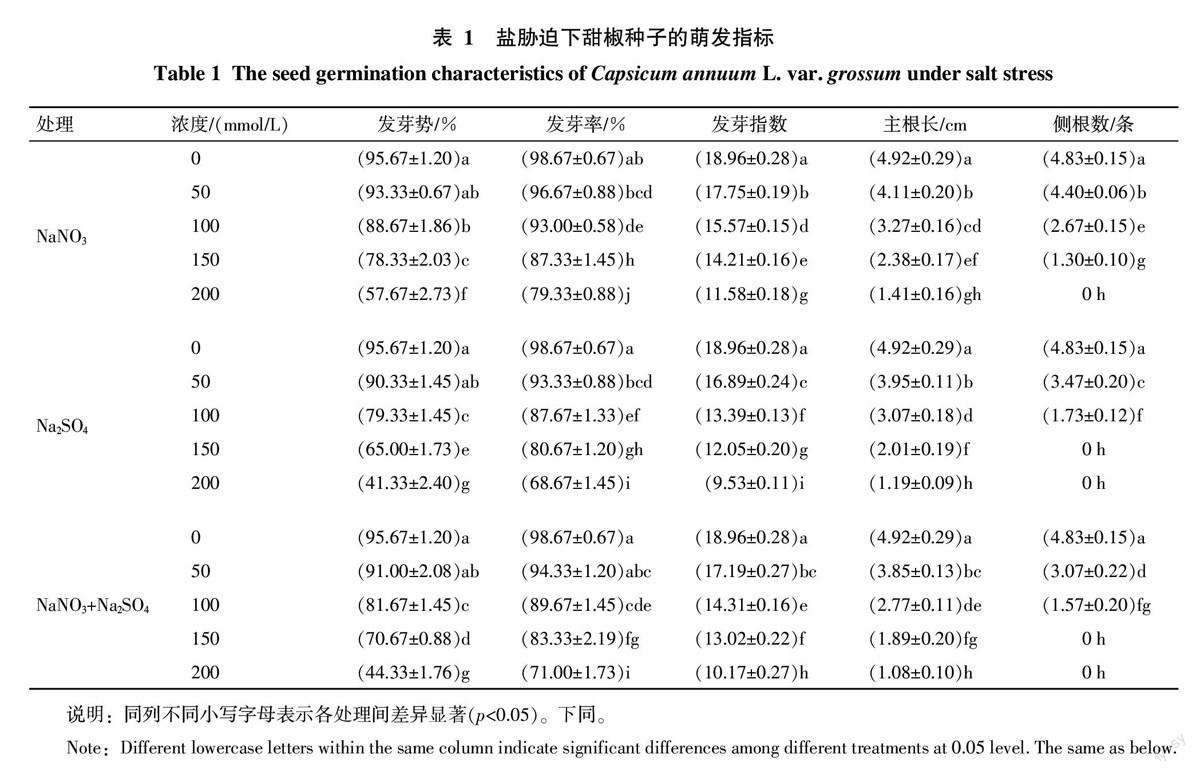
逆境胁迫下植物细胞膜系统往往受到伤害,导致质膜透性加大,细胞内离子外渗量增多,渗透液电导率增大[9]。由图2可知,当盐分浓度为50 mmol/L时,甜椒幼苗叶片渗透液的相对电导率与对照无显著差异;而当盐分浓度≥100 mmol/L时,各胁迫处理的相对电导率均显著大于对照,且随盐分浓度的增大,相对电导率也显著增大,这表明随盐分胁迫强度的增大,甜椒幼苗叶片细胞膜所受伤害增大,膜透性增大。在200 mmol/L的盐分胁迫下,3种盐分处理间的相对电导率差异显著,对相对电导率的影响程度为Na2SO4>NaNO3+Na2SO4>NaNO3,说明在高浓度盐分胁迫下,Na2SO4对细胞膜的伤害程度最大,NaNO3+Na2SO4混合盐的伤害程度次之,NaNO3的伤害程度最小。
2.4 盐胁迫对甜椒幼苗叶片MDA含量的影响
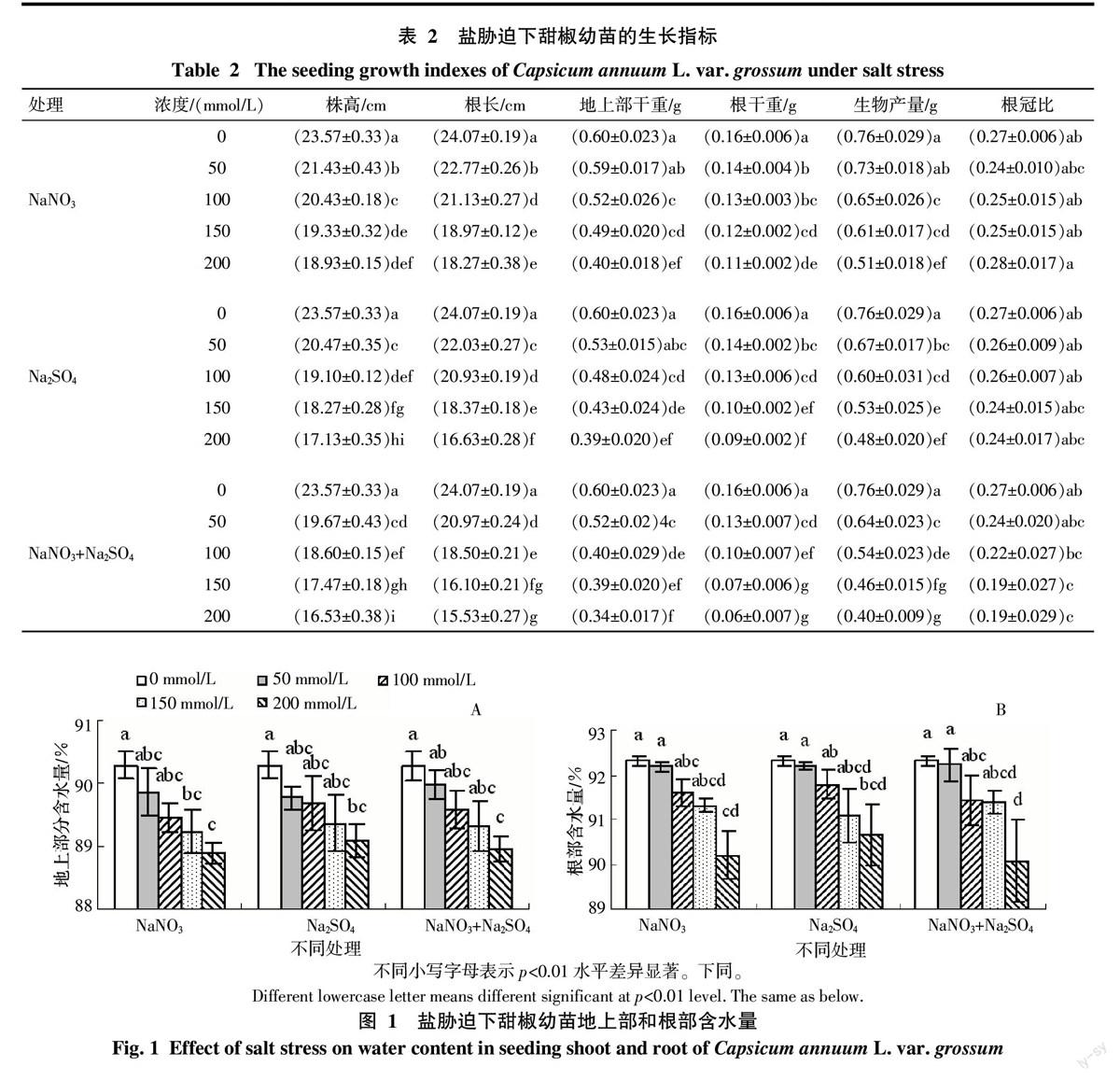
MDA是植物逆境胁迫下产生的膜脂过氧化的产物,常用作测定膜脂过氧化水平的指标[10]。由图3可知,盐胁迫下甜椒幼苗叶片的MDA含量显著大于对照,且随盐分浓度的增大,MDA含量也显著增大,这表明甜椒幼苗叶片的膜脂过氧化程度与盐分胁迫强度显著相关,盐分浓度越大,膜脂过氧化程度越高,受到的伤害越大。当盐分浓度为50 mmol/L时,3种盐分处理间甜椒幼苗叶片的MDA含量没有显著差异;而当盐分浓度为200 mmol/L时,3种盐分处理间的MDA含量差异显著,具体为Na2SO4>NaNO3+Na2SO4>NaNO3,这表明高浓度盐分胁迫下,3种盐分对叶片膜脂过氧化水平的影响程度为Na2SO4>NaNO3+Na2SO4>NaNO3。
2.5 盐胁迫对甜椒幼苗叶片快速叶绿素荧光诱导动力学曲线及其参数的影响
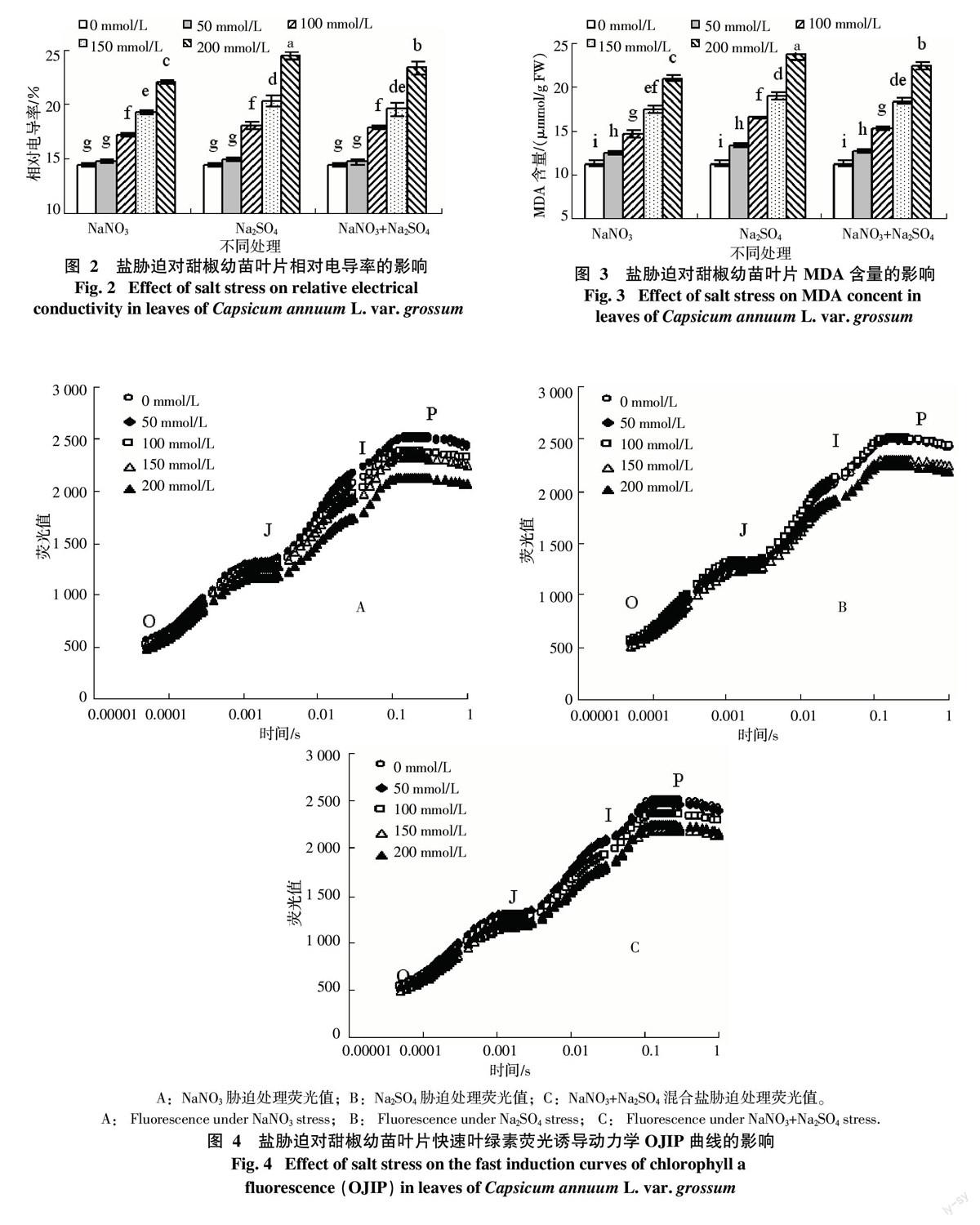
经暗适应的甜椒幼苗叶片暴露在饱和脉冲光强后,其叶绿素荧光值迅速上升,之后略有下降,呈现出典型OJIP四相型曲线(图4)。在3种不同盐分胁迫下,甜椒叶片OJIP曲线的变化趋势大体相同。当盐分浓度≥150 mmol/L时,J、I、P相均有不同程度的下降,其中I、P相降幅较大,且除200 mmol/L NaNO3+Na2SO4混盐处理外,其降幅均随盐分浓度增大而变大,而低浓度盐分处理与对照相比无明显变化。
2.5.1 盐胁迫对能量分配比率的影响 表3反映了在不同盐分不同浓度处理下甜椒叶片的量子产额或能量分配比率发生的变化,其中,φPo表示经暗适应后的PSⅡ最大光化学效率,相当于Fv/Fm;ψo表示捕获激子将电子传递到电子传递链QA(下游的其他电子受体的概率;φEo表示反应中心吸收的光能用于电子传递的量子产额;φDo表示反应中心吸收的光能用于热耗散的量子比率。从表3可知,在盐分胁迫下,φPo随盐分浓度的升高而呈现逐渐下降的趋势;NaNO3+Na2SO4混合盐胁迫下φPo均显著低于对照;而当NaNO3浓度≥150 mmol/L或Na2SO4浓度≥100 mmol/L时,φPo也显著低于对照。这表明随着盐分胁迫浓度的增大,甜椒叶片PSⅡ反应中心活性受到的抑制作用增大,光合作用能力逐渐下降,最大光化学效率逐渐降低。各盐分胁迫处理的ψo和φEo均显著低于对照,且大体上盐分浓度越大,ψo和φEo的降幅越大,说明在盐分胁迫下,PSⅡ受体侧电子传递能力受到明显抑制,光反应活性显著下降。在盐分胁迫下,φDo随盐分胁迫浓度的增大而呈现逐渐升高的趋势,由此可见,在盐分胁迫下甜椒叶片吸收的光能中用于热耗散的能量增加。
2.5.2 盐胁迫对光合性能指数(PIABS)和推动力(DFABS)的影响 由图5可知,3种盐分胁迫下,各盐分处理的以吸收光能为基础的光合性能指数(PIABS)和以吸收光能为基础的光合推动力(DFABS)均显著低于对照。随着盐分胁迫浓度的升高, PIABS和DFABS大体上都是呈现逐渐下降的变化规律,虽然150 mmol/L Na2SO4处理比100 mmol/L Na2SO4处理有所升高,但两处理间差异不显著。在200 mmol/L NaNO3、Na2SO4及其混合盐处理下,PIABS分别比对照下降了27.40%、46.73%、27.76%,DFABS分别比对照下降了37.07%、78.74%、40.52%。这说明在盐分胁迫条件下,甜椒叶片PSⅡ反应中心活性受到明显抑制,其光合作用能力明显下降。总体而言,3种盐分对甜椒叶片PSⅡ活性的抑制程度为Na2SO4>NaNO3+Na2SO4>NaNO3。
3 讨论与结论
本研究结果表明,在盐分胁迫下甜椒种子的各项萌发指标均呈不同程度的下降趋势,其中发芽指数、主根长及侧根数均显著降低,且盐分胁迫浓度越高,对种子萌发的抑制作用越强,这与陈银萍等[14]、乔佩等[15]及郑佳秋等[16]的研究结果一致。张万钧等[17]认为渗透胁迫是抑制种子萌发的重要因素之一,而盐离子大量积累从而抑制细胞酶活性也是种子萌发率降低的原因之一。Jaleel等[18]研究发现,盐胁迫还会降低种子储藏物质的利用率,导致种子萌发受影响。
盐胁迫下,植物根系最早感受逆境胁迫信号,并产生相应的生理反应,导致植物根系生长受抑制,继而影响地上部生长[19]。本研究结果表明,盐分胁迫影响甜椒幼苗的多项生长指标,抑制了甜椒幼苗的生长,且随盐分浓度的增加,对生长指标的抑制作用越大,这与杨婷等[20]和李鸿文等[21]的研究结果相类似。另外,从本试验结果中的根长与株高、根部干重与地上部干重、根部水分含量与地上部水分含量等指标变化趋势对比来看,在高浓度盐分胁迫下,根系所受的抑制作用要大于地上部。这与卢艳敏等[22]和洪森荣等[23]的看法相一致,但也有研究者持不同的观点[24],其原因可能是由于试验材料种类、盐分种类等因素的差异造成的。
相对电导率是反映细胞膜透性的重要指标之一,MDA的含量可以作为衡量脂质过氧化水平的指标,表示细胞膜脂过氧化程度[25]。本研究结果表明,盐胁迫加剧了甜椒幼苗叶片细胞膜脂的过氧化程度,使细胞膜透性增强,导致相对电导率和MDA含量均显著大于对照,且随盐分浓度的增大,胁迫伤害进一步加大,相对电导率和MDA含量显著增大。陆銮眉等[26]研究发现盐胁迫下叶片的膜透性增强,MDA含量增加,这与本研究结果相似。魏国强等[27]的研究结果也表明不同盐浓度处理之间叶片MDA含量差异显著,盐胁迫下耐盐品种MDA含量显著低于不耐盐品种。
王丹等[28]研究发现,盐胁迫既可以直接影响植物的生长,也可以通过抑制光合作用而间接影响植物的生长。利用JIP-test可以快速无损地探测逆境胁迫对光合机构的影响[29-30]。本研究结果表明,盐分胁迫下甜椒叶片PSⅡ反应中心活性受到明显的抑制,随着盐分浓度的增大,最大光化学效率φPo逐渐降低,φDo逐渐升高,同时盐分胁迫下PSⅡ受体侧电子传递能力受到明显抑制,ψo和φEo均显著低于对照。盐分胁迫下光合性能指数PIABS和光合推动力DFABS均显著低于对照,且随着盐分浓度的升高,大体上都是呈现逐渐下降的变化规律。另外,本研究中还发现PIABS对盐分胁迫比较敏感,特别是低浓度盐胁迫下其变化比φPo更敏感,更能反映盐分胁迫对叶片光合机构的影响,这与刘炳响等[31]和许珍等[32]的研究结果相一致。
李鸿文等[21]认为,不同种类的盐胁迫对作物的毒性差异可能是由于不同的阴、阳离子类型对植物的作用机制不同。牛彩霞等[33]也认为不同阴离子钠盐对作物不同生育期的毒害作用机理及程度不相同。本研究证实,不同种类盐分胁迫对甜椒种子萌发和幼苗生长有不同程度的影响,3种盐分对甜椒种子发芽指数、细胞膜透性、膜脂过氧化、PSⅡ活性的影响程度均为:Na2SO4>NaNO3+Na2SO4>NaNO3,对胚根、幼苗生长指标的影响程度均为:NaNO3+Na2SO4>Na2SO4>NaNO3。总体而言,NaNO3胁迫对甜椒的影响最小,而Na2SO4胁迫对甜椒的影响程度要大于NaNO3,这与李海云等[34]的研究结果相类似。
综上所述,模拟次生盐胁迫下甜椒的种子萌发、胚根生长、幼苗生长都受到显著的抑制;次生盐胁迫会对甜椒幼苗叶片细胞膜造成损伤,使膜脂过氧化程度增大,并导致质膜透性增大;次生盐胁迫下甜椒幼苗叶片的PSⅡ活性受明显的抑制,导致其光合作用能力下降。不同种类的次生盐分对甜椒的影响有所差异,其中Na2SO4胁迫对甜椒的影响程度要大于NaNO3,而NaNO3胁迫对甜椒的影响最小。
参考文献
[1] 童有为, 陈淡飞. 温室土壤次生盐渍化的形成和治理途径研究[J]. 园艺学报, 1991, 18(2): 159-162.
[2] 李廷轩, 张锡洲, 王昌全, 等. 保护地土壤次生盐渍化的研究进展[J]. 西南农业学报, 2001, 14(S): 103-107.
[3] 薛继澄, 毕德义, 李家金, 等. 保护地栽培蔬菜生理障碍的土壤因子与对策[J]. 土壤肥料, 1994,(1): 4-9.
[4] 李先珍, 王耀林, 张志斌. 京郊蔬菜大棚土壤盐离子积累状况研究初报[J]. 中国蔬菜, 1993,(4): 15-17.
[5] 冯永军, 陈为峰, 张蕾娜, 等. 设施园艺土壤的盐化与治理对策[J]. 农业工程学报, 2001, 17(2): 111-114.
[6] 刘媛媛, 李廷轩, 余海英, 等. 有机肥与尿素配施对设施土壤盐分含量与组成变化的影响[J]. 农业环境科学学报, 2009, 28(2): 292-298.
[7] 宋旭丽, 侯喜林, 胡春梅, 等. NaCl胁迫对超大甜椒种子萌发及幼苗生长的影响[J]. 西北植物学报, 2011, 31(3): 569-575.
[8] 宋旭丽, 胡春梅, 孟静静, 等. NaCl胁迫加重强光胁迫下超大甜椒叶片的光系统II和光系统I的光抑制[J]. 植物生态学报, 2011, 35(6): 681-686.
[9] 汤绍虎, 罗 充. 植物生理学实验教程[M]. 重庆: 西南师范大学出版社, 2012: 3-4, 199-202.
[10] 李合生, 孙 群, 赵世杰. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社, 2000: 127-128.
[11] 李鹏民, 高辉远, Strasser R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报, 2005, 31(6): 559-566.
[12] 孙永平, 张治平, 徐呈祥, 等. 5-氨基乙酰丙酸处理对低温下西瓜叶片快速叶绿素荧光诱导曲线的影响[J]. 园艺学报, 2009, 36(5): 671-678.
[13] Srivastava A, Guisse B, Greppin H, et al. Regulation of antenna structure and electron transport in PSⅡ of Pisum sativum under elevated temperature probed by the fast polyphasic chlorophyll a fluorescence transient: OKJIP[J]. Biochimica et Biophysica Acta, 1997, 1 320(1): 95-106.
[14] 陈银萍, 王晓梅, 杨宗娟, 等. NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响[J]. 农业环境科学学报, 2012, 31(2): 270-277.
[15] 乔 佩, 卢存福, 李红梅, 等. 盐胁迫对诱变小麦种子萌发及幼苗生理特性的影响[J]. 中国生态农业学报, 2013, 21(6): 720-727.
[16] 郑佳秋, 郭 军, 吴永成, 等. 辣椒品种对盐胁迫的响应[J]. 浙江农业学报, 2012, 26(4): 908-914.
[17] 张万钧, 王斗天, 范 海, 等. 盐生植物种子萌发的特点及其生理基础[J]. 应用与环境生物学报, 2001, 7(2): 117-121.
[18] Jaleel C A, Gopi R, Sankar B, et al. Studies on germination, seedling vigour, lipid peroxidation and proline metabolism in Catharanthus roseus seedlings under salt stress[J]. South African Journal of Botany, 2007, 73(2): 190-195.
[19] 王东明, 贾 媛, 崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报, 2009, 25(4): 124-128.
[20] 杨 婷, 谢志霞, 喻 琼, 等. 局部根系盐胁迫对冬小麦生长和光合特征的影响[J]. 中国生态农业学报, 2014, 22(9): 1 074-1 078.
[21] 李鸿文, 林存亮, 石培春, 等. Na2S04和NaCI胁迫对小黑麦萌发及幼苗生长影响[J]. 石河子大学学报(自然科学版), 2012, 30(2): 142-146.
[22] 卢艳敏, 苏长青, 李会芬. 不同盐胁迫对白三叶种子萌发及幼苗生长的影响[J]. 草业学报, 2013, 22(4): 123-129.
[23] 洪森荣, 尹明华, 林国卫, 等. 江西铅山红芽芋试管苗对盐胁迫的生理响应[J]. 热带作物学报, 2014, 35(10): 2 013-2 019.
[24] 姜 伟, 崔世茂, 张怡婷, 等. KN03、 K2S04及其混盐胁迫对辣椒幼苗生长和光合特性的影响[J]. 华北农学报, 2011, 26(2): 192-197.
[25]陈 贵, 胡文玉, 谢甫绨, 等. 提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J]. 植物生理学通讯, 1991, 27(1): 44-46.
[26] 陆銮眉, 吴福妹, 张 琼, 等. NaCl胁迫对大黄龙船花生长及生理生化的影响[J]. 热带亚热带植物学报, 2015, 23(3): 262-267.
[27] 魏国强, 朱祝军, 方学智, 等. NaCl胁迫对不同品种黄瓜幼苗生长、 叶绿素荧光特性和活性氧代谢的影响[J]. 中国农业科学, 2004, 37(11): 1 754-1 759.
[28] 王 丹, 万春阳, 侯俊玲, 等. 盐胁迫对甘草叶片光合色素含量和光合生理特性的影响[J]. 热带作物学报, 2014, 35(5): 957-961.
[29] Strasser R J, Srivastava A, Govindjee. Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J]. Photochemistry and Photobiology, 1995, 61(1): 32-42.
[30] Kooten O V, Snel J F. The use of chlorophyll fluorescence nomenclature in plant stress physiology[J]. Photosynthesis Research, 1990, 25(3): 147-150.
[31] 刘炳响, 王志刚, 杨敏生, 等. 模拟盐胁迫对白榆种子发芽、出苗及幼苗生长的影响[J]. 草业学报, 2012, 21(5): 39-46.
[32] 许 珍, 李鹏民, 高辉远, 等. 玉米不同朝向叶片原初光化学反应日变化的差异[J]. 作物学报, 2007, 33(8): 1 375-1 379.
[33] 牛彩霞, 郁继华, 张 韵, 等. 钠盐对辣椒种子萌发和幼苗生长的影响[J]. 甘肃农业大学学报, 2006, 41(1): 34-38.
[34] 李海云, 王秀峰, 魏 珉, 等. 不同阴离子化肥对黄瓜生长及土壤EC、 pH值的影响[J]. 山东农业科学, 2002(2): 16-18.
