草莓叶叶黄素循环组分超高效液相色谱分析
2016-05-30陈敏氡朱海生
陈敏氡 朱海生
摘 要 为建立草莓叶叶黄素循环组分超高效液相色谱(UPLC)的分析方法,优化草莓叶叶黄素循环组分的提取条件,建立适宜的UPLC测定方法,通过研究强光下各组分含量的变化规律进行验证,结果表明,以丙酮为提取剂,不经过皂化直接提取,采用C18色谱柱,以乙腈 ∶ 甲醇=9 ∶ 1为流动相,流速0.5 mL/min,波长445 nm,柱温30 ℃能较好地分离及测定草莓叶叶黄素循环各组分,方法快速稳定,检测时间仅需1.2 min。强光下,玉米黄质、叶黄素循环库和脱环氧化程度均明显升高而紫黄质下降,符合叶黄素循环调控规律,证实此方法可靠。可见,实验所建立的UPLC测定方法适合草莓叶叶黄素循环组分分析。
关键词 草莓叶;叶黄素循环组分;UPLC
中图分类号 S668.4 文献标识码 A
草莓(Fragaria ananassa Duch.)喜温暖而不耐高温强光,在越夏露地栽培时比一般果菜类更易发生光抑制,光损伤,严重影响其品质及产量[1-3]。目前,有关叶黄素循环对草莓叶片光系统的保护作用成为研究者关注的热点。徐凯等[4]研究了草莓叶片光合作用对强光的响应,推测叶黄素循环在草莓叶片防御光损伤方面起着重要作用。张广华等[5]发现,草莓叶片在光抑制过程中,依赖叶黄素循环的热耗散是其排散过剩光能的重要途径之一。郑毅等[6]认为,叶黄素循环是草莓叶片在温度胁迫下主要的自我保护机制。叶黄素循环(Xanthophyll cycle)主要由玉米黄质(Zeaxanthin,Z)、环氧玉米黄质(Antheraxanthin,A)和紫黄质(Violaxanthin,V)3种组分参与,明确Z、A和V含量以及叶黄素循环库(V+A+Z)、叶黄素循环脱环氧化状态(A+Z)/(V+A+Z)在光抑制中的变化特性是阐明叶黄素循环光保护机制的关键[7-9]。因此,在草莓上,急需建立一种快速、准确的叶黄素循环组分(A、V和Z)的测定方法,分析各组分在光抑制中变化规律,这将对今后探索草莓叶黄素循环在保护光系统和抗逆中的作用产生重要意义。高效液相色谱法(High performance liquid chromatography,HPLC)是近年来分离及测定植物天然色素的主要方法,但在实际应用中仍然存在分析时间长,分离效果不佳等缺陷[10]。Cheng等[11]采用Zorbax-ODS色谱柱(4.6 mm×250 mm,5 μm),甲醇 ∶ 乙腈(75 ∶ 25)和甲醇 ∶ 乙酸乙酯(70 ∶ 30)为流动相分离苹果叶片中的紫黄质、环氧玉米黄质和玉米黄质耗时20 min以上。韦朝领等[12]利用Spherisorb C18色谱柱(4.6 mm×250 mm,5 μm)对茶叶中叶黄素循环组分进行分析,检测时间15 min。崔海岩等[13]通过Spherisorb C18色谱柱(4.0 mm×250 mm,5 μm)可在8 min内完成玉米叶片叶黄素循环组分的定性定量,然而流动相中添加Tris-HCl缓冲液而存在管路堵塞的风险。超高效液相色谱法(Ultra performance liquid chromatography,UPLC)是基于HPLC推出的一种新型的液相色谱技术,它使用粒径低于2 μm的小颗粒填充色谱柱提升样品的分析效率,弥补了HPLC的缺陷,分离速度、灵敏度以及分离度高达HPLC的9、3、1.7倍,且在HPLC的基础上兼具环境友好、成本低等特点,已逐渐成为食品分析检测的有效工具[14-15]。目前,UPLC技术已经应用到草莓果实叶黄素、番茄红素和β-胡萝卜素等多种类胡萝卜素的测定,测定时间仅5 min,比普通HPLC缩短约70%[16]。叶黄素循环的3种组分均属于类胡萝卜素,因此,同样可以将UPLC技术运用到叶黄素循环组分的测定,获得快速、稳定的草莓叶叶黄素组分分析方法。本试验通过优化草莓叶片叶黄素循环组分的提取条件,建立适宜的UPLC分析方法,并通过研究强光下草莓叶片叶黄素循环组分含量的变化规律对此方法进行验证,从而确定适合草莓叶叶黄素循环组分分析的方法,为今后进一步研究草莓叶叶黄素循环在光系统和逆境中的作用提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 试验材料与处理 试验于2014-2015年在福建省福清东张试验基地进行,供试材料为自主选育草莓品种“福莓1号”。选取生长健壮的三叶一心苗,移栽到直径160 mm,高140 mm的塑料盆中,生长期间保证水肥充足,常规管理。当植株张至6~7片叶,选取大小和生长状态一致的草莓盆栽苗,将盆栽苗从室外移至室内预培养一周,每天光照10 h,光源为镝灯,接着取3盆长势一致的草莓苗进行模拟强光胁迫(光强2 000 μmol/(m2·s),温度(25±1)℃ 3 h,以未经处理的盆栽为对照,试验重复3次,取大小相同的功能叶数片,放入液氮中速冻待测。
1.1.2 试剂 玉米黄质、紫黄质、环氧玉米黄质为标准样品(ChromaDex,USA),纯度均为95%以上;乙腈和甲醇为色谱纯(Fisher,USA);甲醇、乙醇、丙酮、石油醚、乙酸乙酯、无水硫酸钠均为分析纯,购自上海国药集团。
1.1.3 仪器 超高效液相色谱仪ACQUITY UPLC H-Class(Waters,USA),光电二极管矩阵检测器eλPDA(Waters,USA),ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)(Waters,USA),旋转蒸发器RV10(IKA,Germany),紫外分光光度计Ultrospec1100 pro(Amersham,USA),超声波粉碎仪VCX130PB(Sonics,USA)等。
1.2 方法
1.2.1 草莓叶叶黄素循环组分的提取 用液氮将草莓叶片研磨至粉末,准确称取0.1 g,加入5 mL丙酮提取剂,于4 ℃避光浸提5 min,低温超声提取2 min,12 000 r/min,4 ℃离心10 min,取上清液,重复操作1次,合并上清液,定容至10 mL,用旋转蒸发仪于40 ℃将其蒸干,用丙酮定容至5 mL,4 ℃避光放置。
提取剂的优化:选择7种不同极性的有机溶剂或组合,依次为:甲醇、乙醇、丙酮、乙酸乙酯、丙酮石油醚(4 ∶ 1)、丙酮石油醚(1 ∶ 1)、石油醚。分析不同提取剂对草莓叶叶黄素循环各组分含量总和(即叶黄素循环库)的提取效果,确定最适提取剂。
提取方法的优化:采用非皂化和皂化2种方法对草莓叶叶黄素循环组分进行提取,其中皂化提取参照草莓类胡萝卜素的皂化方法[16],通过分析二者对草莓叶叶黄素循环库的提取效果,确定适用的提取方法。
1.2.2 标准溶液的配制 将玉米黄质标准样品用丙酮配制成浓度为20 μg/mL的标准溶液,紫黄质和环氧玉米黄质标准样品用乙醇分别配制成浓度为0.8和0.4 μg/mL的标准溶液,放置于-80 ℃备用。
1.2.3 UPLC色谱条件 色谱柱:ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);流动相:乙腈 ∶ 甲醇=9 ∶ 1(V/V);流速:0.5 mL/min;进样体积:10 μL;色谱柱温度:30 ℃;样品温度:30℃;波长扫描范围:100~600 nm;检测波长:445 nm。
1.2.4 标准工作曲线的制备 将1.2.2配制3种标准溶液逐个稀释成不同浓度梯度的标准溶液,按1.2.3的色谱条件进行测定。以标准样品浓度为横坐标(x),峰面积为纵坐标(y),绘制标准工作曲线并计算标准曲线回归方程以及相关系数,
1.2.5 精密度、重复性试验 将3种标准样品的混合标准溶液按1.2.3的色谱条件进行5次连续进样,以各组分峰面积的相对标准偏差(Relative standard deviation,RSD),来检测该方法的精密度。平行制备5份样品,按照1.2.1的提取方法及1.2.3的色谱条件进行测定,计算各组分峰面积的RSD来考察方法的重复性。
1.2.6 加标回收试验 称取4份等量的草莓叶片粉末,其中3份如表3所示分别进行3个水平的加标,余下1份作空白对照。按1.2.1的方法提取样品,按1.2.3的色谱条件分析样品中叶黄素循环组分含量,计算回收率及回收率的RDS,试验平行测定3次。
1.2.7 草莓叶叶黄素循环组分含量的测定 利用1.2.3的色谱条件分别对强光胁迫处理及未处理的草莓叶片中玉米黄质,紫黄质和环氧玉米黄质含量进行测定,测定样品前用流动相进行稀释,并经0.22 μm滤膜过滤,试验平行测定5次。
1.3 数据分析
采用Excel 2010和SPSS 17.0软件对测定的数据进行统计分析。
2 结果与分析
2.1 草莓叶片叶黄素循环组分提取条件的优化
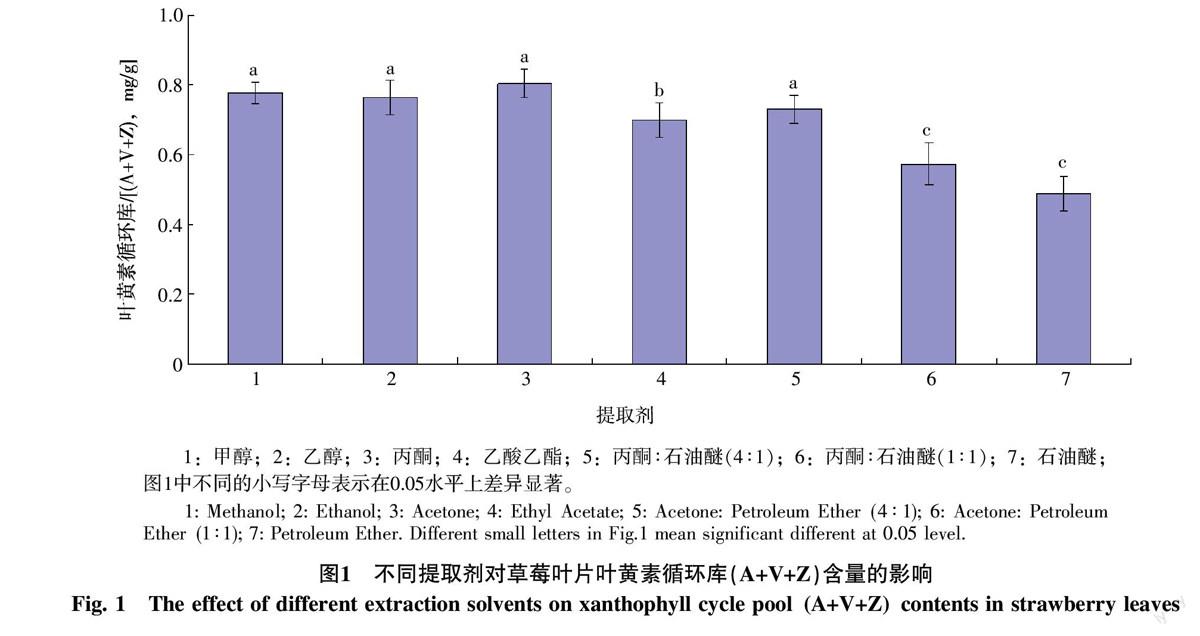
2.1.1 不同提取剂提取效果的比较 由图1可以看出,7种提取剂的提取效果存在显著差异,极性高的提取剂如甲醇、乙醇和丙酮等提取效果较好;反之,极性低的石油醚提取效果最差。其中,通过甲醇或丙酮所提取的叶黄素循环库含量最高,与石油醚的提取效果存在显著差异(p<0.05)。可见,需选择极性高的提取剂来提取草莓叶叶黄素循环各组分。
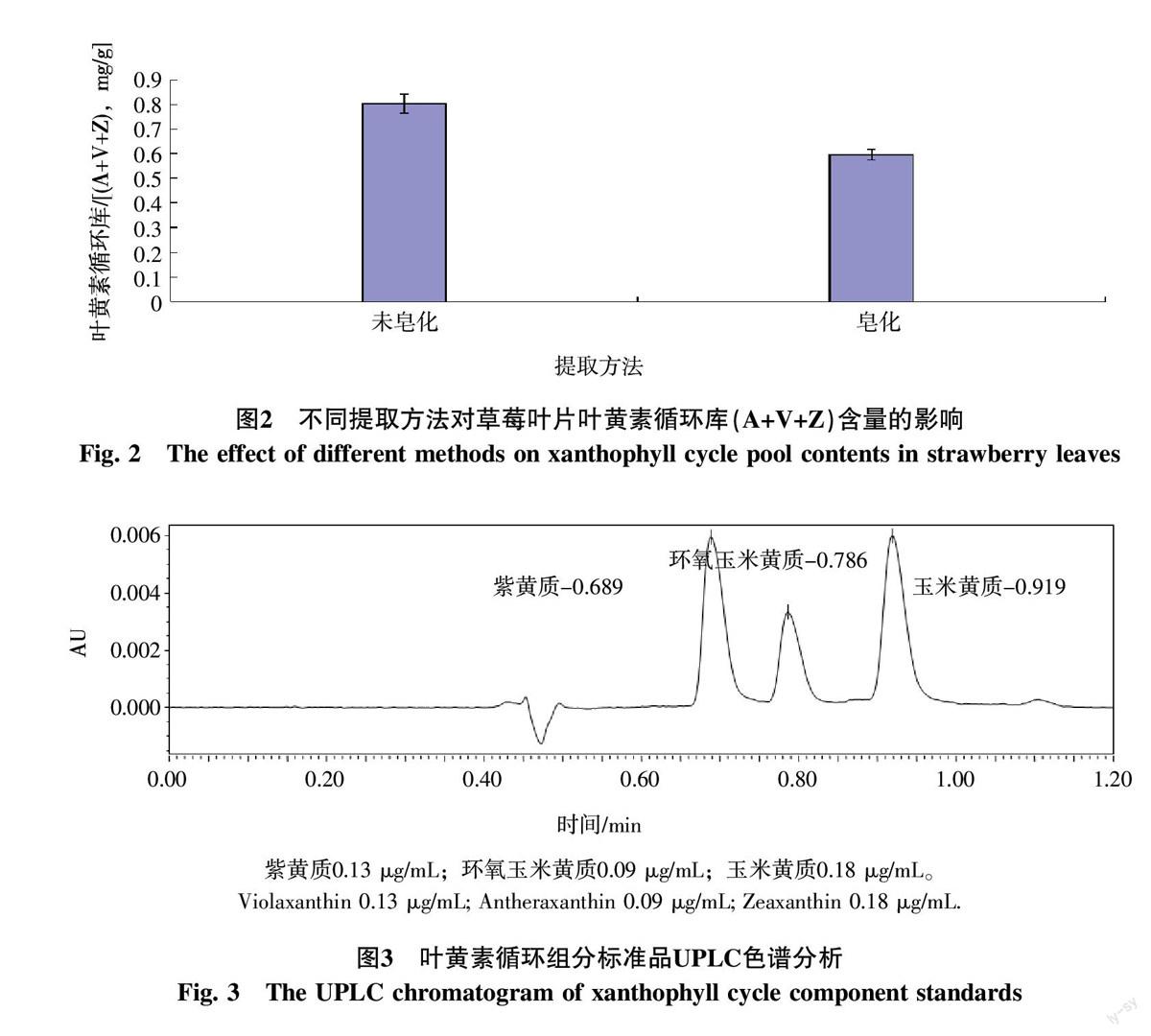
2.1.2 不同提取方法提取效果的比较 由图2可以看出,采用非皂化和皂化2种方法所提取的叶黄素循环库含量差异较大,皂化处理明显损耗草莓叶片叶黄素循环库的含量。因此,确定不经皂化而直接提取草莓叶片叶黄素循环各组分。
2.2 UPLC分析条件的优化选择
2.2.1 检测波长的选择 对玉米黄质、环氧玉米黄质和紫黄质3种标准样品的光谱扫描发现,3种标准样品的吸收峰均集中在445 nm左右,玉米黄质的最大吸收波长为450 nm,紫黄质为440 nm,环氧玉米黄质为449 nm,并且考虑到前人在分析植物叶黄素循环组分时也有采用445 nm作为检测波长[11-12]。因此,选择445 nm作为草莓叶叶黄素循环组分测定的检测波长。
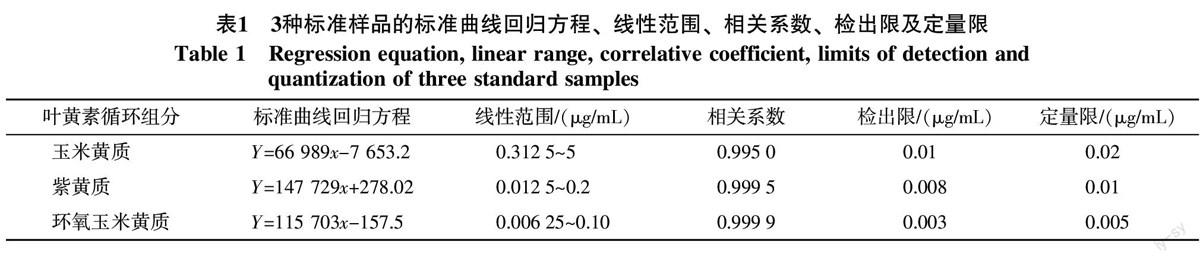
2.2.2 色谱条件的确定 由于叶黄素循环的3种组分均属于类胡萝卜素。因此,本实验参照草莓果实类胡萝卜素UPLC方法的色谱条件[16]对三者进行分析,结果3种组分的分离效果较好,说明该色谱条件适用于叶黄素循环组分的分析,但由于本实验采用是柱长为100 mm的色谱柱,较于原来柱长50 mm的色谱柱分析时间明显增加,因此通过改进原来的色谱条件参数,包括提高进样体积、色谱柱温度以及样品温度,从而缩短分析时间。最终确定的色谱条件为乙腈 ∶ 甲醇=9 ∶ 1(V/V)为流动相,流速0.5 mL/min,进样体积10 μL,柱温30 ℃,样品温度30 ℃,在此色谱条件下3种标准样品可以完全分离,峰形对称性好,并且分析时间较短(图3)。
2.3 UPLC分析方法的可靠性分析
2.3.1 线性关系及检出限、定量限测定 由表1可知,玉米黄质、紫黄质和环氧玉米黄质的线性相关系数依次为0.995 0、0.999 5、0.999 9,表明3种标准样品的进样浓度与峰面积具有良好的线性关系。以信噪比(S/N)为3所对应的标准样品浓度为检出限,以信噪比(S/N)为10所对应的标准样品浓度为定量限,3种标准样品的检出限为0.003~0.01 μg/mL,定量限为0.005~0.02 μg/mL,说明该方法具有较高的灵敏性。
2.3.2 精密度、重复性试验 由表2可知,玉米黄质、紫黄质和环氧玉米黄质3种组分在精密度试验中对应的RSD依次为0.3%、0.7%和1.2%,重复性测定中玉米黄质、紫黄质和环氧玉米黄质3种组分对应的RSD依次为0.5%、0.9%、1.3%,均小于2%,表明该方法具有良好的精密度和重复性。
2.3.3 加标回收试验 由表3可得,玉米黄质、紫黄质和环氧玉米黄质3种标准样品的回收率为95.6%-104.9%,均在95%以上,并且回收率的相对标准偏差为0.9%~1.7%,均小于2%,表明此方法符合分析要求。
2.4 草莓叶片叶黄素循环组分含量的测定
由图4看出,在445 nm下可检测到3种物质,它们的保留时间与3种标准样品的保留时间依次相差0.006、0.009、0.011 min。因此,确定3个物质分别为紫黄质、环氧玉米黄质和玉米黄质。由表4可得,未处理的草莓叶片中紫黄质(V)、环氧玉米黄质(A)和玉米黄质(Z)的含量依次为80.2、24.1、475.1 μg/g,Z的含量分别约为V和A的5.9倍和19.7倍,可见Z是草莓叶黄素循环中的主要组分。强光胁迫后,叶片中的Z含量明显升高,V含量下降,A含量基本不变,Z从475.1变为551.3 μg/g,升高1.16倍,而V则从80.2降至53.9 μg/g。此外,叶黄素循环库(A+V+Z)和脱环氧化状态水平(A+Z)/(A+Z+V)也在强光处理后明显升高,结果符合叶黄素循环调控规律,说明该方法可用于草莓叶叶黄素循环组分的分析。
3 讨论与结论
本实验选择极性不同的7种提取剂,即甲醇、乙醇、丙酮、乙酸乙酯、丙酮 ∶ 石油醚(4 ∶ 1)、丙酮 ∶ 石油醚(1 ∶ 1)和石油醚,通过比较各个提取剂对草莓叶叶黄素循环组分的提取效果来获得适合的提取剂。结果表明,7种提取剂的提取效果差异显著,极性高的单一提取剂如甲醇、乙醇、丙酮的提取效果好,反之,极性低的石油醚效果差,推测可能与玉米黄质、环氧玉米黄质和紫黄质中含有强极性的羟基、羰基、甲氧基或环氧化结构有关[17]。在7种提取剂中,利用甲醇或丙酮所提取的叶黄素循环组分含量最高,可见,甲醇和丙酮均是提取草莓叶片中叶黄素循环组分较好的提取剂,但考虑到甲醇的毒性较大,因此建议使用丙酮进行提取。目前,利用皂化和非皂化的方法提取植物叶片中的叶黄素循环组分均有报道[12,18]。皂化处理可以解决玉米黄质在有机浸提过程中难以分离等问题,然而皂化的过程常常会导致样品中色素单量以及总量不同程度的损失,而在水果类物质中类胡萝卜素皂化提取的损失率约为10%~15%[19-21]。因此,需要比较2种方法对草莓叶片叶黄素循环组分的提取效果,以获得最适的提取方法。结果表明,皂化处理会损耗草莓叶片中的叶黄素循环组分,直接提取效果更好。
针对叶黄素循环组分建立有效的测定方法是开展草莓叶叶黄素循环调控作用研究的必备基础。目前,绝大多数的测定手段还是以普通高效液相色谱(HPLC)为主,然而HPLC在实际应用中存在耗时长,分离度不佳等缺陷[11-13]。因此,寻求更高效的检测方法是未来的研究重点。超高效液相色谱法(UPLC)是近年来发展较快,基于HPLC的新型液相色谱检测技术。它的最大优势在于采用了2.0 μm以下颗粒度的色谱填料柱,以及耐受超高压的色谱泵和色谱系统,现已成为蛋白组学、药物分析、环境监测等众多高端领域的有效检测方法[22-23]。众多研究表明,将HPLC定量方法转换并优化为UPLC方法,在保证含量测定结果准确的前提下,既提高了色谱峰分离度,加快了分析速度,达到了样品分析的高通量,又减少了溶剂损耗及废液处置费用,降低了分析成本[24-25]。本试验利用UPLC分析了草莓叶叶黄素循环组分,相较于普通HPLC技术凸显了2点优势:(1)分析时间明显缩短。利用UPLC 仅仅在1.2 min内就能检测出叶黄素循环的3种组分,对比韦朝领[12]、季本华等[26]利用HPLC的分析时间,缩短近85%以上。(2)分析方法更简单、安全,成本降低。试验的流动相只需要乙腈和甲醇,避免使用了Glimore等[27]和赵世杰等[28]方法中对色谱柱有害的Tris-HCl缓冲液;分析过程以乙腈 ∶ 甲醇=9 ∶ 1(V/V)等度洗脱即可,无需通过梯度洗脱,较于徐坤[29],崔海岩等[13]报道中的提取过程更简单,此外还明显减少了溶剂损耗,节约了分析成本。
本研究通过优化叶黄素循环组分的提取条件,确定色谱条件以及线性关系、重复性、精密度、回收率试验等的考察获得了最适的草莓叶叶黄素循环UPLC分析方法,即以丙酮为提取剂,不经过皂化直接提取,同时采用ACQUITY UPLC BEH C18色谱柱,以乙腈 ∶ 甲醇=9 ∶ 1为流动相,流速0.5 mL/min,波长445 nm,色谱柱温度30 ℃,样品温度30 ℃。此外,通过研究强光下叶黄素循环各组分含量的变化规律对该方法进行验证,结果符合叶黄素循环调控规律。因此,确定试验所建立的UPLC测定方法适合草莓叶叶黄素循环组分分析。
参考文献
[1] 徐 凯. 草莓的光抑制特性及光质对其生长结果的影响[D]. 杭州: 浙江大学, 2005.
[2] 潘 刚. 不同光质对草莓光抑制的影响[D]. 合肥: 安徽农业大学, 2006.
[3] 张广华, 葛会波, 李青云, 等. SOD对草莓叶片光抑制的防御作用[J]. 果树学报, 2004, 21(4): 328-330.
[4] 徐 凯, 郭延平, 张上隆, 等. 草莓叶片光合作用对强光的响应及其机理研究[J]. 应用生态学报, 2005, 16(1): 73-78.
[5] 张广华. 弱光、 低温胁迫对草莓光合作用的影响[D]. 保定: 河北农业大学, 2004.
[6] 郑 毅. 温度胁迫对草莓叶片光合作用的影响[D]. 合肥: 安徽农业大学, 2005.
[7] Demming-Adams B, Adams WW III. Xanthophyll cycle and light stress in nature: uniform response to excess direct sunlight among higher plant species[J]. Planta, 1996, 198: 460-470.
[8] Vaz J, Sharma P K.Relationship between xanthophyll cycle and non-photochemical quenching in rice(Oryza sativa L.)plants in response to light stress[J]. Indian J Exp Biol, 2011, 49(1): 60-70.
[9] Ma F, Cheng L. The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidams of the ascorbate-gluthathione pathway than the shaded peel[J]. Plant Science, 2003, 165(4): 819-827.
[10] 刘丽娟, 吴 颖. UPLC法检测食品中的番茄红素[J]. 食品工业科技, 2009, 30(11): 305-307.
[11] Cheng L. Xanthophyll cycle pool size and composition in relation to the nitrogen content of apple Leaves[J]. Journal of Experimental Botany, 2003, 24: 385-393.
[12] 韦朝领, 江昌俊, 陶汉之, 等. 茶树鲜叶中叶黄素循环组分的高效液相色谱法测定研究及其光保护功能鉴定[J]. 茶叶科学, 2004, 24(1): 60-64.
[13] 崔海岩, 靳立斌, 李 波, 等. 大田遮阴对夏玉米光合特性和叶黄素循环的影响[J]. 作物学报, 2013, 39(3): 478-485.
[14] 丁 雪, 石力夫, 杨 璐. 新型色谱分析技术在中药指纹图谱研究中的应用[J]. 国际药学研究杂志, 2008, 35(6): 447-450.
[15] 郑 洁, 赵其阳, 张耀海, 等. 超高效液相色谱法同时测定柑橘中主要酚酸和类黄酮物质[J]. 中国农业科学, 2014, 47(23): 4 706-4 717.
[16] 陈敏氡, 朱海生, 温庆放, 等. UPLC测定草莓果实中类胡萝卜素含量[J]. 果树学报, 2013, 30(4): 706-711.
[17] 颜少宾, 张妤艳, 马瑞娟, 等. 桃果实类胡萝卜素测定方法的研究[J]. 果实学报, 2012, 29(6): 1 127-1 133.
[18] 费美娟, 赵世杰, 王晓云, 等. 叶黄素循环组分的分离鉴定及紫黄质的大量制备[J]. 西北植物学报, 2004, 24(2): 210-214.
[19] 王 星, 牛黎莉, 王晓璇, 等. 皂化工艺对枸杞皮渣中类胡萝卜素提取效果的影响[J]. 食品与生物技术学报, 2014(7): 709-714.
[20] Minguez-Mosquera M I, Galvez A P. Study of lability and kinetics of the main carotenoid pigments of red pepper in the deesterification reaction[J]. J Agric Food Chem, 1998, 46: 566-569.
[21] Ittah Y, Kanner J. Hydrolysis study of carotenoid pigments of paprika (Capsicum annuum L.) variety Lehava)by HPLC photodiode array detection[J]. J Agric Food Chem, 1993, 41: 899-901.
[22] 汤建国, 袁大林. 超高效液相色谱法测定卷烟烟丝中7种水溶性糖含量[J]. 化学分析计量, 2012, 21(1): 17-19.
[23] 曾祥林, 曾 智. 超高效/高分离度快速/超快速液相色谱技术在分析领域中的应用[J]. 医药导报, 2010, 29(7): 909-912.
[24] 赵振霞, 刘永利, 王 敏, 等. HPLC、 UPLC法同时测定心可舒胶囊中4种成分的含量[J]. 中国医科大学学报, 2014, 45(5): 563-566.
[25] 郑 洁, 赵其阳, 张耀海, 等. 超高效液相色谱法同时测定柑橘中主要酚酸和类黄酮物质[J]. 中国农业科学, 2014, 47(23): 4 706-4 717.
[26] 季本华, 朱素琴, 焦德茂. 低温强光胁迫下籼粳稻的PSⅡ光化学效率和膜脂过氧化表现[J]. 植物学报, 2002, 44(2): 139-146.
[27] Glimore A M. Mechanistic aspects of xanthophyll cyce-dependent photoprotection on higher chloroplasts and Leaves[J]. Physiology Plant, 1997, 99: 197-209.
[28] 赵世杰, 孟庆伟, 许长成, 等. 植物组织中叶黄素循环组分的高效液相色谱分析法[J]. 植物生理学通讯, 1995, 31(6): 438-442.
[29] 徐 坤, 邹 琦, 郑国生. 强光下姜叶片的光呼吸及叶黄素循环[J]. 园艺学报, 2002, 29(1): 47-51.
