秦巴山区三尖杉根际土壤放线菌的分离、筛选及活性菌株的鉴定
2016-05-30阮昌应解修超陈文强邓百万
晏 丽, 阮昌应, 解修超, 彭 浩, 陈文强, 邓百万
(1.陕西理工学院 生物科学与工程学院, 陕西 汉中 723000;2.汉中职业技术学院 药学与医学技术系, 陕西 汉中 723002;3.柞水中学, 陕西 柞水 711400)
秦巴山区三尖杉根际土壤放线菌的分离、筛选及活性菌株的鉴定
晏丽1,2, 阮昌应3, 解修超1, 彭浩1, 陈文强1, 邓百万1
(1.陕西理工学院 生物科学与工程学院, 陕西 汉中 723000;2.汉中职业技术学院 药学与医学技术系, 陕西 汉中 723002;3.柞水中学, 陕西 柞水 711400)
[摘要]采用选择性分离方法从秦巴山区三尖杉植物根际土样中分离得到放线菌35株,以白色念珠菌(Candida albicans)、大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏杆菌(Salmonella typhl)为靶标菌,采用滤纸片扩散法研究三尖杉根际土壤放线菌发酵液的抑菌活性。结果表明,16株放线菌表现出至少对一种靶标菌有抗性,占总分离菌株的45.7%,其中,菌株CF003对所有靶标菌均具有活性;经形态学和16S rRNA基因序列鉴定,这16株放线菌分属于链霉菌属(Streptomyces)和小单孢菌属(Micromonospora)。
[关键词]三尖杉; 根际土壤;放线菌;抗菌活性
放线菌是一类具有很高实用价值的微生物,世界各国对其研究与资源开发极为重视。目前,国内有关放线菌的区系调查及资源开发虽然有一些报道,但对不同药用植物根际土壤放线菌的研究很少[1-3]。土壤是放线菌生活的大本营,目前已从土壤中分离出的放线菌主要包括链霉菌属(Streptomyces)、小单孢菌属(Micromonospora)、拟诺卡氏菌属(Nocardiopsis)、马杜拉放线菌属(Actinomadura)、继生菌属(Jishengella)、疣孢菌属(Verrucosispora)以及游动放线菌属(Actinoplanes)等,但其优势菌群一般为链霉菌属和小单胞菌属;此外,放线菌还是抗生素的主要产生菌,据不完全统计,目前由微生物产生的抗生素约有万余种,其中70%以上都是由放线菌产生的[4]。
三尖杉(Cephalotaxusfortunei),常绿乔木或灌木,树皮灰褐色至红褐色,为三尖杉科三尖杉属植物,常自然散生于海拔800 m至2 000 m的山涧潮湿地带[5]。三尖杉属植物含有黄酮和生物酯碱两大化学成分,其中的生物酯碱具有较好的抗癌作用[6],其价值得到了人们的极大关注和重视。
从药用植物内部分离具有抑菌活性的微生物现已有一些报道,例如刘兆迪等[7]分别从秦巴山区生长的三尖杉根、茎、叶中分离得到30株内生真菌,且有20株内生真菌的代谢产物至少对一种靶标菌有抑制活性。张晓伟等[8]从三尖杉根部分离得到2株内生放线菌ECA023、ECA045,其中ECA023对枯草芽孢杆菌(Bacillussubtilis)和金黄色葡萄球菌(Staphylococcusaureus)表现出较强的拮抗作用。但迄今为止,尚无三尖杉根际土壤放线菌的研究报道。本研究以秦巴山区三尖杉为材料,对根际土壤放线菌进行分离、鉴定,并对其活性代谢产物进行初步研究,旨在发现具有抑菌活性的菌株。这对新菌种及抑菌活性物质的发现及三尖杉资源的开发利用及保护都有重要的理论意义和实际价值。
1材料与方法
1.1材料
1.1.1供试材料
于2014年4月采集陕西省汉中市汉台区天台山三尖杉的根际土壤约50.0 g,装入灭菌袋中,4 ℃保藏并迅速展开实验。
1.1.2靶标菌株
白色念珠菌(Candidaalbicans)、大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus)、沙门氏杆菌(Salmonellatyphl),均由陕西省食药用菌工程技术研究中心提供。
1.1.3培养基
合成(ATCC-172)培养基:葡萄糖10.0 g/L,可溶性淀粉20.0 g/L,酵母粉5 g/L,CaCO315.0 g/L,琼脂18.0 g/L,酪蛋白酶0.5 g/L,pH 7.0~7.4。
淀粉-黄豆粉发酵(SLM)培养基:黄豆粉15.0 g/L,可溶性淀粉20.0 g/L,蛋白胨2.0 g/L,酵母粉5.0 g/L,NaCl 4.0 g/L,CaCO34.0 g/L,pH 7.2~7.4。
酵母膏-麦芽浸汁(YE)液体培养基:酵母粉4.0 g/L,麦芽浸提取物10.0 g/L,葡萄糖4.0 g/L,pH 7.2~7.4。
营养琼脂(NA)培养基:蛋白胨15.0 g/L,牛肉粉3.0 g,氯化钠5.0 g,琼脂15.0 g,pH 7.3±0.1。
酵母浸出粉胨葡萄糖(YPD)培养基:葡萄糖20 g/L,胰蛋白胨20 g/L,酵母粉10 g/L,pH 5.0~5.5。
分离纯化采用ATCC-172和SIM培养基,液体发酵采用YE培养基,待测靶标菌培养基为NA(细菌)和YPD培养基(真菌)。
1.1.4主要仪器和设备
立式压力蒸汽灭菌锅(LDZX-50KBS,上海申安医疗器械厂)、双人双面精华工作台(SW-CJ-2F,苏净集团苏州净化设备有限公司)、生化培养箱(XPX-250BSH-Ⅱ,上海新苗衣料器械制造有限公司)、电子天平(BSA8201,MAX=8 200 g,d=0.1g,北京赛多利斯科学仪器有限公司)、小型台式高速冷冻离心机(Centrifuge 5424R,上海艾研生物科技有限公司)、PCR仪(TC-4000,英国TECHNE公司)等。
1.2方法
1.2.1根际土壤放线菌的分离纯化
取1.0 g风干的土壤样品(样本为植物根际混合土样,已磨碎分散均匀),溶于10 mL无菌水中振荡1 min,吸取1 mL溶液,加入9 mL 0.05%的SDS液中,40 ℃保温20 min,为10-2溶液,根据需要依次稀释至10-3、10-4,各取0.2 mL涂布于分离培养基,28~30 ℃培养5~30 d。待菌落长出后,挑取形态不同的菌落,转入ATCC-172和SIM培养基中,进行纯化。最后接种至试管斜面,于4 ℃冰箱中保藏备用。
1.2.2根际放线菌发酵液抑菌活性筛选
将纯化好的菌株接种于YE液体培养基中进行发酵培养,28 ℃,170 r/min发酵7 d。然后用12 000 r/min的速度离心15 min,得上清液,经0.22 μm微孔滤膜过滤后得原始滤液,用直径6 mm的圆形无菌滤纸片蘸取滤液,放于含相应靶标菌(大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、白色念珠菌和沙门氏杆菌)的平板上,24 h培养后测定抑菌圈直径的大小,并设置空白对照。
1.2.3抗菌活性菌株的鉴定
(1)菌株形态学特征。将分离纯化的放线菌转接至YE固体培养基上,于28 ℃培养7 d观察,记录菌丝形态、孢子丝形态、孢子排列方式、孢子形态及大小、菌落形态及颜色、孢子的颜色和能否产生可溶性色素等,根据以上的形态特征和培养特征对分离纯化的内生放线菌进行初步鉴定。
(2)分子生物学鉴定。将分离纯化得到的放线菌接种到YE液体培养基上,28 ℃,170 r/min的条件下振荡培养2~3 d,离心,收集菌丝体,采用核酸快速提取仪提取放线菌DNA。吸取1 mL含有菌丝体的发酵液,加入到1.5 mL的离心管中,12 000 r/min离心5 min,弃上清液,加入500 μL的TE缓冲液,在DNA快速提取仪Fastprep中震荡1 min,速度6.0 m/s,加入500 μL氯仿:异戊醇(24∶1),颠倒混匀10 s,室温放置5 min,12 000 r/min离心5 min,上清液即可用作PCR模板。用质量分数为1%的琼脂糖进行凝胶电泳检测DNA。
用27F:5’-AGAGTTTGATCCTGGCTCAG-3’、1492R:5’-GGTTACCTTGTTA-CGACTT-3’为特异性引物(上海生物工程有限公司合成)。PCR反应体系(50 μL)包括模板DNA 2 μL,引物(27F/1492R)各1 μL,2×Taq PCR Master Mix 25 μL,无菌水21 μL。
PCR扩增程序:94 ℃,5 min;94 ℃,60 s,55 ℃,60 s,72 ℃,90 s,30个循环;72 ℃,10 min。反应结束后进行琼脂糖凝胶电泳检测。扩增出的16S rRNA基因片段送至上海生工检测序列。
2结果与分析
2.1三尖杉根际土壤放线菌的分离
采用两种不同的培养基从三尖杉根际土壤中共分离得到35株放线菌,依次编号为CF001,CF002,…,CF035。图1所示为三尖杉根际土壤放线菌的部分分离平板。
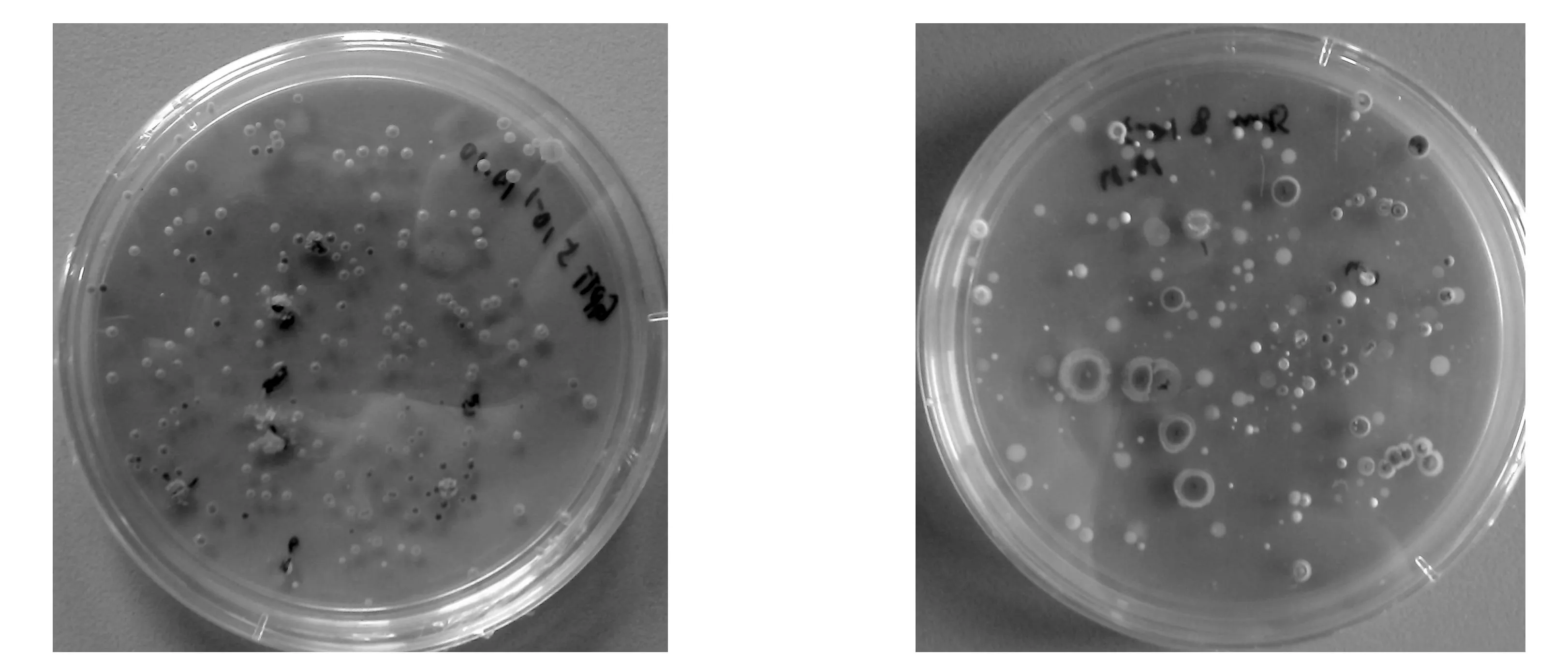
(a) SLM培养基 (b) 1/10 ATCC172分离培养基图1 三尖杉根际土壤放线菌分离平板
2.2三尖杉根际土壤放线菌的抗菌活性筛选
采用滤纸片扩散法对所分离的35株放线菌的发酵液进行抑菌活性检测,发现其中16株菌株具有一定的抑菌活性,这16株菌株的抑菌活性测定结果见表1。
表1结果显示,共有16株放线菌具有不同程度的抗菌活性,占分离菌株的45.7%,其中对白色念珠菌、枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌和沙门氏杆菌有抑制作用的菌株分别为5、12、13、9和7株,占总株数的14.3%、34.3%、37.1%、25.7%和20.0%。这16株菌对革兰氏阳性靶标菌(金黄色葡萄球菌和枯草芽孢杆菌)的抑制作用比革兰氏阴性靶标菌(大肠杆菌和沙门氏菌)的抑制作用强,对靶标细菌的抑制作用较靶标真菌(白色念珠菌)的强。其中CF002、CF003、CF020、CF024和CF027抗菌谱最广。CF003对所有靶标菌均有抑制作用。CF021和CF022仅对一种靶标菌有一定的抑制作用。
2.3三尖杉根际土壤放线菌的鉴定
2.3.1形态学特征
将所分离得到的三尖杉根际土壤放线菌株,在培养基平板上培养15 d后,观察记录各菌株菌落形态、基内菌丝、气生菌丝颜色、可溶性性色素的有无及颜色、平板菌落大小及有无晕圈等培养特征。部分纯化的内生放线菌的菌落形态见图2和表2。

表1 三尖杉根际土壤放线菌发酵液对靶标菌株的拮抗作用
注:“++”:抑菌直径为13~18 mm;“+”:抑菌直径为8~12 mm;“-”:无抑菌活性。
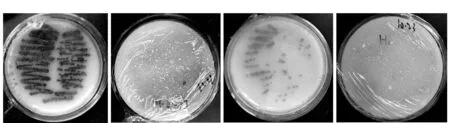
(a) CF024在ATCC培养基菌落形态 (b) CF001在ATCC培养基菌落形态
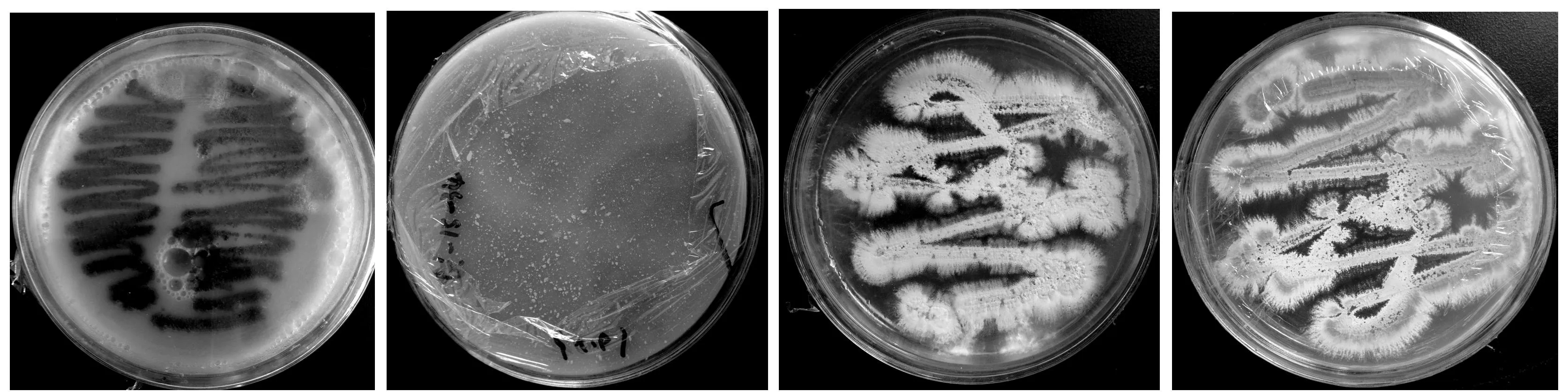
(c) CF029在ATCC培养基菌落形态 (d) CF002在ATCC培养基菌落形态图2 部分三尖杉根际土壤放线菌菌落形态(15 d)
2.3.2三尖杉根际土壤放线菌的分子生物学鉴定
将菌株的16S rRNA基因序列提交到NCBI上进行Blast比对,选取相似度较高的菌株作为参考菌株,利用BioEdit进行序列校准,使用Mega 5.1软件,按照近邻结合(neighbor-joining)聚类,选择1 000个重复作Bootstrap值分析,构建系统发育树。
对所分离的35株放线菌中有抗菌活性的16株及其同源菌株基于16S rRNA基因序列构建系统发育树(见图3)。可以看出,这16有活性的菌株分属小单胞菌属和链霉菌属两个类群,其中菌株CF001、CF031、CF003、CF035、CF009、CF010、CF029亲缘关系较近,CF027和CF004的亲缘关系较近,CF017立形成一支,但以上菌株都属于小单胞菌属;CF002、CF013、CF020、CF022的亲缘关系较近与CF024同属一个大的分支,CF021独立形成一支,但它们都分属于链霉菌属。
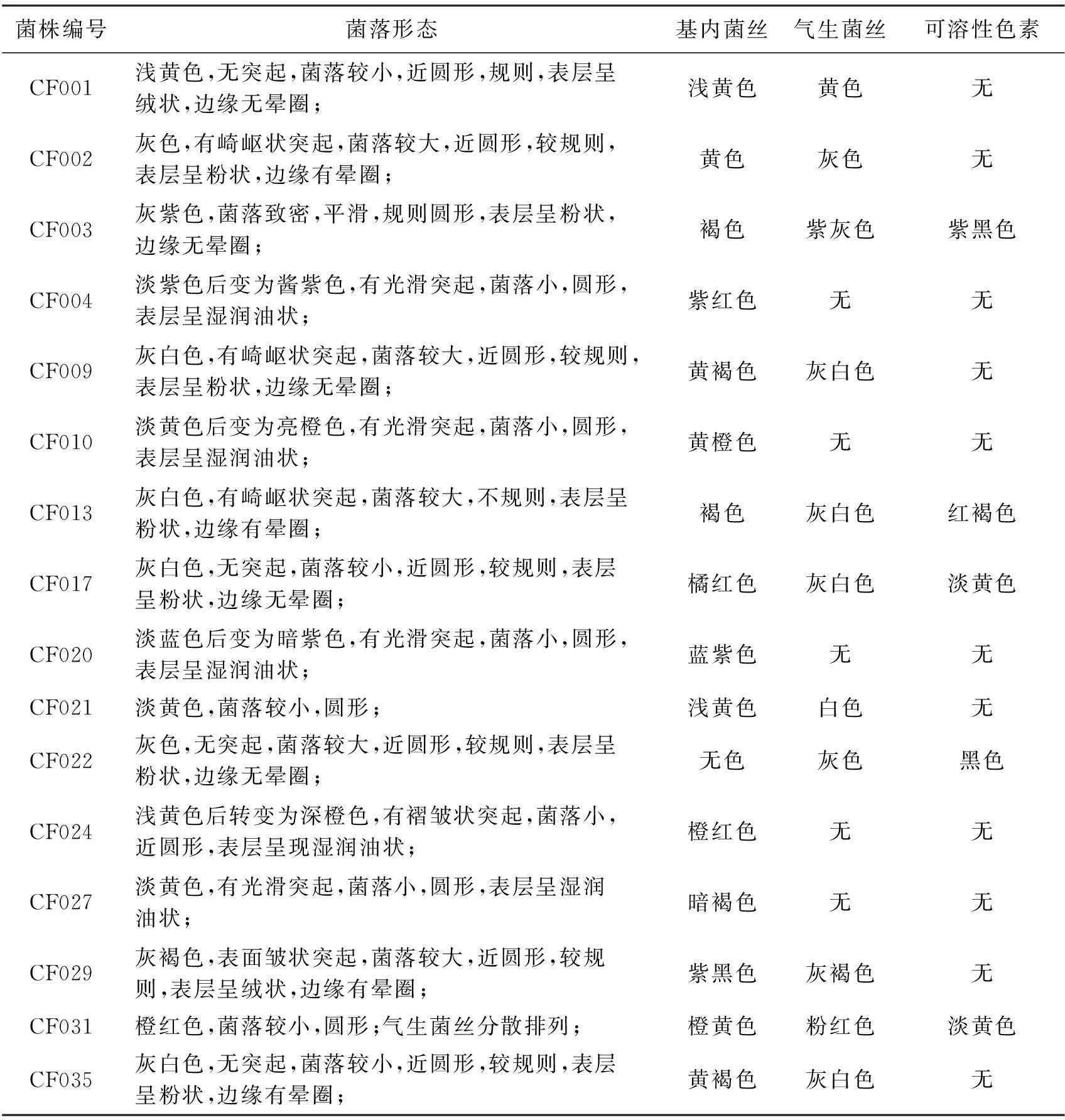
表2 部分分离纯化的放线菌菌落形态

图3 16株放线菌及其同源菌株基于16S rRNA基因序列构建的系统发育树
3讨论
美国亚利桑那大学Gimatilaka教授领导的科研小组对亚利桑那州索诺拉沙漠(Sonoran Desert)植物根际微生物的生态学研究表明[9]:沙漠植物根际微生物的多样性与植物种类及环境因素关系密切,从这些微生物中发现新次级代谢产物的几率极大;美国爱德华大学的D L Crawford教授领导的科研小组发现北美三齿蒿(Artemisiatridentata)根际及周边具有丰富的放线菌资源,很可能蕴藏着发现新抗生素的微生物资源。这些研究表明,放线菌普遍存在于植物根际土壤中,植物与放线菌之间存在明显的互利共生关系,放线菌从植物根部获得营养,同时产生抗真菌和革兰氏阳性菌的抗生素,防止植物真菌对植物的感染。放线菌的种类和数量也因植物和生长环境的不同而不同,即使是同一种植物,也会因品种和生境等不同而分离出不同的放线菌,再加上不同实验室采取不同的培养基和分离条件,也会造成一定的差异。
袁丽杰[3]和赵坷[10]分别从多种药用植物中分离出17属、14属的放线菌,充分显示了药用植物根际放线菌的类群和数量多样性。本试验从秦巴山区获得三尖杉植物根际土壤,分离了35株放线菌,其中有10株抑菌活性较强,对3种及以上靶标菌有抑制作用,占总分离菌株的28.6%,经鉴定为链霉菌属和小单胞菌属。参考类似生境及三尖杉内生放线菌研究推测该样本中蕴含其他放线菌类群的可能性很大,是后续研究的方向。研究秦巴山区生境中药用植物根际土壤放线菌是非常必要的,对新菌种的发现及秦巴山区三尖杉植物的利用及保护具有非常重要的意义。
放线菌是一类重要的微生物资源,是抗生素的主要来源,从微生物中分离到的生理活性物质有70%以上为放线菌的代谢产物,而本研究对三尖杉根际土壤放线菌的发酵液进行抗菌活性检测发现,其中有16株菌对至少一种靶标菌有抗性占分离菌株的45.7%。其中,菌株CF003对5种靶标菌均具有活性。说明秦巴山区三尖杉根际土壤放线菌可以作为抗菌活性物质研究的重要资源。
[参考文献]
[1]DAI Chuan-chao,CHEN Yan,WANG Xing-xiang,et al.Effects of intercropping of peanut with the medicinal plant Atractylodes lancea on soil microecology and peanut yield in subtropical China[J].Agroforestry Systems,2013,87(2):417-426.
[2]黄小龙,陈吉良,李建平,等.热带药用植物根际放线菌的分离、鉴定及生物活性分析[J].生物技术通报,2012(2):122-127.
[3]袁丽杰,章广玲,张玉琴,等.药用植物根际放线菌的种群多样性及生物活性初步研究[J].中国抗生素杂志,2009,34(8):463-466.
[4]严菊芬,王素萍,齐宁波,等.药用植物内生真菌研究进展[J].天然产物研究与开发,2012(增刊):176-181.
[5]BERANOVA L,POMBINHO A R,SPEGAROVA J,et al.The plant alkaloid and anti-leukemia drug homoharringtonine sensitizes resistant human colorectal carcinoma cells to TRAIL-induced apoptosis via multiple mechanisms[J].Apoptosis An International Journal on Programmed Cell Death,2006,72(3):553-562.
[6]Bérdy J.Thoughts and facts about antibiotics:Where we are now and where we are heading[J].Journal of Antibiotics,2012,65(8):385-395.
[7]刘兆迪,解修超,陈文强,等.药用植物三尖杉内生真菌的分离鉴定及抗菌活性[J].中国实验方剂学杂志,2014,20(9):128-132.
[8]张晓伟,解修超,张曼,等.2株三尖杉内生放线菌的分离鉴定与活性研究[J].江苏农业科学,2012,40(5):296-299.
[9]GUNATILAKA A A L.Natural Products from Plant-Associated Microorganisms:Distribution,Structural Diversity,Bioactivity,and Implications of Their Occurrence[J].Journal of Natural Products,2006,69(3):509-526.
[10]赵珂.攀西地区药用植物内生及根际放线菌的多样性与抗菌活性研究[D].成都:四川农业大学,2010.
[11]ZHAN Jing,SUN Qing-ye.Development of microbial properties and enzyme activities in copper mine wasteland during natural restoration[J].Catena,2014,116(3)86-94.
[12]KUMAR D P,PINAKI S.Microbial communities in uranium mine tailing and mine water sediment fron Jaduguda U mine,India:A culture independent analysis[J].Journal of Environmental Science & Health Part A:Toxic/hazardous Substances & Environmental Engineering,2014,49(6):694-709.
[13]陈文强,彭浩,邓百万,等.药用植物虎杖内生放线菌的分离及抑菌活性的研究[J].陕西理工学院学报:自然科学版,2012,28(6):61-67.
[14]黄大林,陈森洲,徐雅娟.广西红树林土壤放线菌的分离和DNA的提取方法[J].广西医学,2008,30(11):1657-1659.
[15]谢学辉,范凤霞,袁学武,等.德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J].微生物学通报,2012,39(5):624-637.
[16]赵莉莉,李秋萍,魏玉珍,等.以SCF为靶点的新型抗绿脓杆菌药物细胞水平筛选模型的建立和应用[J].微生物学通报,2008,35(12):1926-1931.
[17]江翠翠,赵云峰,司美茹.选择性分离放线菌的土壤处理方法研究[J].济宁学院学报,2010,31(6):44-48.
[责任编辑:谢 平]
Isolation, screening and identification of active actinomycete fromCephalotaxusfortuneirhizosphere soil in Qinba Mountains
YAN Li1,2,RUAN Chang-ying3,XIE Xiu-chao1,PENG hao1,CHEN Wen-qiang1,DENG Bai-wan1
(1.School of Bioscience and Engineering, Shaanxi University of Technology, Hanzhong 723000, China;2.Department of Pharmaceutical and Medical Technology,Hanzhong Vocational and Technical College,Hanzhong 723002, China;3.Zhashui High School, Zhashui 711400, China)
Abstract:35 strains of actinomycetes isolated from Cephalotaxus fortunei rhizosphere soil in Qinba Mountains,China,were studied in this paper.Phylogenetic analysis based on 16S rRNA gene sequences indicated that the 16 strains belong to small group of actinobacterial genera including Streptomyces and Micromonospora.Candida albicans,Escherichia coli,Bacillus subtilis,Staphylococcus aureus,Salmonella typhl were selected as indicator bacteria when the antimicrobial activities of these actinomycetes were tested through antimicrobial experiments in the exterior body.The result showed that 16 strains (45.7%) exhibited activity against at least one target strain,and the CF003 strain has strong inhibition to all target strains.
Key words:Cephalotaxus fortune;rhizosphere soil;actinomycetes;antimicrobial activity
[中图分类号]Q939.13+2
[文献标识码]A
作者简介:晏丽(1985—),女,陕西省汉中市人,汉中职业技术学院助教,陕西理工学院硕士研究生,主要研究方向为微生物代谢产活性物质;[通信作者]解修超(1978—),男,山东省临沐县人,陕西理工学院副教授,硕士生导师,博士,主要研究方向为微生物代谢产活性物质。
基金项目:陕西理工学院研究生创新基金资助项目(SLGYCX1421)
收稿日期:2015-12-31修回日期:2016-02-27
[文章编号]1673-2944(2016)02-0057-07
