重组精氨酸脱亚胺酶的制备工艺
2016-05-28何云凤郭晋霞
何云凤,郭晋霞,范 开
(1.重庆理工大学 药学与生物工程学院,重庆 400054;2.重庆富进生物医药有限公司,重庆 400050)
重组精氨酸脱亚胺酶的制备工艺
何云凤1,郭晋霞1,范开2
(1.重庆理工大学 药学与生物工程学院,重庆400054;2.重庆富进生物医药有限公司,重庆400050)
摘要:研究了重组精氨酸脱亚胺酶(rADIES)的30 L规模发酵、制备工艺及其生物学活性。将构建好的工程菌先进行摇瓶活化获得种子液,转入30 L发酵罐进行培养,用IPTG进行诱导表达;表达产物进行高压匀浆破菌、包涵体洗涤、溶解稀释复性后经DEAE阴离子交换层析柱和Butyl疏水层析柱纯化;通过SDS-PAGE和RP-HPLC等方法检测表达和纯度;用体外测活法检测活性。将工程菌进行放大培养并诱导表达,获得了相对分子质量在46 kDa的rADIES。重组蛋白表达量占总蛋白的25%以上,经制备工艺获得的rADIES纯度高于95%,酶活性为42 IU。实验结果表明:该工艺具有可行性,可以获得较高活性的重组精氨酸脱亚胺酶。
关键词:精氨酸脱亚胺酶;发酵;复性;分离纯化
精氨酸脱亚胺酶(rginine deiminase,ADI,EC3.5.3.6)是一种可以将L-精氨酸不可逆分解为L-瓜氨酸和氨的酶[1],最先在支原体Mycoplasmaarginini中发现。目前研究得最多、最深入的也是来源于支原体的ADI,此后,在其他细菌和少数低等真核生物中也有发现[2]。研究证实,ADI可以抑制很多精氨酸营养缺陷型肿瘤细胞(如肝细胞癌、黑色素瘤细胞、前列腺癌、胶质母细胞癌等)的生长,而对正常人体细胞没有影响[3-4]。其抑制机制主要包括两方面:其一是降低血清中的精氨酸,正常细胞和组织中存在精氨酸琥珀酸合成酶(ASS) 和精氨酸琥珀酸裂解酶(ASL)两种酶,经尿素循环可以自身合成精氨酸,而精氨酸营养缺陷型肿瘤细胞自身不能表达ASS,必须从血液中获得精氨酸合成自身需要的蛋白质,ADI一旦降解血清中的精氨酸,最终将导致肿瘤细胞死亡[5-6];其二是可以抑制血管内皮细胞的合成,减少肿瘤新生血管的生成[7]。因此,ADI具有开发成抗肿瘤药的潜力。
目前在制备ADI时主要从支原体中提取[8]或采取基因工程方法在大肠杆菌中表达和制备[9-12]。美国polaris公司正在制备的临床II-III期抗肿瘤的PEG化ADI(PEG-ADI20)是两个突变的支原体ADI(ADIES)。本研究主要探讨该突变ADI(ADIES)放大制备工艺和活性,为进一步进行PEG修饰和临床研究并实现产业化奠定基础。
1材料与方法
1.1材料与试剂
携带有质粒pET-ADIES的BL21工程菌种(pET-ADIES/ BL21)为重庆派金生物科技有限公司构建保存;中分子蛋白标准来自TIANGEN公司;Bio-Rad Universal 电泳仪购自美国Bio-Rad;TU-1810 紫外可见分光光度计购自北京普析;高速冷冻离心机购自日本日立;DEAE Sepharose Fast Flow和Butyl Sepharose 4 Fast Flow层析填料(General Electric Company);TSK-GEL G3000SWxL Column购自TOSOH公司;Waters Symmetry 300 C18购自沃特世公司;Superdex 100 Column (General Electric Company);Agillent 1200 型高效液相色谱仪(Agilent Technologies);LB培养基和M9-YT培养基均参照Novagen公司pET操作手册配置;其余化学试剂均为常规试剂。
1.2方法
1.2.1重组ADIES的表达
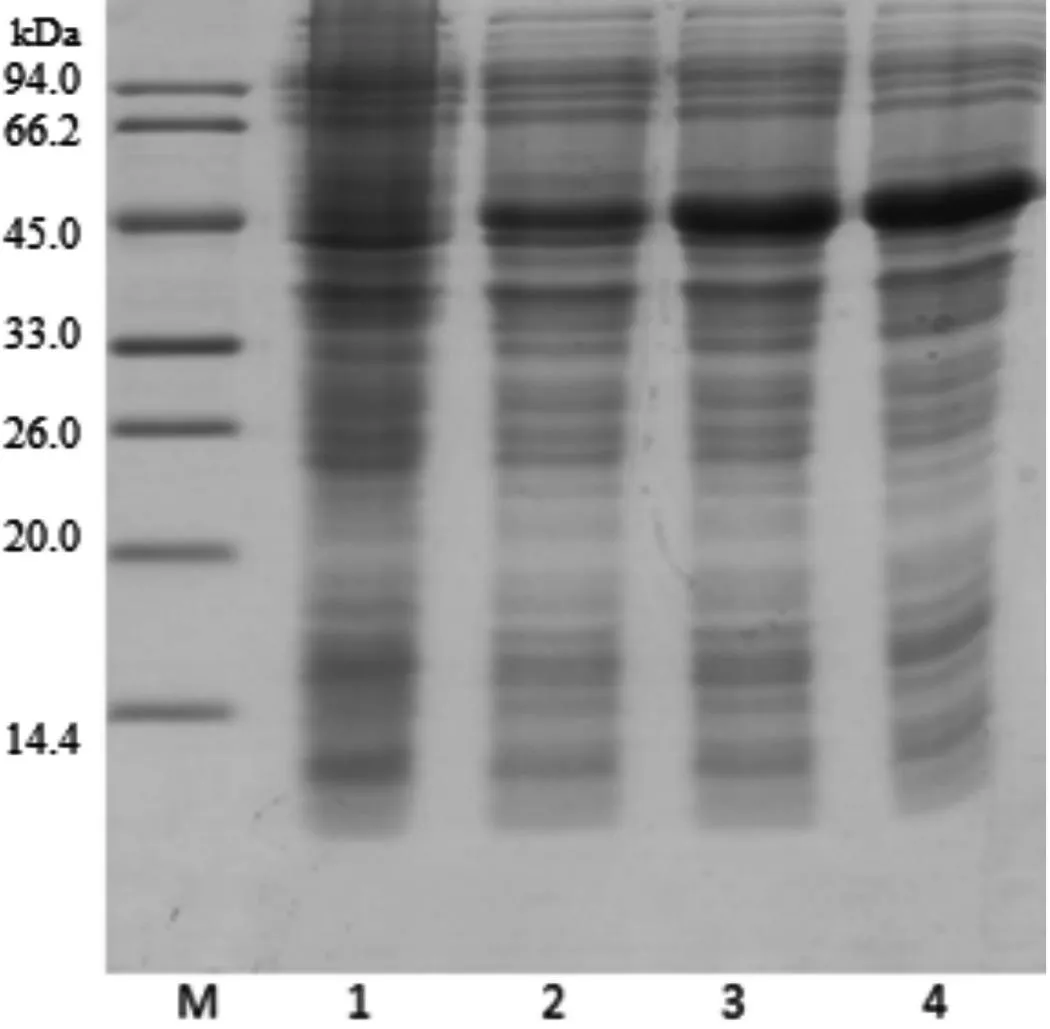
将工程菌种(pET-ADIES/ BL21)从-80 ℃冰箱中取出迅速融化,接种于250 mL/瓶含氨苄青霉素100 μg/mL LB培养基中,共接种4瓶。于30 ℃、180 r/min摇床培养过夜,直至OD值达到1左右即可获得种子液。将2 L种子液全部接入18 L M9-YT培养基开始发酵,pH值维持在7.0左右,通气量维持在10 L/min。加入种子液后pH值和溶氧开始下降,待培养基中葡萄糖消耗完毕后溶氧瞬间升至最高点,pH值开始上升,此时流加补料。流加补料1.5 h后OD值达10左右,加入终浓度为1 mmol/L的 IPTG开始诱导。此时停止加补料,0.5 h后开始流加补料(溶氧维持在40%),诱导4 h后下罐,离心收集菌体。将收集的菌体留样通过SDS-PAGE分析检测表达量,其余菌体冻存于-20 ℃冰箱中。
1.2.2重组ADIES高压匀浆破菌
按1∶10(m/V)的比例将菌体溶于破菌缓冲液(50 mmol/L PB、pH值为8.0的1 mmol/L EDTA)中以200~300 r/min室温搅拌均匀后,在20,40,70 MPa压力条件下各循环1次进行低温高压匀浆。采用显微镜观察破菌效果,当破菌率达95%以上即可用高速冷冻离心机在8 000 r/min、4 ℃条件下离心20 min,收集沉淀。
1.2.3重组ADIES包涵体的洗涤
本研究采用高压匀浆破菌法破菌后分别按照以下洗涤方式各洗涤一次。洗涤缓冲方式1:50 mmol/L PB、1mmol/L EDTA、1%Triton X-100、pH值为8.0;洗涤缓冲方式2:50 mmol/L PB、1 mmol/L DTT、2 mol/L Urea、0.15 mol/L NaCL 、pH值为8.0;洗涤缓冲方式3:50 mmol/L PB、1 mmol/L DTT、pH值为8.0。按以上条件洗涤后经高速冷冻离心机在 8 000 r/min、4 ℃条件下离心20 min,收集沉淀。
1.2.4包涵体变性溶解及复性
按照1∶10(m/V)的比例将包涵体沉淀溶解于变性溶解缓冲液(20 mmol/L PB、6 mol/L盐酸胍、10 mmol/L DTT、pH值为8.0)中。磁力搅拌(300 r/min)助溶过夜。高速冷冻离心机8 000 r/min、4 ℃条件下离心20 min,弃沉淀收集上清。采用稀释复性法复性,按照1∶20 (V/V)的比例将收集的上清液稀释到复性液(50 mmol/L PB、0.1% PEG4000、20 mmol/L NaCL、pH值为7.0)中,并于4℃复性48 h。
1.2.5重组ADIES蛋白纯化
1) DEAE柱纯化。填装DEAE Sepharose Fast Flow填料500 mL,按照常规方法清洗柱子。用平衡液(20 mmol/L PB、pH值为7.0)平衡2~3个柱体积,蠕动泵50 r/min快速上样,在用平衡液进行复平衡2~3个柱体积后,改用洗脱液1 (20 mmol/L PB、0.1 mol/L NaCL、pH值为7.0)冲洗杂蛋白,用洗脱液2(20 mmol/L PB、0.3 mol/L NaCl、pH值为7.0)洗脱目的蛋白。
2) Butyl柱纯化。填装Butyl Sepharose 4 Fast Flow填料400 mL,常规方法清洗柱子。用平衡缓冲(20 mmol/L PB、2 mol/L NaCL、pH值为7.0)平衡2~3个柱体积后,将DEAE洗脱目的蛋白样补加终浓度为2 mol/L NaCl后上样,平衡缓冲(20 mmol/L PB、2 mol/L NaCL、pH值为7.0)进行复平衡2~3个柱体积至电导平稳为止,改用洗脱液1(20 mmol/L PB、0.5 mol/L NaCL、pH值为7.0)洗去杂蛋白,用洗脱液2(20 mmol/L PB、0.1 mol/L NaCL、pH值为7.0)收集目的蛋白。
1.2.6酶活性测定
1) L-瓜氨酸标准曲线的建立。取1 mmol/L 的L-瓜氨酸溶液,用0.1 moL/L PB、pH值为7.0的缓冲液稀释成0,50,100,150,200,250,300,350,400,450,500 μmol/L梯度溶液。
2) 样品的处理:用0.1 mol/L PB分别稀释成1 μg/mL和2 μg/mL溶液。在试管中加入上述稀释好的溶液1 600 mL,用0.1 mol/L PB缓冲液200 μL 混匀。每个样做1个平行复孔。放置于37 ℃水浴锅中预热5 min。加入0.1 mol/L精氨酸200 μL混匀,置37 ℃水浴锅中精确反应5 min,再于100 ℃金属浴中停止反应5 min,取出降至室温。
3) 显色:在标准曲线和处理后的样品试管中依次加入3 mL混合酸-铁溶液,混匀。再加入0.5 mL/管的显色液混匀,立即放入100 ℃金属浴中反应10 min。每管平行操作20 s。反应结束后取出在自来水中降至室温,等待测定。
4) 活性测定:取150 μL反应溶液于酶标板内,波长490 nm测定其吸光度值,记录数据,绘制L-瓜氨酸标准曲线,计算待测样品比活性。
2结果与分析
2.1工程菌的发酵
本实验通过前期已构建的工程菌种(Pet-ADIES/BL21)进行30 L放大培养,收获湿菌体550 g,成功实现了精氨酸脱亚胺酶以包涵体形式在大肠杆菌中高表达。从图1可以看出:工程菌在放大培养过程中呈大肠杆菌的杆状。表达产物经SDS-PAGE分析可得目标蛋白相对分子质量约为46 kDa,位置与理论值一致。通过凝胶成像扫描软件分析,目标蛋白占全菌蛋白的25%以上,如图2所示。

图1 诱导3 h后显微镜分析
1.未诱导全菌; 2.IPTG诱导1 h全菌; 3.IPTG诱导2 h全菌;
2.2高压匀浆破菌
目前已有文献报道,精氨酸脱亚胺酶菌体均采用超声破菌,而在工业上这种方法费时费力,并不能满足工业需求。本研究初次采用效率较高的高压匀浆法破菌,破菌率达95%以上。
2.3重组蛋白的纯度检测
本实验通过两步柱纯化,纯化产物用SDS-PAGE和RP-HPLC方法分析纯度, 用SEC-HPLC方法分析高分子含量。其中SDS-PAGE采用12%的分离胶,考马斯亮蓝染色,用凝胶成像系统分析。RP-HPLC分析条件:分析柱采用Waters Symmetry 300 C18柱,以含0.1%的三氟乙酸为流动相A液,以95%的乙腈溶液为流动相B液,进样量10 μL,检测波长214 nm,流速1 mL/min,分析时间30 min。SDS-PAGE分析结果见图3,RP-HPLC分析结果见图4。主峰ADIES在C18柱上的保留时间为20.442 min,纯度为99.6%。 SEC-HPLC分析条件:采用Superdex100柱子,以20 mmol/L PB、 pH值为7.0作为流动相,流速0.5 mL/min,检测波长280 nm,分析时间30 min,进样量20 μL。结果如图5所示,只出现目的条带单峰,目的蛋白的保留时间为16.446 min,未检测目的峰意外的其他峰。

1.DEAE柱洗脱主峰; 2.DEAE柱洗脱杂峰;

图4 纯化ADIES的PR-HPLC图谱
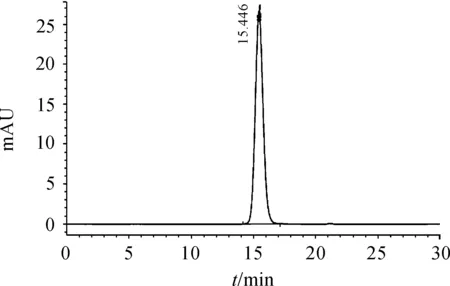
图5 纯化ADIES的SEC-HPLC图谱
2.4酶活性测定
酶活性定义:在最适反应温度为37 ℃、pH值为7.0条件下,1 min内转化1 μmoL L-瓜氨酸所需的酶量称为一个国际单位(IU,又称U)。
测活原理:精氨酸在精氨酸脱亚胺酶的作用下生成L-瓜氨酸,根据L-瓜氨酸在强酸性溶液中与二乙酰一肟的专一性显色反应及反应复合物在490 nm处吸光度与L-瓜氨酸浓度呈线性梯度关系的特点,建立一种准确、快速、简便、灵敏的重组蛋白活性测定方法。
经过纯化后的ADIES样品,采用本文所述的方法进行测活。L-瓜氨酸标准曲线如图6所示,依据该曲线绘制的线性方程为y=0.003 3x=0.007 5(x代表瓜氨酸浓度,y代表对应OD值),R2= 0.999 7,线性结果较为理想。待测活样品按照本文所述方法进行测活,代入公式计算,获得的酶活性为42 IU。
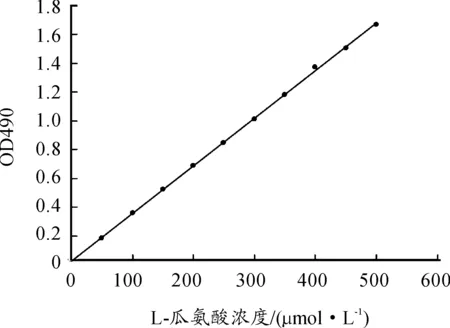
图6 L-瓜氨酸标准曲线
3结束语
某些营养缺陷型肿瘤细胞(如肝细胞癌、黑色素瘤细胞、前列腺癌、胶质母细胞癌等)的生长对精氨酸具有依赖性,而正常细胞没有这种依赖性,精氨酸脱亚胺酶通过降解体内精氨酸达到治疗肿瘤的目的[13]。
本研究前期,已构建出表达目的蛋白的工程菌,通过30 L体系发酵培养,采取IPTG诱导方式获得目标蛋白的包涵体,可获得约550 g的湿菌体。SDS-PAGE分析结果表明:目标基因能够在E.Coli中获得高效表达,产物的相对分子质量在46 kDa左右,与理论分子量一致。由于重组ADIES蛋白是以包涵体的形式表达,在包涵体中除了含有目的ADIES蛋白外,仍含有大量宿主菌蛋白和核酸类杂质。通过对包涵体进一步洗涤提纯,不仅能有效提高蛋白复性效率、降低纯化工艺难度,而且能显著提高目的蛋白回收率。本工艺每100 g湿菌菌体经高压匀浆法破菌后可获得约25 g包涵体沉淀。包涵体经洗涤后,每25 g可获得10 g纯度较高的包涵体沉淀。经复性、DEAE Sepharose Fast Flow和Butyl Sepharose 4 Fast Flow等工艺流程,可获得SDS-PAGE和RP-HPLC纯度均不低于95%的目标蛋白,每100 g可获得1 g以上的重组精氨酸脱亚胺酶。经过体外测活法进行测活,测得的酶活性高达42 IU。
目前由美国polaris公司开发的聚乙二醇修饰精氨酸脱亚胺酶(ADI-PEG 20)正在进行临床3期的研究实验。这种酶是一种外源蛋白,用于人体会出现严重的免疫原性。目前普遍采用的方式是进行PEG修饰,降低免疫原性和延长半衰期[14]。本实验通过中试规模的制备放大研究,获得了高纯度高产量的精氨酸脱亚胺酶,为后期进一步PEG修饰研究、药理和药效学研究等奠定了基础,具有一定的实际应用前景。
参考文献:
[1]GILBERT C S,MILAN A L,ALFRED A T.The degradation of arginine by Clostridium perfringens (BP6K)[J].Journal of Biological Chemisty,1952,198(2):771-783.
[2]KNODLER L A,SCHOFIELD P J,EDWARDS M R.Larginine transport and metabolism in Giardia intestinalis support its position as a transition between the prokaryotic and eukaryotic kingdoms[J].Microbiology,1995,141 (5):2063-2070.
[3]SYED N,LANGER J,JANCZAR K,et al.Epigenetic status of argininosuccinate synthetase and argininosuccinate lyase modulates autophagy and cell death in glioblastoma[J].Cell Death Dis,2013,4(1):e458.
[4]ENSOR C M,HOLTSBERG F W,BOMALASKI J S,et al.Pegylated arginine deiminase (ADI-SS PEG20,000mw) inhibits human melanomas and hepatocellular carcinomas in vitro and in vivo[J].Cancer Res,2002,62(19):5443-5450.
[5]DILLON B J,PRIETO V G,CURLEY S A,et al.Incidence and distribution of argininosuccinate synthetase deficiency in human cancers:a method for identifying cancers sensitive to arginine deprivation[J].Cancer,2004,100(4):826-833.
[6]ANNA S,TERESA S,ELZBIETA A.The role of arginine and the modified arginine deiminase enzyme ADI-PEG 20 in cancer therapy with special emphasis on Phase I/II clinical trials[J].Expert Opinion on Investigational Drugs,2014,23(11):1517-1529.
[7]ATKAN F.iNOS-mediated nitric oxide production and its regulation[J].Life Sci,2004,75(6):639-653.
[8]GONG H,ZLZER F,von RECKLINGHAUSEN G,et al.Arginine deiminase inhibits cell proliferation by arresting cell cycle and inducing apoptosis[J].Biochem Biophys Res Commol/Lun,1999,261(1):10-14.
[9]KIM J E,JEONG D W,LEE H J.Expression,purification and characterization of arginine deiminase from Lactococcus lactis ssp.lactis ATCC 7962 in Escherichia coli BL21[J].Protein Expr Purif,2007,53(1):9-15.
[10]魏星,苏勇,张加慧.精氨酸脱亚胺酶的克隆表达和纯化[J].世界临床药物,2013,34(5):280-284.
[11]刘咏梅,倪晔,李娜,等.精氨酸脱亚胺酶基因在大肠杆菌中的克隆、表达及纯化[J].食品与生物技术学报,2011(5):750-756.
[12]FAYURA L R,BORETSKY Y R,PYNYAHA Y V,et al.Improved method for expression and isolation of the Mycoplasma hominis arginine deiminase from the recombinant strain of Escherichia coli.[J].Journal of Biotechnology,2013,167(4):420-426.
[13]TOMLINSON B K,THOMSON J A,BOMALASKI J S,et al.Phase I Trial of Arginine Deprivation Therapy with ADI-PEG 20 Plus Docetaxel in Patients with Advanced Malignant Solid Tumors[J].Clinical Cancer Research,2015,21(11):2480-2486.
[14]FARIDEH M,GHAZALY E,LINDA A,et al.Arginine deprivation using pegylated arginine deiminase has activity against primary acute myeloid leukemia cells in vivo[J].Blood,2015,125(26):4060-4068.
(责任编辑何杰玲)
Study of Preparation Technology of Recombinant Arginine Deiminase
HE Yun-feng1, GUO Jin-xia2, FAN Kai2
(1.College of Pharmacy and Biological Engineering, Chongqing University of Technology,Chongqing 400054, China; 2. Fagen Techenology Inc., Chongqing 400050, China)
Abstract:The 30 L scale fermentation, preparation technology and biological activities of recombinant arginine deiminase (rADI-ES) were investigated. The seed solution was obtained by shaking flask activation of the constructed engineering bacteria, and then transferred it to 30 L fermenter for enlarging cultivation, and IPTG was used for its induction expression. The expression products broke bacterium by high-pressure homogenizer, and inclusion bodies were washed by buffer, and after dissolved refolding, the product was purified with DEAE anion exchange chromatography and Butyl hydrophobic interaction chromatography column, and we detected its expression and purity by SDS-PAGE and RP-HPLC analysis. The activity of rADI-ES was determined in vitro. We successfully amplified and induced expression of the engineering bacteria, and obtained the rADIES with the molecular weight of 46 kDa. The expression quantity of recombinant protein counts about more than 25% total protein, and the purity of the purified rADI-ES is more than 95% and its enzymatic activity is 42 IU. The expeiment show that the process is feasible to obtain a higher purity and activity of recombinant arginine deiminase.
Key words:arginine deiminase; fermentation; refold; purification
文章编号:1674-8425(2016)04-0073-06
中图分类号:Q3441.13
文献标识码:A
doi:10.3969/j.issn.1674-8425(z).2016.04.013
作者简介:何云凤(1987—),男,重庆云阳人,硕士研究生,主要从事基因工程制药研究。
收稿日期:2016-01-11
引用格式:何云凤,郭晋霞,范开.重组精氨酸脱亚胺酶的制备工艺[J].重庆理工大学学报(自然科学),2016(4):73-78.
Citation format:HE Yun-feng, GUO Jin-xia, FAN Kai.Study of Preparation Technology of Recombinant Arginine Deiminase[J].Journal of Chongqing University of Technology(Natural Science),2016(4):73-78.
