丝素/泊洛沙姆复合水凝胶的药物缓释研究
2016-05-28邓春闽钟天翼左保齐
邓春闽,钟天翼,左保齐
(1.苏州大学 现代丝绸国家工程实验室,江苏 苏州 215123;2.苏州唯特工程咨询有限公司,江苏 苏州 215104)
丝素/泊洛沙姆复合水凝胶的药物缓释研究
邓春闽1,2,钟天翼2,左保齐1
(1.苏州大学 现代丝绸国家工程实验室,江苏 苏州 215123;2.苏州唯特工程咨询有限公司,江苏 苏州 215104)
摘要:选定不同分子量的表面活性剂泊洛沙姆,分别将它们与丝素溶液以不同的比例混合形成复合水凝胶,考察其对阿司匹林与吲哚美辛两种药物的体外缓释性。利用扫描电镜对丝素/泊洛沙姆水凝胶缓释前后的形态结构进行了检测,以及用紫外分光光度计分析不同条件下的药物缓释曲线。结果表明通过改变水凝胶的共混比例、泊洛沙姆的分子量和链段比可以调节两种药物的释放速率,以达到药物缓释的目的。丝素/泊洛沙姆有望作为一种新的递送载体用于药物缓释。
关键词:丝素;泊洛沙姆;水凝胶;药物缓释
药物的控制释放是一门新的交叉学科,起源于20世纪60年代,随着科学技术发展,药物控制释放已成为国内外热门研究领域之一。将药物与载体制成制剂,通过适当的形式控制药物在人体内释放的过程就是药物控制释放技术。从方法上说,它可以分为时间控制释放和分布控制释放两种,即一定的时间范围内在体内以一定的模式释放与在指定部位释放。和传统给药方式相比,药物控释体系降低了药物的毒副作用,减少了给药次数,从而提高了药物的疗效,减少了病人痛苦。从剂型上分,药物控制释放可分为高分子包囊体系、凝胶体系、胶束体系、电纺丝超细纤维体系及脂质体体系,本研究选用凝胶体系。
丝素蛋白来源于蚕丝,富含甘氨酸(G1y)、丙氨酸(Ala)和丝氨酸(Ser)等20种氨基酸[1],无毒、无刺激,另外还具有优良的物理机械性能[2]、降解性能[3],并且降解产物不会引起炎症反应[4]。丝素水凝胶中含有大量水分的三维网络状结构使其具有良好的可透性和可塑性,可以被广泛研究应用于药物和生长因子缓释载体,骨填充材料和细胞培养支架等方面。而泊洛沙姆具有无毒、无抗原性、无致敏性、无刺激性、化学性质稳定、不溶血和可控的亲疏水性等优点,在组织工程中,尤其是在骨组织工程和生长因子的释放上有着明显的优势。本文通过不同分子量泊洛沙姆与丝素制成共混水凝胶,考察其对阿司匹林与吲哚美辛的体外缓释性,为其进一步研究用于组织工程中生长因子的释放做准备。
1实验部分
1.1实验材料
无水碳酸钠(Na2CO3)(化学纯,上海兴达化学试剂厂);溴化锂(LiBr·H2O)(化学纯,上海恒信化学试剂有限公司);桑蚕丝(浙江湖州);不同分子量泊洛沙姆:泊洛沙姆P188(分子量1 800,聚氧乙烯80%),泊洛沙姆P338(分子量3 300,聚氧乙烯80%),泊洛沙姆P407(分子量4 000,聚氧乙烯70%)(Sigma,美国)。
吲哚美辛(C19H16ClNO4,郑州益康药业);
阿司匹林(C9H8O4,郑州益康药业);
无水乙醇(C2H6O,AR,国药集团化学试剂有限公司);
十二水合磷酸氢二钠(Na2HPO4•12H2O,AR,国药集团化学试剂有限公司);
磷酸二氢钾(KH2PO4,AR,国药集团化学试剂有限公司)。
1.2实验仪器
DKZ-2型恒温振荡水槽(上海精宏实验设备有限公司) ;
DZF-1B型真空干燥烘箱(上海贺德实验股份有限公司);
FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司);
ISO 9001型分析天平(北京赛多利斯仪器系统有限公司);
UV-2550型紫外分光光度计(日本Shimadzu公司);
PB-10型精密pH计(北京赛多利斯仪器系统有限公司);
Hitach S-480扫描电子显微镜(日本Hitach公司)。
1.3实验方法与测试
1.3.1丝素蛋白溶液
桑蚕丝用0.5%(质量比)的碳酸钠溶液脱胶,浴比1∶20,在沸水中煮30min,然后用去离子水洗涤,如此反复进行3次。
将脱胶的桑蚕丝溶于LiBr∶C2H5OH=40∶60(质量比)溶液中,恒温(80±2)℃水浴搅拌溶解获得再生丝素溶液,经冷却以后,将丝素溶液注入8 000~14 000道尔顿的透析袋中,用自来水流动透析1d,再用去离子水透析2d,得到纯SF水溶液。最后将丝素水溶液调控到3%浓度。
1.3.2载药Poloxamer/SF水凝胶的制备
将泊洛沙姆与丝素溶液分别以P188∶SF=1∶1;P338∶SF=1∶1;P407∶SF=1∶1;P188∶SF=1∶3;P188∶SF=3∶1共混,再称取0.005g的阿司匹林粉末,分别加入的Poloxamer/SF共混溶液中,充分搅拌混合均匀后分装至10mL离心管,每个离心管含2mL载药共混溶液,置于37℃水浴中待其完全形成凝胶,得到载药量2.5mg/mL的载药水凝胶。吲哚美辛载药水凝胶的制备与阿司匹林相同。
1.3.3磷酸盐缓冲液(PBS)的配制
分别称取1/15mol/L浓度的Na2HPO4溶液和KH2PO4溶液,按照81.8∶18.2的比例混合,在37℃下,使用稀盐酸和氯化钠溶液微调,待溶液稳定后,用精密pH计测量得到pH=7.4、浓度为0.1mol/L的PBS缓冲液,最后密封室温保存。
1.3.4药物标准曲线的绘制
精密称取0.5g阿司匹林,然后放到50mL容量瓶中,加50mL无水乙醇溶解,得到10mg/mL的溶液;然后吸取这5mL的浓溶液于50mL容量瓶中,加磷酸盐的缓冲液50mL得到1mg/mL标准溶液;用同样的方法,再精密称量适量标准溶液,加磷酸盐缓冲液,浓度分别为1,5,10,20,30,50,100μg/mL。吲哚美辛标准溶液的配制和阿司匹林的方法相同。用紫外分光光度计分别测定吸光度(阿司匹林λ=302nm,吲哚美辛λ=320nm),然后进行回归计算,得到两种药物的药物的标准曲线方程[5-6],以质量浓度(C)为横坐标,吸光度(A)为纵坐标绘制标准曲线,如图1。
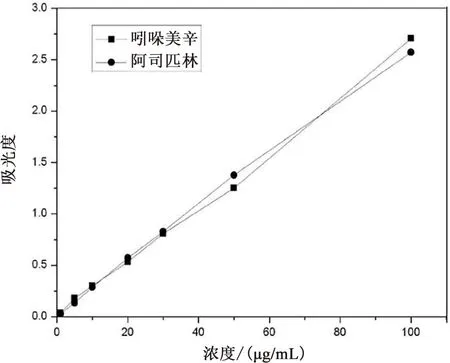
图1 吲哚美辛和阿司匹林的标准曲线
1.3.5载药Poloxamer/SF水凝胶的体外缓释
分别加入8mL的PBS缓冲液到装有2mL载药共混水凝胶的离心管中,再将离心管放到烧杯中,37℃下在恒温振荡水槽中振荡(频率设为60r/min),隔一段时间从离心管中取出4mL的释放液,同时向离心管中加入4mL的PBS缓冲液。再用紫外分光光度计分别测定阿司匹林药物λ=302nm,吲哚美辛药物λ=320nm释放液的吸光度,根据标准曲线方程,计算释放液的释药量及药物浓度,随着时间的增长,计算累积释药百分率,并绘制累积释药曲线。
2结果与讨论
2.1载药Poloxamer/SF水凝胶的研究

图2 阿司匹林和吲哚美辛的分子式结构
阿司匹林又称乙酰水杨酸(图2)。至今它仍是世界上应用最广泛的解热,镇痛及抗炎药,是作为比较和评价其他药物的标准制剂。其性状为白色针状或板状结晶或粉末。熔点135℃,无臭或微带醋酸臭,味微酸,在干燥空气中稳定,在潮湿空气中缓缓水解成水杨酸和乙酸,微溶于水,在水里的溶解度大概为3.3mg/mL[7]。吲哚美辛(图2)又名消炎痛,是一种白色或者微黄色的结晶性粉末,几乎无臭,无味。在丙酮中溶解,在甲醇、乙醇、氯仿或乙醚中略溶,在苯中微溶,在甲苯中极微溶解,在水中几乎不溶[8]。适用于活血化瘀、消肿止痛,可用于风湿性、痛风性关节炎及一些癌性疼痛,也可用于滑囊炎、腱鞘炎及关节囊炎等。根据两种药物在水里的溶解度,载阿司匹林药物的释放时间选定为20h,载吲哚美辛药物的释放时间选定为19d。
阿司匹林是一种偏酸性的药物(图3)。选择P188、P338、P407三种不同分子量的非离子表面活性剂泊洛沙姆分别与SF以1∶1比例混合载阿司匹林得到共混水凝胶,如图3(A)(B)(C)所示SEM图,对载阿司匹林药物后共混水凝胶的形貌进行对比研究。与载药前相比,加入阿司匹林药物后,不同分子量的泊洛沙姆,其载药后的水凝胶都为大的片层结构。纤维之间的缝隙减少,变的较为致密。我们知道,丝素蛋白是一种含有大量正负电荷的两性蛋白质,其在水中的等电点约为4.5。在等电点时,蛋白质分子以双极离子存在,总净电荷为零,颗粒无电荷间的排斥作用,易凝集成大颗粒,因而最不稳定,溶解度也最小,易沉淀析出。而阿司匹林偏酸性,其结构中含有大量的羧酸根(-COO-),当阿司匹林加入泊洛沙姆/丝素共混溶液中后,其溶解于水中,会释放出大量的羧酸根,降低了溶液的pH值并接近等电点,从而丝素分子之间的电荷排斥作用减弱,聚集作用变强,进而影响了水凝胶的结构,片层结构会变得更加紧密。图3中(D)、(E)和(F)所示,是载阿司匹林药物缓释120h后水凝胶截面的SEM图像,水凝胶变得脆弱且易碎,可以看出泊洛沙姆/丝素水凝胶表面孔壁均存在大量的细小孔洞。这是由于阿司匹林在PBS溶液中的不断溶解释放,而丝素分子中存在大量的极性氨基酸残基,易与阿司匹林之间生成氢键结合,这些结合的位置就形成了细小的孔洞。

A、P188/SF 1∶1,B、P338/SF 1∶1,C、P407/SF 1∶1载阿司匹林药物缓释前;D、P188/SF 3∶1, E、P338/SF 1∶1, F、P407/SF 1∶1载阿司匹林药物缓释后图3 共混水凝胶的扫描电镜图
图4是载吲哚美辛缓释前后的水凝胶形貌图,其中A、B、C是载吲哚美辛后的水凝胶SEM图像,与载阿司匹林后的水凝胶对比,不同分子量的泊洛沙姆载吲哚美辛后的水凝胶也是均匀的多片层结构。不过这种片层变得更脆弱易断,这可能是因为吲哚美辛是一种疏水性药物难溶于水,由于泊洛沙姆的存在,增加了吲哚美辛的溶解性,泊洛沙姆中的疏水性基团将其包裹聚集在一起。但是这些疏水性药物会使疏水性基团的作用力减弱,从而这些片层结构会更加脆弱。D、E、F为吲哚美辛缓释14D后水凝胶截面的SEM图像,可以观察到膜的表面存在许多微小的孔洞。E是对水凝胶孔壁的进一步放大的SEM图像,这些大小不一的纳米孔洞直径分布约10~400nm。结合缓释吲哚美辛前水凝胶的形态,可能是随着时间的增加,吲哚美辛逐渐释放出来形成的。

A、P188/SF 1∶1, B、P338/SF 1∶1, C、P407/SF 1∶1载吲哚美辛药物缓释前;D、P188/SF 3∶1, E、P338/SF 1∶1,F、P407/SF 1∶1载吲哚美辛药物缓释后;图4 共混水凝胶的扫描电镜图
2.2不同种类泊洛沙姆对水凝胶体外缓释行为的影响
图5为不同分子量Poloxamer/SF水凝胶相同比例混合在37℃、pH=7.4的磷酸盐中缓冲液的药物释放累积曲线。可以看出载阿司匹林水凝胶释药过程是先快后慢地释放,而载吲哚美辛水凝胶释药过程是先快后慢再快地释放。
A和C图分别为P188、P338、P407载阿司匹林和吲哚美辛水凝胶的释药累积速率。可以看出,载阿司匹林和吲哚美辛水凝胶的释药累积速率略有不同,对阿司匹林药物来说,P407累计释放药物最少最快,而P338累计释放药物最多最慢。这可能是因为阿司匹林偏酸性,其与丝素形成氢键,而P407的分子量最大,而亲水性最弱,其在一定程度上减弱了氢键作用,所以药物释放会最快。而对于大多数药物缓释系统来说,主要涉及扩散和降解溶蚀两种作用。结合之前对载阿司匹林水凝胶的研究,阿司匹林与Poloxamer/SF共混水凝胶形成了致密的大片层结构,阿司匹林扩散到共混水凝胶中间,而释放液不易进入孔壁内部,孔壁内部的阿司匹林需通过扩散作用到达孔壁表面再释放,而P407与丝素溶液最快最容易形成水凝胶,所以阿司匹林也会更最不容易释放,其累计释放量也会最少。对于吲哚美辛药物来说,药物释放速率差不多,不过P407的药物释放量最多,而P188的药物释放量最少。我们知道,泊洛沙姆具有增溶作用,分子量越大,疏水性作用越大,泊洛沙姆与吲哚美辛的结合也越容易,但随着时间的增加,由于PBS缓冲液的加入,吲哚美辛药物要释放。而增溶作用药物与泊洛沙姆结合的并不是那么紧密,所以会有更多药物释放出来。
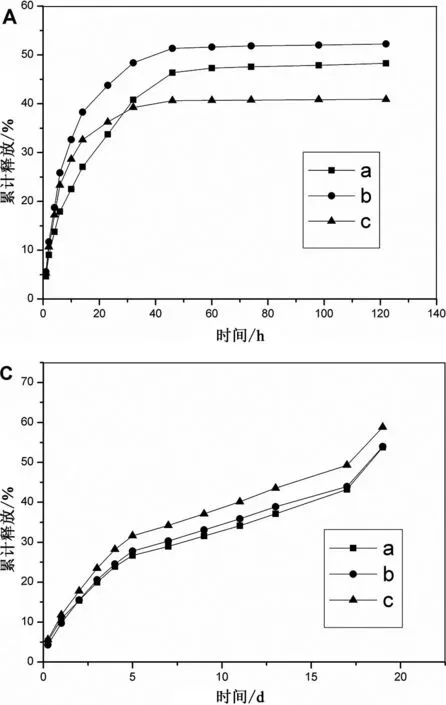
a、P188∶SF=1∶1,b、P338∶SF=1∶1,c、P407∶SF=1∶1A、阿司匹林,C、吲哚美辛图5 不同分子量Plolxamer/SF共混水凝胶的体外药物释放累积曲线
图6为相同分子量不同共混比例P188/SF水凝胶在37℃、pH=7.4的磷酸盐中缓冲液的药物释放累积曲线。可以看出载阿司匹林水凝胶释药过程也是先快后慢地释放,而载吲哚美辛水凝胶释药过程也是先快后慢再快地释放。
图6中的B、D图为同种泊洛沙姆与丝素以不同比例混合的释药累积速率。可以看出,随着P188含量的的增加,载阿司匹林和吲哚美辛水凝胶的释药累积速率都会有不同程度的降低。这是因为随着载药量的增加,材料与药物分子之间的相互作用增强,阿司匹林与丝素之间存在氢键作用,吲哚美辛与泊洛沙姆存在增溶作用,两者均会使释药累积一定程度的下降。

a、P188:SF=1:1, b、p188:SF=1:3, c、p188:SF=3:1B、阿司匹林,D、吲哚美辛图6 相同分子量Poloxamer/SF共混水凝胶的体外药物释放累积曲线
3结论
(1)当阿司匹林加入共混溶液中后,会释放出大量的羧酸根,降低了溶液的 pH值,使其接近丝素的等电点,同时易于和丝素之间以氢键结合,进而影响了水凝胶的形态结构,形成了大量大片层水凝胶。
(2)药物吲哚美辛加入共混溶液中后,泊洛沙姆会对其发生增溶作用,形成含有大量载药多片层水凝胶,但这种片层结构比较脆弱。
(3)载阿司匹林水凝胶释药过程是先快后慢地释放,而载吲哚美辛水凝胶释药过程则是先快后慢再快地释放。随着共混比例中丝素比例的下降或P188含量的的增加,载阿司匹林和吲哚美辛水凝胶的释药累积速率都有不同程度的降低。
(4)对不同分子量的泊洛沙姆P188、P338、P407来说,载阿司匹林和吲哚美辛水凝胶的释药累积速率则略有不同;对阿司匹林药物来说,P407累计释放药物最少最快,而P338累计释放药物最多最慢;对于吲哚美辛药物来说,药物释放速率差不多,但是P407的药物释放量最多,而P188的药物释放量最少。
因此,可以通过改变共混比例、泊洛沙姆的分子量和链段比例,使载药水凝胶能够定量匀速的向外释放药物,从而达到控释的目的。
参考文献:
[1] Akira M. Mechanisms of silk fibroin sol-gel transitions. [J]. Phys. Chem. B 2006, 110, 21630-21638.
[2]宁丽,薛淼,黄海宁等.皮肤再生膜的生物相容性系列研究[J].中国修复重建外科杂志,2000,14(1):44-48.
[3] Ming zhong Li, Masayo Ogiso, Norihiko Minoura. Enzymatic degradation behavior of porous silk fibroin sheets.[J].Biomaterials,2003,24:357-365.
[4]王洪,严力军,杨树华,等.丝状支架韧带材料机械强度和体外降解性研究[J].中华实验外科杂志,2006,23(7):881-883.
[5]张幼珠,雷晓英,王新波,李建.再生丝素蛋白-壳聚糖包药微囊的质量研究[J].东华大学学报自然科学版,2003,29 (5):117-121.
[6]张幼珠,丁悦,吴徵宇,廖镇江.复层药物丝素膜中药物的释放[J].丝绸,2001(8):10-13.
[7]黄进.阿司匹林[J].中国处方药,2009 (5):20-20.
[8]王飞,梁文权.吲哚美辛包合物微球的制备和释放研究[J].中国现代应用药学,2003,20(6):483-485.
收稿日期:2016-01-05
